
Инж. А.А. ФРЕЙМАН
КРАТКИЙ КУРСПИРОТЕХНИКИ
ГОСУДАРСТВЕННОЕ ИЗДАТЕЛЬСТВО
ОБОРОННОЙ ПРОМЫШЛЕННОСТИ
______________________________________
Москва – 1940
В книге кратко изложена теория пиротехники, описаны пиротехнические составы, сырье и вспомогательные материалы, а также приведены основные сведения об устройстве, действии и технологии пиротехнических средств.
В издаваемой книге собраны и систематизированы все основные материалы по пиротехнике, что дает возможность использовать ее в качестве учебного пособия для слушателей техникумов и сети рабочего образования.
Редактор Е.Н.Сильвановская Тех.редактор И.М. Зудакин
Сдано в набор 14/11-1940 г. Подписано к печати 19/VII-1940 г. Тираж 10000.
Печ.листов 9 ½. Формат бумаги 60*92 1/18. №А30718. Учетн.авт.л. 10,7. Учетн. № 617. Зак. № 49
Типография Оборонгиза, Киев, Крещатик, 42.
ГЛАВА 1
ВВЕДЕНИЕ
§ 1. ОСНОВНЫЕ ПОНЯТИЯ
Пиротехника - специальная отрасль техники, к области которой относятся производство и изучение различных веществ и смесей веществ, образующих при сгорании цветной или яркий белый огонь, дым или дающих звуковые эффекты и зажигательное действие.
Слово «пиротехника» происходит от греческих слов «пир» (огонь) и «техне» (искусство, ремесло) и означает уменье изготовлять горючие изделия.
Эта отрасль техники получила быстрое развитие сравнительно недавно. Бурное развитие военной промышленности во всех странах в начале 20 века вызвало и быстрое развитие пиротехники.
Пиротехнические изделия делятся на две основные группы: 1) изделия военной пиротехники; 2) изделия мирной пиротехники.
Военная пиротехника занимается изучением и изготовлением осветительных, зажигательных, сигнальных, трассирующих и имитационных средств. Мирная пиротехника занимается изучением и изготовление средств для фейерверков.
§ 2. КРАТКИЕ ИСТОРИЧЕСКИЕ СВЕДЕНИЯ
Огнем как средством защиты и нападения люди пользовались еще в глубокой древности. Огневые средства в военных целях применялись задолго до нашей эры. Впервые их использовали китайцы, войска которых были снабжены «огненными повозками». Эти повозки представляли собой метательные машины, которые выбрасывали горшки с горящим зажигательным составом и горящие шары.
Огонь служил также и для целей сигнализации. Дикари пользовались кострами для передачи сообщений на большие расстояния, древние персы создали систему сигнализации при помощи факелов; эта система положила начало развитию современных методов оптической сигнализации, которая применяется и до настоящего времени.
Более подробные сведения о древней пиротехнике можно найти в описаниях Энея, жившего за 360 лет до нашей эры. Он описывает зажигательный состав из смолы, серы, ладана, пакли и стружек, который подожженным в горшках выбрасывали на войска неприятеля.
В литературе, относящейся к концу IV в. нашей эры, встречаются описания зажигательных стрел с оболочками, наполненными горючими веществами (смолой, серой, паклей, нефтью). Нефть как горючее и зажигательное средство применяли еще во времена Александра Македонского.
Начиная приблизительно с VII в. появляются сообщения о «греческом» и «морском» огне.
Греки готовили составы для этого огня из смеси различных легковоспламеняющихся веществ. Рецепты таких составов хранились в глубокой тайне, - они обеспечивали византийцам победы над врагами. В эти составы входили вера, винный камень, клей, смола, нефть и другие горючие вещества. Иногда в эти составы входили негашеная известь, вызывающая самовоспламенение состава при соприкосновении его с водой. Составы с негашеной известью обычно имели удельный вес меньше единицы и могли держаться на воде. Самовоспламенение этих составов при соприкосновении с водой объясняется тем, что под действием тепла, выделяющегося при гашении извести, воспламеняются легко горючие компоненты состава, в частности, легкие углеводороды, находящиеся в сырой нефти.
«Морской» огонь состоял из перемешанных в спирте порошкообразной серы, винного камня, поваренной соли. Горящим «морском» огнем обливали корабли противника с помощью «сифонов».
Твердые горящие составы в глиняных сосудах выбрасывались на противника метательными машинами.
Однако, метание зажигательных составов на большие расстояния было затруднительно. Позднее для этой цели использовали животных и птиц. К ним привязывали сосуды с зажигательными составами, составы поджигали и животных или птиц направляли во враждебные укрепления. Но использование животных и птиц было небезопасно: они могли занести пламя и в войска или строения той стороны, которая их использовала для нанесения ущерба противнику. Например, в 1422 г. лекарь Гуситов сгорел от своих птиц с горящими сосудами, пущенных во враждебный стан.
Для поджогов на территории противника применяли также зажигательные движущиеся пиротехнические изделия (типа ракеты), снаряженные зажигательным составом
Однако горение известных в то время зажигательных средств на воздухе не давало достаточного эффекта: пламя можно было сравнительно легко порушить. Применение веществ, содержащих кислород, например селитры, значительно увеличило возможности пиротехники. По литературным данным, селитра из Китая была завезена приблизительно в XIII в. в магометанские страны. Ко второй половине XIII в. относятся сообщения о появлении нового состава из серы, селитры и угля, т.е. черного пороха, который, очевидно, вначале использовался как зажигательное средство. В XIV в. в Германии появились первые орудия, основанные на баллистическом применении черного пороха.
Развитие пиротехнических средств шло по пути подбора составов и регулирования их действия на основе, главным образом,
опытных данных. Появились такие средства воспламенения, как фитили, стопин и др.; зажигательные средства выбрасывались с помощью пороха. Позднее применялись специальные ракеты (зажигательные, системы Конгрэва) и другие изделия боевой пиротехники.
Развитие пиротехники шло и по линии фейерверков. Индусы издавна устраивали фейерверки в дни религиозных праздников. Первый в Европе фейерверк был сожжен в Италии в конце XIV в. В XV- XVI I вв. фейерверки применяли в европейских странах в качестве народного увеселения. Они имели большой успех. В те времена для фейерверков употребляли селитро-серные составы, которые давали очень слабо окрашенные огни. Только в XIX в., после открытия хлорновато-калиевой соли, стали появляться яркие фейерверочные огни различных цветов. Во второй половине XIX в. для фейерверков начали применять магний.
В России устройство фейерверков началось с XVIII в.
§3. СОВРЕМЕННОЕ СОСТОЯНИЕ ПИРОТЕХНИКИ
К началу империалистической войны 1914 г. на вооружении уже было немало различных пиротехнических изделий. Например, в Германии в 1918 г. было выработано около 6 млн. осветительных и сигнальных патронов 4-го калибра. Во время войны выявилось большое значение различных средств военной пиротехники. По силе морального воздействия на людей и по своему разрушительному действию зажигательные средства представляют собой очень мощное и грозное оружие.
С развитием авиации большое значение приобрели зажигательные авиабомбы, которые позволяют устраивать пожары в тылу противника. В 1917 – 1918 гг. город Реймс был бомбардирован зажигательными бомбами; от них Реймс пострадал больше, чем за время войны. Зажигательные средства вызывают массовые пожары в крупных городах.
Ведение современного боя в ночное время вызывает необходимость в различных осветительных средствах; из них наиболее важны осветительные снаряды. Имеются специальные пиротехнические осветительные составы, дающие настолько мощные источники света, что при них возможно производить ночью фотосъемку.
Трассирующие средства, оставляющие на траектории своего полета видимый след, огненный или дымовой, имеют также большое применение в современной войне. Развитие боевой авиации и автоброневых и боевых мотомеханизированных средств вызывает необходимость в специальных средствах для пристрелки по движущимся целям.
Пиротехнические средства связи (сигнальные) незаменимы в боевых условиях для передачи условных сообщений на расстояние.
Пиротехника имеет очень большое значение и для научно-исследовательских работ. При изучении стратосферы используются дымовые шашки, поднимаемые на специальных шарах-зондах; на
определенной секунде времени подъема догорает замедлитель дымовой шашки, и она образует облако дыма. Наблюдения за этим облаком дают ценные научные данные о многих явлениях в стратосфере. Пиротехнические сигнальные средства используются с большим успехом в дальнейших арктических экспедициях.
Во время учебных маневров армии и при войсковом обучении большую роль играют пиротехнические имитационные средства, которые употребляются взамен боевых; например, взрывы шрапнельных и фугасных снарядов имитируются так называемыми взрывпакетами.
Современное пиротехническое производство основывается теперь не только на опытных данных о приготовлении составов и конструкции изделий. Современная пиротехника основывается на всех достижениях химических, физических и специальных военных наук. Основное внимание современных пиротехников направлено на изучение физико-химических процессов, происходящих при действии составов, свойств компонентов, на научно обоснованный выбор новых зажигательных средств и конструкции пиротехнических изделий.
§ 4. КЛАССИФИКАЦИЯ ПИРОТЕХНИЧЕСКИХ ИЗДЕЛИЙ
все пиротехнические изделия, как было сказано, можно разделить по характеру их применения на две основные группы: изделия военной пиротехники и изделия мирной пиротехники.
Изделия военной пиротехники можно отнести к следующим подгруппам: 1) осветительные; 2) сигнальные: а) ночного действия, б) дневного действия; 3) зажигательные; 4) трассирующие; 5) имптационные. В каждую из перечисленных групп входят различные изделия.
ГЛАВА II
ОСНОВЫ ТЕОРИИ ПИРОТЕХНИКИ
§ 1. ОБЩИЕ СВЕДЕНИЯ О ПИРОТЕХНИЧЕСКИХ СОСТАВАХ И ИХ КОМПОНЕНТАХ
Пиротехнический эффект достигается в результате химической реакции горения. Горение представляет собой реакцию соединения горючего вещества с кислородом. При этой реакции обычно происходит значительное повышение температуры и образование пламени или выделение дыма.
Горючие вещества отличаются друг от друга способностью с той или иной активностью соединяться с кислородом; от их активности зависят сила света пламени и количество выделяемого тепла. Количество газообразных и твердых продуктов, получающихся в результате реакции, зависит от свойств реагирующих веществ. Для горения необходим кислород. Следовательно, для получения требуемого эффекта пиротехнические изделия следует сжигать на открытом воздухе или вводить в смесь с горючим вещество, богатое кислородом и способное легко его отдавать. Кислорода воздуха обычно бывает недостаточно для получения требуемого эффекта, поэтому в составы для пиротехнических изделий вводят вещества, богатые кислородом – окислители.
В качестве горючих веществ применяются некоторые металлы, сернистые соединения, органические соединения и др. В качестве окислителей применяются соли хлорноватой, азотной и других кислот, некоторые окислы металлов и пр. При взаимодействии горючего и окислителя, применяя различные компоненты, т.е. составленные части смеси, и меняя их количественные соотношения, можно изменять течение реакции в соответствии с теми требованиями, которые предъявляются к изделию.
Смесь из окислителя и горючего называется о с н о в н о й д в о й н о й с м е с ь ю. Для получения различных по действию составов к основной смеси добавляются различные компоненты или смешиваются различные основные смеси.
Таким образом можно получить очень много разнообразных по свойствам смесей, или так называемых п и р о т е х н и ч е с к и х с о с т а в о в.
§ 2. РЕАКЦИИ ГОРЕНИЯ
Для начала горения необходимо нагреть часть горючего вещества, а затем выделяющееся в процессе горения тепло будет поддерживать температуру, необходимую для продолжения горения. Реакции горения сопровождаются, как было сказано, выделением тепловой и световой энергии. Пиротехника использует реакции горения специальных составов для получения тепловых и световых эффектов.
Если при реакции горения пиротехнических составов получаются горящие и накаленные от горения пары и газы или происходит свечение накаленных твердых или жидких частиц, то такие пиротехнические составы дают пламенное горение.
Для пиротехники наиболее интересны реакции соединения и реакции обмена, особенно экзотермических реакции, в которых участвуют твердые вещества. Если реакция происходит в смеси веществ без участия воздуха, она называется реакцией внутреннего горения. Действие пиротехнических составов в большинстве случаев основывается именно на внутренней реакции обмена кислородом между окислителем и горючим, находящимися в порошкообразной смеси. Применяя окислители в качестве основных компонентов реакции горения, необходимо учитывать следующие их характеристики, влияющие на горение: а) температуру разложения окислителя; б) теплоту образования; в) стойкость по отношению к воздействию атмосферы.
Применяя горючие вещества в качестве основных компонентов, следует учитывать: а) температуру их воспламенения; б) тепловой эффект соединения с кислородом; в) стойкость.
Реакция горения характеризуется: а) скоростью горения; б) тепловым эффектом реакции; в) агрегатным состояние и свойствами продуктов реакции; г) величиной начального импульса, требуемого для возникновения реакции горения.
§ 3. СОСТАВЛЕНИЕ ОСНОВНЫХ ПИРОТЕХНИЧЕСКИХ СМЕСЕЙ
Основа каждого пиротехнического состава – смесь из окислителя и горючего – обладает способностью сгорать за счет кислорода, выделяемого при разложении окислителя. Активность такой смеси объясняется химическим взаимодействием между окислителем и горючим. Поэтому для определения количественных соотношений между компонентами смеси нужно знать ход химической реакции между ними.
Для составления уравнения реакции горения нужно: 1) написать реакцию разложения окислителя; 2) написать реакцию горения взятого горючего в чистом кислороде; 3) уравнять коэффициенты у атомов кислорода; 4) сложить написанные уравнения.
Пример 1. Нужно составить двойную основную смесь из азотнокислого бария и крахмала
Ba(NO3)2 + C6H10O5.
Во-первых, напишем реакцию разложения окислителя, т.е. азотнокислого бария:
Ba(NO3)2 BaO + N2 + 5 O2. (1)
Реакция окисления крахмала в чистом кислороде до сгорания крахмала в СО (неполное сгорание) будет иметь вид:
C6H10O5 +6 O 6 CO2 +3 H2O (2)
Для уравнения коэффициентов у кислорода нужно увеличить в 6 раз коэффициенты уравнения (1) и в 5 раз коэффициенты уравнения (2). Получим:
6 Ba(NO3)2 6 BaO + 6 N2 + 30 O; (1)
5 C6H10O5 + 80 O 30 CO + 25 H2O. (2)
сложив оба уравнения по частям и сократив кислород, получим общее уравнение реакции:
6 Ba(NO3)2 + 5 C6H10O5 6 BaO + 6 N2 + 30 CO + 25 H2O.
Исходя из этого уравнения, можно подсчитать рецепт смеси. Беря эти вещества в количествах, соответствующих граммолекулам, получим:
6 * 261 = 1566 г.
где 261 – молекулярный вес Ba(NO3)2 ;
для C6H10O5
5 * 162 = 810 г.
где 162 – молекулярный вес крахмала.
Всего смеси 2376 г.
Или, переводя в проценты:
Для Ba(NO3)2
для C6H10O5
(точность подсчета до целых чисел).
Как видно из этого примера, при разложении окислителя – азотнокислого бария Ba(NO3)2 – выделяется кислород; 1 молекула его содержит 6 атомов кислорода, а в свободном виде выделяется лишь 5 атомов; 1 атом кислорода остается в соединении с барием в виде окиси бария BaO и окисляющего действия не обнаруживает.
Так же, как нитрат бария, действуют и другие соли азотной кислоты, давая при своем разложении свободный кислород и окислы металлов. Кроме нитратов другие окислители также не всегда выделяют весь свой запас кислорода в свободное состояние. Но существуют окислители, выделяющие весь свой кислород в виде свободного, например, бертолетова соль, или хлорат калия KCIO3 , который разлагается по схеме:
KCIO3 KCI + 3 О.
Кислород, выделяющийся в свободном состоянии при разложении вещества, называется активным, а все количество кислорода, содержащееся в веществе, называется общим с о д е р ж а н и е м к и с л о р о д а.
Пример 2. Составить двойную смесь из хлората калия (окислитель) и сахара (горючее):
KCIO3 + C12H22O11.
Аналогично предыдущему примеру реакция разложения хлората калия:
KCIO3 KCI + 3 О. (1)
Реакция полного сгорания сахара в кислороде до образования СО2:
C12H22O11 + 24 О 12 СО2 + 11 Н2О. (2)
Для уравнения коэффициентов кислорода умножаем уравнение (1) на 8. Получим;
8 KCIO3 8 KCI + 24 О.
Складываем уравнения (1) и (2):
8 KCIO3 8 KCI + 24 О
+ C12H22O11 + 24 О 12 СО2 + 11 Н2О
____________________________________
8 KCIO3 + C12H22O11 12 СО2 + 11 Н2О + 8 KCI
взяв граммолекулярные соотношения веществ, получим:
для хлората калия 8*122,56=980,5 г., где 122,56 – молекулярный вес KCIO3; для сахара 342 г., где 342 – молекулярный вес сахара. Итого смеси 1322,5 г.
Переводя в проценты, получим:
для хлората калия
для сахара
Кроме основных смесей из двух компонентов (двойных) могут применяться тройные смеси. Они состоят из двух двойных смесей, имеющих одинаковые окислители, но разные горючие, т.е. состоят из трех веществ: одного окислителя и двух горючих. Тройные смеси могут состоять также из двух различных окислителей и одного горючего.
Мы разобрали в первом примере случай составления пиротехнической смеси, в которой активного кислорода окислителя не хватает для полного сгорания углерода, содержащегося в горючем. Углерод в этом случае сгорает только до образования СО.
Пиротехнические смеси, в которых кислорода, получаемого при разложении окислителя, не хватает для полного сгорания горючего, имеют так называемый о т р и ц а т е л ь н ы й к и с л о р о д н ы й б а л а н с. Смеси с избытком активного кислорода обладают п о л о ж и т е л ь н ы м к и с л о р о д н ы м б а л а н с о м.
§ 4. ОБРАЗОВАНИЕ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
На базе основной двойной смеси из окислителя и горючего строится более сложный пиротехнический состав.
В зависимости от требований, предъявляемых к составу, к основной смеси примешиваются различные компоненты. Например, для получения пламени, окрашенного в определенный цвет, в состав вводится соль соответствующего металла: для получения зеленого цвета – соли бария, красного – соли стронция, желтого – соли натрия.
Для придания составу механической прочности добавляются особые вещества, обладающие способностью склеивать (или связывать) состав при уплотнении или прессовании его. Такие вещества называются цементаторами, или с в я з ы в а ю щ и м и в е щ е с т в а м и. Обычно они одновременно являются и горючими; это – готовые лаки, олифа, смолы (с добавлением в составы растворителей) и др .
Иногда для уменьшения активности состава или уменьшения чувствительности отдельных компонентов к механическим и тепловым импульсам к составам прибавляют вещества, способные замедлять процессы горения; такие вещества называются ф л е г м а т и з а т о р а м и. К их числу относятся парафин, канифоль, некоторые масла и др.
Разберем пример составления сигнального состава, дающего пламя красного цвета. Для окрашивания пламени возьмем в состав 20% (от всего состава) углекислого стронция SrCO3. В качестве окислителя возьмем хлорат калия KCIO3; в качестве горючего – шеллак С16Н24О5, который одновременно служит цементатором.
При температуре разложения углекислый стронций разлагается по уравнению:
SrCO3 SrO + CO2.
Продукты разложения
SrCO
3
вполне окислены и поэтому не нуждаются в окислителе. Следовательно, окислитель требуется только для того, чтобы дать кислород на сгорание шеллака (горючего), т.е. имеется двойная смесь из хлората калия и шеллака:
KCIO3 + C16H24O5.
Напишем уравнение разложения хлората калия:
KCIO3 KCI + 3 О. (1)
Напишем уравнение горения шеллака в кислороде до полного сгорания в углекислый газ:
C16H24O5 + 39 О 16СО2 + 12 Н2О (2)
Уравняем коэффициенты кислорода в уравнениях (1) и (2), для чего умножим уравнение (1) на 13. получим:
13 KCIO3 13 KCI + 39 О.
Сложив полученное уравнение с уравнением (2), получим:
C16H24O5 + 13 KCIO3 13 KCI + 16СО2 + 12 Н2О
Из этого уравнения найдем количества C16H24O5 и KCIO3 в двойной смеси.
1 граммолекула C16H24O5 составляет 296,2 г.; 13 граммолекул KCIO3 составляют 13*122,56 г. = 1593,8 г. Всего смеси 1890 г.
Переводя в проценты, получим:
для хлората калия
для шеллака
Но в состав входит 20% углекислого стронция и только 80% рассчитанной нами двойной смеси. Следовательно, каждого компонента двойной смеси тоже будет по 80% от полученных нами величин, а именно: хлората калия 84,3*0,8=67,44%; шеллака 15,7*0,8=12,56%.
Общий рецепт будет таким (проц.):
SrCO3 ……………………… 20
KCIO3 ……………………. 67,44
C16H24O5……………………. 12,56
§ 5. НАЧАЛЬНЫЙ ИМПУЛЬС И ВОСПЛАМЕНЕНИЕ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Для воспламенения пиротехнического состава необходимо затратить какое-то количество энергии, которое обычно называется н а ч а л ь н ы м и м п у л ь с о м. Во многих случаях от характера начального импульса зависит характер реакции сгорания пиротехнического состава.
 В качестве начального импульса могут быть использованы: механическая энергия (удар, трение), лучистая (ультрафиолетовые лучи, свет), тепловая, химическая энергия.
В качестве начального импульса могут быть использованы: механическая энергия (удар, трение), лучистая (ультрафиолетовые лучи, свет), тепловая, химическая энергия.
Часто действие различных видов энергии сводится к воздействию тепловой энергии, например, при ударе и трении развивается повышенная температура; то же происходит и при воздействии крепкой серной кислоты на состав: при химической реакции между кислотой и отдельными компонентами состава тоже выделяется тепло.
Иногда один и тот же состав при воспламенении его от искры сгорает сравнительно медленно, а при более мощном начальном импульсе реакция протекает со взрывом.
Каждый состав или основная смесь воспламеняются при определенной температуре. Эта температура – очень важная характеристика состава; знание ее позволяет установить безопасный режим работы при производстве и применении данного состава.
Рис. 1. Прибор для определения температуры самовоспламенения.
1- железная баня;
2- испытуемый состав;
3- сплав Вуда;
4- электронагрев;
5- латунный футляр;
6- 6- термометр.
Температура, при которой начинается горение состава под действием пламени, называется т е м п е р а т у р о й в о с п л а м е н е н и я .
Но, иногда, состав, подвергающийся нагреву, может самовоспламениться без воздействия огня. Температура, при которой в определенных условиях нагрева состав самовозгорается. Называется т е м п е р а т у р о й с а м о в о с п л а - м е н е н и я. Эта температура для каждого состава определяется следующим опытом (рис. 1).
В металлическую пробирку 2 помещают 0,5 г состава. В железной бане 1 расплавляется сплав Вуда. Когда температура в бане достигнет 100 градусов , в сплав Вуда погружают пробирку с составом приблизительно на 0,3 ее длины. Далее баню нагревают с такой интенсивностью, чтобы температура ее повышалась на 20 градусов в минуту, и отмечают температуру в момент самовоспламенения состава.
При испытании различных составов установлено, что некоторые осветительные составы самовоспламеняются при температуре около 330 градусов, цветные хлоратные составы – около 215-225 градусов. Хлорат сильно понижает температуру самовоспламенения состава.
§ 6. ЧУВСТВИТЕЛЬНОСТЬ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Чувствительность пиротехнических составов к действию начального импульса – к огню, и удару и к трению – зависит от химических свойств компонентов, от степени их измельчения, от плотности состава и от примесей к компонентам. Характеристика чувствительности составов чрезвычайно важна как с точки зрения применения их в различных изделиях, так и для разработки безопасного режима производства и обработки в заводских условиях.
Чувствительность состава определяется экспериментально.
Увеличение степени измельчения компонентов увеличивает чувствительность состава. Это явление можно объяснить тем, что увеличивается поверхность реагирующих компонентов, а это облегчает условия возбуждения реакции горения.
С увеличением плотности чувствительность состава уменьшается. При большой плотности энергия, сообщаемая начальным импульсом, распределяется на относительно большую массу, и эффективность воздействия на отдельные части состава несколько снижается.
Примеси в основных компонентах влияют на чувствительность состава двояко. Некоторые примеси увеличивают ее, другие уменьшают. Твердые примеси с острыми краями (песок, осколки стекла, твердые металлические стружки и т.п.) увеличивают чувствительность состава к трению. Другие примеси, способные обволакивать частицы компонентов, входящих в состав, наоборот, уменьшают его чувствительность. Так действуют парафин, олифа, касторовое масло, канифольный лак и некоторые другие вещества, называемые ф л е г м а т и з а т о р а м и.
Некоторые инертные примеси, например кизельгур, понижают чувствительность состава, воспринимая часть энергии, сообщаемой составу каким-либо начальным импульсом.
Ч у в с т в и т е л ь н о с т ь с о с т а в о в к д е й с т в и ю о г н я, т. е. в о с п л а м е н я е м о с т ь, определяется действием луча огня от горящего бикфордова шнура или от газовой горелки. Бикфордов шнур состоит из хлопчатобумажной оплетки с запрессованным внутри пороховым столбиком.
Для испытания бикфордовым шнуром небольшую навеску состава (о,1 –0,2 г) помещают на дно пробирки, неплотно закрытой пробкой; в пробирку вставляют отрезок бикфордова шнура. Наибольшее расстояние между концом шнура и поверхностью состава, при котором последний воспламеняется, может служить мерой чувствительности состава. Хлораты повышают чувствительность составов к огню.
Чувствительность составов к огню газовой горелки определяется на специальном маятниковом приборе (рис. 2).


Небольшое количество испытуемого состава насыпается в железную чашечку b вровень с ее краями. Чашечка находится на нижнем конце маятника, который, качаясь, проходит через пламя бунзеновской горелки a. При этом по шкале отмечается либо начальное положение маятника (т.е. угол его отклонения), при котором первое качание его даст воспламенение состава, либо то количество качаний при данном угле отклонений, которое потребуется для воспламенения состава.
Данные испытаний пиротехнических составов на чувствительность к воспламенению, приводимые в статье Ленце и др. (перевод в сбор-
нике «Пиротехния» № 1), показывают, что результаты, получаемые двумя описанными выше способами, соответствуют друг другу. Хлоратные составы сравнительно легко воспламеняются при обоих испытаниях. Составы, содержащие в качестве окислителя нитраты, воспламеняются труднее. Сравнительно легко воспламеняются составы, содержащие пороховую мякоть.
Чувствительность пиротехнических составов к удару определяется на приборе, называемым копром. Он устроен следующим образом (рис. 3). Между двумя неподвижными рельсами 1 свободно скользит стальной груз 2 (вес его можно брать 2,5 или 100 кг). Груз в верхней части заканчивается головкой, зажимаемой между стальными лапками выключателя. Специальным приспособлением выключатель с грузом можно перемещать на различную высоту, измеряемую по шкале. Под рельсами на прочном фундаменте помещается стальная наковальня 3, на которой установлен штемпельный приборчик Каста (рис. 4).
 Приборчик Каста состоит из стальной наковальни 1 с основанием, стального бойка 2 с головкой и стальной направляющей муфты 3. ударные поверхности бойка и наковальни обычно хорошо пришлифовываются.
Приборчик Каста состоит из стальной наковальни 1 с основанием, стального бойка 2 с головкой и стальной направляющей муфты 3. ударные поверхности бойка и наковальни обычно хорошо пришлифовываются.
Небольшая навеска состава помещается между ударными поверхностями наковальни и бойка. Груз ударяет по головке бойка; чтобы отскочивший при ударе груз не упал вторично, его удерживает специальное приспособление.
В зависимости от чувствительности состава, веса груза и высоты его падения состав при ударе может воспламениться или дать отказ. Иногда за меру чувствительности принимается процент воспламенений (или взрывов) состав при 20 или более испытаниях ударом одного и того же груза с той же высоты. Можно также принимать за меру чувствительности величину работы удара груза, вызывающего воспламенение. При опытах установлено, что наибольшей чувствительностью обладают составы с хлоратом бария.
Ч у в с т в и т е л ь н о с т ь п и р о т е х н и ч е с к и х с о с т а в о в к т р е н и ю обычно определяется простым растиранием маленькой навески состава в фарфоровой ступке. Вспышки при этом доказывают, что состав чувствителен к трению. Этот способ прост, но недостаточно точен и объективен. Между тем большинство составов в производственных процессах подвергаются трению, и очень важно найти более точный способ определения чувствительности составов к трению.
§ 7. СКОРОСТЬ ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Под скоростью горения обычно понимают время в секундах, в течение которого горение распространяется на 1 см длины изделия из определенного состава. Различные пиротехнические составы горят с разной скоростью; она зависит от многих причин. Если рассмотреть с к о р о с т ь г о р е н и я о с н о в н о й д в о й н о й с м е с и, можно установить зависимость этой скорости от следующих основных факторов: а) от свойств окислителя и горючего; б) от величины зерен каждого компонента, в) от плотности смеси.
а) С в о й с т в а к о м п о н е н т о в – важнейший фактор, влияющий на скорость горения. Например, хлораты со всеми горючими дают смеси, горящие значительно быстрее, чем нитраты с теми же горючими.
К быстро горящим смесям можно отнести:
KCIO3 + S,
KCIO3 + C,
KCIO3 + сахар,
KCIO3 + шеллак,
Ba(CIO3)2 + S,
KNO3 + C.
К медленно горящим смесям относятся:
KCIO3 + канифоль,
Ba(CIO3)2 + канифоль,
Ba(NO3)2 + шеллак,
Sr(NO3)2 + идитол.
б) С т е п е н ь и з м е л ь ч е н и я к о м п о н е н т о в, или величина их зерен, влияет на скорость горения смеси следующим образом: чем мельче зерна компонентов, тем больше скорость горения. Большая степень измельчения увеличивает поверхность горения и ускоряет процесс.
в) У в е л и ч е н и е п л о т н о с т и с м е с и обычно уменьшает скорость ее горения, затрудняя распространение реакции горения внутрь состава. Однако для многих смесей существует некоторый предел плотности, после которого увеличение ее уже не изменяет скорости горения.
При прибавлении к основной двойной смеси различных компонентов для образования состава скорость горения его изменяется. Это изменение зависит от всех разобранных выше факторов, от свойств добавок и характера взаимодействия между компонентами
состава. Поэтому изучение скорости горения многокомпонентных составов значительно сложнее, чем изучение горения основных двойных смесей.
Некоторые добавки, не участвующие в реакции горения, замедляют процесс. Такими замедлителями могут служить инертные, негорючие вещества – инфузорная земля и др. Иногда для ускорения реакции горения в состав вводят ускорители, или так называемые а к т и в а т о р ы, например, перекись марганца. Иногда для регулирования скорости горения смешивают две или несколько смесей, имеющих разные скорости горения.
Если при этом две смеси имеют один и тот же окислитель или горючее, получается так называемая т р о й н а я с м е с ь. Примером тройной смеси из одного окислителя и двух горючих является дымный порох, состоящий из калиевой селитры, серы и угля. Такие тройные смеси обычно имеют значительно большую скорость горения, чем каждая из исходных двойных смесей. Это явление можно объяснить схематично следующим образом. В первый момент возникновения горения начинает гореть горючее, имеющее большее сродство с кислородом; при этой реакции выделяется тепло, которое улучшает скорость горения второго горючего. Горение его будет в свою очередь способствовать более энергичному горению первого горючего. Таким образом процесс сравнительно быстро развивается, и скорость горения значительно возрастает. Следовательно, при горении тройной смеси реакция проходит чрезвычайно энергично, скорость горения значительно превышает скорость горения двойных смесей.
Дымный порох можно рассматривать как состав, образованный двумя двойными смесями:
1-я смесь – калиевая селитра KNO3 + уголь С;
2-я смесь – калиевая селитра KNO3 + сера S.
Первая смесь имеет скорость горения 5 см/сек. Вторая смесь при обыкновенных условиях совсем не загорается, а нагревается до 100 градусов горит слабо. Тройная смесь (порох) горит со скоростью 1 – 0,6 см/сек.
Экспериментально скорость горения наиболее просто определяется следующим образом. Состав прессуется в виде цилиндра определенных размеров, воспламеняется от определенного начального импульса, и с помощью секундомера определяется продолжительность его горения.
§ 8. ИЗУЧЕНИЕ ПРОДУКТОВ РЕАКЦИИ ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
В результате сгорания пиротехнического состава получается газообразные и твердые продукты. Изучение их позволяет точно установить ход реакции, изучить процесс их горения и на этой основе видоизменить состав в соответствии с требованиями, предъявляемыми к нему.
Обычно исследуют: а) продукты сгорания, б) объем газов, в) вес твердых продуктов (шлаков).
Х и м и ч е с к и й а н а л и з п р о д у к т о в с г о р а н и я производится после охлаждения их. Состав сжигается в герметически закрытом специальном приборе, затем его охлаждают до комнатной температуры и через отвод улавливают образовавшиеся при реакции газы, а затем прибор открывают и из него извлекают твердые продукты.
О б ъ е м о б р а з о в а в ш и х с я г а з о в м о ж н о о п р е д е л и т ь о п ы т н ы м п у т е м и т е о р е т и ч е с к и н а о с н о в а н и и р а с ч е т а.
Определить объем газов опытным путем в процессе горения при температуре, иногда доходящей до 2000 – 3000 градусов, практически невозможно. Это определение производится в особых герметически закрытых приборах, после охлаждения их до нормальной комнатной температуры, как указано выше. Кроме того, объем полученных газов может быть рассчитан по увеличению давления, отмечаемого манометром. Можно также перевести газы в газометр, в котором их объем отсчитывается после приведения к атмосферному давлению.
Теоретический расчет объема газов производится по уравнению реакции горения пиротехнического состава. Основанием для расчета служит закон Авогадро-Жерара. По этому закону «в равных объемах газов при одинаковых условиях давления и температуры содержится одинаковое количество молекул». Следовательно, объем 1 граммолекулы газа при определенных условиях давления и температуры будет величиной постоянной для всех газов, независимо от их свойств и состава.
Вычислено, что при температуре 0 градусов и давлении 760 мм. рт. ст. объем 1 граммолекулы газа 22,4 л. Отсюда, зная количество граммолекул газов, выделившихся в результате реакции горения пиротехнического состава, легко определить их объем.
Разберем сказанное на примере.
Требуется определить объем газов, выделившихся в результате сгорания пиротехнической двойной смеси, состоящей из нитрата калия (селитры) и угля. Реакция горения будет выражаться уравнением:
4 KNO3 + 5 C 2 K2CO3 + 3 CO2 + 2 N2
Количество молекул газообразных продуктов:
3 + 2 = 5 моль.
Следовательно, объем газов, выделившихся при сгорании 4 граммолекул селитры и 5 граммолекул углерода:
5 * 22,4 = 112 л.
Для вычисления объема газообразных продуктов реакции, выделившихся в результате сгорания 1 кг состава, найденную выше величину нужно умножить на 1000 и разделить на число, выражающее сумму молекулярных весов компонентов, входящих в состав в соответствующих количествах:
где 101 – молекулярный вес KNO3;
12 – атомный вес С.
Исходя их уравнения реакции, можно определить и вес образующихся в результате ее твердых продуктов. Разберем, например, реакцию горения дымного пороха, состоящего из смеси калиевой селитры KNO3 серы S и угля С. Реакцию разложения пороха можно выразить уравнением:
10 KNO3 +4 S + 12 C = 8 CO2 + 3 CO + 5 N2 + K2CO3 + 2 K2SO4 + K2S. (1)
Сначала по известному уже нам способу определим объем газов. Количество молекул газов будет:
8 + 3 + 5 = 16 мол.
Следовательно, из 1 кг пороха выделится:
л газов;
здесь 1282 – сумма молекулярных весов компонентов пороха в соответствующих количествах.
Но в результате реакции, кроме газообразных продуктов, образовались и твердые продукты K2CO3, K2SO4 и K2S с количеством молекул в каждом по уравнению (1). Следовательно, вес K2CO3 будет равен его молекулярному весу, а веса K2SO4 и K2S будут равны их молекулярным весам, умноженным на число граммолекул, т.е. на 2. Итак,
вес K2CO3 = 138 г;
вес 2 K2SO4 = 2 * 174 = 348 г;
вес 2 K2S = 110 г.
Следовательно, вес всех твердых веществ 596 г.
Чтобы вычислить количество твердых веществ, получаемое на 1 кг пороха, делим полученный вес на 1282.
Получим:
кг твердых продуктов.
§ 9. ТЕПЛОВОЙ ЭФФЕКТ ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Химические реакции можно разделить на реакции, которые протекают с выделением тепла, и на реакции, которые протекают с поглощением его. Реакции первого типа называются э к з о т е р м и ч е с к и м и , а второго типа – э н д о т е р м и ч е с к и м и .
Горение пиротехнических составов является экзотермической реакцией.
Образование веществ также происходит в результате либо экзо- либо эндотермических реакции. Выделение при реакции тепла обычно обозначают + Q и поглощение тепла – Q.
Уравнение экзотермической реакции разложения хлората калия можно представить в следующем виде :
KCIO3 KCI + 3 O + Q,
где Q =11,9 кал.
При соединении некоторых элементов в сложные химические вещества также происходит выделение или поглощение тепла. Для каждого соединения теплота образования ровна теплоте его разложения, но знаки у этих теплот взаимно противоположны. Следовательно, если при образовании воды в жидком виде из атомов водорода и кислорода выделяется Q кал тепла, то для разложения воды на водород и кислород надо затратить тоже Q кал. Сказанное можно условно выразить следующими реакциями:
Реакция эндотермическая, идущая с поглощением теплоты (закон Лавуазье и Лапласа)
Н2О 2 Н + О – 68,4 кал.
В некоторых случаях одно вещество можно получить различными путями. Изменяя условия, в которых протекает реакция, можно в один прием получать конечные ее продукты, либо,останавливаясь на промежуточных продуктах, дойти до тех же конечных. При этом теплота образования (или разложения) химического соединения будет одной и той же, независимо от того, произошло ли последовательных реакции (закон Гесса). При образовании 1 граммолекулы угольного ангидрида из 1 атома углерода и 2 атомов кислорода выделяется 94,5 кал, т.е.
2О + С СО2 + 94,5 кал.
При последовательном образовании угольного ангидрида, сначала получая окись углерода из 1 атома углерода и 1 атома кислорода, а затем присоединяя 1 атом кислорода к 1 молекуле окиси углерода, получим сумму теплот образования, также равную + 94,5 кал.
Сказанное выражается уравнениями:
2О + С СО2 + 94,5 кал. (1)
О + С СО + 26,2 кал. (2)
СО + О СО2 + 68,3 кал. (3)
Общая сумма теплот образования СО2 во втором случае 26,2 + 68,3 = 94,5 кал.
Теплота образования одного вещества изменяется в зависимости от того, в каком агрегатном состоянии оно получается.
На основании разобранных выше законов термохимии (учение о теплоте, сопровождающей химические реакции) можно теоретически определить количество тепла, выделившегося при горении или при разложении веществ.
Теплота образования очень многих различных соединений определена и указана в специальных термохимических таблицах.
Теплота горения (или теплота разложения) может быть определена по уравнению:
Qгор = Q2 – Q1,
Где Qгор - количество калорий тепла, выделившегося в результате реакции горения;
Q2 – сумма теплот образования конечных продуктов реакции;
Q1 – сумма теплот образования начальных продуктов реакции.
Теплоту реакции можно определить теоретически или опытным путем.
Разберем примеры теоретического определения теплоты реакции.
О п р е д е л и т ь т е п л о т у р е а к ц и и в з а и м о д е й с т в и я а з о т н о к и с л о г о б а р и я с а л ю м и н и е м.
Уравнение реакции:
3Ba(NO3)2 + 10 AI 3 BaO + 5 AI2O3 +3 N2 + Qгор.
Сумма теплот образования начальных продуктов равна теплоте образования Ba(NO3)2, умноженной на число взятых в реакцию его молекул: алюминий – элемент и теплоты образования не имеет. Теплота образования Ba(NO3)2 равна 238,2 кал.
Следовательно,
Q1 = 238,2 * 3 = 714,6 кал.
Сумма теплот образования конечных продуктов реакции представляет собой сумму образования 3 мол ВаО и 5 мол AI2O3 равна 389,4 кал.
Следовательно,
Q2 = 3 * 133,1 + 5 * 389,4 = 2346,3 кал;
откуда
Qгор = Q2 – Q1 = 2346,3 – 714,6 = 1631,7 кал.
Уравнение реакции можно теперь написать более полно:
3Ba(NO3)2 + 10 AI 3 BaO + 5 AI2O3 +3 N2 + 1631,7 кал.
Для определения количества тепла, выделяющегося из 1 кг смеси начальных компонентов разделим полученное количество теплоты на сумму их молекулярных весов и умножим на 1000:
кал/кг.
Теплоту разложения окислителя также можно определить теоретически.
У р а в н е н и е р а з л о ж е н и я н и т р а т а к а л и я:
2 KNO3 K2O + N2 + 2,5 O2.
Теплота образования 1 мол KNO3 = 119,5 кал; теплота образования 1 мол K2O = 86,8 кал. Азот и кислород как элементы не имеют теплот образования.
Следовательно, теплота разложения KNO3
Q = 86,8 – 2 * 119,5 = - 152,2 кал.
При этом считаем, что KNO3 – начальный продукт реакции, а K2O, N2 и O2 – конечные продукты, которые могут быть получены из KNO3.
Теплоту горения пиротехнического состава можно подсчитать правильно лишь в тех случаях, когда реакция проходит точно по уравнению и не происходит образования других продуктов, не участвует в реакции кислород воздуха и т.п. Практически, однако, большей частью реакция проходит с некоторыми отклонениями от теории. Поэтому кроме теоретического подсчета обычно необходимо определять теплоту реакции опытным путем. Она определяется в специальном приборе – калориметрической бомбе (рис. 5)

Это прочный стальной цилиндрический сосуд, герметически закрывающийся стальной крышкой. В крышке имеется кран для выпуска газов. Для навески испытуемого вещества внутри бомбы помещается платиновая чашечка С, удерживаемая платиновым стержнем S1, ввинченным в крышку бомбы. По тонкой платиновой проволочке S2 пропускают электрический ток для воспламенения состава. Бомба помещается в водяной калориметр (рис. 5а). Вода в калориметре и в рубашке перемешивается мешалками М2 и М1. температуру воды измеряют термометрами Т1 и Т 2. при сгорании состава внутри бомбы выделяется некоторое количество тепла, повышающее температуру воды в калориметре. Перед опытами определяется так называемый водяной эквивалент калориметрической системы, т.е. количество воды, которое при нагревании на 1° требует столько
тепла, сколько его требует сумма всех деталей калориметра. Водяной эквивалент определяется сжиганием в бомбе вещества с известной теплотой горения. Зная водяной эквивалент, сжигают испытуемый состав в бомбе и по изменению температуры воды в калориметре рассчитывают количество тепла, выделившегося при сгорании единицы веса состава. Если это количество тепла обозначить Q, то его можно определить по формуле:
,
где t2 - температура воды в калориметре после сжигания состава;
t1 – температура воды в калориметре до сжигания состава;
Р – вес воды в калориметре;
W - водяной эквивалент;
m – вес сжигаемого состава.
Зная количество теплоты, выделяющееся при сгорании 1 г состава, можно приближенно вычислить температуру реакции. Точных методов практического определения температуры реакции пиротехнических составов еще до сих пор не найдено; на практике температуру реакции можно приближенно определить специальными пирометрами.
§ 10. СТОЙКОСТИ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Способность составов не изменять с течением времени своих физико-химических свойств называется с т о й к о с т ь ю.
Стойкость пиротехнических составов имеет очень важное значение. Если компоненты состава способны самопроизвольно реагировать между собой, то при длительном его хранении химическая природа компонентов и действие состава изменится. Если при этом взаимодействии будет выделяться тепло, то при хранении состав может самовоспламениться.
Иногда стойкость составов нарушается действием различных примесей, сопровождающих основные компоненты, в частности воды. Вода может вступать в реакцию с металлами – магнием или алюминием, которые являются компонентами многих составов. При этих реакциях выделяется тепло, которое может при длительном пребывании состава во влажной атмосфере вызывать его самовоспламенение. При наличии в числе компонентов гигроскопических веществ (т.е. веществ, способных притягивать влагу из окружающей среды) состав легко увлажняется и может оказаться нестойким.
Весьма важно знать степень стойкости составов. Для этой цели их подвергают воздействию влаги, повышенной температуре и других факторов, после чего составы анализируют и изучают произошедшие изменения.
§ 11. ВЗРЫВЧАТЫЕ СВОЙСТВА ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Многие пиротехнические составы при некоторых условиях, например при сгорании в замкнутом пространстве, при воздействии весьма мощного начального импульса и т.п., обнаруживают свой взрывчатые свойства.
Взрывчатые свойства составов характеризуются скоростью детонации, бризантностью и фугасным действием. В процессе сгорания составов, как и при взрывах взрывчатых веществ, выделяется много газов, но горение составов сопровождается все же значительно меньшим газообразованием.
С к о р о с т ь д е т о н а ц и и, т.е. скорость распространения реакции, при действии одинаково мощного начального импульса на пиротехнические составы с хлоратами не превышает 2500 м/сек, в то время как для некоторых взрывчатых веществ она доходит до 8000 м/сек. Пиротехнические составы, имеющие в качестве окислителей нитраты, обычно не дают скорости детонации больше 1000 м/сек, а некоторые составы вообще не детонируют.

Б р и з а н т н о с т ь с о с т а в о в, т.е. их мощность, оценивается обычно количеством возможной работы в единицу времени. По сравнению с взрывчатыми веществами пиротехнические составы обладают малой бризантностью. Составы с хлоратами наиболее бризантны. Бризантность определяется сравнением степеней обжатия свинцовых столбиков при взрыве состава.
Ф у г а с н о е д е й с т в и е с о с т а в о в – их способность расширять объем, в котором в начальный момент образовались продукты взрывчатого разложения. Фугасность пиротехнических составов сравнительно невелика. Наибольшее расширение объема дают составы, содержащие хлораты. Испытание на фугасное действие производится в бомбе Трауцля: она представляет собой свинцовый цилиндр с цилиндрическим каналом (рис. 6). В канал помещается навеска состава и воспламеняется. Под давлением образовавшихся в закрытом пространстве газов цилиндрический канал расширяется, приобретая грушевидную форму (рис. 7). По увеличению объема канала (измеряемого водой) судят о фугасности состава.
§ 12. КЛАССИФИКАЦИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Все пиротехнические составы можно разделить по действию их на: 1) пламенные, 2) дымовые, 3) динамические.
Первые две группы можно подразделить на более мелкие группы.
В группу пламенных входят составы: осветительные, сигнальные ночные, трассирующие и некоторые зажигательные.
В группу дымовых составов входят составы для дневной сигнализации и составы маскирующих дымов.
Контрольные вопросы к главе II
Что такое окислитель и какова его роль в пиротехническом составе?
Какими свойствами должен обладать цементатор?
Чем отличаются друг от друга разные горючие вещества и как использует эти отличия пиротехника?
Что такое основная смесь?
Какие основные компоненты входят в пиротехнический состав?
Что такое детонация?
Как изменяется характер горения в зависимости от внешних условий?
Что такое начальный импульс?
Какие существуют виды начального импульса?
Как определяется температура самовоспламенения?
Как влияет изменение плотности составов на скорость горения?
Что такое флегментаторы?
В чем заключается закон Авогадро-Жерара?
Определить объем газов, выделяющихся при реакции разложения 5 кг калиевой селитры по уравнению:
2 KNO3 K2O + N2 + 2,5 O2.
Определить объем газов и вес твердых веществ, образующихся при разложении 7 кг перхлората бария Ba(CIO4)2 по уравнению:
Ba(CIO4)2 BaCI2 + 4 O2.
Что такое теплота образования химического соединения?
Какие реакции называют экзотермическими?
Как определяется количество тепла, выделяемое при реакции горения?
Как влияет величина теплоты образования вещества на его способность к взрыву?
Что такое температура самовоспламенения?
Как можно повысить чувствительность пиротехнического состава к механическим воздействиям?
Какие примеси понижают чувствительность пиротехнического состава и как они называются?
Какие свойства веществ оказывают большое влияние на их чувствительность?
Что такое стойкость пиротехнического состава?
Какое правило облегчает составление уравнения реакции горения?
Написать реакцию взаимодействия хлората калия с углем.
Рассчитать основную смесь из калиевой селитры KNO3 и магния Mg.
На какие группы классифицируют пиротехнические составы?
ГЛАВА III
СЫРЬЕ И ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ ДЛЯ ПРОИЗВОДСТВА ПИРОТЕХНИЧЕСКИХ ИЗДЕЛИЙ
§ 1. ОБЩИЕ ТРЕБОВАНИЯ К СЫРЬЮ
Для получения требуемого эффекта при сгорании пиротехнического состава все продукты, входящие в него, должны иметь строго определенные физико-химические свойства. По назначению различных компонентов в составах все исходные продукты можно подразделить на следующие группы: окислители, горючие и цементирующие вещества, цветнопламенные добавки, вспомогательные добавки, красители дыма.
В пиротехнике для изготовления составов следует применять вещества, очищенные от загрязнений и примесей, негигроскопичные, сравнительно недорогие, отечественного происхождения или изготовления.
Отсутствие загрязнений или примесей обеспечивает получение определенного действия вещества; примеси, загрязняющие продукт, изменяют его действие в составе, чувствительность состава и др. Однако некоторые примеси в небольшом количестве могут быть допущены. Для каждого продукта опытным путем устанавливаются допускаемые нормы тех примесей, которые не вредят составу. Каждый продукт, поступающий в производство, подвергается химическому анализу, в результате которого проверяется количество примесей в нем.
Совокупность требований к химическому составу, чистоте и физико-химическим свойствам вещества обычно называется т е х н и ч е с к и м и у с л о в и я м и.
Способность некоторых веществ притягивать влагу из окружающей их среды называется г и г р о с к о п и ч н о с т ь ю. Гигроскопичные вещества не следует употреблять для пиротехнических составов. Еще в процессе производства влажность их увеличивается, увлажняя состав, что недопустимо в пиротехнических изделиях.
При хранении изделий гигроскопичные вещества также увеличивают влажности состава.
§ 2. ОКИСЛИТЕЛИ
Окислители представляют собой вещества, богатые кислородом и способные легко отдавать его.
Легкость отщепления кислорода от молекул окислителей объясняется сравнительно малой прочностью непосредственной связи между кислородом и другими атомами, например, хлором, азотом.
Примером строения молекул окислителей могут служить азотнокислый калий

хлорноватокислый калий

По химическому составу окислители, применяемые в пиротехнике, можно разделить на следующие основные группы: 1) хлораты, 2) перхлораты, 3) нитраты, 4) окислы металлов.
Некоторые окислители одновременно, служат и носителями цветности пиротехнического пламени. Они называются цветно-пламенными окислителями. К ним принадлежат, например, хлорат бария и нитрат стронция.
Хлораты
Хлораты представляют собой соли хлорноватой кислоты HCIO3.
Хлорноватая кислота соединение неустойчивое, быстро разлагается; при разложении ее выделяется газ CIO2 (двуокись хлора), который на воздухе поджигает такие вещества, как хлорок, бумага, дерево.
Хлорноватая кислота с различными металлами образует соли. В пиротехнике применяются, главным образом, хлорноватокислый калий и хлорноватокислый барий; реже применяется хлорноватокислый натрий, отличающийся сравнительно большой гигроскопичностью.
Все хлораты разлагаются, выделяя тепло и свободный кислород.
Х л о р н о в а т о к и с л ы й к а л и й (б е р т о л е т о в а с о л ь) KCIO3, молекулярный вес 122,56; впервые был получен ученым Бертоле, по имени которого и называется.
Хлорат калия получается хлорированием извести с последующим обменным разложением хлорноватокислого кальция с солями калия по уравнениям:
6 Ca(OH)2 + 6 CI2 Ca(CIO3)2 + 5 CaCI2 + 6 H2O;
Ca(CIO3)2 + 2KCI CaCI2 + 2KCIO3.
Полученный таким образом хлорноватокислый калий в случае надобности может быть очищен перекристаллизацией из горячей воды.
Хлорат калия с трудом растворяется в воде при низких температурах; при охлаждении горячего концентрированного раствора хлорат кали выкристаллизовывается. По внешнему виду он представляет собой мелкие белые ромбические кристаллы. Температура плавления 357,1 градус, температура разложения 364 градуса. При этой темпе-
ратуре хлорат калия разлагается сравнительно медленно; часть кислорода, которая выделяется при разложении КСIO3, окисляет оставшийся неразложившимся КСIO3 в соединение КСIO4 (хлорно-кислый калий) по уравнению:
4 КСIO3 З КСIO4 + K СI + Q,
где Q —тепло, выделяющееся при разложении.
В присутствии примесей, играющих роль катализаторов разложения (например, некоторые окислы металлов, песок, стекло и др.), или веществ, способных легко окисляться (горючих), хлорат калия разлагается очень энергично; реакция идет с выделением большого количества кислорода по уравнению:
2 КСIO3 2КСI + ЗО2 + Q.
Реакция разложения хлората калия экзотермична.
В присутствии примесей хлорат калия разлагается настолько энергично, что иногда вызывает взрыв. Смесь бертолетовой соли с горючими веществами легко воспламеняется от действия небольшого количества концентрированной серной кислоты. Это явление объясняется тем, что при действии серной кислоты на бертолетову соль выделяется свободная хлорноватая кислота, которая разлагается с образованием двуокиси хлора. Последняя, как указано выше, обладает свойством зажигать горючие вещества.
Реакцию образования СIO2 можно представить уравнениями:
2КСIO3 + H2SO4 K2SO4 + 2HCIO3;
ЗНCIO3 2CIO2 + HCIO4 + H2O.
Эта реакция используется в пиротехнике для воспламенения некоторых составов.
Хлорат калия в чистом виде негигроскопичен. Однако примеси, в частности, хлористого кальция, вызывают некоторую его гигроскопичность.
Хлорат калия применяется в пиротехнике в качестве окислителя, главным образом, в цветнопламенных составах. Составы с бертолетовой солью очень чувствительны к механическим воздействиям. Поэтому работа с такими составами требует осторожности, чистоты и аккуратности.
Х л о р н о в а т о к и с л ы й б а р и й Ва(СIO3)2Н2O, молекулярный вес 322,29; получается из природного минерала витерита действием на него хлора при нагревании (может быть также получен электролизом из насыщенного при 75° раствора хлористого бария).
Хлорат бария растворяется в воде; в спирте нерастворим, кристаллизуется в прозрачные призматические кристаллы, при температуре 300—310° разлагается; в сухом виде при нагревании до более высокой температуры взрывает.
Реакция разложения хлората бария проходит аналогично разложению хлората калия по уравнению:
Ва(CIO3)2 ВаСI2 + 3O2 + Q.
В смеси с горючими хлорат бария дает энергичную вспышку; составы с хлоратом бария чувствительны к механическим воздействиям.
Пламя, образуемое составами с хлоратом бария, имеет ярко-зеленую окраску. Следовательно, хлорат бария в составах является одновременно окислителем и носителем цветности, почему он может быть назван цветнопламенным окислителем.
Хлорат бария применяется, главным образом, для составов зеленого огня. При работе с ним следует применять те же меры предосторожности, что и при работах с хлоратом калия.
Перхлораты
Перхлораты — соли хлорной кислоты НСIO4. Хлорная кислота в свободном состоянии чрезвычайно нестойка: на воздухе дымит, легко взрывает в присутствии горючих веществ, воспламеняет бумагу, дерево. Водный раствор ее безопасен.
Соли хлорной кислоты — перхлораты — более стойки, чем хлораты. Это объясняется тем, что реакция разложения перхлоратов происходит с поглощением тепла. В пиротехнике применяется перхлорат калия.
П е р х л о р а т к а л и я (или хлорнокислый калий) КСIO4, молекулярный вес 138,56; представляет собой белый кристаллический порошок, слабо растворяющийся в воде и негигроскопичный. При температуре 420° начинает разлагаться по уравнению:
4 КСIO4 2 КСIO3 + 2 КСI + 5 O2.
При более энергичном нагревании или в смеси с горючими веществами разложение перхлората калия идет с образованием хлористого калия и кислорода по уравнению:
КСIO4 -> КСI + 2O2 - Q,
где Q — количество тепла, требуемое для разложения перхлората, равно 7,8 кг-кал.
Составы с перхлоратом менее чувствительны к механическим воздействиям, чем составы с хлоратами.
Перхлорат калия применяется в качестве окислителя; он дает более спокойное горение, чем хлорат калия. Работа с ним требует тех же мер предосторожности, что и с хлоратами. Перхлоратные составы обладают чувствительностью к трению и удару, хотя и в меньшей степени, чем хлоратные. Высокая стоимость перхлората калия ограничивает его применение.
Нитраты
Нитраты представляют собой соли азотной кислоты. Азотная кислота —очень важный для техники продукт; она применяется во многих отраслях химической промышленности. Действием азотной кислоты на некоторые органические продукты получаются нитропроизводные, служащие для приготовления взрывчатых веществ, красителей и др.
Все нитраты являются хорошими окислителями; они легко отдают свой кислород, выделяя азот, различные его окислы, или аммиак (в зависимости от условий реакции). Нитраты более стойки в химическом отношении, чем хлораты, но также образуют с горючими веществами легко воспламеняющиеся смеси.
В пиротехнике большей частью применяются азотнокислые соли калия, бария, стронция, реже — натрия.
Разложение нитратов происходит с поглощением тепла.
А з о т н о к и с л ы й к а л и й (н и т р а т к а л и я, или к а л и е в а я с е л и т р а) KNO3, молекулярный вес 101,1; образуется в почве при гниении органических соединений.
Технически азотнокислый калий можно получить реакцией обменного разложения азотнокислого натрия и хлористого калия или из синтетической азотной кислоты.
Азотнокислый калий — белый порошок или бесцветные кристаллы ромбической системы; легко растворим в воде. Температура плавления 337°, температура разложения 400°.
Нитрат калия разлагается с выделением части содержащегося в нем кислорода по уравнению:
4KNO3 2К2O + 2N2 + 5O2.
Таким образом в азотнокислом калии 39,6% активного кислорода, а общего кислорода 47,5%.
Выделяющийся кислород используется на окисление горючих в составах. Обычно нитрат калия содержит примеси нитрата натрия, хлористых калия и натрия, которые в сильной степени повышают его гигроскопичность. Поэтому в нитрате калия, применяемом в пиротехнике, чистого продукта должно быть не меньше 99,0%.
Калиевая селитра применяется в качестве окислителя во многих пиротехнических составах. Вследствие сравнительно большей стойкости нитратов составы с ними обладают меньшей чувствительностью к механическим воздействиям, чем хлоратные, и дают возможность при соответствующих мерах предосторожности легче механизировать производственные процессы, чем в случае применения хлоратов.
А з о т н о к и с л ы й н а т р и й (н и т р а т н а т р и я, или н а т р и е в а я с е л и т р а) NaNO3, молекулярный вес 85; образуется в природе так же, как и калиевая селитра. Природные месторождения находятся в Чили и Перу, отчего азотнокислый натрий часто называют чилийской селитрой. В СССР добывается в Средней Азии и на Кавказе.
Нитрат натрия — бесцветные кубические кристаллы; после измельчения они имеют вид белого порошка.
Нитрат натрия хорошо растворим в воде и очень гигроскопичен, почему им нельзя заменить нитрат калия при производстве пороха.
Натриевая селитра значительно дешевле, чем калиевая.
Нитрат натрия разлагается аналогично нитрату калия по уравнению:
4 NaNO3 2 Na2O +5 O2+2 N2.
Натриевая селитра в смесях с горючими окрашивает пламя в желтый цвет и могла бы применяться в пиротехнике в качестве, цветнопламенного окислителя, однако этому препятствует большая ее гигроскопичность.
А з о т н о к и с л ы й б а р и й (н и т р а т б а р и я) Ba(NO3)2, молекулярный вес 261,39; получается при реакции обменного разложения между хлористым барием в растворе и нитратом натрия при 80—90°.
Представляет собой бесцветные октаэдрические кристаллы, превращающиеся при измельчении в белый порошок; в воде мало растворим, негигроскопичен; температура плавления 593°. При более высокой температуре разлагается, выделяя кислород, по уравнению:
2 Ba(NO3)2 2 ВаО + 2 N2 + 5O2.
При этой реакции поглощается тепло.
При горении смесей азотнокислого бария с горючими пламя окрашивается в зеленый цвет.
Азотнокислый барий служит окислителем во многих пиротехнических, особенно осветительных составах. Составы с азотнокислым барием значительно менее чувствительны, чем с окислителями, указанными выше. В некоторых случаях азотнокислый барий применяется в составах в смеси с другими, более активно действующими окислителями.
А з о т н о к и с л ы й с т р о н ц и й (н и т р а т с т р о н ц и я) Sr(NO3)2, молекулярный вес 211,62; цветнопламенный окислитель, окрашивающий пламя в густой и яркий красный цвет, но очень гигроскопичен, к тому же различные примеси увеличивают его гигроскопичность, поэтому в пиротехнике он применяется сравнительно мало.
Азотнокислый стронций — белое кристаллическое вещество с температурой плавления 645°.
Окислы металлов
В качестве окислителей в пиротехнике применяются некоторые окислы металлов, способные сравнительно легко отдавать свой кислород (перекись бария, двуокись марганца, двуокись свинца, сурик, окись железа и др.).
П е р е к и с ь б а р и я ВаO2, молекулярный вес 169,4; получается прокаливанием окиси бария ВаО в муфельных печах при температуре 500—600° в струе воздуха, освобожденного от влаги и углекислоты. Получение происходит по уравнению:
2 ВаО + O2 ВаO2 + 24 кал.
При температуре выше 500—600° начинается обратное разложение перекиси бария, и при 900° реакция проходит по уравнению:
2 ВаО2 2 ВаО +O2;
выделяющийся кислород можно использовать для окисления.
Д в у о к и с ь м а р г а н ц а МnO2, молекулярный вес 86,93; может применяться в качестве окислителя; в чистом виде имеет
темно-серый цвет и может быть приготовлена нагреванием азотномарганцевистой соли Mn(NO3)2; при нагревании эта соль разлагается, выделяя окислы азота, а часть выделяющегося кислорода окисляет марганец до МnO2.
Двуокись марганца встречается в природе в виде минерала черного цвета —пиролюзита. Пиролюзит содержит МnO2•nН2O; это сравнительно дешевое сырье для получения марганца и различных его соединений.
При разложении двуокись марганца выделяет кислород и образует различные окислы марганца (в зависимости от условий реакций). Например, при нагревании разложение идет по уравнению:
2 МnO2 2 МnО + O2.
При сильном прокаливании на воздухе она разлагается по уравнению:
ЗМnO2 Мn3O4 + O2.
Двуокись свинца РЬO2, молекулярный вес 239,2; разлагается при 300° по уравнению:
З PbO2 РЬ3O4 + O2.
Двуокись свинца служит окислителем. Окисляющее действие ее настолько велико, что смесь ее с серой воспламеняется при растирании.
С у р и к РЬ3O4 может быть получен или из двуокиси свинца, как показано выше, или нагреванием до 470—480° окиси свинца РЬО на воздухе.
Разлагается при температуре около 650° по уравнению:
2 РЬ3O4 6 РЬО + O2.
Сурик служит окислителем, а также применяется обычно в качестве краски.
О к и с ь ж е л е з а Fe2O3 встречается в природе в виде безводного окисла - гематита Fe2O3 (темно-красного цвета). При температуре 1455° окись железа начинает разлагаться, выделяя кислород.
В пиротехнике окись железа применяется, главным образом, для получения термита, где Fe2O3 переходит в железо Fe, отдавая выделившийся кислород алюминию. Кроме того, применяется и закись-окись железа Fe304 (окалина).
Окислители других групп
В пиротехнике можно использовать окисляющее действие также и некоторых солей — марганцево-калиевой и двухромовокислых.
М а р г а н ц е в о к а л и е в а я с о л ь КМnO4 — калиевая соль марганцевой кислоты НMnO4.
Марганцево-калиевая соль легко разлагается, выделяя кислород, а потому используется в качестве окислителя. При нагревании сухая КМnO4 разлагается по уравнению:
2КмnO4 К2МnO4 + МnO2 + O2,
а при нагревании до 700—750° разлагается и марганцевистокалиевая соль (К2МnO4), тоже выделяя кислород.
Марганцево-калиевая соль разлагается с выделением различных продуктов реакции и разного количества кислорода в зависимости от того, в кислой или щелочной среде протекает реакция.
Реакция в щелочной среде протекает сначала с выделением мар-ганцевистокалиевой соли, которая затем разлагается, давая двуокись марганца и кислород, т. е. по уравнениям:
2 KMnO4 + 2 KOH 2 К2МnO4 + Н2O + (О)
+
2 К2МnO4 + 2Н2O 2 MnO2 + 4 KOH + (2O)
------------------------------------------------------------
2 К2МnO4 + Н2O 2 MnO2 + 2 KOH +(3O)
В кислой среде реакция проходит с образованием свободной марганцевой кислоты, которая разлагается, выделяя кислород. Реакции можно выразить уравнениями:
2 KMnO4 + H2SO4 K2SO4 + 2 HMnO4
+
2 HMnO4 + 2 H2SO4 2 MnSO4 + 3H2O + (5O)
---------------------------------------------------------------------------
2 HMnO4 + 3 H2SO4 2 MnSO4 + K2SO4 + 3H2O + (5O)
2 мол марганцевокалиевой соли в кислой среде выделяют 5 атомов кислорода, а в щелочной среде 3 атома.
Д в у х р о м о в о к и с л ы е с о л и. Из этих солей иногда применяют соли натрия: Na2Cr2O7; и калия К2Сг2O7, выделяющие кислород при действии минеральных кислот.
Эти соли получаются действием минеральных кислот на хромовокислые соли (например Na2CrO4). Двухромовокислый калий называется также хромпиком.
Исходным продуктом для получения двухромовокислых солей служит хромистый железняк FeCrO4, который встречается в природе, например, в СССР —на Урале.
Пиротехника может располагать большим количеством разнообразных окислителей. В зависимости от того, какие свойства должен иметь состав, можно применить окислитель той или иной группы.
Здесь освещены далеко не все возможности пиротехники в области расширения сырьевой базы. Исследовательской мысли предоставляется обширное поле деятельности. Для удобства выбора окислителей и их практического применения приводим таблицу, где указаны некоторые свойства наиболее важных для пиротехники веществ (см. стр. 34).
§ 3. ГОРЮЧИЕ И ЦЕМЕНТИРУЮЩИЕ ВЕЩЕСТВА
К горючим веществам принадлежат представители разнообразных классов соединений. Их можно подразделить на неорганические и органические вещества.
Многие из органических горючих обладают цементирующими свойствами и в пиротехнических составах служат одновременно и горючими и цементаторами.
Наименование окислителя
Формула
Молекулярный вес
Удельный вес
Теплота образования кал
Температура плавления °С
Температура разложения °С
Примечание
Хлорат калия
KCIO3
122.56
2.34
89.6
357.1
364
Хлорат бария
Ba(CIO)4*H2O
322.29
~ 3
173.9
-
300
Хлорат натрия
NaCIO3
106.46
2.49
82.3
255
350
Гигроскопичен
Перхлорат калия
KCIO3
138.56
2.54
112.0
610
420
Плавится с разложением
Перхлорат бария
Ba(CIO4)2
336.29
~ 3
210.2
505
-
Нитрат калия
KNO3
101.1
2.109
118.8
337
400
Нитрат натрия
NaNO3
85.0
2.265
112.1
312
-
Гигроскопичен
Нитрат бария
Ba(NO3)2
261.39
3.23
238.2
593
Выше температуры плавления
Нитрат стронция
Sr(NO3)2
211.62
2.93
234.4
645
-
Гигроскопичен
Перекись бария
BaO2
169.37
4.96
151.7
-
795
Двуокись марганца
MnO2
86.93
5.0
125.4
Плавится с разложением при 530 °
Сурик
Pb3O4
685.6
9.1
174.2
-
650
Окись железа
Fe2O3
159.68
5.12
190.6
1560; плавится с разложением
Марганцевокислый калий
KMnO4
158.03
2.7
194.2
-
200
П р и м е ч а н и е. Данные о температуре и удельном весе взяты из книги Каст и Мец «Химическое исследование взрывчатых веществ», ОНТИ, 1934.
Неорганические горючие
К неорганическим горючим, применяемым в пиротехнике, принадлежат легко окисляющиеся металлы, некоторые сплавы, фосфор, сера, сернистые соединения сурьмы и мышьяка.
А л ю м и н и й АI, атомный вес 27; это металл, соединения которого широко распространены в природе. Наиболее распространена окись алюминия АI2O3 — г л и н о з е м.
Безводная окись алюминия образует минералы — корунд, рубин, сапфир (очень ценные), а водная окись алюминия — залежи боксита, который служит основным сырьем для получения алюминия.
Кроме того, алюминий входит в состав глины, минералов криолита, полевого шпата и др.
Прокаливанием боксита с содой или обработкой его едким натром получается чистый глинозем АI2O3. Электролизом глинозема, растворенного в расплавленном криолите 3 NaF • AIF3, получается металлический алюминий. Для применения в пиротехнических составах его измельчают в порошок или в пудру.
Алюминий — серебристо-белый металл, тускнеющий на воздухе вследствие образования тонкой пленки окисла, которая предохраняет его от дальнейшего воздействия кислорода воздуха. Это очень легкий металл; его удельный вес 2,7. Он очень тягуч, но при нагревании выше 500° делается хрупким.
Температура плавления 657°, температура кипения выше 2200°. На воздухе алюминий загорается при значительно более низкой температуре. Температура воспламенения его зависит от степени измельчения. Очень мелкая алюминиевая пыль воспламеняется при температуре около 250°.
Мелкая пыль и мелкий порошок алюминия очень энергично разлагают воду, особенно при высокой температуре, выделяя водород. Действуя углекислотой на слабо раскаленный алюминиевый порошок, можно достичь энергичного горения его. Это явление объясняется тем, что раскаленный алюминиевый порошок восстанавливает углекислоту до окиси углерода по уравнению:
2СO2 2 CO + O2,
а выделяющийся кислород ускоряет горение алюминия. Горение алюминиевой пыли и порошка ни в коем случае нельзя тушить водой и обычными огнетушителями, действующими струей пены, содержащей углекислоту. Наиболее надежно тушить такое горение сухим песком, который следует насыпать осторожно, не вздымая горящей алюминиевой пыли.
Алюминий отличается очень большим сродством с кислородом. При высоких температурах алюминий соединяется с кислородом, отнимая его от окислов других металлов. Алюминий хорошо растворяется в щелочах. С кислотами он энергично реагирует, выделяя водород.
Горение алюминия сопровождается выделением большого количества тепла и света. Реакция горения происходит по уравнению:
4 АI + 3 O2 2 АI2O3.
При этой реакции на 1 кг алюминия выделяется 7041 кал тепла.
Алюминий широко применяется в различных отраслях промышленности. В пиротехнике он применяется в качестве горючего, главным образом, в осветительных и зажигательных составах. При горении порошка алюминия происходит искрение. Иногда алюминий добавляется в небольшом количестве (до 5%) в составы цветных огней для увеличения яркости. Часто алюминий применяется в виде сплава с магнием.
М а г н и й Mg, атомный вес 24,32; металл, встречающийся в природе в виде различных соединений: магнезита MgCO3, доломита MgCO3 • СаСO3 и других, образующих пласты горных пород. В морской воде находится так называемый карналлит MgCl2 • KCl • 6Н2O.
Металлический магний может быть получен электролизом его солей или окиси.
Магний — легкий металл серебристо-белого цвета; удельный вес 1,74; в нагретом состоянии тягуч; температура плавления 650°, температура кипения около 1100°. На воздухе магний быстро окисляется, покрываясь окисной пленкой; при высоких температурах воспламеняется, сгорая с большим выделением тепла и света; пламя ослепительно белое. Реакция горения происходит по уравнению:
2 Mg + O2 2 MgO + 288 кал,
т. е. при сгорании 1 мол магния выделяется 144 кал. Образующаяся при этом окись магния не плавится и не испаряется, почему температура реакции высокая. С водой магний реагирует медленно, но реакция ускоряется в присутствии хлористого аммония.
На воздухе магний, в особенности измельченный, воспламеняется легче, чем алюминий.
Магний в виде порошка применяется в пиротехнике в качестве горючего в осветительных составах и в специальных составах для освещения при фотографировании. Применяется он также в виде сплава с алюминием. Иногда небольшое количество магния добавляют в составы цветных огней для увеличения яркости.
Магний легко окисляется, и поэтому иногда частицы магния перед употреблением в составы изолируют от действия кислорода воздуха; для этого порошок магния парафинируют, лакируют или смешивают с жирами, например, с олифой.
С п л а в ы м а г н и я с а л ю м и н и е м удобны для пиротехнических изделий, потому что они значительно легче других металлов поддаются измельчению и меньше окисляются на воздухе. Наиболее часто употребляется сплав, называемый электроном- Электрон в виде порошка может быть использован в качестве горючего в составах; он отличается большой легкостью; удельный вес его около 1,8.
Эти сплавы отличаются друг от друга соотношением в них магния и алюминия. Все они обладают достаточной механической прочностью и используются для изготовления сгораемых оболочек зажигательных изделий.
С е р н и с т а я с у р ь м а, или а н т и м о н и й Sb2S3, молекулярный вес 339,8; отличается сильной восстановительной способностью и в смеси с окислителями, например с бертолетовой солью, взрывает от незначительных внешних воздействий. Антимоний — темно-серый порошок, применяется для составов, чувствительных к внешним воздействиям, например для терочных составов, воспламеняющихся от трения.
Антимоний встречается в природе в виде минерала—«сурьмяного блеска» Sb2S3. При горении антимоний превращается в сурьмянистый ангидрид с выделением сернистого газа.
Реакция протекает по схеме:
2 Sb2S3 + 9 O2 2 Sb2O3 + 6 SO2.
Ф о с ф о р Р, атомный вес 31,02; для его получения прокаливают фосфорнокальциевую соль с песком и коксом, полученный фосфор очищают. Он существует в нескольких видах (модификациях). Бесцветный, или белый, фосфор плавится при 44,3°, но на воздухе загорается уже при 30°.
Белый фосфор легко воспламеняет горючие вещества, обладает неприятным запахом. Обычно его хранят в керосине или под водой. Белый фосфор ядовит; при нагревании его до 250° без доступа воздуха он превращается в красный фосфор, который не имеет запаха, не ядовит, загорается только при 230°, плавится при 592°.
В красном фосфоре иногда бывает примесь белого фосфора (2—1%), которая может воспламенить фосфор.
При нагревании белого фосфора до 240—350° под давлением в несколько сот атмосфер он переходит в черный фосфор, который загорается при 500°.
При 600° все модификации переходят в пар,который при охлаждении дает белый фосфор.
Явление существования различных модификаций элемента называется аллотропией.
Красный фосфор применяется в пиротехнике для составов, зажигающихся от трения (терочных). Красный фосфор понижает температуру воспламенения составов.
Фосфор можно использовать как дымообразующее вещество, так как при горении он окисляется в фосфорный ангидрид, выделяющийся в виде густого дыма.
Реакцию окисления фосфора можно представить уравнением:
4 Р + 5 O2 2 Р2O5.
Технически фосфор получают, прокаливая смесь фосфорнокальциевой соли Са3(Р04)2 с песком и коксом в электрических печах, полученный фосфор очищается.
С е р а S, атомный вес 32; так же, как и фосфор, существует в нескольких модификациях в зависимости от температуры. Обычно употребляемая в производстве сера представляет собой желтый порошок (удельного веса около 2), растворимый в сероуглероде и нерастворимый в воде.
Температура плавления серы 112,8°. При нагревании жидкой серы до 180° она густеет и темнеет. При дальнейшем нагревании почти до температуры кипения 444,6° и при быстром охлаждении сера превращается в тягучие нити; эта модификация серы непрочна. В природе сера встречается в виде различных соединений и в свободном состоянии.
Для получения чистой серы существуют различные способы. При очистке плавлением сера получается в виде тонких палочек и называется ч е р е н к о в о й с е р о й. При очистке серы возгонкой, т. е. переводом ее в пар и при быстром охлаждении пара с переходом в твердое состояние, получается так называемый с е р н ы й ц в е т, т.е. мелкий порошок серы.
Недостаточно чистую серу можно получить в виде больших кусков, но и в черенковой сере остаются землистые примеси, а в серном цвете бывает примесь серной кислоты, которую необходимо отмывать или нейтрализовать.
Сера хорошо горит. На воздухе она загорается при температуре 360°, а в кислороде при 285°. На воздухе в присутствии влаги измельченная сера окисляется. При реакциях соединения с кислородом она может давать различные окислы: сернистый газ (ангидрид)
S + O2 SO2;
серный ангидрид
2 SO2 + O2 2 SO3.
Соединение серного ангидрида с водой дает серную кислоту. Сернистый ангидрид с водой образует сернистую кислоту; он обладает очень резким запахом и сильно раздражает слизистые оболочки.
При применении серы в составах с окислителями, особенно с бертолетовой солью, следует опасаться увлажнения составов; в этих условиях сера окисляется в серную кислоту, которая вызывает самовоспламенение состава. Сера не должна содержать свободной серной кислоты.
Сера применяется как составная часть дымного пороха и как горючее в некоторых пиротехнических составах.
У г л е р о д С, атомный вес 12; весьма распространенный в природе элемент, так как он образует все многочисленные органические соединения.
При сгорании углерод образует кислородные соединения — угольный ангидрид, или углекислый газ СO2, и окись углерода СО.
Горение углерода проходит с образованием того или иного окисла, в зависимости от наличия кислорода в окружающей среде или количества окислителя в смеси. Реакция горения углерода может происходить по уравнениям:
2 С + O2 2 СО;
2 CO + O2 2 СO2.
Окись углерода — ядовитый газ.
Большое количество углерода содержится в древесном и каменном угле.
Для пиротехнических целей употребляется обычно древесный уголь. Для его получения куски подсушенного дерева складывают в железный сосуд и сжигают до прекращения выделения пламени. После этого сосуд плотно закрывают и уголь выдерживают 10—12 час.
Хороший уголь должен быть совершенно черного цвета и хрупким; он должен легко воспламеняться и тлеть без пламени. Уголь гигроскопичен, его следует хранить в сухих помещениях или в закрытых сосудах.
При длительном хранении уголь, особенно приготовленный при сравнительно низких температурах, способен самовоспламеняться на воздухе.
Уголь входит в состав дымного пороха и во многие пиротехнические составы; для быстро горящих составов обугливают мягкие и легкие породы деревьев, например, ольху, иву, черемуху и др.; для медленно горящих составов — твердые и тяжелые породы, например, дуб, клен, березу и др.
Уголь легко измельчается. Для некоторых составов уголь употребляется в виде очень мелких зерен, а для других (искрящих) — крупнозернистый.
Органические горючие
В качестве горючих применяется также очень большое количество разнообразных органических соединений. Некоторые из них служат одновременно и цементаторами. Наиболее часто применяемые органические соединения можно подразделить на следующие группы: углеводороды, углеводы, горючие связывающие вещества (жиры, смолы, лаки), растворители.
У г л е в о д о р о д ы
Углеводороды — обширная группа органических соединений, состоящих из углерода и водорода. В зависимости от количества атомов углерода и водорода в молекуле и их взаимной связи, определяющих строение молекулы, получаются продукты различных свойств.
Из углеводородов в качестве горючих в пиротехнике применяют парафин, нафталин, антрацен и некоторые другие.
П а р а ф и н — белое или слегка желтоватое вещество, плавящееся в зависимости от состава при 45—110°. Это продукт перегонки нефти, состоящий из углеводородов; он замедляет горение некоторых составов, т. е. служит флегматизатором. Парафин не растворяется в воде и применяется в качестве защитного слоя для предохранения от увлажнения различных изделий.
Парафин, применяемый в составах, растворяют в органических растворителях (в бензине).
Н а ф т а л и н С10Н8, молекулярный вес 128,6; получается при переработке каменноугольной смолы. Нафталин имеет очень важное значение в производстве красителей, медикаментов.
Нафталин кристаллизуется в виде белых кристаллов и может возгоняться; эта способность нафталина используется для очистки его. Температура плавления 80,1°.
При полном сгорании нафталин образует воду и углекислый газ по уравнению:
С10Н8 + 24 O 10 СO2 + 4 Н2O.
А н т р а ц е н С14Н10, молекулярный вес 178,08; как и нафталин, — ароматический углеводород. Это кристаллическое вещество с температурой плавления 217,0°. В технике антрацен получается из составных частей каменноугольной смолы (из антраценового масла).
Антрацен, как и нафталин, служит горючим веществом в пиротехнических составах.
У г л е в о д ы
Углеводы — органические соединения, в состав которых входят углерод, водород и кислород; отношение числа атомов кислорода к водородным такое же, как в воде, т. е. 1:2. Это и объясняет их название — углеводы.
К группе углеводов принадлежат горючие — сахар, крахмал и др.
К р а х м а л С6Н10O5, молекулярный вес 162; имеет вид белого порошка, образуется в растительных организмах вследствие поглощения ими углекислоты. Клубни картофеля, зерна хлебных растений содержат много крахмала; из них он чаще всего и добывается.
Крахмал нерастворим в холодной воде, но при нагревании с водой разбухает и образует мутную жидкость — крахмальный клейстер.
В пиротехнике крахмал применяется в качестве горючего, а также в качестве клейстера.
Д е к с т р и н получают, нагревая крахмал до 150° с небольшим количеством азотной кислоты (около 0,5%) и очищая полученный продукт.
Декстрин растворим в воде и употребляется большей частью как склеивающее вещество, но его можно использовать и как горючее.
Т р о с т н и к о в ы й с а х а р С12Н22O11, молекулярный вес 342,2; белое вещество, сладкое на вкус, употребляемое в пищу; горючее вещество, иногда применяется в пиротехнических составах; хорошо растворяется в воде.
М о л о ч н ы й с а х а р C12H22O11*H2O, молекулярный вес 360,2; углевод, сходный по составу и свойствам с тростниковым сахаром. Применяется в качестве горючего, большей частью в составах цветных дымов, негигроскопичен, растворим в горячей воде.
Г о р ю ч и е с в я з ы в а ю щ и е в е щ е с т в а
Сюда относятся вещества, служащие одновременно горючими и склеивающими веществами, например, маслянистые вещества (олифа, эфирные масла), различные смолы, которые можно применять с разными растворителями также и в виде лаков, и др.
Связывающие вещества называются также ц е м е н т а т о р а м и.
О л и ф а — переработанное льняное (или конопляное) масло. Для получения олифы масло нагревают до 200—260° в течение нескольких часов; для окисления добавляют соединения свинца или марганца — сурик, перекись марганца, борнокислый марганец. Такие соединения называются сиккативами.
Олифу можно получить и так называемым холодным способом. Льняное масло нагревается до 120^150°, затем в нем растворяется 1—5% органических соединений свинца, марганца или кобальта (чаще всего берут льнянокислые соли) и через раствор продувается струя воздуха.
Таким образом, олифа представляет собой масло, окисленное под действием высокой температуры и кислорода.
Сиккативы ускоряют высыхание олифы.
Хорошо приготовленная олифа должна быть прозрачной и цветом от светло-желтой до темно-бурой.
Известны способы получения искусственной олифы.
Олифа применяется большей частью в таких составах, от которых не требуется быстрого высыхания, так как длительность ее высыхания около 14 суток. Олифа хорошо обволакивает частицы составов, покрывая их после затвердевания пленкой, которая защищает от влияния воздуха, влаги и т. п.
Э ф и р н ы е м а с л а изредка применяются при изготовлении изделий, которые должны распространять при горении приятный запах. Для этой цели можно употреблять различные эфирные масла. Эфирными маслами можно также смазывать некоторые составы для удобства работы с ними.
С к и п и д а р о ч и щ е н н ы й, или т е р п е н т и н, извлекается перегонкой из сосновой смолы, легко высыхает и твердеет. По внешнему виду это летучая, бесцветная, желтеющая на воздухе жидкость с характерным, резким запахом. Применяется для изготовления разных мастик.
Смолы
Смолы естественные и искусственные широко применяются при приготовлении пиротехнических составов.
Из естественных смол употребляют канифоль, шеллак, аравийскую камедь, естественный каучук, мастике и др. Из искусственных смол используют идитол (новолак), синтетическую камфору и др.
Некоторые из смол, например канифоль, горят значительно медленнее, чем основные смеси, и их иногда добавляют в составы., чтобы замедлить процесс горения.
К а н и ф о л ь С20Н30O2, молекулярный вес 302,2; получается при перегонке сосновой смолы; летучие составные части смолы образуют скипидар, а твердый остаток перегонки называется канифолью. Это — твердое вещество, плавящееся при 100—130°. Цвет его изменяется в зависимости от условий перегонки смолы; при перегонке ее без водяного пара канифоль получается черного цвета и называется г а р п и у с о м. При перегонке смолы с водяным даром канифоль получается желтоватая или коричнево-бурая, прозрачная.
Канифоль нерастворима в воде, но растворяется в спирте, эфире, хлороформе и других органических растворителях и поэтому часто применяется в виде лака, т. е. раствора канифолив летучем растворителе.
Ш е л л а к. Молекулярный вес 296,2. Это естественная смола, образующаяся на некоторых сортах деревьев в Ост-Индии от укола особого насекомого «л а к о в о г о ч е р в е ц а».
Из ветвей в местах этих проколов вытекает смолистый, быстро твердеющий сок. В зависимости от обработки смолы можно получить разные сорта шеллака цветом от бурого до лимонного оттенка. Самым лучшим сортом считается светло-желтый (лимонный) шеллак в виде тонких пластинок.
Шеллак — одна из наиболее дорогих смол; в СССР не добывается. Шеллак хорошо растворим в спирте и некоторых других органических растворителях и часто применяется в виде лака; после высыхания лак образует прочную пленку.
Шеллак измельчается с большим трудом; для этой цели иногда приходится применять специальные мельницы или плавить шеллак в смеси с какой-нибудь солью, а затем измельчать его и удалять соль растворением в воде (шеллак в воде не растворяется).
Шеллак негигроскопичен. Формула его точно не установлена, но предполагается, что состав его С16Н2405.
Шеллак используют в качестве цементатора и для лакировки некоторых деталей.
А р а в и й с к а я к а м е д ь (иначе гумми-арабик) — затвердевший сок различных сортов акаций, высыхающий на воздухе. Камедь бывает белого или желтоватого цвета в виде блестящих полупрозрачных хрупких кусков или белого порошка.
Отличается она от некоторых других смол тем, что растворима в воде, особенно в горячей; эфир и спирт не растворяют камеди.
В пиротехнике камедь (или ее водный раствор) применяется довольно часто.
Большинство других смол — копал, мастике, даммара — не применяется вследствие высокой стоимости.
И д и т о л — смола, получаемая синтетически при реакции между фенолом и формальдегидом в присутствии соляной кислоты, которая способствует протеканию реакции (катализатор). Получаемая смола называется идитолом, или н о в о л а к о м; температура ее плавления около 85°, растворяется в спирте, ацетоне, щелочах и некоторых других органических растворителях; в воде не растворяется.
Измельченный идитол имеет вид светло желтого порошка.
До сих пор точно не установлен состав молекулы идитола; предполагается, что формула его С18Н17O7; молекулярный вес 735,4.
Идитолом пользуются для приготовления различных составов; часто его применяют в виде лака. Идитол значительно менее замедляет горение, чем некоторые другие смолы.
Смеси идитола с нитратом калия служат в качестве воспламенительных составов.
Б а к е л и т — искусственная смола, получается конденсацией фенола и формальдегида в присутствии щелочей. Бакелит вначале образуется в виде так называемой стадии А, которая характеризуется растворимостью в ацетоне, спирте и едких щелочах, плавится при 50—60°. При долгом нагревании бакелит А переходит в стадию В; бакелит В не плавится в растворителях, он лишь разбухает. При дальнейшем нагревании получается бакелит С, —очень прочный нерастворимый продукт, стойкий к воздействию химических реагентов. Бакелит С обладает хорошей механической прочностью.
Р а с т в о р и т е л и
Органические растворители применяются в пиротехнике большей частью для растворения смол и увлажнения состава.
Э т и л о в ы й с п и р т С2Н5ОН — алкоголь — наиболее распространенный из растворителей; он получается при брожении сахаристых и крахмалистых веществ. По внешнему виду это прозрачная бесцветная жидкость, летучая и сильно гигроскопичная. Спирт 100%-ный называется абсолютным спиртом; его необходимо хранить без доступа влаги, так как он жадно впитывает воду. Обычно применяется спирт крепостью 96°. Спиртом растворяют смолы, а также смачивают составы, чтобы уменьшить их способность распыляться.
Эфир (С2Н5)2O — летучая жидкость с характерным сильным запахом, получается синтетически из этилового спирта; часто употребляется в смеси со спиртом.
Ацетон (СН3)2СО — легко-летучее органическое соединение, получаемое из продуктов перегонки дерева или синтетическим путем. Это бесцветная жидкость с резким своеобразным запахом; применяется в пиротехнике редко.
Б е н з и н является продуктом перегонки нефти при температуре до 150°. Летучая бесцветная жидкость, хорошо растворяющая жиры и другие органические продукты.
Все перечисленные растворители горючи.
§ 4. ЦВЕТНОПЛАМЕННЫЕ ДОБАВКИ
Для окрашивания пламени в составы вводят соединения некоторых металлов. При высокой температуре, развиваемой при горении составов, соединения металлов частично или полностью диссоциируют и, перейдя в парообразное состояние, дают спектр излучения. Каждый металл дает спектр особого, характерного для него цвета.
Атомы натрия дают пламя желтого цвета; соединения стронция, цезия, рубидия и атомы лития дают пламя красного цвета (практически применяются только соединения стронция, остальные стоят очень дорого).
Соединения бария и атомы таллия дают пламя зеленого цвета (практическое значение имеют лишь первые).
Пламя синего цвета получается при свечении соединений меди, главным образом, монохлорида меди. Пламя розового цвета дают соединения кальция.
Рассмотрим наиболее употребительные продукты, применяемые для получения окрашенного пламени. В тех случаях, когда эти продукты не участвуют в реакции горения пиротехнического состава , они называются ц в е т н о п л а м е н - н ы м и д о б а в к а м и.
Щ а в е л е в о к и с л ы й н а т р и й, или оксалат натрия, Na2C2O4, молекулярный вес 134; белое кристаллическое негигроскопичное и нерастворимое в воде вещество; дает желтое пламя; большей частью употребляется в хлоратных составах.
Недостатком этой соли является ее ядовитость.
Дешевая соль натрия — хлористый натрий (поваренная соль) не применяется в пиротехнике из-за большой гигроскопичности.
К р и о л и т 3NaF • AIF3, молекулярный вес 125,97; представляет собой минерал, негигроскопичен, окрашивает пламя в желтый цвет.
Щ а в е л е в о к и с л ы й с т р о н ц и й, или оксалат стронция, SrC2O4, молекулярный вес 175,6; представляет собой мелкокристаллический порошок белого цвета; он негигроскопичен и не растворяется в воде.
Щавелевокислый стронций дает хорошую красную окраску пламени, но менее яркую, чем азотнокислый стронций.
У г л е к и с л ы й с т р о н ц и й (карбонат стронция) SrCO3, молекулярный вес 147,6; нерастворим в воде, негигроскопичен, окрашивает пламя в красный цвет, но менее яркий, чем цвет пламени, получаемый от оксалата и нитрата стронция. Однако из-за сравнительной дешевизны он применяется в составах красного огня.
У г л е к и с л ы й б а р и й (карбонат бария) ВаСO3, молекулярный вес 197,4; прозрачные кристаллы, почти нерастворимые в воде. В хлоратных составах углекислый барий может быть использован для окраски пламени в зеленый цвет .
М е д н ы е с о л и. Для окраски пламени в синий цвет применяются некоторые соли меди, например, углекислая медь СиСO3; она представляет собой светло-зеленые кристаллы, нерастворимые в воде.
В пиротехнике применяются также соединения меди, встречающиеся в природе: малахит СиСO3 • Cu(OH)2, горная синь 2СиСO3. • Си(ОН)2 и др.
Медные соли ядовиты. Они применяются большей частью в составах, содержащих хлорат калия.
Одним из распространенных медных соединений является м е д н ы й к у - п о р о с CuSO4, т. е. сернокислая медь. Эту соль нельзя применять в составах: она имеет кислую реакцию и в смеси с бертолетовой солью может вызвать самовоспламенение.
Купорос может быть использован только совместно с аммиаком, с которым CuSO4 образует сложные соединения.
Для получения розового огня можно пользоваться солями кальция.
У г л е к и с л ы й к а л ь ц и й, или м е л, СаСO3, молекулярный вес 100,0; образует природные залежи и является сравнительно дешевым продуктом. Иногда мелом заменяют более дорогие соли стронция; мел окрашивает пламя в розовый цвет.
Добавки, улучшающие окраску пламени
Для усиления цвета пламени или для уменьшения температуры и скорости горения состава и для некоторых других целей могут применяться различные добавки к составам.
Иногда, чтобы получить густой и чистый цвет пламени, в составы добавляют хлористые соли или органические соединения, содержащие хлор. Их действие заключается в выделении свободного хлора при разложении этих соединений в условиях горения состава. Выделяющийся хлор может реагировать с окрашивающими пламя металлами с образованием их хлористоводородных солей, которые и улучшают окраску пламени.
Рассмотрим некоторые из этих веществ.
Х л о р и с т а я р т у т ь Hg2Cl2, молекулярный вес 472,1; иначе называется каломелем; это белый, мелкокристаллический порошок, очень ядовитый.
На свету каломель разлагается, выделяя хлор; при этом соль сперва желтеет, а потом чернеет, поэтому ее следует хранить в посуде из темного стекла.
Обычно каломель добавляется к сигнальным составам.
Х л о р и с т ы й с в и н е ц РЬСI2 менее опасен и менее дорог, чем каломель; хлористый свинец негигроскопичен; может употребляться в составах для улучшения цвета пламени.
Х л о р и с т ы й а м м о н и й, нашатырь, NH4CI; белый кристаллический порошок, замедляющий горение составов, но значительно усиливающий густоту окраски пламени. Большой недостаток нашатыря — его гигроскопичность, препятствующая долгому хранению тех составов, в которые он входит.
Г е к с а х л о р э т а н ССI3—ССI3, молекулярный вес 236,76; температура плавления 187°; в пиротехнических составах используется редко.
М е т а л л и ч е с к и е о п и л к и. В пиротехнике применяются железные, стальные, чугунные и другие металлические опилки для получения искрения при горении составов. Раскаленные опилки выбрасываются из изделия и сгорают в воздухе. Цвет искр зависит от свойств металла. Стальные опилки дают белые искры, опилки цинка — голубые.
Опилки легко подвергаются окислению, поэтому перед введением в состав рекомендуется их воронить, нагревая с льняным маслом.
§ 5. КРАСИТЕЛИ ДЫМОВ
Для получения цветных дымов можно применять органические красители и неорганические краски. Однако хорошее дымовое облако дают неорганические красители, измельченные в такой степени, какой практически трудно достигнуть.
Ультрамарин — синяя краска, встречающаяся в природе в виде минерала — лапис-лазури.
Искусственно ультрамарин получается обжиганием смеси каолина (белая глина), соды, угля и серы. Ультрамарин представляет собою ярко-синий порошок, его используют обычно в качестве краски, синьки для белья и для других целей.
Ультрамарин дает дымовое облако синего цвета.
Органические красители используются в пиротехнике для получения цветных дымов чаще, чем неорганические пигменты.
Эти красители представляют собой сложные органические продукты, получаемые искусственно из продуктов переработки каменноугольной смолы. В настоящее время техника освоила производство очень многих органических красителей разных цветов, но для пиротехнических целей используются немногие из них, а именно те, которые способны возгоняться, т. е. превращаться из твердого состояния в пар и обратно, минуя жидкое состояние.
Рассмотрим наиболее часто применяемые красители.
Р о д а м и н — краситель, имеющий формулу:

Это темный кристаллический порошок бронзово-зеленого оттенка.
Родамин образует дым темно-малинового цвета. Для получения красного дыма к родамину добавляются другие красители.
Сухой родамин легко распыляется, пыль его ядовита, сильно раздражает слизистые оболочки, вызывая иногда кровотечение из носа.
Работу с сухим родамином нужно производить в респираторах.
Ж и р о о р а н ж относится к группе так называемых а з о к р а с и т е л е й и имеет формулу:

Образует дым красно-оранжевого цвета. Как и другие органические красители, сухой жирооранж сильно пылит.
М е т и л е н о в а я г о л у б а я имеет формулу:

Этот краситель образует двойную соль с хлористым цинком; обладает сильной гигроскопичностью. Раствор метиленовой голубой в спирте и в воде имеет синий цвет. Пыль от метиленовой голубой чрезвычайно ядовита. Работая с сухим красителем, необходимо употреблять респиратор.
И н д и г о так же, как и метиленовая голубая, дает дым синего цвета. Формула индиго:

§ 6. ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ И ПОЛУФАБРИКАТЫ
Для изготовления пиротехнических изделий требуется обычна много разнообразных вспомогательных материалов и полуфабрикатов. Рассмотрим вкратце важнейшие из них.
Д ы м н ы й, или ч е р н ы й, п о р о х, чрезвычайно важный для пиротехники материал. Он представляет собой механическую смесь серы, калиевой селитры и угля, которая обладает свойствами метательного взрывчатого вещества.
Для изготовления дымного пороха смешивают измельченные компоненты, указанные выше, в специальных шаровых мельницах. Смесь просеивается, после чего обрабатывается на бегунах.
На бегунах смесь перетирается под большим давлением, затем смачивается водой (около 8% воды) и спрессовывается на бегунах до получения так называемых пороховых лепешек, которые затем прессуются на прессах в пороховые плитки.
Прессование придает пороху однообразную плотность, от чего зависит равномерность его горения и другие свойства.
Плитки в особых зернильных машинах измельчают на зерна требуемой величины. После полирования (округление зерен), сушки и сортирования порох считается готовым. Существуют и другие способы изготовления пороха.
Обычно охотничий порох содержит 75% калиевой селитры, 10% серы, 15% угля.
При горении пороха развивается высокая температура и выделяется много газообразных продуктов.
Горение пороха можно выразить уравнением:
2 KNO3 + 3 C + S = K2S + N2 + ЗСO2.
Отсюда можно подсчитать, что в газы должно превращаться около 60% пороха, но в действительности реакция проходит по более сложному пути с образованием еще некоторых твердых продуктов; поэтому практически в газы превращается около 43% пороха.
Дымный порох имеет температуру вспышки 290 — 310°. Чувствительность его к удару сравнительно с другими взрывчатыми веществами незначительна.
Порох используется для приготовления вышибных зарядов, замедлителей, имитации взрыва и др.
П о р о х о в а я м я к о т ь — измельченный, но незерненный дымный порох; она более чувствительна к внешним воздействиям, чем зерненый порох; применяется в пиротехнике для приготовления некоторых составов, стопина, подмазки и т. п.
С т о п и н. Для быстрой передачи огня от одной части изделия к другой применяются особые нити, ткани или тесьма, пропитанные и покрытые горючими веществами. Наиболее часто употребляют стопин.
Для приготовления стопина скручивают три-четыре бумажных нити и погружают на несколько часов в 10%-ный водный раствор калиевой селитры; затем нити высушивают н тщательно промазывают густой тестообразной смесью из пороховой мякоти с 5%-ным водным раствором гумми-арабика. В такой обмазке проселитрованные нити выдерживают 4 часа, после чего их проволакивают в руках или в специальном приспособлении, наматывают рядами на деревянные рамы, опудривают сухой просеянной пороховой мякотью и медленно сушат при температуре около 30°. При быстрой сушке затвердевающий наружный слой обмазки не позволяет просохнуть внутренним слоям, и получается мягкий стопин.
Пороховая обмазка на стопине должна прочно держаться.
Нить стопина длиной 1 м должна гореть на воздухе около 30 сек.; такой же отрезок стопина внутри слоя сухого песка горит около 60 сек., а внутри бумажной трубки горение стопина можно считать мгновенным.
П о д м а з к а представляет собой тестообразную смесь из легко воспламеняющегося вещества или состава и какого-либо лака (или воды и т. п.). Подмазку наносят на те части изделия, кото-
рые должны воспламеняться. Высохнув, она образует слой быстро воспламеняющегося вещества.
Для передачи огня заряду через строго определенное время после поджигания применяют специальные шнуры.
Наиболее распространен бикфордов шнур; внутри него находится слабо спрессованный порох, сквозь который пропущены две направляющие сплетенные хлопчатобумажные нити, покрытые изоляционным слоем асфальта или гуттаперчи.
По характеру изоляции различают три вида шнура: 1) белый, употребляемый для передачи огня в сухих местах; 2) асфальтированный, т. е. покрытый снаружи слоем смолы; его используют для работы в условиях влажности; 3) гуттаперчевый, применяемый при подводных работах.
Бикфордов шнур должен гореть со скоростью 1 см/сек; его применяют для разнообразных подрывных работ, а в пиротехнике — при изготовлении замедлителей, т.е. средств, при наличии которых состав действует через определенное время после поджигания или выстрела.
К а п с ю л и. Взрывчатые вещества и пиротехнические составы могут воспламеняться лучом огня, нагреванием, искрой, ударами, трением, передачей взрыва и т. п.
Наиболее легко взрывают инициирующие взрывчатые вещества, и детонация их передается бризантным взрывчатым веществам.
Пороха воспламеняются лучом огня. Обычно достаточно незначительного количества инициирующего взрывчатого вещества, чтобы воспламенить порох или пиротехнический состав или взорвать бризантное взрывчатое вещество. Количество инициирующего вещества, которое необходимо для воспламенения взрывчатого вещества или состава, называется инициирующим зарядом.
Инициирующие заряды обычно запрессовываются в специальные оболочки; такое изделие называется капсюлем.
Часто для капсюлей применяют взрывчатые смеси различных веществ, т. е. ударные составы. Капсюли, предназначенные для воспламенения состава или пороха, называются капсюлями-воспламенителями, а предназначенные для передачи детонации — капсюлями-детонаторами.
Обе эти группы содержат большое количество разнообразных типов; некоторые из них применяют в пиротехнике.
Капсюли-воспламенители для огнестрельного оружия действуют от удара. Капсюль (рис. 8) представляет собой металлический колпачок, в который запрессован небольшой инициирующий заряд ударного состава, закрытый сверху кружком из оловянной фольги или бумаги. Внутренняя поверхность колпачка и кружка обычно покрывается лаком.
Вес инициирующего заряда в капсюлях для воспламенения дымного ружейного пороха 0,018—0,03 г.
В ударный состав входит обычно гремучая ртуть, антимоний и бертолетова соль. Гремучая ртуть ускоряет реакцию. Антимоний, являясь горючим веществом, повышает температуру горения и образует пламя. Бертолетова соль служит окислителем.
Капсюли-детонаторы применяются для детонации взрывчатых веществ, для различных подрывных работ и т. п. Эти капсюли действуют от накола (рис. 9) по металлической чашечке, которая закрывает инициирующий заряд, запрессованный в гильзу, или от луча огня (рис. 10); в последнем случае в центре дна чашечки делается отверстие.
 Капсюли-детонаторы приводятся в действие и электрическим током. Электрические запалы, служащие для воспламенения детонаторов, представляют собою два соединенных металлических проводника. Тонкий отрезок проволоки, соединяющий их, называется м о с т и к о м н а к а л и в а н и я; он обычно покрывается легко воспламеняющимся составом и вставляется в гильзу капсюля-детонатора. Такие капсюли называются э л е к т р о д е т о н а т о р а м и.
Капсюли-детонаторы приводятся в действие и электрическим током. Электрические запалы, служащие для воспламенения детонаторов, представляют собою два соединенных металлических проводника. Тонкий отрезок проволоки, соединяющий их, называется м о с т и к о м н а к а л и в а н и я; он обычно покрывается легко воспламеняющимся составом и вставляется в гильзу капсюля-детонатора. Такие капсюли называются э л е к т р о д е т о н а т о р а м и.
Некоторые пиротехнические изделия для стрельбы воспламеняются капсюлями разных типов.
К а р т о н различных сортов используется для приготовления гильз, коробок, прокладок, пыжей и т. п. Толщина картона, применяемого в пиротехнике, различна и доходит до 2—3 мм.
Б у м а г а часто употребляется для тонких гильз, частей оболочки.
Из писчей и альбомной бумаги делают тонкостенные гильзы. Такая бумага должна быть хорошо проклеенной, гибкой и не должна иметь изъянов.
Картузная бумага грубее писчей; из нее делают более прочные оболочки.
Газетная бумага, обрезки и т. п. может быть использована для забивания ракетных колпачков, бураков, обертывания готовых изделий и т. д.
Б у м а ж н ы е т к а н и — бязь, холст, полотно — применяются в пиротехнике для приготовления оболочек вышибных зарядов, для оклейки некоторых изделий, чтобы придать им прочность, и т. п.
Н и т и в пиротехнике применяются различных сортов. Нити большей частью идут для приготовления стопина. Поэтому они должны быть достаточно рыхлыми, толстыми и слабо скрученными.
Картонные гильзы небольших размеров, приготовляемые для фейерверочных изделий, можно перевязывать голландскими нитками или тонкими пеньковыми бечевками.
Д е р е в о. Для многих пиротехнических работ требуются деревянные инструменты. Поэтому полезно знать свойства некоторых сортов дерева.
Бук, дуб, вяз — наиболее крепкие и твердые породы деревьев. Бук (плотность 0,721) упруг, тверд, но дает сравнительно легко трещины; древесина его красно-бурого цвета (красный бук). Дуб (плотность 0,785) — наиболее твердая и тяжелая порода деревьев. Вяз (плотность 0,627) колется с трудом, хорошо полируется.
Из этих пород деревьев делают молотки, набойники, формы и подставки для ручной набивки составов в различные пиротехнические изделия.
К породам деревьев средней крепости относятся береза (плотность 0,664), которая очень упруга, но легко распиливается на тонкие планки, и клен (плотность 0,681).
К слабым породам принадлежат сосна (плотность 0,583) и ель (плотность 0,426).
Г и л ь з ы. Наиболее употребительными оболочками для снаряжения пиротехнических изделий, особенно для фейерверков, являются гильзы, т. е. трубки с центральным каналом.
Гильзы можно разделить на сильные и слабые. К первым oi-носятся гильзы с прочными, толстыми стенками. Эти гильзы служат оболочками для составов, развивающих при горении большее давление газов, сообщающее изделию движение (ракеты, форсы).
Такие гильзы делают обычно из картона толщиной около 1 мм, который плотно накатывают в несколько рядов. Иногда их можно делать из металлов, но они сравнительно дороги и могут вызвать некоторые разрушения при падении на землю, после того как состав сгорит.
К слабым относятся тонкостенные гильзы для составов, горящих ярким, блестящим пламенем. Гильзы должны сгорать вместе с составом, не изменяя цвета его пламени. Поэтому такие гильзы обычно изготовляются из писчей или альбомной бумаги, а иногда из коленкора, пропитанного каучуком.
Для некоторых пиротехнических изделий, предназначенных для стрельбы из огнестрельного оружия, делают картонные гильзы с металлическими шляпками. Такие гильзы можно изготовлять на специальных станках.
Все размеры гильз определяются обычно в зависимости от основного их размера — диаметра внутреннего канала. Этот размер называется калибром. В современной пиротехнике калибр измеряется метрическими единицами, но в пиротехнической литературе иногда встречаются измерения калибра в дюймах, линиях.
Контрольные вопросы к главе III
1. Какие требования предъявляются к пиротехническому сырью?
2. На какие общие группы можно подразделить все виды пиротехнического сырья?
3. Перечислите основные окислители для пиротехнических составов.
4. Какими свойствами должны обладать горючие вещества?
5. Что такое цементаторы?
6. Какие вещества служат цементаторами?
7. Что такое смолы и для чего они употребляются в пиротехнике?
8. Какие растворители наиболее выгодны для производства и почему?
9. Перечислите свойства парафина.
10. Что служит сырьем для производства органических красителей?
11. В чем заключается вредность работы с сухими органическими красителями?
12. Перечислите, какие красители наиболее пригодны для пиротехнических целей, и укажите почему.
13. Какими свойствами обладает дымный порох?
14. Для чего применяется черный порох в пиротехнике?
15. Что такое пороховая мякоть?
16. Что обладает большей чувствительностью — черный порох или пороховая мякоть?
17. Как изготовляется стопин?
18. Как влияет влага воздуха на стопин?
19. Объясните устройство и действие капсюля-воспламенителя.
20. Для каких изделий применяются наиболее прочные и толст!
21. Какие требования предъявляются к тонким гильзам?
ГЛАВА IV
ПИРОТЕХНИЧЕСКИЕ СОСТАВЫ
§ 1. КЛАССИФИКАЦИЯ СОСТАВОВ
Общие принципы расчета количеств входящих в состав компонентов были рассмотрены в гл. II. Там же были рассмотрены некоторые общие свойства составов.
Все пиротехнические составы подразделяются по применению их на следующие группы: 1) осветительные; 2) сигнальные ночного действия, 3) зажигательные; 4) сигнальные дневного действия; 5) трассирующие; 6) маскирующие; 7) фейерверочные; 8) вспомогательные воспламенительные.
К п л а м е н н ы м относятся осветительные, ночные сигнальные, трассирующие и некоторые зажигательные составы. К д ы м о в ы м составам относятся дневные сигнальные и маскирующие.
§ 2. ОБЩИЕ СВЕДЕНИЯ О СВОЙСТВАХ ПЛАМЕННЫХ СОСТАВОВ
Пиротехнические составы, при горении которых образуется светящее интенсивное пламя, используемое для освещения, сигнализации и дрочих целей, называются пламенными составами. Пламя может быть окрашено в различные цвета.
Если пучок лучей белого света пропускать через стеклянную призму, то пучок претерпевает некоторые изменения. Он отклоняется от своего первоначального направления в сторону основания призмы; бесцветный пучок расщепляется на лучи разных цветов. Если проектировать эти лучи на экран, получается разноцветная полоска, в которой можно различить фиолетовый, синий, голубой, зеленый, желтый, оранжевый и красный цвета, т. е. семь основных цветов. Такая цветная полоса называется с п е к т р о м.
Появление спектра объясняется тем, что составные части сложного светового луча отклоняются призмой в различной степени: фиолетовые лучи сильнее, а красные слабее других.
Лучи света различных цветов характеризуются длиной волн. Если стекло, через которое пропускается пучок сложного белого света, пропускает лучи только какой-либо определенной длины волны, например красные, а остальные поглощает, то такое стекло будет казаться наблюдателю красным. Спектр, измененный вследствие поглощения некоторой части лучей окрашенным телом, называется с п е к т р о м п о г л о щ е н и я э т о г о т е л а. Если
тело поглощает все лучи, падающие на него, оно называется абсолютно черным.
Раскаленные тела обычно сами испускают световую энергию.
Лучеиспускание раскаленных тел, вызываемое высокой температурой, называется температурным излучением. Чем выше температура тела, тем интенсивнее его излучение. Спектры света, даваемые источниками света, называются с п е к т р а м и и с п у с к а н и я. Раскаленные твердые и жидкие тела дают непрерывный, или сплошной, спектр испускания, а раскаленные газы —прерывчатый. В первом случае спектр представляет собой разноцветную полосу с постепенным переходом цветов; во втором случае на темном фоне наблюдаются разноцветные линии или полосы. При свечении раскаленных молекул газа получаются п о л о с а т ы е с п е к т р ы; при свечении одноатомных газов получаются л и н е й н ы е с п е к т р ы .
Каждое вещество обладает способностью испускать свой особый, характерный спектр. В том случае, когда вещество в раскаленном состоянии излучает лучи определенной длины волны, лучеиспускание называется избирательным. Всякое тело поглощает те лучи, какие оно способно излучать при той же температуре (из закона Кирхгофа). Если раскаленные газы поглощают часть излучаемого ими спектра, то получаются прерывчатые спектры с темными линиями (или полосами) поглощения. Такие с п е к т р ы называются о б р а щ е н н ы м и.
В зависимости от свойств излучающих веществ получаются световые лучи различной длины волны. Человеческий глаз способен воспринимать световые лучи с длиной волны от 0,4 до 0,75 μ (μ — микрон — одна тысячная доля миллиметра). Длина волны около 0,4 μ -соответствует фиолетовым лучам спектра, а длина около 0,75 μ — красным. Человеческий глаз наиболее чувствителен к лучам с длиной волны 0,555 и, относящимся к желто-зеленой части спектра.
При горении различных пиротехнических пламенных составов появление светящего пламени обусловливается излучением раскаленных частиц продуктов реакции. В зависимости от свойств компонентов состава и конечных продуктов реакции горения можно получить пламя с большей или меньшей силой света; бесцветное или окрашенное.
§ 3. ОСВЕТИТЕЛЬНЫЕ СОСТАВЫ
Составы, образующие при горении сильный свет, применяются для освещения местности. Для фотосъемок служат специальные фотоосветительные составы (фотовспышки).
Химическая энергияреакции горения, происходящей в осветительных составах, частично переходит в световую. При этом образуется интенсивное белое пламя.
Для осветительного пламени с большой силой света необходимы следующие условия:
1) химическая реакция горения должна протекать с большой скоростью;
2) при горении должно выделяться много тепла, т. е. реакция должна быть высоко экзотермичной;
3) температура, развиваемая реакцией, должна быть высокой (доходить до 2500—3000°);
4) в результате реакции должны образовываться и газообразные и твердые (или жидкие) продукты, которые определяют появление интенсивного белого пламенного свечения.
При горении осветительного состава происходит термическое излучение раскаленных твердых и газообразных частиц. Твердые частицы излучают сплошной (непрерывный) спектр, а газообразные — прерывчатый; при этом раскаленная газовая фаза пламени поглощает часть излучаемой световой энергии, образуя обращенный спектр. Таким образом, при горении пиротехнических осветительных составов получается сложный спектр. Его можно рассматривать как сплошной спектр с некоторым количеством темных линий и полос поглощения (обращения), а также ярких линий и полос излучения газовой фазы пламени. В результате человеческий глаз воспринимает этот спектр как белый свет, оттенок которого зависит от относительного преобладания линий и полос спектра той или иной длины волны.
Наибольшая чувствительность человеческого глаза к желтым лучам объясняется тем, что глаз больше всего приспособлен к свету солнца. Солнце излучает желтых лучей больше всех других. Температура солнца доходит приблизительно до 6000°; такой температуры осветительные составы не дают, и поэтому от чисто термического излучения при горении составов преобладания желтых или близких к ним по длине волны зеленых лучей не может быть. Однако осветительные составы, основанные на использовании физиологического действия света, должны давать пламя желтого или желто-зеленого оттенка. Для этой цели в осветительные составы вводятся п л а м е н н ы е д о б а в к и, т. е. вещества, которые при температуре горения состава излучают световые лучи в желтой и зеленой частях спектра. Соединения натрия дают желтое, а соединения бария — желто-зеленое пламя.
Таким образом, в осветительный состав должны входить следующие компоненты: окислитель, горючее, пламенная добавка и цементатор. Однако основные компоненты часто выбирают с таким расчетом, чтобы они сами играли роль пламенных добавок, например, в качестве окислителя употребляют соль бария.
Роль каждого из этих компонентов в составе различна. При выборе их следует учитывать характер тех продуктов, которые получаются в результате реакции горения. Среди них обязательно должны быть газообразные продукты, без которых не может появиться пламя. Однако большое преобладание газообразных продуктов понизит температуру реакции и снизит световой эффект. Поэтому около половины всех продуктов реакции горения должны составлять твердые вещества. Для получения интенсивного белого цвета необходимо, чтобы среди этих твердых продуктов реакции были тугоплавкие вещества, способные излучать свет при температуре горения составов.
Для получения высокой степени экзотермичности реакции горения состава, которая способствует увеличению светоотдачи, применяют горючие с большой калорийностью. От окислителей для той же цели требуется затрата возможно меньшего количества тепла на их разложение; следовательно, желательны окислители с минимальной положительной теплотой образования.
Наиболее пригодными горючими для осветительных составов оказываются металлы — магний и алюминий. Они обладают сравнительно высокой калорийностью.
Магний при окислении в MgO выделяет 146 кал/мол, алюминий при окислении в АI2O3 выделяет 385 кал/мол. Вследствие большего теплового эффекта, даваемого алюминием при окислении, составы с ним дают силу света, большую, чем составы с магнием. Однако присутствие алюминия вызывает искрение состава при горении.
Искрение может быть ф о р с о в ы м и ш л а к о в ы м. Форсовое искрение вызывается неполным сгоранием частиц алюминия в составе; несгорающие частицы выносятся газами за пределы пламени и догорают в окружающем воздухе. Форсовый свет понижает силу света состава. Шлаковое искрение появляется вследствие разбрасывания раскаленных частиц твердых продуктов горения (шлаков), образующих искры.
Для уменьшения искрения применяют сильно измельченный алюминий; он способствует более полному протеканию реакции горения. Кроме того, можно уменьшить скорость реакции и газовую фазу процесса, однако, уменьшая искрение, это вместе с тем снижает силу света.
В составах с магнием реакция горения протекает очень бурно, с большой скоростью вследствие большой реакционной способности магния. Кроме того, магний кипит при температуре около 1100°, а следовательно, часть процесса окисления происходит в присутствии парообразного магния. Низкая температура испарения магния приводит к тому, что некоторая часть магния в составах не используется по назначению: магний успевает испариться до сгорания. Для осветительных составов иногда используют смеси магния и алюминия или их сплавы.
В качестве окислителя для осветительных составов большей частью применяют азотнокислый барий. При горении составов с азотнокислым барием образуется окись бария, при температуре горения состава она излучает яркие линии и полосы в желто-зеленой части спектра. Таким образом, давая кислород для реакции горения, нитрат бария одновременно служит и пламенной добавкой.
Цементатор вводится в состав для придания механической прочности при прессовании и для уменьшения скорости реакции. Цементаторами в большинстве случаев служат органические смолы пли масла (олифа). Они сгорают за счет кислорода окислителя, образуя газообразные продукты. Увеличение при этом количества газообразных продуктов реакции понижает температуру реакции и уменьшает ее скорость. Поэтому цементаторы и флегматизаторы снижают силу света, даваемую составом. Меньше других снижает световой эффект состава шеллак.
Как было сказано, наиболее часто употребляются осветительные составы, основанием которых служит двойная смесь: бариевая селитра + металл (магний или алюминий).
Приведем рецепт состава, основанного на взаимодействии азотнокислого бария и магния (в проц.):
Азотнокислого бария ………………………………………74
Магния…………………………………………………………20
Шеллака ………………………………………………………..6
Шеллак служит цементатором.
Аналогичный рецепт осветительного состава применяется для снаряжения английских осветительных снарядов (в проц.):
Азотнокислого бария ………………………….………. 66
Магния (в порошке)………………………………………30
Шеллака …………………………………………………...4
Рецепт состава с алюминием (в проц.):
Азотнокислого бария ………..…….…………………………68
Алюминия (в пудре) ……………….…………………………14
Алюминия (в порошке)……………………………………….14
Шеллака …………………………………………………………4
Часто применяется смесь металлов, например, в следующем составе (в проц.):
Азотнокислого бария …………………………...……………75
Алюминия ……………………………………………………...18
Магния …………………………………………………………4
Олифы ………………………………………………………….. 3
В некоторые составы для улучшения реакции горения п для облегчения воспламенения вводится пороховая мякоть, как, например, в составы, применяемые в снарядах системы Погребнякова1 (в проц.):
Азотнокислого бария …………………………………………80
Алюминия ………………………………………………………15
Пороховой мякоти ……………………………………………...5
Олифы (сверх 100°) …………..…………………………..……6 ч.
Применение металлов вызывает некоторые недостатки в составах. Энергичное взаимодействие металлов с водой может вызывать самовоспламенение составов при хранении; сильное распыление металлов создает неудобства в производственном процессе; кроме того, магний и алюминий сравнительно дороги.
Все эти недостатки вызвали необходимость заменить магний п алюминий в составах другими веществами.
Одна из немецких фирм (Geka-Werke) выработала рецепты осветительных составов без металлов; в этих составах в качестве горючего используются твердые смолы, например (в весовых частях):
Азотнокислого бария ....………………………... 60
Азотнокислого стронция .…………………………….... 10
Перекиси марганца ....………………………………….... 1
Твердой смолы ………………………………….............. 20
Азотнокислого бария ..….…………………...... 60
Азотнокислого стронция ………..………………........ 15
Перекиси бария …………………………………............ 30
Смолы..…………………………………………................ 20
Германский патент (№ 826761) предлагает в качестве осветительного состава следующую смесь:
Перекиси бария .………………..…………………………......... 34 ч.,
Ферросилиция (или кристаллического кремния) .......... 3 ч.
Во время империалистической войны 1914—1918 гг. в австрийской армии был предложен следующий рецепт осветительного состава (в проц.):
Азотнокислого бария …………………………………….72,6
Алюминия ………………………………………………….21,8
Магния …………………………………………………………4
Парафина ……….…………..……………..............…… 1,6
В некоторых германских патентах (например № 314668) рекомендуется употреблять пек в качестве горючего и связующего вещества (с применением органического растворителя, который высушивается после смешения состава).
По предложениям других патентов к обычным компонентам осветительных составов прибавляются добавки фтористых солей, например криолита 3NaF • AIF3. Приводим один из предлагаемых составов (в весовых частях):
Хлората калия ....…………………………….......... 180
Селитры ..………………………………………………15
Сплава алюминия и магния (1 • 1)………………170
Шеллака ..….…………………………………............. 40
Декстрина .………………………………….............. 12
Фтористых солей …………………………............ 40
Осветительные составы, применяемые для снаряжения пиротехнических изделий, обычно спрессовываются под давлением 1000 кг/см"* и более. Величина давления, выбираемого для прессования состава, зависит от свойств состава и требований, предъявляемых к нему (скорость горения).
Чаще всего составу придают форму цилиндра, который называется «звездкой».
Фотоосветительные составы (фотовспышки)
Пиротехнические составы, предназначенные для освещения при фотографировании, основаны на применении химического действия света. Свет действует на фотоматериалы, вызывая химическое изменение их. Фотографические материалы обладают разной чувствительностью к свету различных длин волн.
По цветочувствительности различают н о р м а л ь н ы е, о р т о х р о м а т и- ч е с к и е и п а н х р о м а т и ч е с к и е м а т е р и а л ы.
Н о р м а л ь н ы е фотоматериалы чувствительны к свету более коротких волн, т. е. к ультрафиолетовым, фиолетовым и синим лучам (очень незначительно — к зеленым).
О р т о х р о м а т и ч е с к и е фотоматериалы воспринимают свет от ультрафиолетовой до желто-зеленой части спектра.
П а н х р о м а т и ч е с к и е фотоматериалы чувствительны к лучам от ультрафиолетовой до инфракрасной части спектра, т. е. все видимые глазом лучи действуют на эти фотоматериалы.
Обработав фотографическую пластинку или пленку различными веществами (называемыми сенсибилизаторами), можно увеличить ее чувствительность к лучам определенной длины волны. При всех условиях кривые чувствительности фотоматериалов к свету не имеют такого характера, как кривая чувствительности глаза, и для освещения при фотографировании не обязательно постоянное преобладание желтых или желто-зеленых лучей.
Наиболее часто от фотоосветительных составов требуется очень большая скорость горения. Часто достаточно освещения в течение долей секунды, чтобы сфотографировать объект. Поэтому наиболее подходящим горючим для фотовспышек является магний: он очень легко переходит в парообразное состояние и очень быстро реагирует.
В качестве окислителей выгодно применять активные кислородсодержащие соединения, быстро разлагающиеся с выделением кислорода (перхлораты, хлораты). Обычно в фотовспышках берется избыток магния по сравнению с теоретически рассчитанным количеством. Главная роль окислителя при этом заключается в создании начального импульса реакции, а после достижения требуемой температуры часть магния, перешедшего в парообразное состояние, сгорает за счет кислорода воздуха.
Новый французский патент рекомендует применять в качестве окислителей для фотовспышек молибденовую или вольфрамовую кислоты в смеси с порошком магния или алюминия или со сплавом их. По указанию патента такие составы отличаются малым выделением дыма.
Примеры рецептов (в проц.):
1. Молибденовой кислоты …………….…....... 70
Сплава алюминия и магния (1 : 1)…….…… . 30
2. Вольфрамовой кислоты …………………...... 75
Сплава алюминия и магния (1:1)……………. 25
Состав следует обработать спиртовым раствором смолы.
Определение силы света (фотометрия)
Сила света, даваемая осветительным составом при горении, является одной из важнейших его характеристик.
Измерение силы света может быть произведено с у б ъ е к т и в н ы м и о б ъ е к т и в н ы м способами.
Субъективный способ заключается в том, что наблюдатель сравнивает на глаз две непосредственно граничащие друг с другом освещенные поверхности. Одна из них освещается эталонным источником света, сила которого известна, а другая — исследуемым источником света. Освещаемые поверхности передвигают на различные расстояния от источников света до получения одинаковой освещенности. Тогда искомая сила света исследуемого источника будет найдена вычислением на основании того, что сила света исследуемого источника во столько раз больше (или меньше) силы света эталона, во сколько раз квадрат расстояния от точки равенства освещенностей до исследуемого источника меньше (или больше), чем до эталона.
На таком принципе построены различные приборы для определения силы света — ф о т о м е т р ы.
Однако субъективная фотометрия дает весьма неточные результаты, зависящие от индивидуального восприятия наблюдателем.
Силу света осветительных составов субъективная фотометрия определяет с большой неточностью вследствие кратковременного действия источника света. При методе объективной фотометрии сила света определяется специальным прибором — фотоэлементом. Наблюдатель только регистрирует показания прибора.
Фотоэлемент — прибор, преобразующий световую энергию в электрическую.
При воздействии света фотоэлемент создает в цепи электрический ток. Это явление объясняется тем, что под действием световой энергии с поверхности некоторых металлов (например, щелочных) отрываются электроны. Чувствительность фотоэлементов к свету меняется в зависимости от длин волн лучей.
В настоящее время существует много конструкций фотоэлементов. Для фотометрирования наиболее пригодны фотоэлементы с запирающим слоем, или вентильные.
Достоинства этих фотоэлементов состоят в следующем:
1. Вентильные фотоэлементы непосредственно, без добавочных источников электрической энергии (батарей), превращают энергию световых лучей в электрическую.
2. Электрический ток, получаемый с помощью вентильных фотоэлементов, прямо пропорционален силе света.
3. Спектральная чувствительность (т. е. чувствительность к лучам света определенной длины волны) вентильных фотоэлементов близка к чувствительности человеческого глаза.
4. Общая (интегральная) чувствительность к свету у вентильных фотоэлементов очень велика.
Прямая пропорциональность между силой света и возникающим в цепи с фотоэлементом электрическим током позволяет очень просто измерить силу света. Световые лучи от горящего осветительного состава попадают на светочувствительный слой фотоэлемента, который соединен с чувствительным электроизмерительным прибором. Ток, возникающий в фотоэлементе, под влиянием света, отклонит стрелку прибора. Можно предварительно с помощью эталонных
ламп прокалибровать установку так, чтобы стрелка измерительного прибора показывала на шкале его непосредственно световые единицы (свечи).
Практически для определения силы света удобно пользоваться селеновыми фотоэлементами, которые изготовляются в соединении с чувствительным стрелочным гальванометром (рис. 11).

§ 4. СИГНАЛЬНЫЕ СОСТАВЫ НОЧНОГО ДЕЙСТВИЯ
Сигнальные составы ночного действия при горении образуют окрашенное в яркий цвет пламя. Для сигнализации применяются составы, дающие красное, желтое, зеленое и реже синее пламя.
Сигнальные составы должны давать пламя такого яркого цвета, чтобы его можно было различить на больших расстояниях (ночью на расстоянии 5—15 км).
Пламя этих составов не должно изменять своего цвета во время горения состава.
Кроме того, составы должны обладать определенной скоростью горения и химической стойкостью.
При высокой температуре горения пиротехнических составов соединения металлов разлагаются иногда до атомов, иногда до каких-либо других соединений, отличных от исходных. Эти продукты разложения, а также некоторые продукты реакции, происходящей при горении состава, переходят в парообразное состояние и, раскаляясь, дают прерывчатые спектры излучения в виде линий или полос. Если светятся атомы, то получаются линейные спектры, молекулы дают полосатые спектры.
Для получения пламени, окрашенного в характерный цвет и пригодного для ночной сигнализации, можно использовать свечение только тех атомов, которые дают при излучении яркие спектральные линии в определенной видимой части спектра.
Практическое значение для пиротехники имеет атомарное свечение натрия, дающее желтое пламя. Для получения пламени других цветов используется молекулярное свечение соединений бария,
стронция и меди. Обычно в пламени излучают монохлориды этих металлов, образующиеся вследствие легкого отщепления атома хлора от их двухвалентных соединений при высокой температуре пламени (доходит до 2500°).
При получении окислов перечисленных выше металлов окраска пламени бывает хуже. Лучше других окрашивает пламя окись стронция; свечение ее наблюдается при горении составов, содержащих азотнокислый стронций.
Если в основной сигнальный состав не входят перхлораты, хлориды или хлораты, а цветнопламенные добавки также не содержат хлора, к составу прибавляют дополнительно хлорсодержащие вещества: хлористый аммоний (нашатырь), хлористую ртуть (каломель), некоторые хлорорганические соединения. Они улучшают окраску пламени, так как за их счет образуются монохлориды металла. Введение н составы хлор со держащих веществ позволяет употреблять нитраты вместо хлоратов и перхлоратов в качестве окислителей. Это значительно снижает чувствительность составов к механическим воздействиям.
В качестве окислителей применяются хлораты или, реже, перхлораты. Наиболее выгодны цветнопламенные окислители, т. е. окислители, содержащие металлы, окрашивающие пламя. Из горючих чаще всего применяются смолы, которые одновременно служат и цементаторами. Иногда для увеличения силы света в составы прибавляется магний или алюминий. Металлы развивают при горении высокую температуру и повышают силу света и яркость его. Однако прибавление металлов в количестве более 1—3% к составу не рекомендуется; при большем содержании металлов температура реакции настолько повышается, что наступает диссоциация (разложение) молекул монохлоридов бария, стронция и др. на атомы. Цветная окраска пламени обусловливается излучением моиохлоридов, а их диссоциация уничтожает окраску. Атомы бария, стронция и меди дают совершенно другой спектр излучения, отличный от спектра излучения монохлоридов. Например, атомарное свечение стронция дает линии в синей и ультрафиолетовой части спектра, а монохлорид стронция излучает в красной его части. Только в тех случаях, когда используется атомарное свечение (например желтый огонь с натрием), можно для увеличения силы света состава добавлять более 3% металла.
В качестве горючего во многие составы цветных огней иногда рекомендуется кроме смол вводить серу. Горение составов с серой обычно сопровождается хорошо окрашенным пламенем. Но сера опасна в составах, содержащих хлораты. Такие составы иногда самовоспламеняются при хранении. Это объясняется присутствием свободной серной кислоты, которая почти всегда содержится в сере (особенно в серном цвете). Серная кислота взаимодействует с хлоратом калия, выделяя тепло, что и вызывает самовоспламенение состава.
Для нейтрализации серной кислоты в составах с серой Демидов предлагает употреблять карбонаты металлов, окрашивающие одновременно пламя в соответствующий цвет.
С о с т а в ы к р а с н о г о о г н я На больших расстояниях наиболее хорошо различим огонь красного цвета, главным образом, потому, что атмосфера лучше всех других лучей пропускает красные (лучи с наибольшей длиной волны из всех видимых). Красные лучи частицами воздуха рассеиваются меньше, чем другие, и цветность красного огня с увеличением расстояния изменяется сравнительно незначительно.
Носителями цветности в пламени красного огня могут быть атомы лития или молекулы соединений стронция — монохлориды или окись стронция. Практического применения атомарное свечение лития не имеет, — он очень дорог и мало доступен. Хорошую красную окраску пламени можно было бы получить, используя в качестве цветнопламенных окислителей хлорат или нитрат стронция. Однако большая гигроскопичность совершенно исключает применение хлората стронция и ограничивает применение нитрата стронция. Некоторые примеси, встречающиеся в нитрате стронция, увеличивают; его гигроскопичность.
Широко применяется хлорат калия (бертолетова соль) в качестве окислителя для составов красного огня.
Из горючих наиболее часто употребляют смолы: шеллак, идитол, канифоль. Идитол — лучшее горючее. Он обладает хорошими цементирующими свойствами и доступен. Смолы одновременно служат горючими и цементаторами.
В некоторых составах красного огня в качестве горючих употребляются сера и антимоний или уголь.
Если окислителем в составе является нитрат стронция, к двойной смеси нитрат стронция + горючее прибавляется для увеличения скорости горения небольшое количество двойной смеси хлорат калия + горючее.
Приводим примерный состав (в проц.):
Азотнокислого стронция ..…………………....... 44
Хлората калия .…………………………............. 32
Серы ......………………….………………............. 19
Угля ............……………………………………...... 3
Декстрина .............……………………………….. 2
Однако многокомпонентность такого состава затрудняет его производство; кроме того, звездки получаются малой механической прочности.
Из цветнопламенных добавок в составы красного огня вводят щавелевокислый или углекислый стронций. Первый из них лучше окрашивает пламя (большая насыщенность цветом), но дороже углекислого стронция.
Рекомендуются для таких составов красного огня следующие рецепты11 (в проц.):
1. Хлората калия ......…………………..... 60
Щавелевокислого стронция .…………... 25
Идитола или декстрина ..……………..... 15
2. Хлората калия .....…………………...... 60
Углекислого стронция ....………………... 25
Идитола или декстрина ....…………….. 15
Приводим примерный состав с серой (в проц.):
Хлората калия …………………………….......…41
Серы ………………………………………………10
Углекислого стронция ……………….………... 49
Схему реакций горения этого состава можно выразить уравнением:
КСIO3 + S + SrCO3 KCI + SrSO4 + СO2.
Следующий рецепт предлагает введение металла в состав (в проц.):
Хлората калия …………………….…………….………….....53
Азотнокислого стронция………………………………………24
Шеллака ..……………………………………………………….20
Магния. .......……..………………………………………………3
С о с т а в ы з е л е н о г о о г н я. Излучение в зеленой части спектра дают атомы таллия и монохлорид бария. При низкой температуре медь окрашивает пламя в зеленый цвет. На практике в пиротехнике применяют только соединения бария.
Наиболее выгоден хлорат бария. Давая ярко-зеленую окраску пламени, он служит одновременно и окислителем.
При раскислении хлората бария образуется хлорид бария ВаС12, который легко переходит в пар при температуре горения состава (температура кипения 1520°) и диссоциирует, давая монохлорид бария BaCI, который излучает зеленые лучи. Наиболее простым рецептом зеленого огня является двойная смесь хлорат бария + горючее, рассчитанная по реакции горения. Если горючим служат смолы, то состав обладает хорошей механической прочностью. Приводим примерный рецепт состава зеленого огня (в проц.):
Хлорноватокислого бария ..…………………..... 88
Идтола ...……………………………………............. 12
Недостатком хлората бария является большая чувствительность составов с ним к механическим воздействиям; производство этих составов опасно.
Другой солью бария, применяемой в составах зеленого огня, является азотнокислый барий. Однако двойные смеси с нитратом бария не дают хорошей зеленой окраски пламени, поэтому в состав вводится более энергично действующая двойная смесь на основе хлората калия, который выделяет хлор для образования в пламени монохлорида бария.
Приводим примерный состав с нитратом бария (в проц.):
Хлората калия…………………………………………………….20
Нитрата бария………………………..….………………………..60
Серы ....…………………………………………………………….20
Иногда применяется смесь хлората и нитрата бария, например, в таком составе (в проц).:
Хлората бария………………………………………… 63
Нитрата бария ……………………………………….. 25
Идитола ………………………………………………… 12
Другие соединения бария, например углекислый барий (карбонат), более слабо окрашивают пламя и иногда применяются в соединении с двойной смесью хлорат калия + сера, например (в проц.):
Хлората калия .……………………………………........... 77
Серы .........…………………………………………......... 15,5
Карбоната бария .....…………………………………...... 7,5
С о с т а в ы с и н е г о о г н я. Сигналами синего огня нельзя пользоваться для больших расстояний. Атмосфера рассеивает коротковолновые лучи, и на расстоянии цвет синего сигнала приближается к желтому.
Пламя в синий цвет может окрашиваться медью при сравнительно высокой температуре (при более низких температурах медь дает зеленое окрашивание пламени).
Синюю окраску пламени солями меди можно получить и при сравнительно низких температурах, но для этого вводят в состав вещества, дающие при разложении свободный хлор.
В процессе реакции горения медь соединяется с хлором и образует монохлорид меди CuCl, который окрашивает пламя в синий цвет. Часто применяются основные углекислые соли меди, например горная или медная лазурь 2СuСO3 •Сu(ОН)2.
Приводим примерный состав синего огня (в проц.):
Хлората калия КСIO3………………………….………….. .......... 56
Серы S....…………………………………………………….............. 22
Медной лазури 2 CuCO3 Cu(OH)2 .……………………………….. 22
В этом составе двойная смесь из хлората калия и серы дает нужный для разложения медной лазури тепловой эффект.
Иногда в качестве основной смеси применяется тройная смесь (в весовых частях):
Хлората калия КСIO3 …………………………….......... 64
Серы S ……...…………………………………….............. 13
Полусернистой меди CuS …………………….. ........ 21
Эта тройная смесь имеет такую реакцию горения:
4 КСIOз + 3 S + CuS 4 КСI + 2 CuSO4 + 2 SO2.
К этой смеси добавляют медную лазурь или другую соль меди в количестве, определяемом опытом; без добавки соли тройная смесь дает голубое пламя.
С о с т а в ы ж е л т о г о о г н я. Желтое пламя получается при атомарном излучении натрия. Соли натрия, играющие роль цветнопламенных окислителей, как хлорат и нитрат натрия, почти не применяют, так как они гигроскопичны. Поэтому в большинство составов желтого огня кроме основной двойной смеси вводят цветно-пламенные добавки. Из них наиболее часто применяют щавелевокислый и углекислый натрий (оксалат и карбонат натрия).
Карбонат натрия (сода) Na2CO3 • 10Н2O, имеет кристаллизационную воду; 10 мол кристаллизационной воды можно удалить сушкой соды при 115 — 120°.
Приводим примерный рецепт состава желтого огня, содержащего серу в качестве горючего, хлорат калия в качестве окислителя и соду в качестве цветнопламенной добавки (в проц.):
Хлората калия ..…………………………….…………........... 47
Серы . . .........……………………………………………...... 12
Карбоната натрия (соды) ……………………………. ........ 41
Химическая реакция горения такого состава выражается уравнением:
КСIO3 + S + Na2CO3 KCI + Na2SO4 + CO2.
В таком составе двойная смесь хлорат калия + сера дает термический эффект, требуемый для разложения соды и окрашивания пламени в желтый цвет. В то же время сода предохраняет смесь хлората калия и серы от саморазложения.
Иногда вместо карбоната натрия применяют двууглекислый натрий, например (в проц.):
Хлората калия ………………………………............. 38
Двууглекислого натрия ..……….………………...... 52
Серы ..............……………………………………….... 10
Оксалат натрия более пригоден для производства, чем карбонат, в нем нет кристаллизационной воды, он не гигроскопичен, разлагается при более низкой температуре и лучше окрашивает пламя.
Приводим примерный рецепт состава со щавелевокислым натрием (в проц.):
Хлората калия ...………………………………………….......... 60
Щавелевокислого натрия ……………………………….......... 25
Идитола ...………………………………………………............. 15
Для увеличения силы света и яркости окраски пламени можно . вводить в состав магний, например (в проц.):
Хлората калия .…………………………………........... 46
Нитрата натрия ..………………………………............ 28
Шеллака ........……………………………………......... 18
Магния. .....………………………………………........... 8
Хорошей цветнопламенной добавкой служит криолит 3NaF • AIF3, который отличается негигроскопичностью. Примерный состав с криолитом (в проц.):
Хлората калия ……………………………60
Нитрата натрия…………………………...28
Шеллака……………………………………18
Магния ……………………………………....8
С о с т а в ы о г н я п р о ч и х ц в е т о в. Состав, дающий при горении розовое пламя, получается при наличии солей кальция, например (в проц.):
Хлората калия . …………………………............. 60
Углекислого кальция .…………………………......... 25
Идитола .........……………………………………....... 15
Или при наличии серы (в проц.):
Хлората калия ……………….............. 60
Серы ..........………………………......... 20
Углекислого кальция ...…………….... 20
В составе, изготовленном по последнему рецепту, наилучшие результаты дает применение углекислого кальция в виде мрамора СаСO3.
Оранжевое, фиолетовое, голубое пламя можно получить, смешивая различные цветнопламенные добавки в составах или ослабляя основную окраску пламени. Так, для получения оранжевого пламени можно ввести в состав красного огня соли натрия или в состав желтого огня — соли стронция. Для получения фиолетового огня смешивают составы синего и красного огней в пропорциях, определяемых опытным путем.
Составы, дающие огни переходных цветов, не применяются для целей сигнализации (их применяют в фейерверочных изделиях).
§ 5. ТРАССИРУЮЩИЕ СОСТАВЫ
Трассирующие пламенные составы применяют для снаряжения трассирующих средств. Они могут давать белый, красный, зеленый, огни.
Трассирующие составы обычно применяют в пулях или снарядах в сравнительно небольших количествах, а горение их должно быть продолжительным. В зависимости от условий применения трассирующие составы должны обладать следующими свойствами:
1) большой силой света (и яркостью);
2) окрашенное пламя должно быть очень густого и резкого цвета;
3) небольшой скоростью горения;
4) хорошо поддаваться прессованию под давлением до 10 000 кг/см3, так как в некоторых трассирующих снарядах состав подвергается большому давлению при выстреле;
5) легкой воспламеняемостью;
6) безопасностью в обращении;
7) стойкостью при хранении.
Противоречивость некоторых требований, предъявляемых к трассирующим составам, затрудняет выбор компонентов. Составы, дающие пламя большой силы света и легко воспламеняющиеся, обычно быстро горят и не обеспечивают продолжительности горения при малом их количестве.
В качестве окислителей в трассирующих составах можно применять перекись бария, нитрат бария, нитрат калия, хлорат калия и др.
Горючими в трассирующих составах служат магний в порошке и алюминий, дающие при горении свет большой силы.
Для цементации составов применяют смолы, льняное масло, олифу и др.
Иногда в трассирующие составы добавляют флегматизаторы, замедляющие горение, и вещества, повышающие силу света и яркость пламени при горении состава.
Для трассирующих составов, дающих при горении окрашенное пламя, применяют те же цветнопламенные добавки, что и для сигнальных огней.
Приведем примерные трассирующие составы (в проц.):
1. Магния………………………………............. 5 — 25
Перекиси бария ……………….....……...... 95 — 75
Стеарата цинка .....…………………………. 0,5 — 10
(стеарат цинка увеличивает стойкость состава по отношению
к воде).
2. Магния .......………………………………….......... 20
Хромата бария ....……………………………………… 80
Трассирующие составы большей частью прессуются в специальную оболочку или непосредственно в корпус трассирующего объекта пули или снаряда).
§ 6. ЗАЖИГАТЕЛЬНЫЕ СОСТАВЫ
Зажигательные составы для снаряжения зажигательных боеприпасов имеют большое военное значение. Эти составы подразделяются на термитные, зажигательные с кислородсодержащими солями в качестве окислителей и на зажигательные вещества (фосфор, электрон, горючие масла и др.)-
Все зажигательные составы должны: 1) развивать высокую температуру при горении (около 2500°), обеспечивающую воспламенение трудно зажигающихся объектов; 2) обладать большой продолжительностью горения; 3) легко воспламеняться; 4) не поддаваться легко тушению; 5) обладать стойкостью при хранении; 6) быть безопасными в обращении и при перевозках; 7) изготовляться из доступных и дешевых исходных продуктов.
Термитные составы лучше всех других удовлетворяют этим требованиям.
Термитные составы
В основе применения термитных составов лежат так называемые термитные реакции.
Термитная реакция происходит между окислителем и горючим, но условия ее отличаются от условий реакции в обычных пиротехнических двойных смесях.
Под термитными подразумеваются экзотермические реакции между металлом и окислом другого металла, когда свободный металл окисляется за счет кислорода окисла. Следовательно, в термитной реакции окислителем служит окисел металла, а горючим — свободный металл.
Термитные реакции отличаются следующими свойствами от реакций, происходящих в других пиротехнических составах:
1) начальные и конечные продукты реакции — твердые вещества;
2) для возбуждения термитной реакции требуется мощный тепловой импульс (реакция начинается при высокой температуре);
3) при термитной реакции развивается высокая температура, что объясняется, главным образом, отсутствием газообразных продуктов, при наличии которых обычно теряется много тепла;
4) теплота реакции настолько велика, что продукты ее (шлак) расплавляются и могут растекаться. Это свойство шлака очень полезно в зажигательном составе, так как расплавленные шлаки увеличиваю? радиус его действия.
Термитные реакции, как и другие в пиротехнике, после возбуждения их начальным импульсом протекают без постороннего притока тепла. Скорость термитных реакций обычно велика.
Главную роль в термитном процессе играет горючее. Теплота сгорания горючего определяет тепловой эффект реакции. Горючее вещество в термитных реакциях должно образовывать окислы, легко плавящиеся при температуре реакции, что необходимо для получения расплавленного шлака. Однако температура кипения окисла должна быть выше температуры реакции, чтобы не было парообразования окисла. Парообразование окисла понизит температуру реакции, так как потребуется излишнее тепло на процесс парообразования, и часть тепла уйдет с парами.
Для умеренной скорости реакции требуется, чтобы и самое горючее (металл) не переходило в парообразное состояние в процессе реакции. Таким образом температура кипения металла должна по возможности превышать температуру реакции.
Наиболее подходит для термитных реакций алюминий. Реакция его окисления за счет кислорода окислов некоторых металлов была открыта в 1894 г. Гольдшмидтом и широко используется в технике. Вследствие большой теплоты сгорания алюминий способен отнимать кислород от окислов большинства металлов.
Окислитель (т. е. окисел) должен легко отдавать кислород, затрачивая на свое разложение минимальное количество тепла. В таком случае реакция проходит с большим выделением тепла. В результате восстановления окисла должно получиться легкоплавкое, но труднолетучее вещество (как и в результате окисления горючего — металла).
Для практического использования термитных реакций необходимо, чтобы компоненты были доступны и сравнительно недороги.
Наиболее подходящими окислителями являются окислы железа. Железо, образующееся в результате реакции, расплавляется при температуре процесса. Скорость реакции железоалюминиевого термита регулируется подбором величины зерен компонентов.
Обычно для зажигательного состава применяется смесь алюминия (24—25%) с окислами железа (75—76%) Fe3O4 и Fe2O3, называемая железным термитом.
Термит воспламеняется при высокой температуре; для его воспламенения используют специальные составы. Горящий термит с трудом поддается тушению. Реакция горения термита может продолжаться даже под водой. Термит не чувствителен к механическим воздействиям и безопасен в обращении.
В процессе реакции образуются железо и окись алюминия в расплавленном, огненно жидком состоянии; эти расплавленные шлаки растекаются по поджигаемой поверхности, создавая очаги пожара.
Температура реакции железо алюминиевого термита приблизительно 2500°. Точно она не определена, главным образом, потому, что отсутствуют данные о теплоемкости продуктов реакции при высоких температурах. Приближенными расчетами, исходя из реакции горения термита:
3 Fe3O4 + 8 AI 9 Fe + 4 AI2O3 + (772,5 кг-кал ± 3),
найдено, что температура ее может достигать 3200 ± 200°. Однако предполагается, что в процессе реакции происходит парообразование самого алюминия, поэтому температура реакции снижается до температуры кипения алюминия, т. е. до 2500—-2300°.
Опытные определения температуры реакции оптическими методами дают 2250—2300°.
При применении термита в качестве зажигательного состава выявились некоторые его недостатки, например, трудность воспламенения и недостаточный радиус действия.
Для улучшения свойств термита к нему добавлялись различные вещества. В английских авиабомбах применялся следующий состав (в проц.):
Окалины железа ………………………............. 50
Алюминия ..........………………………………..... 24
Нитрата бария ......... ……………………. .... 26
Применением нитрата бария предполагалось повысить эффективность термита за счет увеличения количества кислорода, но это дало отрицательные результаты.
В некоторых составах к термиту добавлялись различные цементаторы, чтобы придать составу механическую прочность, например (в проц.):
Окиси железа .……………………….............. 76
Алюминия ............…………………………..... 22
Жидкого стекла ..……………………............. 2
Количество жидкого стекла может повышаться до 15%. Смесь термита с 15% жидкого стекла высушивается до полного удаления воды, и полученное вещество оказывается нечувствительным к удару.
Из органических цементаторов применяется целлулоид (в растворе эфира), который после высушивания смеси участвует в горении с образованием пламени. В некоторых случаях для связывания термитной массы применяются смолы, пек и другие вещества. Однако, прибавляя к термиту горючие связывающие вещества и окислители, дающие в результате реакции газообразные продукты, можно снизить температуру реакции, а это ухудшит зажигательное действие термита.
Для увеличения радиуса действия термита он применяется в смеси с различными нефтепродуктами и горючими маслами (например с «сгущенным нефтемаслом», предложенным американскими химиками). При горении смеси термита со сгущенным маслом получается
столб пламени, высотой до 4 м, горящее масло растекается на большую площадь.
Чтобы затруднить тушение пожаров, вызванных термитными зажигательными средствами, к составам иногда добавляется металлический натрий, который вызывает взрывы при тушении состава водой.
Для снаряжения зажигательных средств термитные составы прессуются под большим давлением. Этим достигается действие большой массы термита, занимающей сравнительно небольшой объем. Чаще всего состав прессуется в металлическую оболочку, чем обеспечивается механическая прочность изделия.
Составы с кислородсодержащими солями
Зажигательные составы с различными солями в качестве окислителей принципиально мало отличаются от осветительных составов.
В зажигательных составах окислителями служат нитраты, хлораты или окислы тяжелых металлов (свинца, бария), а горючими служат металлы (магний и алюминий или железо), сульфиды (сернистая сурьма), уголь и др. Цементаторами служат органические вещества — пек, шеллак и др. Главным требованием, предъявляемым к таким составам, является максимальная температура реакции.
Зажигательные вещества
Из горючих веществ, применяемых для снаряжения зажигательных средств, наиболее важен фосфор.
Белый или желтый фосфор воспламеняется при 40°. Порошкообразный, он легко самовоспламеняется на воздухе и сгорает за счет его кислорода, развивая высокую температуру. В зажигательных средствах пользуются хорошей растворимостью фосфора в легколетучем растворителе — сероуглероде (он растворяет фосфор в количестве, превосходящем собственный вес почти в 20 раз). В воздухе сероуглерод быстро испаряется, оставляя фосфор измельченным. Фосфор самовоспламеняется, зажигая пары сероуглерода.
Однако зажигающее действие фосфора ограничено. Температура горения его недостаточна для воспламенения, например, дерева. Он воспламеняет лишь легкозажигающиеся предметы — бензин, сухое сено и т. п. Недостатком фосфора является образование им при горении пятиокиси фосфора Р2O5; она быстро поглощает влагу и покрывает окружающие предметы пленкой. Эта пленка — тонкий слой фосфорной кислоты, затрудняющий распространение огня.
Чтобы улучшить зажигательные свойства фосфора, к нему прибавляют горючие вещества — нефтемасло, смолы, металлический натрий и др. Французы применяли следующую смесь (в проц.):
Фосфора ...………………………………..………............. 23
Сероуглерода ....... …………………………….. ....... 60
Погонов каменноугольной смолы .…………………... 17
Эта смесь помещалась в целлулоидные цилиндры.
Кроме фосфора, применяются и некоторые другие самовоспламеняющиеся вещества, например, некоторые металлоорганические соединения. Иногда можно получить самовоспламеняющиеся вещества из обычно не воспламеняющихся элементов, если их тонко измельчить. При этом значительно увеличивается поверхность их соприкосновения с воздухом и увеличивается реакционная способность. Такое состояние веществ называется п и р о ф о р н ы м. Известен способ получения в пирофорном состоянии железа и некоторых других металлов. Практически вещества в пирофорном состоянии в пиротехнике пока не применяются.
Для зажигательных целей используются также горючие масла. Струя горящего масла воспламеняет легкогорючие предметы. Специальные аппараты, о г н е м е т ы, силой давления сжатого воздуха или инертного газа выбрасывают на большое расстояние струю горючего масла. Масло при выходе из аппарата воспламеняется от электрического тока. Для огнеметов следует выбирать горючее масло с большим удельным весом, чтобы не было распыления его при выходе из аппарата. Для горючей жидкости рекомендуется брать, например, смесь из 70% смоляного масла и 30% неочищенного бензина; удельный вес такой смеси 1,044.
Начиная с империалистической войны 1914—1918 гг., большое значение приобрел сплав алюминия с магнием — электрон. Большая экзотермичность реакции горения, хорошие механические свойства, высокая температура горения делают электрон весьма пригодным для зажигательных целей. Он применяется, главным образом, для изготовления сгораемых оболочек зажигательных бомб, снаряженных термитом.
§ 7. ДЫМОВЫЕ СОСТАВЫ
Дымовые составы служат для снаряжения пиротехнических изделий, образующих дымовые облака в воздухе, и применяются для маскировки и сигнализации.
Дым представляет собой скопление чрезвычайно мелких частиц твердых веществ в воздухе.
Размеры твердых частиц дымовой системы измеряются миллионными долями сантиметра. Диаметр частиц дыма 10—5 —10—7 см, т. е. иначе от 100 mμ до 1 mμ, где 1 mμ (миллимикрон) равен одной десятимиллионной доле сантиметра, или 10-7 см.
Взвесь таких мелких частиц вещества в какой-либо среде по своим свойствам занимает промежуточное место между обычными (истинными) растворами и грубыми суспензиями. Такие системы принадлежат к коллоидным растворам. Взвешенное вещество называется д и с п е р с н о й ф а з о й, а среда, в которой оно находится во взвешенном (диспергированном) состоянии, д и с п е р с и о н- н о й с р е д о й. Если дисперсионной средой является газ, система называется а э р о з о л е м. Следовательно, дым — это аэрозоль, у которого дисперсной фазой являются частицы твердых веществ, а дисперсионной средой — воздух. К аэрозолям относятся и туманы; дисперсная фаза в них находится в жидком состоянии.
Изучение характерных свойств аэрозолей позволяет совершенствовать технику получения и использования дыма в военном деле. Некоторые особенности аэрозолей зависят от того, что частицы дисперсной фазы настолько мелки, что все реакции, которые происходят в аэрозолях на поверхности соприкосновения реагирующих веществ, отличаются большой скоростью, так как общая поверхность их чрезвычайно велика. Примерами, подтверждающими сказанное,, являются известные случаи взрывов мучной или каменноугольной пыли. Мука и уголь в обычном состоянии горят медленно, а измельченные до пыли сгорают с большой скоростью и иногда со взрывом-
Частицы аэрозолей находятся в непрерывном движении; это - происходит по трем причинам: 1) вследствие действия силы тяжести (внешняя сила); 2) вследствие действия сил, развиваемых при ударах частиц аэрозоля о молекулы газовой среды; 3) вследствие движения среды.
Действие силы тяжести заставляет частицы аэрозоля падать вниз. Однако действие силы сопротивления молекул воздуха, которые также находятся в движении, изменяет скорость и направление падения частиц в зависимости, главным образом, от вязкости среды и размера частиц аэрозоля. Действие силы тяжести вызывает оседание облака в воздухе. Мелкие частицы аэрозоля не оседают вниз по вертикальным направлениям, а совершают беспорядочное движение, которое вызывается ударами этих частиц о молекулы воздуха. В таком хаотическом движении находятся не только частицы аэрозолей, но и других коллоидных систем; это движение называется броуновским. Скорость его увеличивается с уменьшением размеров частиц и с повышением температуры. В результате броуновского движения аэрозоль рассеивается.
Движение среды влияет очень сильно на устойчивость облака. При малых частицах облако рассеивается от воздушных течений раньше, чем успеют подействовать сила тяжести и сила ударов молекул. Особенно быстро аэрозоль рассеивается при большой скорости ветра.
Следовательно, большое значение для устойчивости аэрозоля имеет размер частиц дисперсной фазы. Регулируя их размеры, можно изменить степень устойчивости облака. Размеры частиц определяются опытным путем на основе некоторых физико-химических законов; при этом обычно принимается, что частица имеет форму шара.
Приведем сравнительно простой способ определения радиуса частиц. В специальной камере образуется облако дыма. На определенный промежуток времени на дно камеры кладут стеклянную пластинку, затем ее помещают под микроскоп, дающий большое увеличение. Микроскоп снабжается особой сеткой с такими точными делениями, чтобы можно было определить размеры наблюдаемых частиц. Сделав большое число таких измерений, выводят среднюю величину радиуса частиц дыма, осевших на пластинке за определенное время.
Размеры частиц аэрозоля не постоянны. При движении частицы сталкиваются между собой и некоторые из них укрупняются. Укрупнение частиц называется к о а г у л я ц и е й. При этом процессе образующиеся крупные частицы выпадают из воздушной среды, и облако разрушается. Укрупненные твердые частицы дымов образуют так называемые хлопья, по-английски flocks, отчего весь процесс называют флокуляцией.
Коагуляция происходит вследствие присутствия на некоторых частицах электрических зарядов. Иногда разные частицы имеют заряды противоположных знаков. В таких случаях коагуляция происходит быстро вследствие взаимного притяжения отрицательных и положительных зарядов. Наоборот, в случае одноименно заряженных частиц они отталкиваются друг от друга; устойчивость аэрозоля в этом случае выше, чем в первом.
Устойчивость увеличивается также в том случае, когда частицы дисперсной фазы аэрозоля окружены пленкой газа, поглощенного аэрозолем. Она как бы защищает частицу аэрозоля от слипания с другой частицей и, задерживая коагуляцию, увеличивает устойчивость облака.
Весьма важны для применения аэрозолей в военной технике их о п т и ч е с- к и е с в о й с т в а. Если лучи света проходят через аэрозоль, они встречаются с частицами дисперсной фазы. При этом в зависимости от свойств аэрозоля и длины волн световых лучей происходят следующие явления: 1) свет проходит и преломляется, 2) поглощается, 3) отражается, 4) рассеивается.
Если размеры частиц дисперсной фазы превышают длину волны видимых лучей света, свет может частично проходить через них, преломляясь и отражаясь при этом по законам оптики. Поглощение, отдельных частей спектра имеет избирательный характер, т. е. частицы определенного вещества поглощают лучи определенной длины волны. Поэтому некоторые аэрозоли имеют характерную окраску. Аэрозоль будет казаться прозрачным, если количество отраженных им лучей невелико; если же большая часть падающих лучей будет отражаться, аэрозоль будет непрозрачным. При одновременном наличии отражения и избирательного поглощения части светового потока можно получить непрозрачные окрашенные аэрозоли.
Если частицы дисперсной фазы аэрозоля меньше длины волны видимых лучей света, то происходит частичное поглощение и рассеивание света. Мелкие частицы рассеивают падающий свет во все стороны равномерно и сами становятся источником излучения света. Таким образом при прохождении луча света через аэрозоль уменьшается интенсивность света. Это свойство дымов и туманов используется в военной технике для маскирующих средств. Для них желательны аэрозоли с минимальной прозрачностью. Обычно з а т е м н я ю щ а я (или «кроющая») способность аэрозоля измеряется уменьшением интенсивности светового потока (в процентах) после прохождения им слоя аэрозоля толщиной в 1 м. Иногда кроющая способность дыма условно выражается величиной 1/L, где L —тол-
щина слоя дыма, полностью затемняющего свет от электрической лампы, которая служит эталоном.
Аэрозоли можно получить дисперсионным и конденсационным методами.
Д и с п е р с и о н н ы й м е т о д заключается в измельчении (диспергировании) вещества до частиц нужных размеров и рассеивании их в воздухе. Это достигается разными путями, например, действием взрыва. Малолетучие вещества подвергаются давлению газов, образующихся при взрыве взрывчатого вещества. Сила мгновенного удара газов распыляет вещество и рассеивает частицы его в воздухе, образуя облако. Этот метод не экономичен и трудно осуществим; для получения частиц требуемых размеров затрачивается очень много энергии.
К о н д е н с а ц и о н н ы й м е т о д заключается в соединении молекул вещества до частиц требуемой величины. При этом вещество, находящееся в воздухе в виде пара, переходит из парообразного в твердое или жидкое состояние.
Аэрозоли, получаемые конденсационным способом, имеют более мелкие частицы, чем получаемые диспергированием. Конденсационный метод более распространен, чем дисперсионный. Аэрозоли по этому способу получают двумя путями: а) охлаждением паров вещества, б) конденсацией в результате химической реакции.
Для конденсации паров вещества необходимо, чтобы пары пересыщали пространство. Следовательно, необходимо получить сначала пересыщенный пар, который затем конденсируется.
К о н д е н с а ц и я о х л а ж д е н и е м п а р о в. Пары вещества можно охлаждать по всему объему пара, либо по его поверхности.
Для объемного охлаждения пара используется способ быстрого увеличения его объема, без притока тепла извне. Работа, расходуемая паром на расширение, происходит за счет запаса тепла, имеющегося у пара; при этом соответственно понижается его температура и происходит частичная конденсация.
Поверхностное охлаждение пара происходит при соприкосновении его с холодными телами, например, с холодным воздухом.
Практически для получения аэрозолей часто используется возгонка, т. е. испарение вещества и конденсация его паров при соприкосновении с холодным воздухом.
К о н д е н с а ц и я в р е з у л ь т а т е х и м и ч е с к о й р е а к ц и и. Для получения аэрозоля необходимо, чтобы в результате химической реакции образовались пересыщенные пары вещества, которые затем могут конденсироваться. Это происходит при реакции некоторых веществ с водой, например, при присоединении молекул воды к химическому соединению (реакция гидратации) или при разложении химического соединения при взаимодействии с водой (реакция гидролиза).
Для образования аэрозолей используются также реакции горения и некоторые другие реакции.
§ 8. МАСКИРУЮЩИЕ ДЫМЫ
Дымовые завесы для маскировки широко применялись уже во время империалистической войны 1914—1918 гг. и, несомненно, будут иметь значение в будущем. Маскирующими дымами прикрывают действия войск, тыловые объекты (особенно небольшие), например заводы, аэродромы, электростанции и т. п. Дымовая завеса часто позволяет застигнуть противника врасплох. Дымы уменьшают действенность огня противника, лишая последнего возможности наблюдения.
Для получения дымового облака используются различные дымообразователи. Индивидуальные дымообразователи можно разделить на три группы.
К первой группе относятся вещества, дающие дымовое облако при горении. Из них практически важен фосфор. При горении на воздухе он или его сернистые соединения образуют окислы фосфора, которые конденсируются, соединяются с влагой и образуют белое облако.
Во вторую группу входят ангидриды, которые на воздухе реагируют с водой, образуя облако. Некоторые ил них (неорганические ангидриды) при этом гидратируются, образуя кислоты, например, серный ангидрид SO3. Другие (хлорангидриды) гидролизуются водой, например, треххлористый фосфор РСI3, пятихлористый фосфор РСI5, хлорсульфоновая кислота SO2(OH)CI и др.
К третьей группе относятся возгоняющиеся вещества, выдерживающие высокую температуру без разложения, — хлористый аммоний NH4CI и некоторые тяжелые углеводороды (парафины).
Кроме индивидуальных дымообразователей для маскирующих дымов применяют специальные составы. Дымообразование при их горении происходит либо в результате возгонки дымообразующего вещества, находящегося в соприкосновении с термической смесью, либо в результате химической реакции между компонентами состава, дающей пары хлорида металла, которые конденсируются в воздухе.
Примером состава первого типа служит смесь Ершова (в проц.):
Хлората калия ....…………………..…………………………......... 20
Угля ........ ………………………..………………………... ........... 10
Нафталина. ..………………………….……………………............ 20
Хлористого аммония ………………………………………............. 50
В этом составе хлорат калия служит окислителем, уголь — горючим, а хлористый аммоний — дымообразующим веществом; нафталин частично участвует в реакции горения, как горючее, а частично возгоняется, образуя дым. Смесь Ершова обладает хорошей стойкостью.
Существует много составов, действующих аналогично смеси Ершова, например, быстрогорящая смесь Горбова (в проц.):
Хлората калия …………………..…………………................ 67
Угля ........…………………………………………………............ 7
Нафталина ......……………………………………………......... 3
Хлористого аммония ………………………………….......... 23
Примером состава, дающего при горении облако хлорида металла, служит смесь Бергера (в проц.):
Четыреххлористого углерода …………………………………........ 50
Цинковой пыли ...………………………………………………….......... 25
Окиси цинка ......………………………………………………….......... 20
Кизельгура ..........……………………………………………………...... 5
При горении смеси четыреххлористый углерод реагирует с цинковой пылью
CCl4 + 2 Zn 2 ZnCl2 + C.
При этом образуются пары хлористого цинка, которые конденсируются в воздухе, давая облако белого дыма; выделяющийся углерод окрашивает это облако в серый цвет. Окись цинка и кизельгур вводятся в смесь для фиксации жидкого четыреххлористого углерода. Они служат как разрыхлители, удерживающие на себе жидкость, и способствуют сохранению порошкообразной консистенции состава.
Составы маскирующих дымов применяются в специальных дымовых шашках.
§ 9. СИГНАЛЬНЫЕ ДЫМОВЫЕ СОСТАВЫ
Для сигнализации днем применяются окрашенные дымы —красные, желтые, черные, зеленые и синие.
Цветное дымовое облако можно получить дисперсионным (распыление взрывом) или конденсационным способами. По последнему способу цветной дым получается двумя путями: а) образованием цветного дыма путем химической реакции, в результате которой получаются окрашенные продукты; б) возгонкой органических красителей.
Д и с п е р с и о н н ы й с п о с о б п о л у ч е н и я ц в е т н ы х д ы м о в. Измельченное окрашенное вещество измельчается и рассеивается действием газов, образующихся при взрыве взрывчатого вещества. Однако частицы получаются обычно настолько крупные, что облако дыма имеет малую устойчивость. Большей частью для распыления применяются неорганические краски, из которых лучшие результаты дают ультрамарин (синяя краска), киноварь (красная краска), оурик, сажа, мелкий древесный уголь.
К о н д е н с а ц и о н н ы й с п о с о б п о л у ч е н и я ц в е т н ы х д ы м о в. В результате химических реакций можно получить окрашенные дымы. При реакции между газообразными продуктами (хлором, йодистым водородом и аммиаком) получается хорошее облако дыма, окрашенное выделяющимся иодом. Реакция протекает следующим путем:
2 HI + СI2 + 2 NH3 2 NH4CI + I2.
Получение дыма таким способом, однако, практически неудобно ввиду трудности хранения и транспортирования баллонов с газообразными компонентами. Кроме того, облако, выделяющееся при горении такого состава, наблюдателю, находящемуся на земле,
кажется белым, а наблюдателю, смотрящему с самолета, —пурпурным.
Желтый дым можно получить в результате реакции образования сернистого мышьяка. Для этого употребляется следующий состав (в проц.):
Серы ..........………………………….………….......... 28,6
Трехокиси мышьяка …………….…………........... 31,0
Азотнокислого калия .……………..………….......... 33,8
Стеклянного порошка. ...……….………………..... 6,6
Черный дым получается при горении такого состава (в проц.):
Гексахлорэтана ...………………….……………......... 60,5
Магния (в порошке) . ………….……………........... 18,6
Нафталина. ..........……………….………………….... 20,9
Этот состав мало чувствителен к механическим воздействиям и дает густой черный дым. Недостатками его является быстрое улетучивание нафталина при горении и низкая температура плавления смеси нафталина и гексахлорэтана. Чтобы устранить эти недостатки, нафталин заменяют антраценом, который замедляет горение. Основная реакция горения этой смеси происходит между магнием и гек-сахлорэтаном с образованием углерода и хлористого магния. Антрацен частично сгорает, а частично служит дымообразователем.
Некоторые органические красители при возгонке до 350—500° дают окрашенные пары, не разлагаясь при этом или разлагаясь в незначительной степени. Такие красители можно использовать в качестве дымообразователей для получения цветных дымов. Требуемая для возгонки красителя температура создается быстрым сгоранием термической смеси из окислителя и горючего, которая смешивается с красителем.
В результате опытных работ найдена некоторая зависимость между химическим строением красителей и их способностью возгоняться без разложения. Не возгоняются красители, имеющие следующие химические группы в своей молекуле :сульфогруппу SO3H; бензидиновую группу Н5С6—С6Н5; группу —О—Na, присоединенную к бензольному ядру.
Наибольшей стойкостью при высокой температуре обладают. красители с простым строением, с небольшим числом атомов в молекуле .
Непригодны красители, дающие облако переходного цвета, плохо различимого на расстоянии- Ограниченное количество пригодных красителей очень затрудняет разработку рецептов дымовых составов.
Иногда применяют разные окрашенные промежуточные продукты, дающие характерного цвета облако.
Проверить, пригоден ли краситель для дымообразования, можно простым способом. Небольшое количество (2—3 г) красителя помещают в стеклянную пробирку и медленно нагревают. Если краситель возгоняется быстро, его можно испытывать в дымовых составах. Если же краситель расплавляется или разлагается и пенится, он явно не пригоден для дымообразования.
При нагревании выше температуры возгонки красители большей частью разлагаются. Поэтому, желая получить дымовое облако, нужно создавать такие условия, чтобы температура была достаточной для возгонки красителя, но недостаточной для его разложения. Конечно, такие условия будут различными в зависимости от свойств красителей.
Практически удобно смешивать краситель со специальной горючей смесью, которая при сгорании выделяет требуемое для возгонки тепло.
Термическая смесь должна обладать определенной скоростью горения, развивать температуру, соответствующую температуре возгонки красителя, и давать сравнительно мало нагретые продукты горения. Наиболее подходящей является смесь хлората калия (окислитель) и молочного сахара (горючее), рассчитанная на сгорание углерода горючего только до окиси углерода. Такая термическая смесь развивает не слишком высокую температуру.
Таким образом в дымовой состав входят измельченные и тщательно перемешанные окислитель, горючее и краситель в следующих: соотношениях (в проц.):
Хлората калия ........……………………………...... 30 ± 10
Молочного сахара. ...…………………………........ 20 ± 5
Красителя .........…………………………………...... 50 ± 10
В зависимости от свойств красителя и нужной скорости его возгонки устанавливается точный рецепт состава. В некоторых случаях в составы вводятся цементаторы или другие добавки. Иногда вместо одного красителя употребляют смесь двух или более красителей. Смешиваемые красители должны обладать наиболее близкими температурами возгонки для равномерной окраски облака.
Выгодно, чтобы скорость реакции была максимальной, а температура реакции — близкой к температуре возгонки красителя. При этих условиях краситель не успевает разлагаться. Однако температура реакции горения дымовых составов лежит в пределах 800—1200°. При такой температуре значительная часть красителя разлагается, но снижать температуру реакции невыгодно, так как сильно уменьшится скорость реакции и увеличится продолжительность воздействия высокой температуры на краситель. Это также усиливает его разложение.
Для правильного дымообразования необходимо регулировать доступ воздуха к составу во время горения термической смеси. При свободном доступе воздуха горючее, рассчитанное на неполное сгорание (до СО), будет сгорать до СO2, почему сильно повысятся тепловой эффект и температура реакции и произойдет разложение красителя. Поэтому дымовые составы сжигаются в оболочке, затрудняющей доступ воздуха. Для выхода паров красителя в оболочке делаются отверстия.
Установлено, что слой массы, через которую проходит краситель, не должен быть толще 3,75 см. Иначе краситель успевает разложиться от длительного соприкосновения с горячим шлаком. Следовательно, количество и величина отверстий в оболочке должны
быть рассчитаны так, чтобы каждый участок дымового состава находился не далее 3,75 мм от отверстия. Следовательно, цилиндрическая оболочка должна иметь или диаметр не более 7,5 см при любой длине, или наоборот, длину не более 7,5 см при любом диаметре.
Однако при слишком малой площади отверстий дымообразование будет очень медленным, или газы, не находя выхода, могут разорвать оболочку. При слишком большой площади отверстий горение будет слишком бурным, с выделением пламени.
С о с т а в ы к р а с н о г о д ы м а. К красителям, дающим красный дым, относятся: родамин В, который дает дым лилового оттенка, жирооранж, который дает дым оранжевого оттенка, и паранитранилиновый красный, дающий ярко-красный дым.
Приводим примерные составы красного дыма (в проц.):
1. Хлората калия. ……………………….………………........... 20
Молочного сахара ....…………………….…….……………...... 20
Паранитранилинового красного …….…….……………….... 60
2. Хлората калия ……………………….……………............. 29
Молочного сахара . …………………..……………. .... .... 32
Родамина .....……………………………………………….......... 39
С о с т а в ы ж е л т о г о д ы м а. Наилучшим красителем для желтого дыма признан аурамин. Его недостатком является лишь то, что он дает зеленоватый оттенок дыма; однако его можно .устранить прибавлением небольшого количества хризоидина.
Приводим примерный состав желтого дыма (в проц.):
1. Хривоидина ...…………………………………………......... 9
Аурамина. .......……………………………………………....... 34
Хлората калия .....…………………………………………...... 33
Молочного сахара …………………………………….......... 24
2. Хривоидина .………………………………………............ 10
Аурамина ...........……………………………………………..... 40
Хлората калия …………………………………………............ 30
Молочного сахара ..………………………………………....... 20
С о с т а в ы с и н е г о д ы м а. Красителями синего дыма могут служить индиго, метиленовый синий и их смесь. Приводим примерный рецепт состава синего дыма (в проц.):
1. Индиго ....... ……………………………….…. ......... 40
Хлората калия .....……………………………….……....... 35
Молочного сахара ...…………………………….…........ 25
2. Индиго ............………………………………….……..... 40
Метиленового синего ...……………………….……...... 20
Хлората калия. ………………………………….............. 25
Молочного сахара ………………………………........... 15
С о с т а в ы з е л е н о г о д ы м а. Изучение зеленых красителей показало непригодность имеющихся образцов для сигнального дымообразования. Зеленое дымовое облако наиболее удачно получается из смеси синего и желтого красителей. Следует выбирать эти красители с близкими температурами возгонки. Зеленый дым можно получить из смеси индиго и аурамина. Приводим примерный состав зеленого дыма (в проц.):
Индиго ………………………....…………………………..26
Аурамина ..………………………………………..……..15
Хлората калия ……………………………………..…….33
Молочного сахара………………………………………..26
§ 10. ФЕЙЕРВЕРОЧНЫЕ СОСТАВЫ
Для изготовления фейерверочных фигур употребляются специальные составы. По характеру действия эти составы можно разделить на сильные (или динамические) и на слабые (или чисто пламенные) составы.
Сильные составы
Сильными, пли динамическими, составами называют пиротехнические смеси, которые при горении выделяют так много газов, что давление их способно производить работу. Они употребляются в качестве движущих составов для фейерверочных фигур. Сильные составы могут быть искристыми (давать при горении много искр) или пламенными (давать белое или окрашенное пламя).
Такие составы применяются в пиротехнике для получения движущихся объектов: ракет, «жаворонков», фонтанов и других фигур.
Динамические составы должны обладать следующими свойствами :
1) сравнительно большой скоростью горения;
2) выделять много газообразных продуктов сгорания для получения давления в место горения и производства работы;
3) образовывать минимальное количество шлака (твердых остатков), причем только рыхлого и поддающегося разбрасыванию газами, чтобы он не задерживал выхода газов из пространства горения. Это требование особенно важно, если состав помещается в гильзах (чрезмерное скопление газов в гильзе вызывает ее разрыв).
Практически лучшей считается для динамического состава тройная пороховая смесь: сера, селитра и уголь. Но эта смесь настолько активна, что обычно разрывает оболочки и не может быть использована в пиротехнике. Уменьшение активности пороховой смеси замедляет процесс ее горения и газообразования и позволяет применять составы из этой смеси, в частности для фейерверков. Активность пороховой смеси можно уменьшить прибавлением различных веществ или увеличением ее плотности. Иногда оба эти способа комбинируются.
Различные добавки к смеси придают составам разную силу и разный эффект.
Добавки в пороховую смесь употребляют горючие и негорючие. Горючие добавки сгорают за счет кислорода в пороховой смеси и дают продукты горения с меньшим выделением тепла при реакции. Чаще всего в виде такой добавки берут уголь.
Негорючие вещества, прибавляемые к основной тройной смеси, понижают температуру выделяющихся газов и уменьшают их давление; они отнимают часть теплоты реакции горения состава на нагревание этих веществ. Негорючие вещества уменьшают скорость горения основной смеси.
Увеличение плотности сильных составов так же, как и пламенных составов, понижает скорость горения их. Это объясняется тем, что рыхлый состав имеет большую поверхность, по которой огонь распространяется мгновенно, охватывая все частицы состава.
Чем плотнее спрессован состав, тем меньше остается свободного пространства между частицами и тем труднее огню охватить весь состав. Состав должен будет гореть постепенно, слоями и значительно медленнее.
Сильные (динамические) составы получаются смешением пороховой мякоти с измельченным древесным углем. Таким образом получают основной сильный состав.
Для большей эффектности горения такого состава, например, искристости, к составу прибавляют крупный уголь или металлические опилки.
В процессе горения нормальной пороховой смеси, как было указано, уголь переходит в двуокись углерода СO2 по уравнению:
2 KNO3 + З С + S K2S + 3CO2 + N2.
Основные сильные составы рассчитываются на сгорание угля в окись углерода СО по уравнению:
2 KNO3 + 6 С + S K2S + 6 CO + N2.
Из приведенных реакций видно, что во втором случае расход угля вдвое больше, чем в первом. В нормальной теоретически подсчитанной пороховой смеси уголь составляет 13%, следовательно, для сильного состава требуется давать еще 13 весовых частей измельченного угля на 100 весовых частей пороховой смеси.
Полученная смесь служит основой для очень сильных составов, применяемых большей частью для изделий, производящих механическую работу и дающих движущиеся фигуры.
Горение сильного состава может сопровождаться образованием пламени разных цветов или красивых искр. Искристые составы можно получить, прибавив к сильному составу крупные (1,5—5 мм) частицы угля, полученного из твердых пород деревьев. Такие составы дают длинную огненную ленту с розоватыми искрами.
Если необходимы составы с небольшим динамическим действием, то количество угля увеличивают.
Более яркие искры получаются, если вместо крупного угля добавлять в состав металлические опилки. Железные опилки (зерна 1—2 мм) дают белые искры, но недостаточно яркие; стальные и чугунные опилки дают более яркие белые искры, а дробленый сплав из 2 частей меди и 1 части цинка дает зеленоватые искры.
Приводим примерный сильный (искристый) состав с крупным углем (в весовых частях):
Пороховой мякоти……………….………………………….100
Угля мелкого ………………………………..…….………………13
Угля крупного . ………………………………….…..……………5
Пороховой мякоти……………………………….………….100
Угля мелкого ………………………………………….…………..13
Угля крупного . ………………..……….……………..……………5
Иногда применяют составы без серы, например (в проц.):
Азотнокислого калия ………………………………………......... 81
Угля ................. . . ……………………………………………… 19
Составы с металлическими опилками следует подбирать такие, чтобы температура горения их была ниже температуры плавления металла опилок. Опилки должны не плавиться, а накаливаться.
Приводим примерный сильный искристый состав с железными опилками (в весовых частях):
1. Пороховой мякоти....……………………………………...... 100
Угля мелкого ........………………………………………….... 13
Опилок железных ......……………………………………….... 10
2. Пороховой мякоти ....………………………………………..... 100
Угля мелкого ………....……………...…………………………….13
Опилок железных …………………………………………….......... 4
Рецепты составляются в зависимости от величины изделий, для которых предназначаются составы.
Комбинируя количество крупного угля и железных опилок, можно получить двойную ленту; при этом получается розоватая огненная полоса, выбрасывающая сноп ярких искр. Примерный состав с двойной лентой (в весовых частях):
Пороховой мякоти .………………….……………………………100
Угля мелкого .......... ………………….………………………… .... 13
Угля крупного ........……………………………………………..... 2,5
Опилок железных.......……………………………………………...... 5
Составы, дающие двойную ленту, иначе называют б р и л л и а н т о в ы м и.
Слабые составы
Слабыми называются пламенные составы, горящие сравнительно медленно и не производящие при атом работы. Они употребляются для звездок, свечей и других неподвижных фейерверочных фигур. Обычно используются составы, основанные на двойной смеси хлората калия с горючим, аналогичные сигнальным пламенным составам. Приводим примерный слабый, или чистоплеменный, состав (в проц.):
1. К р а с н ы й о г о н ь
Хлората калия …………………………………………………………60
Углекислого стронция …………………………………………….….25
Идитола ………………………………………………………………..15
2. Ж е л т ы й о г о н ь
Хлората калия …………………………………………….…………..60
Криолита ……………………………………………………………….25
Идитола ……………………………………………………………..…15
В литературе описано очень много рецептов для изготовления фейерверочных фигур (см. список литературы).
§11. ВСПОМОГАТЕЛЬНЫЕ ВОСПЛАМЕНИТЕЛЬНЫЕ СОСТАВЫ
Если для воспламенения основного пиротехнического состава нити стопина и другие подобные средства являются недостаточным импульсом, то применяют воспламенительные составы. Они должны легко воспламеняться сами и при горении развивать высокую температуру, достаточную для воспламенения основного состава.
Применение того или другого воспламенительного состава обусловливается свойствами, главным образом температурой воспламенения, основного состава.
Большей частью воспламенительным составом служит смесь окислителя и горючего, рассчитанная по реакции горения.
Некоторые пиротехнические составы, особенно запрессованные под большим давлением, не воспламеняются даже при соприкосновении с горящими воспламенительными составами. Тогда вводят переходные составы. Они представляют собой смесь основного и воспламенительного составов большей частью в равных количествах. Температура горения переходного состава выше, чем воспламенительного, и основной состав воспламеняется при соприкосновении с горящим переходным.
Контрольные вопросы к главе IV
1. Какие требования предъявляются к пиротехническим составам?
2. Какие составы называются пламенными?
3. Каковы основные свойства пламенных составов?
4. Как влияет увеличение газовой фазы в продуктах реакции на силу света горения пиротехнического состава?
5. Какие приборы служат для определения силы света?
6. Что такое фотоэлемент и на каком принципе основано его устройство?'
7. Как уменьшить искрение при горении осветительных составов?
8. Какие составы служат для освещения при фотографировании?
9. Чем отличается цветочувствительность фотоматериалов от цветочувствительности глаза?
10. Какие сигнальные составы применяются в пиротехнике?
11. Почему в составы с солями натрия можно вводить металлы для увеличения силы света?
12. Какие вещества окрашивают пламя в зеленый цвет?
13. Что такое термитная реакция?
14. Почему применяется алюминий в качестве горючего в термите?
15. Какое значение имеют шлаки в термитных зажигательных составах?
16. Какими свойствами обладает фосфор?
17. Что такое пирофорные металлы?
18. Какое значение в военной технике имеет электрон?
19. Какие размеры имеют частицы дыма?
20. Что означает явление флокуляции и чем оно объясняется?
21. Почему дымовое облако затрудняет видимость?
22. Что значит кроющая способность дыма?
23. Как получаются маскирующие дымы?
24. Какие способы существуют для получения цветных дымов?
25. Какой способ получения дымов наиболее удобен и почему?
26. Как получить черный дым?
27. Что такое возгонка?
28. Какие органические красители образуют цветные дымы?
29. Как определить пригодность красителя для дымообразования?
30. Какое действие оказывает на краситель повышение температуры сверх температуры его возгонки?
31. Какие красители употребляются для получения красного дыма?
32. Что служит окислителем в дымовом составе?
33. Какими свойствами должны обладать красители, чтобы можно было образовать цветной дым из их смеси?
34. Какие составы называются сильными?
35. Как получить сильный искристый состав?
ГЛАВА V
УСТРОЙСТВО И ДЕЙСТВИЕ ПИРОТЕХНИЧЕСКИХ СРЕДСТВ ДЛЯ ВОЕННЫХ ЦЕЛЕЙ
В военной технике применяются осветительные, зажигательные, трассирующие и сигнальные средства. Последние разделяются на средства ночного и дневного действия.
§ 1. ОСВЕТИТЕЛЬНЫЕ СРЕДСТВА
Осветительные пиротехнические средства служат для освещения местности в условиях ночного боя, при фотосъемках, при посадке самолетов на неосвещенные места, при разведке и т. п. Современная военная техника располагает и другими средствами освещения, например, прожекторами, но во многих случаях пиротехнические осветительные средства значительно удобнее.
Главные преимущества пиротехнических осветительных средств заключаются в следующем: они имеют большой запас световой энергии в малом объеме; отличаются простотой применения и не требуют дорогих и громоздких установок; способны внезапно действовать; маскируют место выпуска; неуязвимы для противника; освещают сравнительно большой радиус.
К пиротехническим осветительным средствам предъявляются следующие основные требования: 1)определенная сила света, достаточная для освещения местности или других целей; 2) определенная продолжительность действия; 3) безопасность в обращении; 4) герметичность оболочки, обеспечивающая стойкость состава; 5) доступность и сравнительная дешевизна материалов, требующихся для изготовления.
Осветительные средства, применяемые в настоящее время в разных армиях, можно подразделить по назначению на следующие группы:
С р е д с т в а б л и ж н е г о д е й с т в и я, т. е. пиротехнические осветительные изделия, имеющие небольшой радиус действия (около 200 м).
С р е д с т в а д а л ь н е г о д е й с т в и я, т. е. артиллерийские снаряды, дающие радиус освещения около 500 м.
О с в е т и т е л ь н ы е с р е д с т в а, применяемые авиацией для освещения места посадки, для фотосъемки и т. п.
Осветительные средства ближнего действия
К осветительным средствам ближнего действия относятся изделия, дающие радиус освещения 100—200 м, дальность полета 120—200 м и имеющие время горения около 7 сек. К таким изделиям относятся 2Q-MM патроны, винтовочные гранаты под мортирку Дьяконова и др.
Наиболее употребительны 26-мм патроны.
 26-мм о с в е т и т е л ь н ы е п а т р о н ы. Эти патроны называются также патронами 4-го калибра. Они выстреливаются из специального пистолета того же калибра. Патрон 4-го калибра изображен на рис. 12. Он состоит из бумажной гильзы 3, которая является оболочкой патрона. Снаружи готовый патрон покрывается слоем парафина, который предохраняет внутреннее снаряжение от влияния влаги.
26-мм о с в е т и т е л ь н ы е п а т р о н ы. Эти патроны называются также патронами 4-го калибра. Они выстреливаются из специального пистолета того же калибра. Патрон 4-го калибра изображен на рис. 12. Он состоит из бумажной гильзы 3, которая является оболочкой патрона. Снаружи готовый патрон покрывается слоем парафина, который предохраняет внутреннее снаряжение от влияния влаги.
Гильза имеет латунную шляпку 11, которая служит дном гильзы. В шляпке имеется гнездо для наковаленки 9 и капсюля-воспламенителя 10. Внутри гильзы помещен вышибной заряд из 3 г дымного пороха 8. Заряд плотно закрыт картонным пыжом 6, имеющим центральное отверстие, заклеенное марлей 7. Этот пыж создает сопротивление пороховым газам, образующимся от сгорания вышибного заряда, чтобы улучшить их работу — выбрасывание осветительной звездки 4 из гильзы. Марля защищает порох от высыпания. Поверх картонного пыжа 6 помещен войлочный пыж с центральным отверстием 5, который защищает звездку от повреждений в результате удара пороховых газов при выстреле. Отверстия в обоих пыжах обеспечивают передачу пламени звездке. Звездка 4 состоит из осветительного состава; для воспламенения его звездка имеет слой воспламенительного состава 12, в который впрессована нить стопина 13, выступающая из звездки. Поверх звездки помещена плотная войлочная набивка 2, которая защищает все элементы снаряжения от перемещений. Верхний край гильзы закрыт картонным пыжом 1; он закрепляется путем закатки края гильзы и предохраняет все снаряжение от выпадения.
Звездка (рис. 13) представляет собой цилиндр, спрессованный из осветительного состава 3 с небольшим слоем воспламенительного состава 2 и нитью стопина 1. Диаметр осветительной звездки около 24 мм, высота до 40 мм.
При выстреле боек пистолета ударяет по капсюлю, оболочка которого вдавливается внутрь. При этом капсюль накалывается острыми краями наковаленки, и капсюльный со став воспламеняется, воспламеняя вышибной заряд. Образовавшиеся газы выбрасывают загорающуюся при этом осветительную звездку. Горение звездки
в начальный период ее полета мало заметно, так как вначале сгорает воспламенительный состав, не дающий яркого пламени. Горение

 основного осветительного состава продолжается около 7 сек. При стрельбе из пистолета под углом в 65° зьездка поднимается на высоту до 120 м. давая радиус освещения 100 м. Сила света звездки достигает 30 000 свечей.
основного осветительного состава продолжается около 7 сек. При стрельбе из пистолета под углом в 65° зьездка поднимается на высоту до 120 м. давая радиус освещения 100 м. Сила света звездки достигает 30 000 свечей.
Осветительные 26-мм патроны обладают многими достоинствами: не требуют предварительной подготовки для приведения в действие, просты в обращении, обладают достаточной продолжительностью действия.
К недостаткам патронов следует отнести огнеопасность их, что затрудняет хранение и транспортировку.
Пистолет 4-го калибра для стрельбы осветительными патронами изображен на рис. 14.
О с в е т и т е л ь н ы е в и н т о в о ч н ы е г р а н а т ы. Винтовочная граната (рис. 15) — более мощное осветительное средство ближнего действия, чем 26-лш патрон. Гранаты выстреливаются холостыми патронами из винтовочной мортирки Дьяконова (мортирка Д), надеваемой на винтовку.
Оболочкой служит корпус гранаты 1 — картонный цилиндр; длина его 86 мм, наружный диаметр 40.5 мм, толщина стенок 3,5 мм. В верхней части корпуса находится выточка для надевания овальной головки 2, спрессованной из картона; высота ее около 45 мл. В нижней части цилиндра находится донная пробка 3 (рис. 16)
. В донной пробке (рис. 15) прочно закреплены два отрезка бикфордова шнура 10 длиной около 2 см каждый, которые служат замедлителями. Два замедлителя обеспечивают надежность безотказного действия гранаты. На оба конца замедлителей нанесена поро-
ховая подмазка, облегчающая воспламенение бикфордова Дно закрыто кружком картона 11, герметизирующим внутренние части от влияния влаги. Замедлители верхними концами соприкасаются с вышибньм зарядом 4, (0,7 г дымного i в пороха). Для смягчения удара пороховых газов о звездку 6 служит войлочный пыж 5 с отверстием, выше которого расположена осветительная звездка 6. Слой воспламенптельного состава и стопин звездки обращены к вышибному заряду. Осветительная звездка аналогична звездке в 26-мм патроне, но больше размером: диаметр ее около 32 мм, высота около 50 мм. Свободное пространство внутри гранаты над звездкой заполняется войлочными обрезками 7; они удерживают части гранаты от смещения. На герметизирующий кружок 11 наклеены три малых картонных кружка 8, которые служат отличительными знаками осветительных гранат — для опознавания их ночью на ощупь (в отличие от сигнальных).
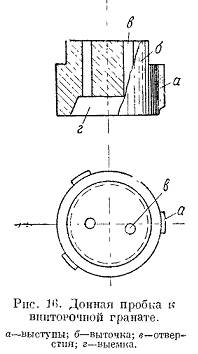 На рис. 17 показаны эти отличительные знаки.
На рис. 17 показаны эти отличительные знаки.
Осветительными гранатами стреляют из мортирки Дьяконова (рис. 18), которую надевают на ствол винтовки.


На внутренней поверхности передней части стальной мортирки (называемой телом 1 мортирки) имеются три нареза, почему граната в полете получает вращение. Тело мортирки неподвижно скреплено с чашкой 2, в которую ввинчивается шейка 3 с коленчатой прорезью. Мушка винтовки входит в продольный канал этой прорези, а с поворотом мортирки мушка входит в боковую прорезь шейки, и мортирка закрепляется на стволе винтовки. Длина мортирки Д 335 мм.
Граната вкладывается в мортирку так. чтобы выступы на донной пробке гранаты (рис. 16) вошли в нарезы. Выстрел производится
холостым патроном; винтовку держат упором в землю под углом 45—55°.
Удар пороховых газов холостого патрона прорывает герметизирующий кружок донной пробки, воспламеняя замедлители и выбрасывая гранату из мортирки. Огонь от замедлителей передается вышибному заряду через 2,5—3 сек. после их воспламенения. Давлением пороховых газов вышибного заряда отрывается головка гранаты и выбрасывается загоревшаяся при этом звездка. Звездка загорается со стороны стопина и воспламенительного состава, затем загорается основной осветительный состав. При выстреле под углом 45—55° дальность полета осветительной гранаты около 230 м; граната разрывается на высоте около 150 м; время, в течение которого производится освещение, — около 7 сек. Сила света гранаты около 50 000 свечей.
Осветительные средства дальнего действия
В армиях разных стран имеется большое количество разнообразных конструкций осветительных снарядов. В основном их можно подразделить на беспарашютные и парашютные.
Осветительные снаряды по способу выбрасывания внутреннего снаряжения во время действия бывают: а) с выбрасыванием снаряжения через головную часть и б) с выбрасыванием снаряжения через донную часть.
По количеству осветительных элементов (звездок) снаряды подразделяются на о дно звездчатые и многозвездчатые.
Б е с п а р а ш ю т н ы е о с в е т и т е л ь н ы е с н а р я д ы могут иметь до 24 звездок. Беспарашютный снаряд из-за простоты конструкции мог бы представлять значительный интерес. Кроме того, в нем сравнительно хорошо используется объем: снаряд вмещает относительно большое количество осветительного состава. Однако беспарашютные снаряды имеют крупные недостатки. Осветительные звездки горят не больше 30 сек., что совершенно недостаточно для наблюдения за местностью, наблюдение затрудняется также быстротой движения осветительных звездок по направлению к земле, к тому же во время полета звездки освещение местности меняется.
Парашютные осветительные снаряды большей частью имеют одну или две звездки сравнительно больших размеров. Каждая звездка снабжается парашютом. Время горения звездки до 60 сек. Парашюты значительно уменьшают скорость падения звездок и поддерживают их в воздухе, позволяя получить их горение на высоте, требуемой для освещения местности.
Необходимость в безотказном действии парашютов заставляет делать к ним специальные приспособления. В момент разрыва снаряда в воздухе смятый парашют может не развернуться, могут загореться тросы и ткань. Поэтому снаряды снабжают специальными устройствами, предохраняющими парашют от смятия и загорания.
Но парашюты и предохранительные приспособления занимают много места внутри корпуса снаряда, а вес осветительного состава поэтому проходится уменьшать. Это один из недостатков парашютных снарядов.
 Беспарашютные и парашютные снаряды имеют различные конструкции, в зависимости от способа выбрасывания внутреннего снаряжения. Для производства снарядов, в которых снаряжение выбрасывается через головную часть, можно использовать обычные шрапнельные корпуса. Однако это невыгодно. Внутреннее снаряжение, выбрасываемое по направлению движения снаряда в воздухе, получает настолько большую скорость, что могут разорваться и перепутаться тросы парашюта, может порваться парашют и пр. Увеличение скорости полета получается вследствие того, что на элементы внутреннего снаряжения в момент выбрасывания их из корпуса действует дополнительная сила давления газов вышибного заряда, увеличивающая их скорость.
Беспарашютные и парашютные снаряды имеют различные конструкции, в зависимости от способа выбрасывания внутреннего снаряжения. Для производства снарядов, в которых снаряжение выбрасывается через головную часть, можно использовать обычные шрапнельные корпуса. Однако это невыгодно. Внутреннее снаряжение, выбрасываемое по направлению движения снаряда в воздухе, получает настолько большую скорость, что могут разорваться и перепутаться тросы парашюта, может порваться парашют и пр. Увеличение скорости полета получается вследствие того, что на элементы внутреннего снаряжения в момент выбрасывания их из корпуса действует дополнительная сила давления газов вышибного заряда, увеличивающая их скорость.
Снаряды, которые выбрасывают снаряжение через донную часть, значительно надежнее.
Рассмотрим устройство и действие некоторых осветительных снарядов.
Примерная схема беспарашютного снаряда показана на рис. 19.
Корпус снаряда снабжен прочной донной частью, в которую ввинчена центральная трубка 2. Она сообщается с дистанционной трубкой. На центральную трубку надета шашка из осветительного состава 3. На шашке имеются каналы от центральной трубки к периферии шашки и столбик из воспламенительного состава 4.
Дистанционная трубка приводит снаряд в действие в требуемый момент.
 Б е с п а р а ш ю т н ы й с н а р я д с ш е с т н а д ц а т ь ю о с в е т и -т е л ь н ы м и э л е м е н т а м и, с в ы б р а с ы в а н и е м с н а р я ж е н и я ч е р е з г о л о в н у ю ч а с т ь, показан на рис. 20. В камере донной части корпуса снаряда помещен вышибной заряд 9 из дымного пороха. Осветительные элементы, или так называемые сегменты 7, расположены по четыре в четыре ряда. Каждый сегмент имеет слой воспламенптельного состава 3. Между сегментами — центральный вертикальный канал, по которому проходит огнепровод — нить стопина 4. Он передает огонь от дистанционной трубки 1 к вышибному заряду и воспламеняет сегменты.
Б е с п а р а ш ю т н ы й с н а р я д с ш е с т н а д ц а т ь ю о с в е т и -т е л ь н ы м и э л е м е н т а м и, с в ы б р а с ы в а н и е м с н а р я ж е н и я ч е р е з г о л о в н у ю ч а с т ь, показан на рис. 20. В камере донной части корпуса снаряда помещен вышибной заряд 9 из дымного пороха. Осветительные элементы, или так называемые сегменты 7, расположены по четыре в четыре ряда. Каждый сегмент имеет слой воспламенптельного состава 3. Между сегментами — центральный вертикальный канал, по которому проходит огнепровод — нить стопина 4. Он передает огонь от дистанционной трубки 1 к вышибному заряду и воспламеняет сегменты.
Вышибной заряд отделен от осветительных сегментов диафрагмой 8 с центральным отверстием, через которое огнепровод соприкасается с вышибным зарядом. Сегменты отделены друг от друга картонными прокладками 6', которые смягчают силу удара пороховых газов о сегменты (аналогичная схема снаряжения применяется, как увидим ниже, и в снарядах зажигательного действия).
Действие снаряда происходит следующим образом. В требуемой точке траектории полета снаряда огонь от дистанционной трубки по огнепроводящему стопину передается осветительным сегментам и вышибному заряду. При сгорании порохового вышибного заряда образуется много газов, горением которых горящие сегменты выбрасываются из снаряда, срывая его головку.
П а р а ш ю т н ы й о д н о з в е з д ч а т ы и с н а р я д с в ы б- р а с ы в а н и е м с н а р я ж е н и я ч е р е з г о л о в н у ю ч а с т ь показан на рис. 21 (снаряд фирмы Крупна в Германии). На дне корпуса 1 снаряда находится диафрагма 2, имеющая в сечении форму буквы Т. Между дном корпуса и диафрагмой расположен вышибной заряд 3. Оболочка звездки 4 заполнена осветительным составом 5. К звездке присоединен парашют 6 (рис. 22).
Парашют (рис. 21) защищен полуцилиндрами 7 от повреждений при действии снаряда; полуцилиндры опираются на диафрагму 2.
Сверху парашют закрыт второй диафрагмой 8. В головной части снаряда помещен отрывной пороховой заряд 9, который „отрывает головную часть при действии снаряда. В оболочке 4 звездки и в одном из полуцилиндров сделана выемка для огнепроводной трубки 10. По этой трубке передается огонь от дистанционной трубки к вышиб-
ному заряду 3. Выемка показана на поперечном разрезе снаряда (рис. 23).
Огнепроводная трубка (рис. 21) помещается над отверстиями 12 и 11 в диафрагмах 8 и 2. В диафрагме 2 имеются каналы 13, над которыми расположены воспламенители 14 осветительной звездки.
 Рассмотрим действие описанного снаряда. В момент, установленный на дистанционной трубке, от нее передается огонь заряду 9. Давлением газов, образующихся при взрыве заряда, отрывается головная часть снаряда, одновременно огонь передается огнепроводу 10. После выгорания огнепровода воспламеняется вышибной заряд 3. Газы, образующиеся при взрыве заряда, давят на диафрагму 2, которая выталкивает полуцилиндры 7; вместе с ними из стакана снаряда выталкивается звездка 4—5 с привязанным к ней парашютом 6. Вместе с этим пороховые газы проникают через каналы 13 в диафрагме 2 и поджигают воспламенители звездки 14, чем достигается загорание звездки к моменту вылета ее из стакана.
Рассмотрим действие описанного снаряда. В момент, установленный на дистанционной трубке, от нее передается огонь заряду 9. Давлением газов, образующихся при взрыве заряда, отрывается головная часть снаряда, одновременно огонь передается огнепроводу 10. После выгорания огнепровода воспламеняется вышибной заряд 3. Газы, образующиеся при взрыве заряда, давят на диафрагму 2, которая выталкивает полуцилиндры 7; вместе с ними из стакана снаряда выталкивается звездка 4—5 с привязанным к ней парашютом 6. Вместе с этим пороховые газы проникают через каналы 13 в диафрагме 2 и поджигают воспламенители звездки 14, чем достигается загорание звездки к моменту вылета ее из стакана.
С выходом из стакана снаряда полуцилиндры 7 под действием центробежных сил, развивающихся при вращении снаряда в полете, отлетают в сторону, парашют освобождается и под действием потока воздуха, окружающего его при падении звездки, разворачивается. Раскрывание полуцилиндров показано на рис. 24. Развернутый парашют замедляет падение горящей звездки.
Выбрасывание звездки через головную часть усложняет снаряжение, так как требуется огнепровод и специальный вышибной заряд в донной части. В этом не нуждаются снаряды, звездки в которых выбрасываются через донную часть.
П а р а ш ю т н ы й о д н о з в е з д ч а т ы й с н а р я д, в к о т о р о м с н а р я ж е н и е в ы б р а с ы в а е т с я ч е р е з д о н н у ю ч а с т ь, показан на рис. 25. Дно снаряда 1 скреплено с корпусом стопорными винтами 2. Звездка 3 состоит из осветительного состава, запрессованного в оболочку 4. Поверх осветительного состава запрессован слой восдламенительного состава 5. К звездке привязан парашют из шелка 9; он уложен в сосуд, образованный двумя полуцилиндрами с днищами 10. Диаметр купола парашюта 600 —1000 мм. Над звездкой расположена диафрагма 7 с отверстиями 8, через которые огонь передается от дистанционной трубки к осветительной звездке.
Снаряд действует следующим образом. Действием дистанционной трубки, установленной на определенную высоту разрыва, зажигается воспламенительный состав 5 звездки 3, который передает пламя основному осветительному составу. Давлением газов, образующихся при горении составов, срезаются стопорные винты 2, удерживающие дно снаряда, при этом все внутреннее снаряжение выталкивается наружу, назад. Полуцилиндры защищают парашют
от повреждения. В воздухе под действием центробежных сил и встречного потока воздуха полуцилиндры, образующие сосуд для парашюта, расходятся; парашют освобождается и раскрывается, замедляя падение звездки.
Возможно, что давление газов, образующихся при горении состава звездки, будет настолько велико, что сможет деформировать оболочку звездки. Поэтому в головной части корпуса снаряда имеются специальные каналы б, прикрываемые оболочкой звездки. С перемещением ее после срезания стопорных винтов 2 эти каналы открываются, и избыточное давление спускается.

Как можно видеть, выбрасывание внутреннего снаряжения через донную часть значительно упрощает конструкцию и улучшает действие снаряда.
Другим примером парашютного о дно звездчатого снаряда с выбрасыванием внутреннего снаряжения через донную часть может служить английский осветительный снаряд (рис. 26). В этом снаряде дно 12 скреплено с корпусом стопорными винтами 13. В головной части снаряда находится дистанционная трубка 1.
Снаряд снабжен вышибным зарядом 3 из дымного пороха, помещенным в оболочку из легкой воспламеняющейся ткани,. Заряд расположен над диафрагмой 4 с отверстиями для воспламенения осветительной звездки 6 пороховыми газами.
Звездка состоит из металлического цилиндра с дном, в котором запрессованы осветительный и воспламенительный составы 5.
Дно оболочки звездки снабжено вертлюгом 9, т: которому привязаны тросы парашюта 11. Вертлюг дает возможность звездке
вращаться, не скручивая при этом тросы парашюта и не затрудняя развертывания парашюта в воздухе. Парашют 11 обычно делается из шелковой прочной и легкой ткани. Сложенный парашют уложен в цилиндр, образованный двумя полуцилиндрами 10.
Действие снаряда аналогично действию снаряда с выбрасыванием снаряжения через донную часть. Отличие заключается лишь в том, что здесь внутреннее снаряжение выталкивается из корпуса силой давления пороховых газов.
 Осветительная звездка горит 45—65 секунд, сила света до 200000 свечей, радиус освещения достигает 500 м.
Осветительная звездка горит 45—65 секунд, сила света до 200000 свечей, радиус освещения достигает 500 м.
Определяя степень прочности прикрепления дна к корпусу, нужно согласовать ее с величиной вышибного заряда; если крепление будет слишком прочным, потребуется большой вышибной заряд для отрыва дна, причем может быть повреждена осветительная звездка. В обратном случае возможен прорыв пороховых газов при выстреле через дно в снаряд и преждевременный его разрыв.
П а р а ш ю т н ы й д в у х з в е з д ч а т ы и 152-мм о с в е т и т е л ь н ы й с н а р я д с и с т е м ы П о г р е б и я к о в а с в ы б р а с ы в а н и е м с н а- р я ж е н и я ч е р е з г о л о в н у ю ч а с т ь показан на рис. 27. Головка снаряда скреплена с корпусом нарезкой и стопорными винтами. В очко головки ввинчена дистанционная трубка 1. В снаряде помещены две осветительные звездки 2 в форме полуцилиндров. Между ними имеется выемка, по которой проходит центральная трубка 3. Внутри трубки помещена нить стопина б; она служит огнепроводом. Каждая звездка имеет двойной парашют. Звездка состоит из железной оболочки, в которую запрессован основной осветительный состав; для облегчения воспламенения его в звездку запрессовываются слои переходного и воспламенительного составов. Вес звездки до 550 г. Звездки расположены над сложенными парашютами 4 и опираются' на дубовые стойки 9 с резиновыми прокладками. Вокруг центральной трубки также помещены резиновые прокладки-кольца 10. Деревянные стойки защищают парашюты от повреждений и смятия звездками; резиновые прокладки смягчают удар звездок в момент выстрела. Нижняя часть центральной трубки 3 соприкасается с втулкой, в которой запрессован пороховой замедлитель 5. Втулка ввинчена в диафрагму 7. Вышибной заряд 8 из дымного пороха помещен в металлической коробке, соединенной с диафрагмой. Осве-
тительная звездка, имеющая двойной парашют, изображена на рис. 28. Парашюты изготовлены из тонкого прочного шелка.
Снаряд действует следующим образом (рис. 27).В нужной точке траектории огонь от дистанционной трубки 1 передается стопину 6', который воспламеняет замедлитель 5 и звездки 2. Во время горения замедлителя звездки успевают разгореться настолько, что не тухнут в момент разрыва снаряда. После сгорания замедлителя 5 воспламеняется вышибной заряд 8, и звездки вместе с парашютом силой Дороховых газов выбрасываются из корпуса через головную часть.
Парашюты раскрываются и поддерживают горящие звездки в воздухе. В случае отказа одного парашюта действует второй.
 В этих снарядах головка укрепляется на корпусе сравнительно слабо, и поэтому особенно важно тщательно проверять сборку снаряда, следя за герметичностью внутреннего стакана. Иначе влага воздуха может вызвать разложение осветительного состава, слеживание парашютов и другие повреждения внутреннего снаряжения.
В этих снарядах головка укрепляется на корпусе сравнительно слабо, и поэтому особенно важно тщательно проверять сборку снаряда, следя за герметичностью внутреннего стакана. Иначе влага воздуха может вызвать разложение осветительного состава, слеживание парашютов и другие повреждения внутреннего снаряжения.
Слишком слабо закрепленная и расшатанная головка может быть сорвана еще в канале орудия при выстреле, что вызовет порчу орудия. Слишком сильное крепление головки опасно: большое давление может вызвать взрыв осветительного состава и разрыв корпуса снаряда.
Головка крепится на корпусе приблизительно полутора витками нарезки.
Осветительные средства, применяемые авиацией
Осветительные пиротехнические средства широко применяются в авиации, главным образом, для освещения фотографируемой местности или отдельных объектов и для освещения мест посадки самолетов при отсутствии освещенных аэродромов.
В качестве пиротехнических посадочных средств употребляются п о д к р ы л ь н ы е ф а к е л ы и п а р а ш ю т н ы е б о м б ы.
 П о д к р ы л ь н ы й ф а к е л. Принцип устройства подкрыльного осветительного факела показан на рис. 29. Оболочкой факела служит железный цилиндр длиной около 21 см, диаметром около 6 см. Нижний конец цилиндра закрыт железной крышкой 2. В нижней части цилиндра помещены пороховой заряд 6 и электрический запал 4. Ток к запалу подводится от общей электрической сети самолета через контактные болты 5 и провода 9. Внутри цилиндра помещен осветительный состав 3. Иногда поверх осветительного состава помещается дополнительный слой 7 состава, дающего при горении красное пламя. Это пламя указывает конец горения факела. Выше красного состава находится слой гипса 8, защищающий расположенную выше деревянную пробку 1 с контактными болтами 5. Болты служат также и для подвески факела к специальному держателю самолета.
П о д к р ы л ь н ы й ф а к е л. Принцип устройства подкрыльного осветительного факела показан на рис. 29. Оболочкой факела служит железный цилиндр длиной около 21 см, диаметром около 6 см. Нижний конец цилиндра закрыт железной крышкой 2. В нижней части цилиндра помещены пороховой заряд 6 и электрический запал 4. Ток к запалу подводится от общей электрической сети самолета через контактные болты 5 и провода 9. Внутри цилиндра помещен осветительный состав 3. Иногда поверх осветительного состава помещается дополнительный слой 7 состава, дающего при горении красное пламя. Это пламя указывает конец горения факела. Выше красного состава находится слой гипса 8, защищающий расположенную выше деревянную пробку 1 с контактными болтами 5. Болты служат также и для подвески факела к специальному держателю самолета.
Факелы подвешиваются под плоскостями самолета так, чтобы прямые лучи от них не падали в глаза пилоту при повороте им головы. При подвеске факела следует соблюдать все правила пожарной безопасности. Обычно на самолетах деревянной конструкции плоскости со стороны подвеса факела обшиваются асбестом и листовым алюминием.
Включением специальных вытяжных кнопок пилот может воспламенить электрозапал 4, который передает огонь пороховому заряду (во избежание случайного включения нельзя применять обычные кнопки). Пороховые газы срывают нижнюю крышку 2 факела и воспламеняют осветительный состав 3. Факел горит 50 —75 сек., сила света около 50000 свечей.
В случае вынужденной посадки самолета в кусты, на сено и т. п. или на какие-либо другие легко горючие предметы пилот может заблаговременно сбросить горящий осветительный факел так, чтобы не вызвать пожара. Для сбрасывания факела в держателе имеется соответствующее приспособление.
В некоторых конструкциях факелов в верхней части цилиндра над пиротехническим составом помещается второй пороховой заряд
и электрозапал. Они служат для отрыва факела. В деревянной пробке факела в этом случае находится третий контактный болт, а в кабине пилота — отдельная вытяжная кнопка для включения запала сбрасывания.
 Другим видоизменением списанной конструкции факела может быть применение оболочки из сгораемого материала. Горение оболочки и одновременно состава улучшает освещение.
Другим видоизменением списанной конструкции факела может быть применение оболочки из сгораемого материала. Горение оболочки и одновременно состава улучшает освещение.
Для более полного использования световой энергии факелов держатели их снабжаются специальными рефлекторами (отражателями). На рис. 30 показан держатель факела с отражателем, который во время полета самолета находится в плоскости, параллельной его крылу. При зажигании факела отражатель автоматически поворачивается, освещая место посадки.
Подкрыльные факелы имеют сравнительно малый вес и дают хорошее освещение при выборе места посадки. Недостатком их является кратковременность действия.
Продолжительное освещение можно получить от парашютных осветительных бомб, которые выбрасываются из специальных бомбодержателей, укрепленвых под фюзеляжем самолета. Выпадая из держателя, бомба воспламеняется и спускается на парашюте. Горит она до 3—4 мин., сила ее света около 250 000 свечей.
К недостаткам парашютных бомб следует отнести возможность отнесения горящей бомбы ветром в сторону от выбираемого места посадки и большой вес.
Хотя на самолетах имеется электрическое освещение (фары), пиротехнические подкрыльные факелы и парашютные бомбы в ави-
ации применяются очень часто. Гражданские самолеты в СССР снабжаются для ночных полетов двумя фарами на левом крыле и четырьмя подкрыльными факелами попарно на каждом крыле.
§ 2. ЗАЖИГАТЕЛЬНЫЕ СРЕДСТВА
Одним из наиболее важных видов пиротехнических изделий являются зажигательные средства. В условиях современной войны их значение весьма велико (особенно зажигательных бомб, сбрасываемых с самолетов).
В период империалистической войны 1914—1918 гг. зажигательные средства развивались очень быстро. Воюющие страны вступили в войну, имея сравнительно примитивные зажигательные снаряды с белым фосфором и др., а к концу войны они уже имели на вооружении мощные термитные снаряды.
Назначение зажигательных средств — вызвать пожар в различных промышленных предприятиях, складах и в других объектах военного значения.
Зажигательные средства должны работать без отказа, иметь высокую температуру горения составов и охватывать возможно большую площадь действием зажигательного изделия. Зажигательные средства должны обладать способностью проникать на некоторую глубину в деревянные части строений, воспламеняя их. Вместе с этим зажигательные средства не должны легко поддаваться тушению, должны быть безопасными в обращении и обладать стойкостью при хранении.
 К зажигательным средствам относятся разные конструкции ручных зажигательных гранат, фугасы, мины, пули, артиллерийские снаряды разных калибров, авиабомбы, огнеметы. В современных условиях наибольшее значение приобрели зажигательные снаряды и авиабомбы.
К зажигательным средствам относятся разные конструкции ручных зажигательных гранат, фугасы, мины, пули, артиллерийские снаряды разных калибров, авиабомбы, огнеметы. В современных условиях наибольшее значение приобрели зажигательные снаряды и авиабомбы.
Зажигательные пули
Пуля, которая может при попадании в цель вызвать воспламенение, является весьма эффективным средством. Самолеты, танки, автомашины имеют резервуары с горючим, сравнительно легко воспламеняющимся. Зажигательные пули, попадая в бак, зажигают горючее, вызывая этим взрыв бака и воспламенение самого самолета или автомашины. Небольшой размер пули позволяет снарядить ее лишь сравнительно малым количеством зажигательного состава (пли вещества). Большей частью зажигательные пули снаряжаются фосфором (рис. 31).
Металлическая оболочка пули 1 имеет отверстие 4, запаянное легкоплавким составом, который при выстреле расплавляется от
действия горячих пороховых газов. Через это отверстие вытекает белый фосфор. Он помещается в головной части оболочки 2. За фосфором располагается фигурный свинцовый столбик 3 с боковыми продольными каналами для прохода фосфора, свободно примыкающий к свинцовой пробке 5, закрывающей нижнее отверстие оболочки пули.
 Пуля действует таким образом. При ударе ее о преграду свободный свинцовый столбик продолжает двигаться по инерции вперед и при этом выжимает фосфор через свои каналы к отверстию в оболочке, освобожденному уже от легкоплавкой пробки. Фосфор на воздухе само воспламеняется.
Пуля действует таким образом. При ударе ее о преграду свободный свинцовый столбик продолжает двигаться по инерции вперед и при этом выжимает фосфор через свои каналы к отверстию в оболочке, освобожденному уже от легкоплавкой пробки. Фосфор на воздухе само воспламеняется.
Недостатком этой конструкции является воспламенение фосфора часто тотчас же после вылета пули из ствола оружия и выгорание всего фосфора на протяжении приблизительно 300 м полета.
Фосфорная пуля аналогичного действия показана на рис. 32.
Фосфорные пули могут проникать в небронированные баки с горючим. Однако в настоящее время многие самолеты и боевые автомашины снабжаются броней, защищающей их от зажигательных пуль указанных конструкций. Поэтому применяются комбинированные б р о н е- б о й н о - з а ж и г а т е л ь н ы е п у л и, в которых за счет укорочения бронебойного сердечника введен зажигательный состав.
Применение фосфора в пулях также не является достаточно удовлетворительным средством; фосфор воспламеняет только легкие горючие вещества, например, бензин, а тяжелые — нефть, газойль — не воспламеняет. В последние годы во всех странах ведутся работы по переводу двигателей на тяжелые типы горючих. В связи с этим возникла необходимость замены фосфора в зажигательных пулях более сильнодействующим средством. Кроме того, фосфор сильно разбрызгивается и при стрельбе с самолета по самолету противника фосфор может попасть на самолет нападающей стороны. Поэтому ведутся опыты применения в пулях зажигательных составов окислительного и термитного действия.
Зажигательные ручные гранаты
Зажигательные ручные гранаты были очень распространены во время империалистической войны 1914—1918 гг. Гранаты, снаряжённые фосфором, дают при горении много дыма, и они применялись, главным образом, для порчи противогазов противника и «выкуривания» его из окопов, погребов и других убежищ.
 Более широкое применение находили ручные гранаты, снаряженные термитом. Их использовали для поджигания деревянных построек, для приведения в негодность оставляемых орудий, броневиков и пр.
Более широкое применение находили ручные гранаты, снаряженные термитом. Их использовали для поджигания деревянных построек, для приведения в негодность оставляемых орудий, броневиков и пр.
При горении термита развивается настолько высокая температура (до 2500°), что металл легко расплавляется. Поместив зажженную термитную гранату в канал орудия, можно основательно испортить его. На рис. 33 изображена ручная термитная зажигательная граната. Корпус 1 гранаты наполнен смесью термита 2 с жидким стеклом в количестве около 600 г. Воспламенитель 3 помещается внутри термитного состава и снабжен быстро воспламеняющимся шнуром 4.
Американский образец ручной зажигательной гранаты изображен на рис. 34. Внутри корпуса 1 находится перегородка, отделяющая термит 2 от сгущенного масла 4, находящегося в целлулоидной оболочке. Граната воспламеняется при помощи терочного приспособления: сначала загорается термит, а затем пламя передается сгущенному маслу, горящему 3—5 мин.
Зажигательные снаряды
 Зажигательные снаряды сыграли большую роль в империалистической войне i 1914 —1918 гг. В первые годы войны применялись зажигательные снаряды, снаряженные фосфором и целлулоидом; например, немецкий зажигательный снаряд, показанный на рис. 35. В этом снаряде целлулоидные тела окружены фосфором и вставлены в парафин.
Зажигательные снаряды сыграли большую роль в империалистической войне i 1914 —1918 гг. В первые годы войны применялись зажигательные снаряды, снаряженные фосфором и целлулоидом; например, немецкий зажигательный снаряд, показанный на рис. 35. В этом снаряде целлулоидные тела окружены фосфором и вставлены в парафин.
Французские зажигательные снаряды содержали бумажные свертки, пропитанные смесью из калиевой селитры, серы, угля и смолы; эти пакетики помещались в насыщенный раствор фосфора в сероуглероде. Такой смесью наполнялись корпуса снарядов.
К концу войны появились значительно более мощные термитные снаряды, которые вызывали трудно поддающиеся тушению пожары

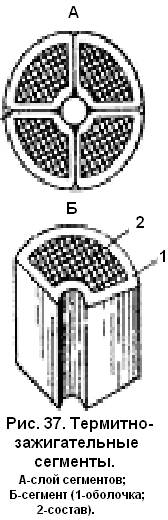 во многих местах. Дальнейшее усовершенствование конструкции термитного снаряда привело к типу 75-мм термитно-сегментного зажигательного снаряда (рис. 36). Корпус 1 снаряда изготовлен из стали. В донной части корпуса помещен вышибной заряд 2 из смеси дымного пороха и древесных опилок, заключенной в тканевый мешочек. Поверх вышибного заряда расположена диафрагма 3 с центральным отверстием, через которое проходит нить стопина б. Стопин передает огонь от дистанционной трубки 8 к вышибному заряду и к зажигательным элементам 4.
во многих местах. Дальнейшее усовершенствование конструкции термитного снаряда привело к типу 75-мм термитно-сегментного зажигательного снаряда (рис. 36). Корпус 1 снаряда изготовлен из стали. В донной части корпуса помещен вышибной заряд 2 из смеси дымного пороха и древесных опилок, заключенной в тканевый мешочек. Поверх вышибного заряда расположена диафрагма 3 с центральным отверстием, через которое проходит нить стопина б. Стопин передает огонь от дистанционной трубки 8 к вышибному заряду и к зажигательным элементам 4.
Древесные опилки увеличивают дымовое облако при разрыве снаряда у цели и улучшают условия наблюдения за его действием и корректировку стрельбы.
Каждый зажигательный элемент состоит из металлической оболочки, заполненной запрессованным зажигательным термитным составом. Обычно их называют зажигательными сегментами (сечение оболочки по форме приближается к сегменту). Сегменты расположены по четыре в ряд и в несколько рядов по высоте. На рис. 37 показан слой сегментов и отдельно сегмент.
Между рядами сегментов (рис. 36) помещены картонные прокладки 5, которые предохраняют сегменты от механических повреждений и от преждевременного воспламенения при выстреле. Головка 7 снаряда удерживает все части внутреннего снаряжения от смещения. В очко головки ввинчена дистанционная трубка 8.
Снаряд действует следующим образом. В момент, установленный с помощью дистанционной трубки, огонь от нее через стопин 6 передается зажигательным сегментам 4 и вышибному заряду 2. Пороховые газы давят на диафрагму 3 и выталкивают внутреннее снаряжение, отрывая головку снаряда. Зажигательные сегменты разлетаются, воспламеняя различные деревянные строения, пробивая крыши зданий и некоторые другие преграды. В толстые бревенчатые стены сегменты могут проникать на некоторую глубину, поджигая их. Горящие сегменты образуют расплавленные шлаки, которые, растекаясь по поджигаемой поверхности, увеличивают площадь действия сегмента.
Достоинством такой конструкции снарядов является большое количество очагов пожаров, создаваемых ими, и трудность их тушения.
Зажигательные авиационные бомбы
Современная империалистическая война достаточно показательна для характеристики роли зажигательных авиационных бомб как мощных зажигательных средств.
Зажигательные авиабомбы бывают различной конструкции и веса —от небольших бомб в 200 г до мощных многокилограммовых.
 Различают авиабомбы следующих типов: и н т е н с и в н ы е, т. е. тяжелые зажигательные бомбы замкнутого типа; р а з р ы в н ы е (так называемые э к с т е н с и в н ы е), разбрасывающие в момент разрыва большое количество горящих элементов; р а с с е и в а ю щ и е, т. е. мелкие бомбы, сбрасываемые в цель в большом количестве.
Различают авиабомбы следующих типов: и н т е н с и в н ы е, т. е. тяжелые зажигательные бомбы замкнутого типа; р а з р ы в н ы е (так называемые э к с т е н с и в н ы е), разбрасывающие в момент разрыва большое количество горящих элементов; р а с с е и в а ю щ и е, т. е. мелкие бомбы, сбрасываемые в цель в большом количестве.
И н т е н с и в н ы е зажигательные авиабомбы предназначены для поджогов крупных деревянных построек, заводских сооружений, вокзалов, складов и пр. Зажигательное действие таких бомб достаточно надежно, но они обладают следующими основными недостатками: сравнительно небольшой площадью действия и необходимостью точного попадания в цель.
Авиабомбы воспламеняются при ударе с помощью взрывателя.
Р а з р ы в н ы е (э к с т е н с и в н ы е) бомбы обладают большим радиусом действия, но менее надежны; во-первых, часть зажигательных элементов часто не воспламеняется, во-вторых, на единицу поражаемой площади приходится сравнительно немного зажигательных веществ.
М е л к и е б о м б ы рассеивающего типа сбрасываются в большом количестве; они большей частью служат для поджога легко загорающихся объектов с большой площадью — лесов, посевов, стогов сена и соломы, легких деревянных бараков и т. п.
Во время империалистической войны 1914—1918 гг. применялись мелкие бомбы английского образца по 200 г, снаряженные термитом. Такие бомбы назывались «Бэби». Один самолет мог вместить до 16 000 таких бомб.
Интенсивная зажигательная бомба изображена на рис. 38. Вес бомб такого типа 5—10 кг.
Зажигательная смесь 4 из парафина и бензина или парафина с перхлоратом калия воспламеняется специальным воспламенительным составом 5, помещенным в трубке 2. Этот состав приготовляется
 из порошка алюминия, железа и азотнокислого бария. Для разрыва бомбы и разбрасывания горящего содержимого ее служит заряд черного пороха 1. Правильный полет бомбы в воздухе обеспечивают стабилизирующие крылья 7.
из порошка алюминия, железа и азотнокислого бария. Для разрыва бомбы и разбрасывания горящего содержимого ее служит заряд черного пороха 1. Правильный полет бомбы в воздухе обеспечивают стабилизирующие крылья 7.
На рис. 39 изображена германская экстенсивная зажигательная авиабомба, снаряженная 47 зажигательными элементами. Корпус бомбы 1 металлический; головная часть заостренной формы сделана из чугуна. Боковые поверхности корпуса — из жести.
Внутри бомбы помещается пороховой заряд, соединенный огнепроводом 4 с воспламенительным терочным приспособлением 3.
Внутреннее пространство бомбы заполнено 46 маленькими дырчатыми цинковыми цилиндриками 2, заполненными зажигательным составом. Состав в указанной немецкой бомбе состоял из азотнокислого бария, дегтя и смолы. Цилиндрики расположены слоями, промежутки между ними заполняются черным мелким порохом 5 или специально обработанной легко воспламеняющейся целлюлозой.
В момент сбрасывания бомбы с самолета автоматически действует терочное
приспособление 3 и зажигается огнепровод 4, передающий пламя пороховому заряду, который воспламеняет зажигательные цилиндрики и вызывает разрыв бомбы.
В описанных конструкциях зажигательных авиабомб оболочка (корпус) их не участвует в горении, являясь «мертвым» грузом.
В электронных бомбах оболочка горит и может усилить зажигательное действие. Корпус их изготовляется из сплава магния с алюминием — электрона. Внутри бомбы помещается термит и воспламенительное приспособление, большей частью ударного действия. Это приспособление воспламеняет термит, который сгорает, образуя раскаленный жидкий шлак, и воспламеняет электронную оболочку бомбы. Не сгорают только стабилизаторы.
Электронные бомбы часто бывают весом 1 кг. При сгорании бомба развивает температуру 2000—3000°. Электрон сгорает с образованием искр и захватывает более обширное пространство, чем обычные термитные бомбы. Пламя электронной бомбы не тушится во-
дои, а наоборот, усиливается от ее действия. Электронные бомбы — одно из наиболее сильно действующих зажигательных средств.
В Германии предложена в 1938 г. (германский патент 649530) зажигательная бомба со сгораемой алюминиевой оболочкой; схема ее показана на рис. 40.
Бомба состоит из алюминиевой оболочки 1 и зажигательного состава 3. Между зажигательным составом н поверхностью оболочки 1 помещен слой промежуточного вещества 2, который служит компонентом реакции для алюминия. Эту роль может выполнять окисел металла (железа, меди и др.), который при нагревании отдает кислород алюминию.
§ 3. ТРАССИРУЮЩИЕ СРЕДСТВА
Для облегчения пристрелки по быстро движущимся целям применяют пиротехнические изделия, дающие на траектории полета видимый след. Такие изделия называются т р а с с и р у ю щ и м и.
По мере развития авиации и быстродвижущихся наземных целей (автобронемашины), большая скорость перемещения которых затрудняет стрельбу, возрастает потребность в трассирующих средствах.
Трассирующие средства должны давать ясно различаемую траекторию полета, обязательно совпадающую с траекторией полета соответствующего боевого объекта. Трассирующие средства должны обеспечивать достаточную дальность трассирования и маскировать точное местонахождение стреляющего. Они должны обеспечивать безотказность действия, быть безопасными в обращении и стойкими при хранении.
Трассирующие средства можно подразделить по способу воспламенения трассирующего состава на средства лучевого и на средства механического воспламенения.
В первом случае состав воспламеняется от пламени порохового заряда в канале ствола орудия. Иногда, чтобы обеспечить и облегчить воспламенение, оно осуществляется через посредство воспламенительного состава.
Для механического воспламенения используется специальный механизм.
Первый способ воспламенения значительно проще и дешевле второго. Однако он дает менее надежное действие. Кроме того, трассирующий состав горит в канале орудия, что вызывает большую его изнашиваемость. Лучевой способ воспламенения применяется в мелкокалиберных изделиях.
Механический способ дает более надежное воспламенение, но значительно удорожает стоимость объекта; он применяется в трассирующих снарядах среднего калибра.
При горении трассирующих составов можно получить пламя, дым или комбинированное огневое и дымовое действие.
Наиболее пригодны для наблюдения огневые трассирующие средства. По конструкции трассирующие изделия разделяются на трассирующие пули и трассирующие снаряды.
Трассирующие пули
К трассирующим пулям предъявляются следующие основные требования: продолжительность горения трассирующего состава 3—5 сек.; безотказное горение без затухания.
Трассирующий состав пули обычно воспламеняется действием газов порохового заряда (лучевое воспламенение).

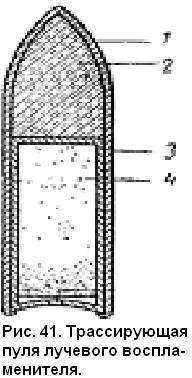 На рис. 41 представлена трассирующая пуля с лучевым воспламенением. Внутри металлической оболочки 1 помещен свинцовый сердечник 2 и латунная гильза -3, в которую запрессован трассирующий состав 4. Дно пули закрывается латунным кружком -5 с отверстием, через которое состав воспламеняется и выходят •светящиеся раскаленные газы.
На рис. 41 представлена трассирующая пуля с лучевым воспламенением. Внутри металлической оболочки 1 помещен свинцовый сердечник 2 и латунная гильза -3, в которую запрессован трассирующий состав 4. Дно пули закрывается латунным кружком -5 с отверстием, через которое состав воспламеняется и выходят •светящиеся раскаленные газы.
На рис. 42 показана французская трассирующая пуля с вспомогательным воспламенительным составом 3, зажигающим основной трассирующий состав 2; через отверстие 4 при выстреле зажигается пороховыми газами воспламенительный состав; через это же отверстие выходят раскаленные газы, образующиеся от сгорания трассирующего состава. Калибр этой пули 8 мм, вес 11—12 г.
Некоторые бронебойно-зажигательные пули для облегчения стрельбы по самолетам снабжаются трассирующим устройством (рис. 43). Конструкция пули изображена по патенту Итальянского металлургического общества. Пуля имеет наружную 1 и внутреннюю 2 оболочки.
Наружная оболочка имеет открытую головку, в которую вставлена внутренняя оболочка. Выступающий конец внутренней оболочки образует головку пули. Оболочка 2 сделана из металла, в ней помещен сердечник 3. Свободное пространство между острием сердечника и передним концом оболочки заполнено фосфором 4, который воспламеняется при соприкосновении с воздухом. Пространство между другим концом сердечника и оболочкой 2 заполнено зажигательным составом 5. Этот состав заключен в металлический сосуд 6, дно которого закрывает отверстие в дне внутренней оболочки.
В полости наружной оболочки 1, находящейся между ее дном и оболочкой 2, помещается свинцовое ядро 7, имеющее гнездо для патрона 8 с трассирующим составом 9. Это ядро 7 уравновешивает массу пули.
Дно патрона 8 представляет собой легкоплавкую пластинку 10, расположенную против отверстия 11 в дне наружной оболочки.
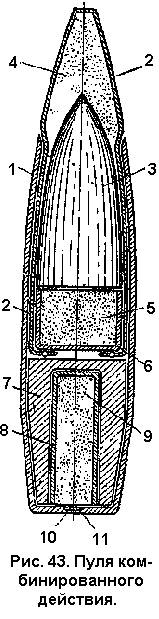 При выстреле пороховые газы расплавляют пластинку 10 и воспламеняют трассирующий состав. Продукты его горения выходят через отверстие 11.
При выстреле пороховые газы расплавляют пластинку 10 и воспламеняют трассирующий состав. Продукты его горения выходят через отверстие 11.
При попадании в цель от удара разрушается закрытый конец внутренней оболочки 2. образующий головку пули. Фосфор 4, приходя в соприкосновение с воздухом, воспламеняется и образует дымовое облачко, которое указывает место попадания пуля. Сердечник 3 пробивает цель. Воспламеняющийся зажигательный состав 5 вызывает пожар.
Трассирующие снаряды
Трассирующий состав в снарядах малого калибра обычно запрессовывается непосредственно в корпус. В снарядах среднего калибра часто встречаются специальные приспособления 2 для трассирования, называемые трассерами. При наличии такого трассера снаряд дает трассирующее действие наряду с боевым. Воспламенение снарядов может быть механическим или лучевым, как было указано выше.
На рис. 44 показан трассирующий снаряд с механическим воспламенением.
При выстреле ударник накалывает капсюль-воспламенитель. Огонь от капсюля передается воспламенительному составу, затем трассирующему. Образовавшиеся при этом нагретые газы выталкивают втулку и свинцовую заливку, почему открывается отверстие в донной части снаряда, и пламя выходит наружу. Видимое пламя появляется на расстоянии 150—200 м от орудия, что скрывает от противника место расположения стреляющего.
В таких снарядах трассирующий состав запрессовывается под давлением 3000 — 4000 кг/см2.
На рис. 45 показан трассирующий снаряд с лучевым воспламенением. В гильзу 2 запрессовывается трассирующий состав под давлением 8000—10000 кг/см2.
Такое большое давление при прессовании необходимо потому, что в канале ствола орудия состав, воспламеняемый пороховыми газами, подвергается большому давлению.
Гильза с запрессованным составом вставляется в корпус 1. Поверхность состава закрывается горючей прокладкой 5, защищающей его от вредного воздействия влаги. Поджимное кольцо 4 удерживает гильзу и прокладку.
При выстреле пороховые газы воспламеняют состав, сжигая горючую прокладку. Через отверстие в поджимном кольце выходят
пламя и газы, образующиеся при сгорании трассирующего состава.
Описанные выше трассирующие снаряды не могут нанести поражения противнику, и стрельба ими производится для пристрелки между выстрелами боевыми снарядами.
 Во многих армиях встречаются снаряды комбинированного действия: осколочно-трассирующие, бронебойно-трассирующие и пр. Некоторые из них снабжаются приспособлением для самоликвидации снаряда в воздухе в случае непопадания в цель. Самоликвидация снарядов очень важна при стрельбе по самолетам, так как не попавший в цель, снаряд может упасть на свою территорию и нанести большой ущерб.
Во многих армиях встречаются снаряды комбинированного действия: осколочно-трассирующие, бронебойно-трассирующие и пр. Некоторые из них снабжаются приспособлением для самоликвидации снаряда в воздухе в случае непопадания в цель. Самоликвидация снарядов очень важна при стрельбе по самолетам, так как не попавший в цель, снаряд может упасть на свою территорию и нанести большой ущерб.
На рисунке 46 представлен осколочно-трассирующий снаряд с самоликвидатором. При выстреле воспламеняются воспламенительный 7 и трассирующий 6 составы. В случае попадания в цель от удара о нее действует взрыватель 1. В случае непопадания снаряда в цель трассирующий состав выгорает и огонь передается детонатору 5, который детонирует заряд взрывчатого вещества.
В большинстве случаев для трассирующих снарядов применяются пиротехнические составы, дающие при горении пламя.
§ 4. СИГНАЛЬНЫЕ СРЕДСТВА
К достоинствам пиротехнических средств сигнализации относятся следующие их свойства: 1) постоянная готовность к действию; 2) простота в обращении; 3) отсутствие необходимости специальной подготовки к подаче сигналов; 4) возможность сигнализации с различных положений и местонахождений сигнальщика; 5) достаточная продолжительность действия сигнала; 6) возможность одновременно сигнализировать большому количеству лиц.
К недостаткам пиротехнических сигнальных средств относится их огнеопасность (она усложняет условия их хранения) и зависимость действия сигнала от погоды (ветер, дождь, туман).
Сигнальные средства разделяются на сигналы ночного действия и сигналы дневного действия.
С и г н а л ь н ы е с р е д с т в а н о ч н о г о д е й с т в и я снаряжаются пиротехническими составами, дающими при горении пламя различных цветов.
С и г н а л ь н ы е с р е д с т в а д н е в н о г о д е й с т в и я снаряжаются составами, дающими окрашенные дымовые облака.
Характер действия различных сигналов зависит от конструкции и размера изделия и от свойств применяемого для его снаряжения
состава.
К сигнальным средствам предъявляются следующие требования: 1) достаточная высота подъема сигнала в зависимости от его мощности; 2) четкая окраска дыма или пламени и различимость ее как вблизи, так и на требуемом расстоянии (в зависимости от мощности сигнала); 3) безотказность действия; 4) достаточная его продолжительность; 5) безопасность в обращении и при хранении.
Требуемое качество пламени или дымового облака и продолжительность действия сигнала обеспечиваются соответствующим составом; высота подъема и безотказность действия зависят, главным образом, от конструкции сигнала и от способа его снаряжения.
Сигнальные средства ночного действия
В сигнальных средствах ночного действия применяются сигнальные пламенные составы, при горении которых образуется пламя определенного цвета. Составы обычно употребляют в виде звездок, для чего перед снаряжением объекта составы прессуют.
Наиболее часто употребляют для сигнализации красный, зеленый и желтый огни; для сигнала белого цвета используют некоторые осветительные средства, например, списанные выше 26-лш патроны и гранаты под мортирку Д. Сигналы синего огня сравнительно плохо различаются на расстоянии.
Конструкции некоторых сигнальных средств ночного действия аналогичны описанным выше осветительным средствам и отличаются от них лишь пиротехническим составом звездок.
Для ночной сигнализации на расстоянии до 7 км применяются 26-мм сигнальные патроны.
 26-мм с и г н а л ь н ы е п а т р о н ы н о ч н о г о д е й с т в и я по устройству и действию совершенно аналогичны 26-мм осветительным патронам (см. рис. 12—13 на стр. 87 и 88). Сигнальными патронами стреляют из 26-лш пистолета под углом в 90°. Высота подъема сигнальной звездки достигает90 м, время горения ее около 6,5 сек. Сила света, даваемого сигнальной звездной, не выше 10 000 свечей.
26-мм с и г н а л ь н ы е п а т р о н ы н о ч н о г о д е й с т в и я по устройству и действию совершенно аналогичны 26-мм осветительным патронам (см. рис. 12—13 на стр. 87 и 88). Сигнальными патронами стреляют из 26-лш пистолета под углом в 90°. Высота подъема сигнальной звездки достигает90 м, время горения ее около 6,5 сек. Сила света, даваемого сигнальной звездной, не выше 10 000 свечей.
Чтобы по внешнему виду патрона знать цвет пламени, даваемый сигналом, верхний пыж патрона окрашивается в цвет, соответствующий окраске огня. Однако ночью не всегда можно различить окраску пыжа, поэтому на шляпках сигнальных патронов ночного действия делаются рельефные отличительные знаки (рис. 47).
. Иногда для этого на дне гильзы делают кольцевые желобки различной ширины. На рис. 48 показаны шляпки патрона желтого огня А с широким желобком (ширина 5 мм) и патрона зеленого огня Б с двумя узкими желобками (ширина 1,5 мм). Для сравнения показана шляпка патрона дневного действия без желобов В.
Сигнальные звездки применяются также для 24-мм сигналов.
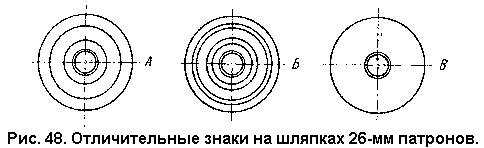
24-мм с и г н а л ы н о ч н о г о д е й с т в и я. Наиболее простая конструкция сигнальных средств — 24-мм сигналы ночного действия. Они представляют собой обычные звездки, спрессованные из сигнального состава, слоя воспламенительного состава и небольшого отрезка стопина.
Такими сигналами стреляют из специальной небольшой мортирки, надеваемой на винтовку.
24-мм сигналы чрезвычайно просты в обращении, допускают стрельбу холостыми и боевыми винтовочными патронами и не требуют длительной подготовки перед выстрелом. Недостатком этих сигналов является незащищенность их от воздействия воды. Вес одного сигнала около 25 г. Горит сигнал около 6,5 сек., высота его подъема под углом около 90° — до 120 м. Сигнал хорошо различается на расстоянии до 7 км.
Устройство винтовочной 24-мм мортирки изображено на рис. 49 и 50.
Шейка мортирки 3 (рис. 50) надевается на дуло ствола винтовки. В случае стрельбы боевыми патронами следует вывернуть втулку 8.

24-мм сигнал вкладывается в ствол 1 мортирки стопином книзу. При выстреле пороховые газы воспламеняют сигнал и выбрасывают его из мортирки.
Несколько большей мощностью обладают с и г н а л ь н ы е в и н т о в о ч-н ы е г р а н а т ы п о д м о р т и р к у Д ь я к о н о в а.

Устройство сигнальных гранат аналогично устройству описанных выше осветительных гранат. Аналогичны и приемы стрельбы ими из мортирки Дьяконова. Цвет пламени зависит от того, из какого состава спрессована звездка.
Сигнальные звездки выстреливаются под углом 85—90°. При этом высота подъема сигналов доходит до 200 м, а граната разрывается обычно в высшей точке траектории. Звездка горит около 10 сек. Сигнал различим на расстоянии до 12 км.
Большей частью применяются сигналы хорошо различимых на расстоянии цветов — красного, зеленого и желтого; в качестве сигналов белого огня используются осветительные гранаты- Все гранаты снабжены отличительными знаками, различимыми на ощупь.
Днем сигнальные гранаты хорошо различимы лишь на расстоянии до 0,75 км.
Для подачи сигналов, видимых ночью на расстоянии до 15 км, применяются 107-мм сигналы.
 107-мм с и г н а л ы н о ч н о г о д е й с т в и я. При разрыве в воздухе эти сигналы дают сноп цветных огней, хорошо видимых ночью на фоне темного неба.
107-мм с и г н а л ы н о ч н о г о д е й с т в и я. При разрыве в воздухе эти сигналы дают сноп цветных огней, хорошо видимых ночью на фоне темного неба.
Устройство 107-мм сигнала ночного действия показано на рис. 51.
Оболочкой сигнала является картонная коробка 1 с крышкой 2. К коробке приклеена ручка 3 из тесьмы. На дне коробки помещен вышибной заряд 4, затем расположены два слоя картона или гофрированной бумаги 5, между которыми находятся войлочные обрезки 6. Они смягчают удар пороховых газов вышибного заряда о сигнал, имеющий форму шара 7. Этот картонный шар внутри снаряжен сигнальными звездками 8.
В верхней части шара находится замедлитель — дистанционная часть 9, представляющий собой отрезок бикфордова шнура, согнутый дугой. К замедлителю присоединяется стопиновый провод 10 от вышибного заряда. Другой стопяновый провод 11, также присоединенный к дуге замедлителя, является запальным и имеет на свободном конце отрезок бикфордова шнура, служащего замедлителем при воспламении запального провода. На конце этого замедлителя нанесен терочный состав, закрытый бумажным колпачком 14.
К внутренней стороне крышки коробки приклеена терка 12, воспламеняющая сигнал. На наружной поверхности крышки коробки находятся рельефные отличительные знаки сигналов. Снаружи крышка прикреплена к коробке с помощью узкой полоски бумаги 13. Наружная поверхность коробки пропарафинена для защиты сигнала от влаги.
Рассмотрим несколько более детально устройство отдельных частей 107-мм сигнала.
На рис. 52 показан к а р т о н н ы й ш а р, снаряженный сигнальными звездками. Оболочка его состоит из двух картонных полушарий; в верхнее полушарие 1 вставлен согнутый в виде дуги отрезок бикфордова шнура 2, рассчитанный на горение в течение 3 сек. Он служит замедлителем. Концы замедлителя, входящие внутрь шара, покрыты пороховой подмазкой. Середина дуги срезана до обнажения пороховой сердцевины шнура 3. В этом месте к дуге присоединены стоппновые провода. Внутри полушария помещается разрывной заряд 4 из 2 г дымного пороха; он прикреп-лен к внутренней стенке полушария с помощью миткалевого кружка 5- Во внутреннем пространстве шара 7—12 сигнальных звездок 6, таких же, как в 26-мм патроне (звездок желтого и красного огня вмещается 10, зеленого огня —12, белого огня —7). Иногда в шар помещают звездки из разных составов, дающие два или три цвета огня. Такой сигнал называется с и г н а л о м к о м б и н и р о в а н н ы х о г н е й.
 Промежутки между звездками заполняют мелкими обрезками стопина 7, что обеспечивает одновременное воспламенение всех звездок. Снаружи шар для большей его прочности оклеен несколькими слоями бумаги и ткани. Наружная часть нижнего полушария оклеена добавочно несколькими слоями ткани и бумаги 8, так как на нее при выстреле приходится удар пороховых газов вышибного заряда.
Промежутки между звездками заполняют мелкими обрезками стопина 7, что обеспечивает одновременное воспламенение всех звездок. Снаружи шар для большей его прочности оклеен несколькими слоями бумаги и ткани. Наружная часть нижнего полушария оклеена добавочно несколькими слоями ткани и бумаги 8, так как на нее при выстреле приходится удар пороховых газов вышибного заряда.
В ы ш и б н о й з а р я д из 125 г дымного пороха помещен в мешочек из миткаля. В два отверстия мешочка проходят концы двух стопиновых проводов, из которых один соединяет вышибной заряд с дужкой замедлителя сигнала, а второй, более длинный, является запальным; он также присоединен к середине дуги замедлителя.
Все стопиновые провода находятся в бумажных оболочках, которые обеспечивают мгновенную передачу огня стопином.
107-.мм сигналы выпускаются из специальной мортирки или из гильзы того же калибра. Обычно используются стреляные гильзы. Перед выпуском сигнала гильзу прочно устанавливают на земле лод углом около 85° и с сигнала снимают крышку (см. рис. 51). Из коробки вынимают конец запального провода с замедлителем 11 п коробку с сигналом опускают в гильзу. С внутренней стороны перышки коробки снимают терку 12 и обнажают терочный состав
 замедлителя. Трением терки о терочный состав воспламеняется замедлитель, горящий 8 сек. За это время стреляющий должен отойти от сигнала не менее, чем на 20—25 шагов, чтобы не получить ранения при выстреле. После догорания замедлителя стопиновые провода 10 и 11 одновременно передают огонь вышибному заряду 4 и дуге замедлителя 9 шара. Пороховые газы, образующиеся в результате сгорания вьшшбного заряда, выбрасывают шар 7 в воздух. В это время горит замедлитель шара. Горение заканчивается тогда, когда шар достигает высшей точки полета. Через концы дуги замедлителя огонь передается внутрь шара разрывному заряду; давлением пороховых газов заряда разрывается шар и воспламеняются все звездки. Горящие звездки выбрасываются в воздух.
замедлителя. Трением терки о терочный состав воспламеняется замедлитель, горящий 8 сек. За это время стреляющий должен отойти от сигнала не менее, чем на 20—25 шагов, чтобы не получить ранения при выстреле. После догорания замедлителя стопиновые провода 10 и 11 одновременно передают огонь вышибному заряду 4 и дуге замедлителя 9 шара. Пороховые газы, образующиеся в результате сгорания вьшшбного заряда, выбрасывают шар 7 в воздух. В это время горит замедлитель шара. Горение заканчивается тогда, когда шар достигает высшей точки полета. Через концы дуги замедлителя огонь передается внутрь шара разрывному заряду; давлением пороховых газов заряда разрывается шар и воспламеняются все звездки. Горящие звездки выбрасываются в воздух.
Высота коробки 190 мм, диаметр ее 105 мм. Вес сигнала около 0,75 кг. Звездки горят около 7 сек.; сигналы различаются на расстоянии до 15 км. Высота подъема сигнала достигает 200 м. Все описанные сигнальные средства беспарашютные. В некоторых случаях удобно применять парашюты, которые значительно замедляют скорость падения горящих сигнальных звездок.
Рассмотрим устройство сигнального п а р а ш ю т н о г о п а т р о н а 4-го к а л и б р а (26-мм), изображенного на рис. 53. Оболочкой патрона служит гильза 2, устройство которой совершенно аналогично с устройством гильз к осветительным 26-мм патронам. Над пороховым, вышибным зарядом 10 расположена внутренняя гильза 3, вмещающая снаряжение патрона. В донную часть внутренней гильзы прочно вставлена пробка 9 с запрессованным в нее пороховым коленчатым столбиком, который служит замедлителем. Поверх пробки помещен дополнительный пороховой заряд 8, затем войлочный пыж с отверстием 7, смягчающий удар пороховых газов по звездке 6. Звездка запрессована в оболочку 5, к которой прикреплен парашют 4. Сверху гильза закрыта картонным пыжом 1. При выстреле таким патроном из сигнального пистолета 4-го калибра боек ударяет по капсюлю патрона, он воспламеняется, и огонь передается вышибному заряду 10. Газы, образующиеся в результате сгорания пороха, своим давлением выбрасывают из патрона всю внутреннюю гильзу, поджигая одновременно запрессованный в пробку 9 гильзы пороховой замедлитель.
При полете внутренней гильзы вверх сгорает замедлитель; по достижении высшей точки траектории пламя от замедлителя передается внутреннему пороховому заряду 5; пороховые газы зажигают и выбрасывают из внутренней гильзы звездку 6 с парашютом 4, который развертывается и удерживает горящую звездку на некоторой высоте.
Устройство парашютных сигнальных средств более громоздко; введение парашюта заставляет уменьшать количество сигнального состава (величину звездки), вмещаемого в патрон.
Беспарашютные сигнальные средства применяются более широко, чем парашютные.
Сигнальные средства дневного действия
Огневые сигнальные средства ночного действия не обеспечивают хорошей видимости и различимости сигналов днем. Они хорошо различаются днем лишь на расстоянии около 0,75—1 км, что совершенно недостаточно.
Поэтому для сигнализации днем применяются дымовые сигналы, дающие облако дыма, окрашенного в разные цвета.
Применяются сигналы красного, желтого, синего и зеленого дымов, в некоторых случаях черного дыма. Лучше других видимы сигналы красного и желтого цветов.
Конструкция дымовых сигналов и воспламенительные устройства для приведения их в действие в большинстве случаев почти аналогичны таковым для сигналов ночного действия; основное различие их заключается в устройстве сигнальной звездки. В дымовых сигналах ее роль выполняют пористые оболочки, заполненные дымовым составом и снабженные огнеприводом (стопин или отрезок бикфордова шнура).
При наблюдении цветного дымового облака могут встретиться затруднения, связанные с освещением и фоном; при большой облачности плохо различимы сигналы зеленого дыма; на фоне зеленого леса плохо различимы зеленые и синие дымовые сигналы. Если сигнал располагается между наблюдателем и солнцем, то различимость сигнала также плохая. Наилучшие условия освещения будут в том случае, когда солнце находится позади наблюдателя.
Схематично зоны разных условий наблюдения дымовых сигналов показаны на рис. 54.
 Зависимость дымовых сигналов от атмосферных условий (ветра, дождя, тумана) и от освещения является их недостатком.
Зависимость дымовых сигналов от атмосферных условий (ветра, дождя, тумана) и от освещения является их недостатком.
 26-мм с и г н а л ь н ы е п а т р о н ы д н е в н о г о д е й с т в и я. Гильза, воспламенительное устройство и вышибной заряд 26-мм патрона дневного действия аналогичны таковым у патронов ночного действия. Как видно на рис. 55, над картонным пыжом 8 (с отверстием, заклеенным марлей 9), который закрывает вышибной заряд 10, расположен дымовой состав 4 в оболочке 2 (называется, как и в ночных сигналах, «звездкой»). Оболочка 2 — мешочек из суровой ткани; конец его зашит или перевязан наглухо, а внутри помещен дымовой состав. Патрон помещен в бумажную гильзу 3 и сверху закрыт картонным пыжом 1.
26-мм с и г н а л ь н ы е п а т р о н ы д н е в н о г о д е й с т в и я. Гильза, воспламенительное устройство и вышибной заряд 26-мм патрона дневного действия аналогичны таковым у патронов ночного действия. Как видно на рис. 55, над картонным пыжом 8 (с отверстием, заклеенным марлей 9), который закрывает вышибной заряд 10, расположен дымовой состав 4 в оболочке 2 (называется, как и в ночных сигналах, «звездкой»). Оболочка 2 — мешочек из суровой ткани; конец его зашит или перевязан наглухо, а внутри помещен дымовой состав. Патрон помещен в бумажную гильзу 3 и сверху закрыт картонным пыжом 1.
С конца, обращенного к вышибному заряду, мешочек закрыт деревянным блочком 6 с отверстием в центре. В этом отверстии на клею укреплен отрезок бикфордова шнура 5, служащий замедлителем. Выступающий из блочка наружу конец замедлителя входит в отверстие войлочного пыжа 7.
При выстреле из пистолета от удара бойка воспламеняется капсюль, передающий огонь вышибному заряду. Пороховые газы воспламеняют замедлитель дымовой звездки, выбрасывая ее в воздух. Ко времени достижения высшей точки траектории замедлитель сгорает и передает огонь дымовому составу, который образует дымовое облако соответствующего цвета. При выстреле сигналом под углом в 80—90° он поднимается на высоту до 70 м. Облако дыма различимо на расстоянии до 2 км в течение 10 сек. при ветре и 30 сек. в тихую погоду.
С и г н а л ь н а я г р а н а т а п о д м о р т и р к у Д ь я к о н о в а д н е в н о г о д е й с т в и я. Как видно на рис. 56, устройство гранаты дневного действия отличается от устройства гранаты ночного действия.
Картонный корпус 1 в форме цилиндра переходит в головную часть оживальной формы. Длина корпуса около 125 мм. В головной части корпуса помещен пороховой вышибной заряд да из 0,7 г
дымного пороха, который предназначен для выбрасывания из корпуса гранаты дымовой звездки 7.
 Дымовая звездка представляет собой мешочек из ткани, в котором помещено около 45 г дымового состава. Мешочек завязан проволокой. В один из концов его вставлен стопиновый провод 6, который передает огонь от замедлителя к вышибному заряду 5а и дымовому составу 7. Под мешочком с дымовым составом помещен второй пороховой заряд 5, предназначенный для отрыва донной пробки 2- Донная пробка имеет два замедлителя 4 из отрезков бикфордова шнура; донная пробка аналогична таковой у осветительных гранат. Дно пробки закрыто герметизирующим кружком.
Дымовая звездка представляет собой мешочек из ткани, в котором помещено около 45 г дымового состава. Мешочек завязан проволокой. В один из концов его вставлен стопиновый провод 6, который передает огонь от замедлителя к вышибному заряду 5а и дымовому составу 7. Под мешочком с дымовым составом помещен второй пороховой заряд 5, предназначенный для отрыва донной пробки 2- Донная пробка имеет два замедлителя 4 из отрезков бикфордова шнура; донная пробка аналогична таковой у осветительных гранат. Дно пробки закрыто герметизирующим кружком.
При выстреле из мортирки Д пороховые газы холостого патрона пробивают герметизирующий кружок и воспламеняют замедлители 4, выбрасывая при этом гранату из мортирки. В высшей точке полета огонь от замедлителей передается нижнему пороховому заряду 5, газы которого срывают донную пробку 2. Одновременно стопиновый провод 6 воспламеняет верхний вышибной заряд 5а и дымовой состав 7. Вышибной заряд выбрасывает в воздух мешочек с дымовым составом, который образует облако цветного дыма.
Высота подъема сигнала при стрельбе под углом 80-90° около 180 м; дымовое облако различается на расстоянии до 3 — 4 км, а при особо благоприятном фоне неба и освещении — до 6 км. Сигнал можно различать в течение 20 сек. при скорости ветра около 4 м/сек. При большей скорости ветра сигнальное облако рассеивается быстрее.
107-мм с и г н а л ы д н е в н о г о д е й с т в и я. Из дневных сигналов наиболее мощные 107-мм сигналы (рис. 57). Устройство дневного сигнала от сигнала ночного действия отличается лишь применением мешочков с дымовым составом вместо звездок из прессованного состава. Сигнал дневного действия дает в воздухе облако цветного дыма, различимого на расстоянии до 5 км, а в ясную погоду — до 7 км.
Примером сигнала, основанного на принципе распыления измельченного окрашенного вещества, служит 107-мм с и г н а л ч е р н о г о д ы м а, показанный на рис. 58.
 Картонный шар сигнала черного дыма снаряжен следующим образом. Внутри шара помещен измельченный угольный порошок. Для его распыления применяется тетриловый детонатор 1, который действует от капсюля-детонатора 2, воспламеняющегося1 отрезком бикфордова шнура 3. Тетриловый детонатор и капсюль помещены в мешочек из ткани 4. Распыляющее устройство помещено в картонную трубку 5, нижняя часть которой заполнена тем же угольным порошком 6.
Картонный шар сигнала черного дыма снаряжен следующим образом. Внутри шара помещен измельченный угольный порошок. Для его распыления применяется тетриловый детонатор 1, который действует от капсюля-детонатора 2, воспламеняющегося1 отрезком бикфордова шнура 3. Тетриловый детонатор и капсюль помещены в мешочек из ткани 4. Распыляющее устройство помещено в картонную трубку 5, нижняя часть которой заполнена тем же угольным порошком 6.
В остальном сигнал аналогичен описанным выше 107-мм сигналам.
В момент догорания замедлителя шара в воздухе огонь от бикфордова шнура передается капсюлю-детонатору и под его действием взрывает тетриловый детонатор. Силой взрыва разрывается шар, а угольный порошок распыляется в воздухе, образуя облако черного дыма.
§ 5. ИМИТАЦИОННЫЕ СРЕДСТВА
Для обучения бойцов Рис. 58. \QI-MM сигнал черного дыма. Красной армии необходимо
проводить практические военные занятия, маневры и т. п. На таких занятиях не всегда возможно употреблять боеприпасы, иногда значительно удобнее и дешевле использовать имитационные средства.
Для имитации разрывов боевых снарядов можно использовать пиротехнические изделия, дающие сильный звуковой эффект.
И м и т а ц и о н н ы й в з р ы в п а к е т (рис. 59) дает на земле разрыв с сильным звуком.
В картонную оболочку, имеющую форму куба 3, помещено определенное количество черного пороха. В одну из стенок оболочки вставлен один конец бикфордова шнура 1, который соприкасается с насыпанным внутрь оболочки порохом. Конец 2 бикфордова шнура обмазан чувствительным зажигательным составом, который загорается от действия терки. Длина всего отрезка бикфордова шнура 1 рассчитана таким образом, чтобы в течение его горения человек мог (после того, как он подожжет бикфордов шнур) отбросить от себя пакет и отойти на 5—6 м от места его падения.
После окончания горения бикфордова шнура луч огня поджигает черный порох, который взрывается с характерным звуком, разрывая оболочку.
Для имитации разрывов боевых снарядов в воздухе применяются имитационные 26-мм патроны и имитационные гранаты под мортирку Дьяконова.
 26-мм и м и т а ц и о н н ы й п а т р о н. Имитационный патрон изображен на рис. 60. Гильза 2, аналогичная применяемым для осветительных патронов, снабжена вышибным зарядом 11, картонным пыжом 9 с отверстием 10 и войлочным пыжом 8. В гильзу помещена разрывная звездка. Оболочкой ее служит прочная бумажная трубка 3. Нижний конец звездки закрыт пробкой 7, в которую вставлен замедлитель 6 — отрезок бикфордова шнура. Часть замедлителя, входящая внутрь звездки, покрыта пороховой подмазкой 5.
26-мм и м и т а ц и о н н ы й п а т р о н. Имитационный патрон изображен на рис. 60. Гильза 2, аналогичная применяемым для осветительных патронов, снабжена вышибным зарядом 11, картонным пыжом 9 с отверстием 10 и войлочным пыжом 8. В гильзу помещена разрывная звездка. Оболочкой ее служит прочная бумажная трубка 3. Нижний конец звездки закрыт пробкой 7, в которую вставлен замедлитель 6 — отрезок бикфордова шнура. Часть замедлителя, входящая внутрь звездки, покрыта пороховой подмазкой 5.
Корпус звездки заполнен взрывчатым составом 4. Другой конец корпуса звездки закрыт верхней пробкой 1.
Действие патрона заключается в следующем. Когда патрон выстреливают из пистолета 4-го калибра, при ударе бойка о капсюль последний воспламеняется, передает огонь вышибному заряду, который действием газов, образующихся при взрыве пороха, выталкивает разрывную звездку из дула пистолета. Одновременно воспламеняется замедлитель в нижней пробке звездки.
Во время полета звездки замедлитель горит определенное время, за которое звездка успевает достигнуть требуемой высоты. По окончании горения замедлителя луч огня вызывает воспламенение состава, который взрывается с сильным звуком, разрывая корпус звездки.
И м и т а ц и о н н а я г р а н а т а п о д м о р т и р к у Д ь я к о н о в а изображена на рис. 61.
Корпус гранаты и донная пробка аналогичны таковым у гранат дневного действия. Корпус заполнен взрывчатым составом. Граната дает при разрыве сильный звук и облако серовато-белого дыма.
Для имитации разрыва различных химических, зажигательных и других снарядов применяются в з р ы в п а к е т ы и ф у г а с ы, дающие цветной дым или пламя. На рис. 62 изображен дымовой
фугас (в разрезе). Фугас состоит из оболочки 5, в которой помещен состав 4, дающий цветной дым.
 Отдельным слоем в оболочку помещена смесь сахара с бертолетовой солью 2; эта смесь соприкасается с тонкой стеклянной трубкой, наполненной концентрированной серной кислотой 1.
Отдельным слоем в оболочку помещена смесь сахара с бертолетовой солью 2; эта смесь соприкасается с тонкой стеклянной трубкой, наполненной концентрированной серной кислотой 1.
Смесь сахара и бертолетовой соли соединена несколькими нитями стопина 3 с дымовым составом.
Оболочка фугаса обычно герметизируется, чтобы состав не увлажнялся.

Перед маневрами фугас укладывается в землю так, чтобы часть его, содержащая трубку с кислотой, выступала немного над поверхностью земли. Если при прохождении по зтому месту войск, автомашин и т. п. кто-либо наступит на фугас или по нему проедет машина, стеклянная трубка разобьется, п серная кислота вытечет на смесь сахара с бертолетовой солью. Известно, что эта смесь воспламеняется от действия кислоты, а через стопин передается огонь дымовому составу, который образует облако дыма требуемого цвета.
Иногда для получения дополнительно и звукового эффекта к дымовому составу добавляется дымный порох, который взрывает, давая звук.
Контрольные вопросы к главе V
1. Какое назначение имеют пиротехнические осветительные средства?
2. Какие изделия называются средствами ближнего действия?
3. Перечислить требования, предъявляемые к осветительным патронам 4-го калибра.
4. Чем отличается осветительный патрон 4-го калибра от сигнального?
5. Для чего служит вышибной заряд в патроне 4-го калибра и из чего он делается?
6. Объяснить устройство и действие осветительного снаряда Погребнякова.
7. Какие требования предъявляются к осветительным снарядам?
8. Какие преимущества дает применение парашютных осветительных снарядов?
9. Как действуют осколочно-трассирующие снаряды?
10. Как действуют трассирующие пули?
11. Каково назначение зажигательных снарядов?
12. Перечислить типы зажигательных авиабомб.
13. Какие авиабомбы называются экстенсивными?
14. Чем достигается разрыв зажигательной бомбы?
15. Какие требования предъявляются к интенсивным авиабомбам.
16. Для чего служат имитационные средства?
17. Как действует имитационный фугас?
ГЛАВА VI
ФЕЙЕРВЕРОЧНЫЕ ИЗДЕЛИЯ
§ 1. ОБЩАЯ ХАРАКТЕРИСТИКА ФЕЙЕРВЕРОЧНЫХ ИЗДЕЛИЙ
Для устройства фейерверков, дающих очень красивые зрелища, применяются разнообразные пиротехнические изделия. Некоторые из предназначенных для военных целей осветительных, сигнальных и имитационных изделий, которые не могут быть по какой-либо причине использованы по назначению, можно применять для фейерверков. Но для получения эффектного зрелища употребляются особые изделия, специально приспособленные для этой цели.
Такие изделия называются ф е й е р в е р о ч н ы м и ф и г у р а м и.
Фейерверочные фигуры, которые употребляются отдельно, независимо друг от друга, называются простыми фигурами. Из них составляются сложные фигуры. Соединение нескольких сложных фигур вместе дает картину, или отделение, фейерверка. Последовательное сожжение нескольких картин дает фейерверк.
Простые фейерверочные фигуры могут быть подразделены на н и з о в ы е, т. е. сгорающие на земле, с р е д н и е, т. е. выбрасывающие вверх помещенные в них изделия, и на в е р х о в ы е, т. е поднимающиеся вверх, в воздух.
Некоторые изделия сжигаются на воде и называются в о д я н ы м и.
Обычно фейерверочные фигуры готовятся незадолго до употребления.
К фейерверочным изделиям предъявляются следующие требования: а) безопасность в обращении и перевозках, б) яркость, красочность и эффектность действия, в) дешевизна и простота изготовления.
§ 2. НИЗОВЫЕ ФЕЙЕРВЕРОЧНЫЕ ФИГУРЫ
Ш л а г и и в ы с т р е л ы. Звуковые эффекты обычно широко используются в фейерверке. Звуки различной силы получаются взрывом различных количеств пороха в замкнутом пространстве — оболочке; такие изделия называются ш л а г а м и и в ы с т р е л а м и.
Для получения шлагов используются прочные картонные гильзы.
В зависимости от калибра гильз можно приготовить изделия, дающие звуки различной силы. Чем больше калибр гильзы, тем больше в нее вмещается пороха и тем сильнее получается звук.
 Шлаги и выстрелы устроены следующим образом. В гильзу длиной в 6 калибров, закрытую с одного конца плотно забитой глухой пробкой на клею, помещена навеска черного пороха, и порох уплотнен до объема, соответствующего по высоте 3 калибрам. Выше него плотно забита пробка со вставленным отрезком стопина, и гильза перетянута так, чтобы свободный конец стопина выходил наружу. Взамен пробок и перетяжек конец гильзы можно наглухо закрыть глиной, а для стопинного провода, проводящего огонь к пороху, сделать отверстие в боковой стенке гильзы, в которое плотно вставить стопин на подмазке.
Шлаги и выстрелы устроены следующим образом. В гильзу длиной в 6 калибров, закрытую с одного конца плотно забитой глухой пробкой на клею, помещена навеска черного пороха, и порох уплотнен до объема, соответствующего по высоте 3 калибрам. Выше него плотно забита пробка со вставленным отрезком стопина, и гильза перетянута так, чтобы свободный конец стопина выходил наружу. Взамен пробок и перетяжек конец гильзы можно наглухо закрыть глиной, а для стопинного провода, проводящего огонь к пороху, сделать отверстие в боковой стенке гильзы, в которое плотно вставить стопин на подмазке.
«М а р с о в о г о н ь» состоит из многих, быстро следующих один за другим выстрелов.
Марсов огонь представляет собой ряд готовых шлагов, прибитых к доске на расстоянии около 20 см один от другого. По середине доски проходит общая нить стопина, к которой присоединены отрезки стопина от каждого шлага. Отрезок общего стопина поджигается с одного конца, и по мере его сгорания загораются отрезки стопина шлагов, давая один за другим выстрелы.
Ф и г у р н ы е с в е ч и — небольшие тонкостенные гильзы, наполненные пламенным составом. Такие свечи употребляются для составления лозунгов, фигур и тому подобных фейерверков.
Фигурные свечи могут быть разных калибров. Мелкие свечи обычно имеют диаметр 2 — 4 мм и став цветного ог- устанавливаются на расстоянии 3—4 см друг от друга; крупные свечи имеют диаметр 6 – 15 мм и устанавливаются на расстоянии 10 – 15 см друг от друга.
Для получения лозунгов или фигур свечи соединяют отрезками стопина, чтобы обеспечить одновременное их зажигание. Все свечи, предназначенные для одной фигуры, должны давать одинаковую продолжительность горения, для чего в свечах при разных составах должно быть определенное количество каждого из них.
Фигурная свеча (рис. 63) —• это тонкостенная гильза, склеенная из писчей бумаги в два-три оборота на крахмальном или декстриновом клейстере, плотно набитая пламенным составом, дающим При горении цветной огонь.
Равномерность наполнения гильзы составом очень влияет на качество свечи (скорость горения, качество пламени и т. п.). С одного конца свечи забито небольшое количество инертного вещества — глины, песка или мела, а с другого конца пламенный состав покрывается слоем воспламенительного состава и легко воспламеняющейся подмазкой. Воспламенение осуществляется с помощью стопина.
.
Б е н г а л ь с к и е о г н и представляют собой цветные пламенные составы, горящие в незапрессованном виде. Они применяются для яркого, кратковременного освещения местности и не требуют никакой последующей обработки состава. Для более длительного освещения из таких же составов приготовляются так называемые фальшфейеры.
 Ф а л ь ш ф е й е р ы — бумажные тонкостенные гильзы, заполненные составом бенгальского огня (рис. 64). Один конец гильзы заполнен негорючим веществом (глина, мел) на высоту около 2 см. К этому концу прикреплена деревянная ручка. Верхний конец гильзы фальшфейера снабжен воспламенительным составом и закрыт картонным кружком.
Ф а л ь ш ф е й е р ы — бумажные тонкостенные гильзы, заполненные составом бенгальского огня (рис. 64). Один конец гильзы заполнен негорючим веществом (глина, мел) на высоту около 2 см. К этому концу прикреплена деревянная ручка. Верхний конец гильзы фальшфейера снабжен воспламенительным составом и закрыт картонным кружком.
Ф о н т а н ы представляют собой толстостенные картонные гильзы, заполненные быстро горящим динамическим составом.
При горении эти составы дают длинную красивую искристую или огненно-искристую ленту, которая взлетает кверху и образует огненный фонтан с рассыпающимися искрами.
 Устройство фонтана показано на рис. 65. Состав помещается в толстостенной картонной гильзе (рис. 66), перетянутой с одного конца, что образует так называемую шейку.
Устройство фонтана показано на рис. 65. Состав помещается в толстостенной картонной гильзе (рис. 66), перетянутой с одного конца, что образует так называемую шейку.
Чтобы во время действия фонтана шейка не прогорела, уменьшив этим эффект действия, она внутри покрывается негорючим веществом. Для этого в гильзу через шейку вставляется стержень, насыпается немного сырой глины, которая уплотняется вручную или на специальном прессе. После этого стержень вынимается, и в глине после подсыхания образуется отверстие, которое не изменяется от огня. Затем гильза заполняется составом, свободный конец ее либо затягивается, либо закрывается наглухо. Противоположный конец гильзы с открытой шейкой обмазан зажигательной подмазкой, и к нему для воспламенения присоединяется огнепровод (стопин или бикфордов шнур и т.п.).
Р и м с к и е с в е ч и представляет собой изделия, из которых при горении вылетают цветные звездки, сопровождаемые выстре-
лами, и появляется пламя, сопровождаемое огненными искрами. Такие свечи очень украшают фейерверк.

 Устройство римской свечи показано на рис. 67. В толстостенную картонную гильзу 7, наглухо закрытую с одного конца слоем глины 2, помещают пороховой заряд 3, затем цветную! звездку о, имеющую в середине сквозной канал, и после нее небольшое количество промежуточного искристого состава 4, горящего медленно. Затем в этой же последовательности снова помещают все указанные вещества и повторяют это несколько раз в зависимости от размеров гильзы. Содержимое гильзы заканчивается искристым составом, поверх которого наносится подмазка. К подмазке присоединяется огнепровод, и гильза закрывается бумажным или картонным кружком.
Устройство римской свечи показано на рис. 67. В толстостенную картонную гильзу 7, наглухо закрытую с одного конца слоем глины 2, помещают пороховой заряд 3, затем цветную! звездку о, имеющую в середине сквозной канал, и после нее небольшое количество промежуточного искристого состава 4, горящего медленно. Затем в этой же последовательности снова помещают все указанные вещества и повторяют это несколько раз в зависимости от размеров гильзы. Содержимое гильзы заканчивается искристым составом, поверх которого наносится подмазка. К подмазке присоединяется огнепровод, и гильза закрывается бумажным или картонным кружком.
Пороховые заряды должны быть рассчитаны так, чтобы звездки не раскалывались и не тухли во время действия свечи. Обычно заряд под верхней звездкой делается наибольшим, а по мере удаления звездок от конца гильзы заряды уменьшаются, так как более удаленная от конца звездка будет дольше подвергаться действию пороховых газов. Верхняя звездка обычно располагается на расстоянии, равном 2 ½ — 3 калибрам, от верхнего конца гильзы; заряд для нее берется по весу равным половине веса этой звездки.
Расчет остальных зарядов Цитович в книге «Опыт рациональной пиротехники» предлагает вести следующим образом.
Приняв вес заряда нижней звездки равным 1/,5 веса верхнего заряда, указанного выше, для расчета остальных зарядов Цитович рекомендует пользоваться таблицей, в которой за единицу измерения принимается вес верхнего заряда.
№ заряда
Относительный вес заряда (за единицу принят вес верхнего заряда)
№ заряда
Относительный вес заряда (за единицу принят вес верхнего заряда)
1 (нижний)
0.07
6
0.31
2
0.08
7
0.42
3
0.11
8
0.57
4
0.15
9
0.76
5
0.22
10
1
Таким образом легко подсчитать вес всех зарядов. Количество искристого состава можно брать равным по весу звездке.
Римские свечи являются изделиями переходного типа от неподвижно горящих к средним изделиям, выбрасывающим в воздух внутреннее снаряжение.
§ 3. СРЕДНИЕ ФЕЙЕРВЕРОЧНЫЕ ФИГУРЫ
Кроме фейерверочных изделий, горящих в неподвижном состоянии, существуют многочисленные изделия, действие которых происходит в воздухе.
К изделиям, выбрасывающим внутреннее снаряжение при помощи порохового заряда, принадлежат бураки, люсткугели и др.
В зависимости от веса заряда и веса изделия можно получить требуемую высоту подъема фигуры.
Б у р а к — прочная гильза, заполненная мелкими пиротехническими изделиями п пороховым зарядом (рис. 68).
 Пороховой заряд 1 располагается в донной части гильзы и отделяется от внутреннего снаряжения картонной прокладкой. Пороховой заряд соединяется с изделиями 3, заполняющими бурак, нитями стопина, которые зажигают изделия при взрыве пороха.
Пороховой заряд 1 располагается в донной части гильзы и отделяется от внутреннего снаряжения картонной прокладкой. Пороховой заряд соединяется с изделиями 3, заполняющими бурак, нитями стопина, которые зажигают изделия при взрыве пороха.
Для воспламенения пороха служит стопиновый провод 2. Бурак выбрасывает одновременно много горящих изделий — звездок. мелких свечей и т. п., образующих красивый огненный дождь.
Л ю с т к у г е л ь — полый картонный шар, заполненный звездками и снабженный пороховым зарядом. Действием порохового заряда шар выбрасывается в воздух. Благодаря замедлителю шар разрывается лишь достигнув высшей точки полета. При разрыве шар дает дождь звездок, горящих цветным огнем.
Обычно такие люсткугели выпускаются из специальной мортирки.
Устройство люсткугеля показано на рис. 69. В шар, сделанный из двух картонных полушарий 1, помещен небольшой заряд пороха, служащий для разрыва шара. Этот разрывной заряд 2 соединен с замедлителем 3 отрезком бикфордова шнура. Внутри шара уложены звездки (или другие мелкие изделия), пересыпанные порохо-
вой мякотью, которая обеспечивает одновременное загорание всех звездок.
Пороховой вышибной заряд 4 помещается в нижней части шара. Вышибной заряд и замедлитель соединены стоповым огнепроводом 6 для одновременного их воспламенения. От этого огнепровода отходит стопиновый провод 5, служащий для воспламенения системы.
§ 4. ВЕРХОВЫЕ ФЕЙЕРВЕРОЧНЫЕ ФИГУРЫ
Из изделий, поднимающихся в воздух давлением газов, которые образуются при горении пиротехнического состава, наибольшего внимания заслуживают ракеты.

 Р а к е т а одно из наиболее красивых фейерверочных изделий. Она взлетает в воздух под действием сил, образующихся при горении состава.
Р а к е т а одно из наиболее красивых фейерверочных изделий. Она взлетает в воздух под действием сил, образующихся при горении состава.
При полете ракета оставляет длинный огненно-искристый след и, достигнув высшей точки подъема, разрывается, давая дождь горящих звездок или выстрел, или то и другое вместе.
Принцип действия ракеты заключается в следующем. Если в сосуд, замкнутый со всех сторон, поместить горящее вещество, при горении которого образуется большое количество газов, то их давление будет распространяться на все стенки сосуда с одинаковой силой. Если сделать сравнительно небольшое отверстие в одной из стенок сосуда, то через него газы будут выходить до тех пор, пока давление внутри сосуда не сравняется с давлением в окружающем его воздушном пространстве-
При этом сосуд будет испытывать давление в направлении, обратном направлению выхода газов из него. Под влиянием этого давления сосуд будет двигаться в направлении, обратном выходу газов. Схематически этот процесс показан на рис. 70.
Обычная фейерверочная ракета представляет собой цилиндрический сосуд, заполненный горючим составом, дающим при горении много газов.
Через отверстие в одном конце сосуда постепенно выходят газы, образуемые составом при горении, а ракета движется в обратном направлении. Устройство ракеты показано на рис. 71. Оболочкой
для состава служит обычно толстостенная скатанная в несколько оборотов картонная гильза 1, перетянутая с одного конца, почему образуется так называемая шейка 2. При изготовлении ракеты шейка насаживается на специальный стержень.
С открытого конца гильза плотно набивается быстро горящим динамическим составом. Если гильза будет набита не плотно, то огонь проникнет внутрь состава, который сгорает слишком быстро,, выделяя сразу так много газов, что гильза не выдержит их давления и порвется. После заполнения составом гильза снимается со стержня. В той части гильзы, где состав набивается со стержнем, внутри: слоя состава образуется свободное пространство, оно обычно называется реактивным каналом 3. Выше стержня состав заполняет гильзу глухим слоем 4. Слой глины 9 предохраняет состав от вышибания во время горения.
Реактивный канал увеличивает поверхность горящего состава в первые мгновения после воспламенения. При этом образуется такое количество газов, которое образует давление, достаточное для подъема ракеты в воздух. Затем уже горит глухой состав, при горении которого развивается очень незначительная подъемная сила, и ракета поднимается с замедлением. После сгорания глухого состава пламя передается в верхнюю часть ракеты, называемую обычно «шатриком» 5, которая заполнена мелкими изделиями 6 (звездками, свечками с искристым составом и т. п.).
Чтобы при полете, ракета не отклонялась в стороны, к ней привязывают особый направляющий деревянный шест — «хвост» 7. Для воспламенения ракеты служит стопин 8.
Контрольные вопросы к главе VI
1. Чем отличаются требования к фейерверочным изделиям от требований предъявляемых к военным пиротехническим изделиям?
2. Какие изделия действуют в неподвижном состоянии?
3. Что такое «марсов огонь»?
4. Как устроены фигурные свечи?
5. В чем заключается принцип действия ракеты?
6. Как устроена ракета?
7. Для чего служат фейерверочные изделие?
ГЛАВА VII
ОСНОВНЫЕ СВЕДЕНИЯ ПО ТЕХНОЛОГИИ ПИРОТЕХНИЧЕСКИХ
СРЕДСТВ
Производство пиротехнических средств представляет собой сложный процесс, который можно разделить на следующие фазы: 1) подготовку компонентов для пиротехнических составов; 2) приготовление составов; 3) прессование составов; 4) подготовку оболочек для объектов и вспомогательные операции; 5) снаряжение объектов; 6) контроль готовой продукции.
Во всех стадиях производства должен быть обеспечен технический контроль всех операций и безопасность работы.
§ 1. ПОДГОТОВКА КОМПОНЕНТОВ ДЛЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Как было указано, составы, применяемые в пиротехнике, являются механическими смесями нескольких компонентов.
Чтобы обеспечить требуемый эффект при горении состава, компонент должен иметь определенную степень измельчения, минимальную влажность и должен быть очищен от примесей и загрязнений.
Особенно важно требование о минимальной влажности компонентов. Влажность замедляет процесс горения состава, вызывает затухание его, понижает температуру горения, так как часть тепла расходуется на переход воды в газообразное состояние. Влажность может вызвать разложение составов при их хранении.
От определенной степени измельчения компонентов зависит определенная скорость горения состава .три определенных условиях и эффект этого горения. Например, крупный порошок алюминия дает значительное искрение, а пыль алюминия резко уменьшает искрение.
Просеивание обеспечивает однородность размеров зерен вещества.
В каждом отдельном случае экспериментально находят наилучшие условия горения состава, в соответствии с которыми и изготовляют нужные компоненты.
Обработка компонентов сводится к трем основным операциям: а) сушке, б) измельчению, в) просеиванию.
Иногда производится специальная обработка материалов, например, воронение металлических опилок, парафинирование магния.
Сушка компонентов
Из компонентов наиболее часто подвергаются сушке окислители (азотнокислый барий, азотнокислый калий и хлорноватокислый калий), горючие (молочный сахар, крахмал, уголь), добавки (щавелевокислые соли натрия и стронция и др.).
Все эти компоненты следует сушить в разных помещениях и обязательно в отдельных аппаратах. Иначе можно загрязнить продукты, и, что особенно важно, пыль горючих может смешатьсч с пылью окислителей, а это может привести к воспламенению смеси.
Такие вещества, как нитраты, большей частью сушатся при 70—80°; органические горючие рекомендуется сушить при 50—60°. Применение вакуума для сушки, т. е. употребление аппаратов, работающих под давлением, более низким, чем атмосферное, позволяет снижать температуру сушки, не задерживая этого процесса.

Сушку компонентов можно производить в различных сушильных аппаратах. Наиболее простое оборудование для сушки — сушильный шкаф периодического действия, в котором материал обогревается горячим воздухом. На полки сушилки устанавливаются противни с высушиваемым материалом.
В крупных производствах, где требуется просушивать большие количества компонентов, можно применять сушильные установки непрерывного действия, например, ленточные сушилки (рис. 72). Внутри прямоугольной камеры движутся одна над другой две бесконечные ленты. Ленты опираются на ряд роликов. В сушилке находится калорифер, обогреваемый паром.
Высушиваемый материал через загрузочную воронку поступает на верхнюю ленту, по ней перемещается на другой конец сушилки и ссыпается на нижнюю ленту, по которой сухой материал подходит к разгрузочному бункеру.
Применение вакуум-сушильного шкафа улучшает условия сушки, снижает ее температуру, но установка вакуум-сушильного агрегата стоит сравнительно дорого. Устройство вакуум-сушильного шкафа
наиболее распространенной системы показано на рис. 73. Высушиваемый материал располагается в противнях на полках. Цилиндрический железный шкаф имеет две выпуклые сферические крышки, из которых одна подвешивается на кронштейне для удобства обслуживания. Внутри шкафа установлены полые плиты, полое пространство каждой плиты на одном конце соединено о коллектором для ввода греющего пара, а на другом — с коллектором для выхода конденсата. Влага, испаряемая материалом, удаляется через конденсационное устройство. Разрежение достигается с помощью вакуум-насоса.
 К о н т р о л ь о п е р а ц и и с у ш к и. Перед направлением компонента на сушку производится анализ его для определения процентного содержания влаги. В продолжение сушки проверяется температура в сушильной установке, которая не должна отклоняться от заданной по технологическому процессу. Перед выгрузкой компонента снова производится анализ содержания влаги. Если продукт высушен до требуемой степени, его выгружают из сушилки.
К о н т р о л ь о п е р а ц и и с у ш к и. Перед направлением компонента на сушку производится анализ его для определения процентного содержания влаги. В продолжение сушки проверяется температура в сушильной установке, которая не должна отклоняться от заданной по технологическому процессу. Перед выгрузкой компонента снова производится анализ содержания влаги. Если продукт высушен до требуемой степени, его выгружают из сушилки.
Измельчение компонентов
Компоненты измельчаются механическим и ручным способами. Наиболее целесообразен и выгоден механический способ. Но иногда для некоторых пиротехнических составов (особенно для вспомогательных) требуется незначительное количество какого-либо компонента, например, для нормального производства какого-либо объекта требуется изготовлять по 1 — 2 кг в час воспламенительного состава, в который входит 10% цементатора. Тогда потребность в этом цементаторе будет 100—200 г в час. В этом случае, конечно, выгоднее ручной способ. Для измельчения малых количеств компонентов служат ступы и растирочные столы. Ступы могут быть медными или чугунными с гладкой внутренней поверхностью. Вещество насыпается в ступу небольшими порциями и измельчается пестами. Смолы перед измельчением рекомендуется охлаждать для придания им хрупкости.
Растирочные столы (рис. 74) изготовляются из дерева. Растираются компоненты специальной растиркой.
Для измельчения больших количеств компонентов в пиротехнических производствах часто применяют шаровые мельницы разных размеров. Главное их преимущество заключается в том, что они
тонко измельчают сухие продукты, как это требуется в пиротехническом производстве.
 Шаровая мельница представляет собой полый вращающийся барабан, внутри которого находятся измельчающие шары вместе с измельчаемым материалом. Размеры шаров и производительность мельниц зависят от их размеров. Материал измельчается ударами падающих при вращении мельницы шаров и истирается между ними и внутренней поверхностью барабана. Шаровые мельницы могут работать периодически и непрерывно. Барабаны их изготовляются из железа, чугуна или дерева.
Шаровая мельница представляет собой полый вращающийся барабан, внутри которого находятся измельчающие шары вместе с измельчаемым материалом. Размеры шаров и производительность мельниц зависят от их размеров. Материал измельчается ударами падающих при вращении мельницы шаров и истирается между ними и внутренней поверхностью барабана. Шаровые мельницы могут работать периодически и непрерывно. Барабаны их изготовляются из железа, чугуна или дерева.
В некоторых случаях, когда измельчаются небольшие количества вещества, барабаны делают из фарфора. Для измельчения чувствительных к механическим воздействиям материалов (например хлората калия) употребляются деревянные барабаны, внутри обитые кожей, а для остальных — железные. Шары изготовляют из

бронзы, стали, твердого дерева или керамики. Обычно вес шаров должен быть одинаковым с весом измельчаемого вещества. Скорость вращения мельницы устанавливается опытным путем; практически мельницы вращаются со скоростью 25 - 30 об/мин. Аппарат приводится в движение электрическим мотором.
На рис. 75 показана чугунная шаровая мельница периодического действия, на рис. 76 — мельница периодического действия
 с деревянным барабаном и на рис. 77 — мельница непрерывного действия. На рис. 78 изображена часть барабана, боковая поверхность которого образуется чугунными плитами 2, находящими одна на другую. В каждой, плите имеются щелеобразные отверстия для прохождения измельченного материала. Сверх чугунных плит закреплены железные рамы, на которые натянуты решета с крупными отверстиями, а сверх решет на деревянных рамах натянуты мелкие сита. Две плиты имеют козырьки 1 для захвата непросеявшегося материала из решета и для подачи его обратно в барабан. Внутри барабана находятся стальные шары и измельчаемый материал. Снаружи барабан одет в железный кожух, сходящий на конус с жолобом для ссыпки готового материала. Для непрерывной равномерной подачи и отвода материала служат разные приспособления: элеваторы, шнеки и т. п.
с деревянным барабаном и на рис. 77 — мельница непрерывного действия. На рис. 78 изображена часть барабана, боковая поверхность которого образуется чугунными плитами 2, находящими одна на другую. В каждой, плите имеются щелеобразные отверстия для прохождения измельченного материала. Сверх чугунных плит закреплены железные рамы, на которые натянуты решета с крупными отверстиями, а сверх решет на деревянных рамах натянуты мелкие сита. Две плиты имеют козырьки 1 для захвата непросеявшегося материала из решета и для подачи его обратно в барабан. Внутри барабана находятся стальные шары и измельчаемый материал. Снаружи барабан одет в железный кожух, сходящий на конус с жолобом для ссыпки готового материала. Для непрерывной равномерной подачи и отвода материала служат разные приспособления: элеваторы, шнеки и т. п.
На рис. 79 изображен загрузочный шнек. В шаровой мельнице описанного типа продукт одновременно измельчается и просеивается, что очень удобно и экономично.

Т е х н и к а б е з о п а с н о с т и п р и р а б о т е н а ш а р о в ы х м е л ь н и ц а х. Для безопасности работы на шаровых мельницах следует размалывать горючие и окислители в различных помещениях. Каждый материал необходимо измельчать совершенно чистой, мельнице.
Нельзя притрагиваться к барабану во время его вращения и открывать люк.
При ручной выгрузке измельченного продукта нужно пользоваться защитными приспособлениями — респираторами или даже

противогазами для защиты дыхательных органов от вредной пыли п резиновыми или кожаными перчатками. На рис. 80 изображен респиратор.
К о н т р о л ь о п е р а ц и и и з м е л ь ч е н и я. Измельченный материал подвергается ситовому анализу в лаборатории для проверки величины зерен.
 Просеивание
Просеивание
Измельченный материал просеивается для получения зерен вещества приблизительно одинаковой величины ручным или механическим способом. Ручной способ просеивания на ручном сите применяется только в тех случаях, когда имеют дело с небольшим количеством материала.
Сетки для сит изготовляются из шелка, металлических нитей пли волэса; нити, составляющие сетку, находятся на определенном расстоянии одна от другой. Количество отверстий между нитями сетки в / линейном сантиметре называется номером сита.
Одна из простых конструкций механических сит изображена на рис. 81. Приводное сито представляет собой деревянный ящик, имеющий внизу форму усеченной пирамиды, с отверстием для ссыпки просеянного материала.
 В ящике устанавливается сито; ему придается небольшой уклон, чтобы непросеянные частицы скатывались вниз к отверстию в стенке ящика. Сито работает приводом от мотора. При вращении вала с кривошипом сито получает поступательно-колебательное движение со скоростью около 250 колебаний в минуту.
В ящике устанавливается сито; ему придается небольшой уклон, чтобы непросеянные частицы скатывались вниз к отверстию в стенке ящика. Сито работает приводом от мотора. При вращении вала с кривошипом сито получает поступательно-колебательное движение со скоростью около 250 колебаний в минуту.
Более сложные конструкции сит дают большую производительность. Например, при большом объеме работ можно использовать вибрационные сита (рис. 82). Колебания этому ситу передаются от вилки, видной на рисунке.
Т е х н и к а б е з о п а с н о с т и п р и р а б о т е н а с и т а х. При просеивании материалов обычно выделяется очень много пыли. Поэтому горючие и окислители следует просеивать в отдельных помещениях.
 Для просеивания каждого материала необходимо употреблять отдельную сетку.
Для просеивания каждого материала необходимо употреблять отдельную сетку.
Помещение, в котором производится просеивание, должно часто и регулярно очищаться от пыли.
К о н т р о л ь о п е р а ц и и п р о с е и в а н и я. При просеивании нужно следить за целостью сетки. Для контроля качества пробу просеянного материала подвергают ситовому анализу; при этом через сито того же номера, что и на просеивающем аппарате, весь материал должен проходить без остатка.
§ 2. ПРИГОТОВЛЕНИЕ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
В пиротехническом составе большинство различных веществ находится в твердом измельченном состоянии. Основной операцией в процессе приготовления состава является смешивание компонентов между собой. Смесь можно считать совершенной, если проба, взятая в любом месте смеси, имеет одинаковые свойства и состав. Совершенную смесь твердых веществ можно получить лишь в приближенной степени, достаточной, однако, для технических целей. При
смешивании происходит перегруппировка мелких частиц веществ; при этом они скользят друг относительно друга, затрудняя достижение совершенной смеси. Прибавлением к твердым смесям некоторого количества жидкости можно увеличить прилипание частиц друг к другу, уменьшив их скольжение, и этим улучшить процесс смешивания.
Смешивание компонентов пиротехнического состава — опасная операция, многие состава во время нее могут воспламениться в результате трения, попадания искры, нечаянного удара и т. п. Поэтому организация технологического процесса приготовления состава должна предусматривать меры обеспечения безопасности.
С м е ш и в а н и е к о м п о н е н т о в можно вести ручным или механическим способами.
Ручной способ заключается в перемешивании руками небольших отвешенных порций компонентов состава. Можно перемешивать смесь сухих компонентов или увлажнять их лаком, спиртом, бензином и т. п. При таком увлажнении уменьшается пылеобразование. Для защиты от возможного при смешивании воспламенения состава рабочий отделен от смешиваемой массы высоким металлическим щитом, в котором сделаны отверстия для рук и смотровое стекло.
Ручной способ смешивания имеет ряд недостатков. Важнейшими являются следующие: неравномерность перемешивания отдельных порций; малая производительность труда; опасность работы.
При механическом способе смешивания отдельные порции состава перемешиваются в одинаковой степени, и получается равномерная смесь. Этот способ значительно безопаснее ручного. Смеситель устанавливается в отдельной комнате-кабине, и пусковое приспособление выводится за ее пределы. Рабочий не входит во время работы смесителя в кабину. В крупных производствах можно использовать смесители непрерывного действия.
 Для смешивания сухих компонентов применяются смесевые барабаны. Это — аппараты, аналогичные по устройству барабанам шаровых мельниц. На внутренней поверхности стенок укреплен ряд наклонно поставленных полок. При вращении барабана эти полки захватывают материал, который пересыпается с каждой полки на расположенные ниже, что улучшает перемешивание. Автоматический смесевой барабан изображен на рис. 83 и 84.
Для смешивания сухих компонентов применяются смесевые барабаны. Это — аппараты, аналогичные по устройству барабанам шаровых мельниц. На внутренней поверхности стенок укреплен ряд наклонно поставленных полок. При вращении барабана эти полки захватывают материал, который пересыпается с каждой полки на расположенные ниже, что улучшает перемешивание. Автоматический смесевой барабан изображен на рис. 83 и 84.
 Загружаются и выгружаются компоненты в этом барабане через отверстие и передней стенке при помощи шнека. При вращении его в одну сторону компоненты вводятся внутрь барабана, а при вращении в другую сторону готовая смесь выгружается.
Загружаются и выгружаются компоненты в этом барабане через отверстие и передней стенке при помощи шнека. При вращении его в одну сторону компоненты вводятся внутрь барабана, а при вращении в другую сторону готовая смесь выгружается.
Внутри барабана на боковых стенках расположены косые перегородки 1. идущие по спирали, а вдоль барабана, внутри его. проходят четыре полки, тоже с перегородками 2. Эти устройства улучшают измельчение. Аппарат работает периодически.
Для увлажненных составов рекомендуются различные смесители, специально приспособленные для пластичных и полусухих ве-
ществ, например смеситель периодического действия конструкции Вернера — Пфлейдерера (рис. 85 и 86).
 Мешалка (рис. 86) представляет собой корытообразный сосуд b с двумя лопастями а1, а2 винтовой формы, вращающимися во встречных направлениях. Смешанный состав выгружается опрокидыванием корыта вокруг вращающейся оси с, расположенной на раме d. Разгрузочное положение показано на рисунке пунктиром.
Мешалка (рис. 86) представляет собой корытообразный сосуд b с двумя лопастями а1, а2 винтовой формы, вращающимися во встречных направлениях. Смешанный состав выгружается опрокидыванием корыта вокруг вращающейся оси с, расположенной на раме d. Разгрузочное положение показано на рисунке пунктиром.
При большом объеме работ можно применять смеситель непрерывного действия, например, лопастную мешалку системы Коста и Геислера (рис. 87).
Благодаря форме и положению лопастей а и b с прорезами смешиваемые материалы движутся в различных направлениях и хорошо перемешиваются.

Постепенно смесь продвигается вдоль смесителя и выгружается готовой. Введение компонентов в смеситель производится шнеками. Жидкий компонент (лак или растворитель) может поступать постепенно из напорного бачка, а также вбрызгиваться форсункой или пульверизатором.
Т е х н и к а б е з о п а с н о с т и п р и с м е ш е н и и. Для предупреждения воспламенения состава необходимо строго придерживаться следующих основных правил:
1) не допускать загрязнения компонентов;
2) части аппаратуры, соприкасающиеся с компонентами п готовым составом, п инструменты должны изготовляться из материалов, не дающих искрения, — из алюминия, бронзы, резины и др.;
3) работать только на исправных аппаратах;
4) не допускать скопления пыли компонентов;
5) избегать ударов, толчков, трения и прочих механических воздействий на смеси и готовые составы;
6) точно придерживаться указанной технологическим процессом рецептуры состава;
7) при ручном способе смешения работать, только защищаясь щитом;
8) при механическом способе смешения не входить в помещение при пуске, в момент остановки и во время работы смесителя;
9) носить предусмотренную спецодежду;
10) не допускать накопления на рабочем месте составов и компонентов сверх установленных норм.
К о н т р о л ь о п е р а ц и и с м е ш е н и я. Готовый состав анализируется для определения в нем процентного содержания компонентов. Если данные анализа соответствуют исходному рецепту состава, то смешение прошло хорошо.
Состав, смешиваемый в сухом виде, после смешения обычно подается на дальнейшие производственные операции. Влажные составы в случае надобности просушиваются до требуемой степени. Сушка составов производится в специальном помещении и аппаратуре при 30—40°.
§ 3. ПРЕССОВАНИЕ
Составы прессуют для придания им определенной формы и плотности. Прессование представляет собой процесс, использующий давление для деформации материалов. Для прессования служат механизмы, называемые прессами. Состав насыпается в специальный прессовочный инструмент и уплотняется давлением пресса на пуансон до требуемого объема. Для прессования пиротехнических изделий могут применяться механические или гидравлические прессы.
Механические прессы различных конструкций можно применять при изготовлении очень большого количества изделий.
Механические прессы характеризуются неравномерным движением бойка, гидравлические — равномерным. Для эксплуатации удобны гидравлические прессы, которые не передают напряжения за пределы конструкции, не требуют особых фундаментов; давление можно подавать плавно, что очень важно для прессования чувствительных к удару пиротехнических составов. К недостаткам гидравлических прессов следует отнести громоздкость установки и сравнительно малую производительность.
На рис. 88 показан гидравлический пресс, а на рис. 89 — схема его устройства.
Пресс имеет рабочий цилиндр А, в котором ходит плунжер, снабженный на верхнем конце подвижной прессовой плитой С; на плиту устанавливается прессуемый предмет. Впускаемая в цилиндр А жидкость (вода или масло) под давлением заставляет плунжер подниматься вверх, прижимая прессуемый предмет к верхней неподвижной раме Е. Эта рама опирается на четыре стальных колонны F,
установленные на нижней раме, в которой помещен цилиндр А. При выпуске воды из цилиндра плунжер и прессовая плита опускаются вниз под действием собственного веса.
 В некоторых конструкциях гидравлических прессов прессовая плита совершает движение в обратном направлении, т. е. сверху вниз, нажимая на прессуемый предмет, расположенный на нижней неподвижной плите.
В некоторых конструкциях гидравлических прессов прессовая плита совершает движение в обратном направлении, т. е. сверху вниз, нажимая на прессуемый предмет, расположенный на нижней неподвижной плите.
Жидкость, например вода, в пресс подается специальными насосами. Для изменения скорости движения плунжера необходимо удалять излишки подаваемой насосом воды или менять скорость работы насоса. Для этого между насосом и прессом устанавливается гидравлический аккумулятор; он удерживает запас воды под давлением в те периоды, когда пресс расходует ее меньше, чем подает насос. В моменты большой нагрузки аккумулятор отдает воду. Часто применяются грузовые гидравлические аккумуляторы, которые состоят из гидравлического цилиндра с постоянным грузом.
 Прессовочный инструмент состоит обычно из нескольких частей. Для насыпки составов служит матрица; это — прочный стальной цилиндр со сквозным внутренним каналом. Канал имеет такую форму, какую следует придать прессуемому изделию. Дном матрицы служит специальная подставка — поддон. Перед прессованием матрицу устанавливают на поддон, в канал ее насыпают порцию состава и вставляют специальный стержень — пуансон, с помощью которого состав уплотняется при прессовании. Вся сборка устанавливается под пресс. Давление пресса через пуансон передается составу, сжимая его до требуемой степени. Давление гидравлического пресса наблюдается с помощью манометра. Запрессованное изделие выталкивается из матрицы через ее нижнее отверстие.
Прессовочный инструмент состоит обычно из нескольких частей. Для насыпки составов служит матрица; это — прочный стальной цилиндр со сквозным внутренним каналом. Канал имеет такую форму, какую следует придать прессуемому изделию. Дном матрицы служит специальная подставка — поддон. Перед прессованием матрицу устанавливают на поддон, в канал ее насыпают порцию состава и вставляют специальный стержень — пуансон, с помощью которого состав уплотняется при прессовании. Вся сборка устанавливается под пресс. Давление пресса через пуансон передается составу, сжимая его до требуемой степени. Давление гидравлического пресса наблюдается с помощью манометра. Запрессованное изделие выталкивается из матрицы через ее нижнее отверстие.
Контроль операции прессования. При прессовании пиротехнических изделий весьма важно точно соблюдать указанное в технологическом процессе давление. Превышение давления может вызвать вспышку состава при прессовании, уменьшение скорости горения его (увеличение плотности) или отказ при вослламе-
нении. При недостаточном давлении получаются непрочные изделия, изделия со слишком большой скоростью горения, иногда с неравномерностью горения и т. п. За величиной давления следует наблюдать по манометру.
Готовые запрессованные изделия подвергаются наружному осмотру для выявления трещин и пр. Изделия проверяются также испытанием в действии.
Т е х н и к а б е з о п а с н о с т и п р и п р е с с о в а н и и. При прессовании пиротехнических составов рабочие не должны находиться около пресса. В момент прессования или выталкивания готового изделия из матрицы состав может воспламениться. Если при горении состава образуется много газов, то воспламенение может сопровождаться взрывом, и осколки инструмента могут нанести тяжелые ранения. Пресс необходимо устанавливать в отдельной кабине или за надежными щитами; управление прессом выносится за пределы кабины или щита.
§ 4. ПОДГОТОВКА ОБОЛОЧЕК ДЛЯ ОБЪЕКТОВ И ВСПОМОГАТЕЛЬНЫЕ
ОПЕРАЦИИ
Многообразие конструкций пиротехнических изделий не позволяет дать перечень вспомогательных и подготовительных работ: в каждом отдельном случае используются наиболее удобные практические способы и средства.
Большинство изделий имеет картонные пли металлические оболочки; снаряды имеют стальные корпусы, фейерверочные изделия большей частью снаряжаются в картонные гильзы. Металл для оболочек очищают от ржавчины на механических станках с помощью керосина, бензина пли спирта. Для защиты металла от коррозии при соприкосновении с составами внутреннюю поверхность снарядов покрывают изолирующим лаком. Лакировку производят пульверизатором или вручную кистью.
Картонные оболочки могут изготовляться на картонажных производствах. В небольших пиротехнических мастерских картонные гильзы для фейерверочных фигур изготовляют на ручных катальных станках.
К вспомогательным операциям относятся шитье тканевых мешочков для пороховых зарядов, катка бумажных трубок для запальных - проводов и замедлителей, приготовление тестообразной воспламенительной подмазки и др. При больших масштабах производства отдельные операции механизируются. В небольших производствах большинство вспомогательных операций, особенно безопасных и нетрудоемких, можно выполнять ручным способом.
§ 5. СНАРЯЖЕНИЕ ОБЪЕКТОВ
Под снаряжением объекта понимают цикл производственных операций, при которых все детали изделия соединяются, образуя объект, обладающий требуемыми свойствами. В современных производствах процесс снаряжения разделяется на ряд' отдельных операций. Изготовление каждого пиротехнического изделия имеет
свои определенные операции снаряжения в зависимости от устройства изделия. Большинство операций механизируется.
Если имеется много последовательных операций, иногда целесообразно устанавливать конвейер.
Снаряженный объект подвергается окончательной отделке. Наружная поверхность изделия покрывается краской, лаком или парафинируется; во многих случаях производится несколько покрытий: изделия с картонной оболочкой часто окрашивают, а затем парафинируют. Окраска является отличительным признаком данного изделия и украшает его, а парафин предохраняет внутреннее снаряжение от влаги. Корпуса снарядов окрашиваются, отдельные части их лакируются для защиты от коррозии. Окраска наносится пли вручную кистью, или на различных станках, или пульверизацией. Для иарафинироваппя изделие опускается в расплавленный парафин, и после остывания на поверхности изделия остается слой парафина.
§ 6. КОНТРОЛЬ ГОТОВОЙ ПРОДУКЦИИ
Партии готовых изделий тщательно проверяют, чтобы избежать выпуска брака.
Выпуск изделий военной пиротехники с браком может повлечь за собой порчу оружия, из которого производится отстрел, перепутывание сигналов, отказы в действии объектов, опасность в обращении.
Недоброкачественные изделия мирной пиротехники могут вызвать отказы в действии, опасность при обращении с ними и во время действия фейерверка могут не дать нужного эффекта.
От каждой партии изготовленных пиротехнических изделий берется определенное количество их для проверки качества. Часть взятой пробы подвергается испытанию в действии, например, если изделие предназначено для отстрела, то эти опытные образцы отстреливаются в соответствующих условиях. При этом проверяется продолжительность их действия; для сигналов —высота подъема в воздухе, различимость с определенных расстояний и др.
Кроме испытания в действии проверяется правильность изготовления объекта. Для этого готовое изделие вскрывается и все его составные части сверяются с соответствующим технически обоснованным описанием процесса его производства.
Пиротехнические изделия при перевозке могут подвергаться всякого рода механическим воздействиям — встряхиванию, толчкам, ударам и т. п. Чтобы при этом изделия не попортились пли чтобы не произошло несчастных случаев, воспламенений, взрывов и т. п., изделие должно быть хорошо упаковано. Готовая продукция, несмотря на проверку качества упаковки, подвергается особому испытанию, называемому тряско и. Это испытание производится на специальном приборе (рис. 90) следующим образом.
На столе или специальной подставке 1 укреплен маховик 2 с двумя кулачками 3. Кулачки вращаются вместе с маховиком, приводимым во вращательное движение мотором. Кулачки заставляют подни-
маться на определенную высоту один конец доски 4, другой конец которой прикреплен к столу 1 шарниром 5. После подъема на указанную высоту доска падает обратно, затем снова повторяется подъем и т. д. На поднимающемся конце доски неподвижно укреплен ящик 6, в который устанавливается коробка с пиротехническими изделиями.
 Изделия таким путем подвергают встряхиваниям и ударам в течение нескольких минут, причем изделия не должны воспламеняться. Тряска не должна также нарушать правильности снаряжения и действия изделий.
Изделия таким путем подвергают встряхиваниям и ударам в течение нескольких минут, причем изделия не должны воспламеняться. Тряска не должна также нарушать правильности снаряжения и действия изделий.
Обычно при испытаниях изделий маховик прибора делает 30 об/мин., т. е. 60 ударов; высота подъема и падения доски 15 см.
После окончания испытания тряской изделия осматривают и проверяют в условиях их дальнейшего применения.
Техника безопасности при операциях снаряжения. Все рабочие места должны быть расположены таким образом, чтобы между ними были свободные проходы. Операции, могущие вызвать вспышку или взрыв, следует производить н отдельных кабинах или защитами. В рабочем помещении нельзя допускать ударов, резких толчков (которые могут вызывать падение продукции с рабочих столон), перемещения по полу тяжелых предметов.
Изделия по мере изготовления необходимо удалять из рабочего помещения. Готовая продукция должна храниться в специальных изолированных помещениях.
§ 7 ОБЩИЕ ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ НА ПИРОТЕХНИЧЕСКИХ ПРОИЗВОДСТВАХ
Все работы с пиротехническими составами и изделиями очень опасны, так как легко может возникнуть взрыв, вспышка или пожар. Поэтому необходимо строго соблюдать правила техники безопасности, которые обеспечивают безаварийность работ.
Как было указано, чувствительность различных веществ изменяется в зависимости от различных условий. В условиях производства следует принять все меры, чтобы устранить причины, повышающие чувствительность составов и вызывающие взрыв или вспышку.
Первым условием нормальной работы является тщательное изучение свойств тех веществ, с которыми приходится работать. Осно-
вываясь на этих свойствах, необходимо выработать правила для работы с каждым веществом.
Но для всех пиротехнических составов существуют общие правила, строго соблюдать которые обязаны все работающие.
Все опасные работы должны производиться в небольших помещениях с комнатами-кабинами, отдельными для каждой опасной операции.
В случае вспышки огонь из одной кабины не проникнет в соседние, и масштаб аварии будет сравнительно небольшим.
При ручном смешивании составов, чувствительных к механическим воздействиям, посуда со смешиваемыми компонентами устанавливается за прочным металлическим щитом, имеющим смотровые стекла и прорезы для рук, а работающий помещается по другую сторону щита.
Порция смешиваемых компонентов ни в коем случае не должна превышать установленной нормы.
В кабинах для смешения составов не должны находиться лишние предметы; стены, потолок и пол должны быть гладкими, без щелей и легко поддаваться обмыванию (лучше всего пол покрывать линолеумом).
Пыль от составов, оседающую на поверхности всех предметов, находящихся в кабине, необходимо систематически вытирать тряпками, смоченными водой или спиртом. Полное соблюдение чистоты в рабочих помещениях сп)собствует безопасности работы.
Во время работы в кабине не должны .находиться посторонние лица. Вход в нее разрешается лишь лицам, непосредственно выполняющим там работу. Двери в кабинах должны быть открытыми, чтобы в случае вспышки рабочий мог немедленно выйти в коридор и захлопнуть дверь за собой для локализации пожара.
Мощным средством для безопасности всех работ служит механизация операций, например, смешение компонентов в смесевых барабанах или других механических смесителях; при ней опасность для работающих значительно уменьшается. Аппарат находится в отдельной закрытой кабине, и во время работы обслуживающий рабочий находится вне кабины. Приспособление для пуска и остановки аппарата также должно помещаться вне кабины.
Работающие должны работать обязательно в спецодежде, покрывая голову, иначе пыль от составов может загореться на одежде или на волосах человека после ухода его с производства, например. дома у печи, и причинить ожоги.
Рабочие должны носить обувь с мягкими или резиновыми подошвами, чтобы подошвы не производили сильного трения о пол.
Особую опасность вызывает обувь, подбитая железными гвоздями, которые могут дать искру от трения по каменному полу п воспламенить осевшую на нем пыль или просыпанный состав.
Опасными операциями являются также сушка, прессование, набивка составов и т. п. При всех этих операциях составы подвергаются тепловым или механическим воздействиям, что может вызвать их вспышку.
Поэтому при всех таких работах рабочие должны быть отделены от обрабатываемого состава щитами, если работа производится не механическим способом в закрытых кабинах с приспособлением для пуска аппарата снаружи.
Во всех мастерских должна бесперебойно работать вентиляция.
§ 8. ХРАНЕНИЕ ПИРОТЕХНИЧЕСКИХ СРЕДСТВ И УНИЧТОЖЕНИЕ ОСТАТКОВ И БРАКА
Необходимо принимать меры предосторожности, чтобы не случилось аварий во время хранения взрывоопасных и пожароопасных веществ.
Устройство складов и других хранилищ пиротехнических средств должно полностью обеспечивать безопасность их хранения. Различные вещества должны храниться в отдельных помещениях. Ни в коем случае нельзя хранить пиротехнические средства вместе с инициирующими или бризантными взрывчатыми веществами.
Здания складов строятся из бетона, кирпича или камня; обычно они окружаются земляными валами для предохранения от разрушения соседних строений в случае взрыва.
Иногда склады для пиротехнических средств делаются в специальных погребах. Такие помещения должны освещаться снаружи (электрические лампы у окон с наружной стороны здания).
Наблюдение за хранением пиротехнических средств, за состоянием складов, чистотой в них и правильностью выдачи, приема п распределения огнеопасных продуктов должны осуществлять технически грамотные, ответственные лица.
В помещении склада нельзя допускать работ, связанных с сильным трением, ударами, так как могут образоваться искры, которые вызовут пожар.
Хранить взрывчатые вещества в производственных помещениях категорически воспрещается. Для хранения текущих запасов пиротехнических средств, требуемых для работы одной-двух смен, должны быть выделены специальные комнаты или кабины в производственном здании. 1
Наблюдать за такой кабиной должно ответственное лицо. На всех сосудах с составами должны быть надписи, указывающие название находящегося в них вещества.
Запас готовых составов, поступающих на дальнейшую обработку, и изделия, находящиеся в разных стадиях работы, необходимо хранить раздельно.
У рабочих мест пли в рабочем помещении нельзя допускать скопления готовой продукции или полуфабрикатов.
Бракованные изделия, остатки взрывчатых веществ и составов уничтожают, сжигая их на специальных площадках с соблюдением мер предосторожности: поджигать их нужно при помощи отрезка бикфордова шнура, чтобы поджигающий мог до начала горения отойти на безопасное расстояние.
Некоторые пиротехнические составы, содержащие водорастворимые соли, например селитру, можно разлагать водой. В этом случае необходимо предварительно проверить остатки, чтобы установить, нет ли в них металлов; при наличии металлов в составах разлагать их водой нельзя, а следует сжигать.
Контрольные вопросы к главе VII
1. Какие стадии производства проходит пиротехническое изделие?
2. Для чего измельчаются компоненты составов?
3. Как работают шаровые мельницы?
4. В чем преимущества механического способа мешки?
5. Каким контрольным испытаниям подвергаются готовые изделия?
6. В чем заключаются опасности пиротехнического производства?
7. Какие работы в пиротехническом производстве наиболее опасны?
8. Что защищает производственное здание от разрушения в случае взрыва в соседнем здании?
9. Что такое кабина н для чего она служит?
10. Какой способ производства обеспечивает наибольшую безопасность для рабочих?
11. Для чего применяются защитные щиты и как они устроены?
12. Перечислить основные правила хранения пиротехнических средств.
13. Почему на складах запрещается вскрывать ящики и производить другие подсобные работы?
ЛИТЕРАТУРА
1. Р у м п ф, Зажигательные бомбы, BXHИИ, 1935.
2. Ч е р в я к о в. Осветительные снаряды, «Техника и вооружение», Госвоениздат, № 8, 1938.
3. Д е м и д о в, Образование пиротехнических составов, Техпрол ВХНИИ на правах рукописи), 1934.
4. Ленце, Чувствительность пиротехнических составов. Сборник «Пиротехния», № 1.
5. Ш и д л о в с к и й и Ж и р о в, Пиротехния (на правах рукописи), Техпроп ВХНИИ, 1935.
6. С о к о л о в, Курс теории взрывчатых веществ, ОНТП, 1937.
7. К а с т и М е ц, Химическое исследование взрывчатых веществ Госхимтехиздат, 1931.
8. С о л о д о в н и к о в, Пиротехника, Оборонгиз, 1938.
9. Д ы м ч и ш и н, Производство бариевых солей, ГОНТП, 1938.
10. К а р п о в, Капсюльное дело, Госхимтехиздат, 1934.
11. «П и р о т е х н и я». № 1. 2, 3, 4. Техпроп ВХНПП.
12. Л а н г е, Фотоэлемент в науке и технике, Гостехтеоретиздат. 1У32.
13. X а л ф и н, Фотоэлементы и их применение в технике, Госрадиоиздат, 1936.
14. Г р и м з е л ь, Курс физики, ОНТИ, 1938.
15. В е й ц е р и .Л у ч и н с к и п. Химия н физика маскирующих дымов, Оборонгиз, 1938.
16. Я н к о в с к и и Дымы н туманы, Техническая энциклопедия, г. VII.
17. Г и б б с, Аэрозоли, НXTИ, 1929.
18. Причины маскирующего действия дымов н туманов, «Техника н вооружение», № 9, 1937
19. Б а д а е в, Боевые ОВ и основы защиты от них, OНTИ, 1938.
20. Ц и т о в и ч, Опыт рациональной пиротехники, тип Артжурнала, 1894.
21. П е т р о в, Общедоступная пиротехния, изд. кооп. артели «Печатня», 1927.
22. С т е п а н о в, Курс фейерверочного искусства.
23. Артиллерийское управление РККА. Описание устройства и способы применения пиротехнических средств, НКО, 1936, 1937.
24. Г л о б у с, Артиллерийские снаряды, Артакадемия РККА, 1934.
25. У с т ю г о в и Р а й с к и й, Светотехника на воздушном транспорте, стр. 429—434, ОНТИ, 1935.
26. Б а д а е в, Аэрозоли, ЛХТИ.
27 Н и к о л а е в, Пиротехник-любитель, 1896.
28. К а с а т к и н, Основные процессы и аппараты химической технологии, ГОНТИ, 1938.
29. Э и к е н, Электрические нмагнитные способы разделения материалов (смешение). ДНТУ. 1938.
30. Измельчение и перемешивание твердых материалов в органической химической промышленности, под ред. Воронцова, ГОНТИ, 1935.
31. Ч е р в я к о в, Специальные снаряды, «Техника н вооружение», № 10, 1938.
32. М а т ю ш и н. «Техника и вооружение» № 3, стр. 59, 1936.
33. Ч е р н о з у б о в. О патронах с пулями специального назначения, ''Техника и вооружение», № 11. 1937.
34. Б о р и с о в, Некоторые новинки стрелкового вооружения, «Техника и вооружение), № 8, 1937.
33. Осветительные пиротехнические средства, «Техника и вооружение» № 1, 1935.
О Г Л А В Л Е Н И Е
Стр.
Глава I
Введение
§ 1. Основные понятия
3
§ 2.. Краткие исторические сведения
-
§ 3. Современное состояние пиротехники
5
§ 4. Классификация пиротехнических изделий
6
Глава II
Основы теории пиротехники
§ 1. Общие сведения о пиротехнических составах
7
§ 2. Реакции горения
8
§ 3. Составление основных пиротехнических смесей
-
§ 4. Образование пиротехнических составов
10
§ 5. Начальный импульс и воспламенение пиротехнических составов
12
§ 6. Чувствительность пиротехнических составов
13
§ 7. Скорость горения пиротехнических составов
16
§ 8. Изучение продуктов горения пиротехнических составов
17
§ 9. Тепловой эффект горения пиротехнических составов
19
§ 10. Стойкость пиротехнических составов.
23
§ 11. Взрывчатые свойства пиротехнических составов
-
§ 12. Классификация пиротехнических составов
24
Контрольные вопросы к главе II
25
Глава III
Сырье и вспомогательные материалы для производства пиротехнических изделий
§ 1. Общие требования к сырью
26
§ 2. Окислители
-
§ 3. Горючие и цементирующие вещества
33
§ 4. Цветнопламенные добавки
43
§ 5. Красители дымов
46
§ 6. Вспомогательные материалы и полуфабрикаты
47
Контрольные вопросы к главе III
51
Глава IV
Пиротехнические составы
§ 1. Классификация составов
53
§ 2. Общие сведения о свойствах пламенных составов
-
§ 3. Осветительные составы
54
§ 4. Сигнальные составы ночного действия
61
§ 5. Трассирующие составы
67
§ 6. Зажигательные составы
68
§ 7. Дымовые составы
72
§ 8. Маскирующие дымы
76
§ 9. Сигнальные дымовые составы
77
§ 10. Фейерверочные составы
81
§ 11.Вспомогательные воспламенительные составы
84
Контрольные вопросы к главе IV
-
Глава V
Устройство и действие пиротехнических средств для военных целей
§ 1. Осветительные средства
86
§ 2. Зажигательные средства
99
§ 3. Трассирующие средства
105
§ 4. Сигнальные средства
109
§ 5. Имитационные средства
118
Контрольные вопросы к главе V
120
Глава VI
Фейерверочные изделия
§ 1. Общая характеристика фейерверочных изделий
121
§ 2. Низовые фейерверочные фигуры
-
§ 3. Средние фейерверочные фигуры
125
§ 4. Верховые фейерверочные фигуры
126
Контрольные вопросы к главе VI
127
Глава VII
Основные сведения по технологии пиротехнических средств
§ 1. Подготовка компонентов для пиротехнических составов
128
§ 2. Приготовление пиротехнических составов
134
§ 3. Прессование
138
§ 4. Подготовка оболочек для объектов и вспомогательные операции
140
§ 5. Снаряжение объектов
-
§ 6. Контроль готовой продукции
141
§ 7. Общие правила техники безопасности при работе на пиротехнических производствах
142
§ 8. Хранение пиротехнических средств и уничтожение остатков и брака
144
Контрольные вопросы к главе VII
145
Литература
145
Заметки
[
←1
]
1 Солодовников