

Л. И. Пономарев
Под знаком кванта
ИЗДАНИЕ ВТОРОЕ, ИСПРАВЛЕННОЕ И ДОПОЛНЕННОЕ

МОСКВА «НАУКА»
ГЛАВНАЯ РЕДАКЦИЯ
ФИЗИКО-МАТЕМАТИЧЕСКОЙ ЛИТЕРАТУРЫ
ББК 22.314
П56
УДК 530.145(023)
Рецензент
член-корреспондент АН СССР
И. И. Гуревич
Пономарев Л. И.
П56 Под знаком кванта.—2-е изд., испр. и доп.— М.: Наука. Гл. ред. физ.-мат. лит., 1989.— 368 с.: ил.
ISBN 5-02-014049-Х
Квантовая физика — самое выдающееся открытие XX века. Практически ни одно глубокое явление природы невозможно понять и объяснить без квантовых идей. Цель книги — познакомить читателя-неспециалиста с основными фактами квантовой физики и историей их открытия. Ярко и образно, достаточно строго, но вполне доступно автор рассказывает об эволюции идей и понятий современной физики. Предыдущее издание (М.: Сов. Россия, 1984) удостоено Диплома первой степени на Всесоюзном конкурсе общества «Знание».
Для старшеклассников; учителей, студентов и всех, кого интересуют основы науки.
1604030000-131
053(02)-89
93-89
ББК 22.314
© Издательство «Советская Россия»,
1984
© Издательство «Наука».
ISBN 5-02-014049-Х
Главная редакция физико-математической литературы, 1989, с изменениями
— Этот мир странно устроен...
— По сравнению с чем?
ОТ АВТОРА
«Настоящее колдовское исчисление»,— писал о квантовой механике Альберт Эйнштейн своему другу Мишелю Бессо в декабре 1925 г.: в то время даже для него новая механика казалась слишком сложной. Сейчас хороший студент-физик знает о квантах больше, чем все великие ученые начала века: квантовая физика стала привычной. Но она йе стала от этого менее удивительной, и каждое новое поколение исследователей отдает ей свою дань восхищения.
Квантовая физика родилась в короткий период между двумя мировыми войнами. С тех пор она изменила жизнь цивилизованных народов больше, чем любое из прежних открытий, но даже образованные люди знают о ней незаслуженно мало. Типичные представления о квантовой физике напоминают отчасти донаучное отношение человека к молнии и грому: он не понимал их природы и потому — боялся. Для многих наука об атомах и квантах навсегда присыпана пеплом атомного взрыва, а «физик-атомщик» — чем-то сродни злому волшебнику. Все это несправедливо и достойно сожаления, ибо такое предвзятое отношение мешает понять главное: квантовая физика — не просто еще одна из бесчисленных ныне наук. Это именно та наука, которая стала основой технотронной эры, привела к пересмотру философии знания, повлияла на политику целых государств. По праву науку о квантах можно сравнить лишь с такими взлетами мысли, как система Коперника, законы Ньютона, учение об электричестве. Все они стали теперь достоянием общечеловеческой культуры, и каждому современнику необходимо иметь о них хотя бы простейшие представления.
Но дело даже не в пользе или необходимости: квантовая физика — это интересно. Интересно — в самом точном смысле этого слова,— и столь же увлекательно. Именно внутренняя логика и красота учения о квантах стали побудительной причиной появления этой книги. Ее основное содержание — эволюция идей и понятий квантовой физики. Я буду считать свою работу не напрасной, если читатель поймет необходимость этого странного мира, почувствует неизбежность его квантовых химер и, наконец, примет их и признает естественными.

«Каждый школьник знаком теперь с истинами, за которые Архимед отдал бы жизнь.»
Эрнест Ренан
«Ощущение тайны — наиболее прекрасное из доступных нам переживаний. Именно это чувство стоит у колыбели истинного искусства и настоящей науки.»
Альберт Эйнштейн
Истоки
ГЛАВА 1
Атомы. Волны. Кванты.
Вокруг кванта
ГЛАВА 2
Спектры. Ионы. Лучистая материя. Атомы, электроны, волны.
Вокруг кванта
ГЛ АВ а з
Планетарный атом. Спектральные серии. Фотоны. Победа атомистики.
Вокруг кванта
ГЛАВА 4
До Бора. Атом Бора. После Бора. Формальная модель атома.
Вокруг кванта
ГЛАВА 5
Учения древних. Первые попытки. Элементы и атомы. Таблица элементов. Периодический закон.
Вокруг кванта
ГЛАВА 1
Жиг-гуаша
Квантовая физика — это наука о строении и свойствах квантовых объектов и явлений.
В этом определении все верно, и тем не менее бесполезность его очевидна до тех пор, пока мы не объяснили, что означают сочетания слов «квантовое явление» и «квантовый объект».
Слово
quant — квант отсутствует во всех словарях прошлого века: оно появилось лишь в начале нашего, XX века. До этого повсеместно знали слово «quantum», которое означает: «сколько», «количество», «доля», «часть», «порция». Если поставить его рядом со словами «объект» и «явление», то получится «количественное явление» или «порционный объект» — в общем, нечто несуразное, если все это понимать буквально.
Каждый, кто изучал иностранные языки, легко поймет причину такой несуразицы: словосочетания «квантовое явление», «квантовый объект», равно как и «квантовая физика»,— это идиоматические обороты, которые нельзя переводить дословно. Чтобы понять их истинный смысл, необходимо предварительно познакомиться с обычаями и культурой страны, в которой они родились.
Квантовая физика — обширная страна с богатой и глубокой культурой. Если вы знаете о ней только то, что она «...разрешила вековую загадку таинственной страны микромира», а также «перевернула все наше мировоззрение», то вам известно о ней примерно столько же, сколько туристам о незнакомой стране, культуры которой они не знают, а языка — не понимают: их память сохранит лишь яркие пятна реклам на незнакомом языке.
Язык квантовой физики своеобразен, но, в сущности, ничем не отличается от любого иностранного. Как и всякий язык, его нельзя усвоить единым усилием воли — нужна система. Для начала надо просто запомнить несколько ходовых слов и пытаться строить из них простые фразы, не очень заботясь о строгости грамматических конструкций. Лишь впоследствии придут та легкость и уверенность владения новым языком, которые приносят с собой удовлетворение и радость чистого знания.
Чтобы привыкнуть к языку и логике квантовой физики, необходимо освоить предварительно несколько понятий, на первый взгляд ничем не связанных между собой. В стройную систему они складываются не сразу, а при длительном сопоставлении и размышлении. Процесс усвоения квантовых идей можно уподобить растворению соли в воде: вначале брошенные в стакан мелкие кристаллы бесследно исчезают, но затем наступает момент, когда достаточно бросить еще один кристаллик, чтобы из этой маленькой затравки вырос большой, правильный кристалл.
В дальнейшем мы узнаем истоки, идеи и находки квантовой физики, объясним систему ее образов и, наконец, расскажем о приложениях. Но вначале мы должны растворить в своем сознании несколько кристаллов первоначальных понятий, усвоить те немногие, но необходимые слова, без которых невозможно построить ни одной осмысленной «квантовой фразы». Для начала запомним три важных понятия квантовой физики:
атомы, волны, кванты — и проследим истоки их возникновения.
АТОМЫ
Сейчас мало осталось людей, для которых реальность атомов менее очевидна, чем движение Земли вокруг Солнца. Почти у каждого с этим понятием связано интуитивное представление о чем-то маленьком и неделимом. И все же, какой смысл вкладывает в понятие «атом» нынешняя физика? Как оно возникло, что понимали под этим древние, как потом развивалось и почему только квантовая механика наполнила реальным содержанием эту умозрительную схему?
Творцом идеи атома принято считать Демокрита, хотя история упоминает также учителя его Левкиппа и — менее уверенно — древнеиндийского философа Канаду. О жизни и личности Демокрита мы знаем мало. Известно, что родился он в ионийской колонии Абдера на Фракийском берегу Средиземного моря; кроме Левкиппа, учился у халдеев и персидских магов, много путешествовал и много знал; прожил около ста лет и в 370 г. до н. э. был похоронен за общественный счет гражданами родного города, которые его глубоко почи-

|
|
Демокрит
|
тали. Многочисленные поколения художников изображали Демокрита высоким, с короткой бородой, в белом хитоне и в сандалиях на босу ногу.
Легенда рассказывает, что однажды Демокрит сидел на камне у моря, держал в руке яблоко и размышлял: «Если я сейчас это яблоко разрежу пополам — у меня останется половина яблока; если я затем эту половину снова разрежу на две части — останется четверть яблока; но если я и дальше буду продолжать такое деление, всегда ли у меня в руке будет оставаться 1/8, 1/16 и т. д. часть
яблока? Или же в какой-то момент очередное деление приведет к тому, что оставшаяся часть уже не будет обладать свойствами яблока?» Впоследствии оказалось, что сомнение Демокрита (как почти всякое бескорыстное сомнение) содержало долю истины. По зрелом размышлении философ пришел к выводу, что предел такого деления существует, и назвал эту последнюю, уже неделимую, частицу
атом — аторо? — «неразрезаемый», а свои мысли изложил в книге «Малый диакосмос». Вдумайтесь — это написано более двух тысяч лет назад: «Начало вселенной — атомы и пустота, все же остальное существует лишь в мнении. Миров бесчисленное множество, и они имеют начало и конец во времени. И ничто не возникает из небытия, не разрешается в небытие. И атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля. Дело в том, что последние суть соединения некоторых атомов. Атомы же не поддаются никакому воздействию и неизменяемы вследствие твердости».
Когда умер Демокрит, Аристотелю, будущему учителю Александра Македонского, было 14 лет. Он был худощав, невысок ростом,

изыскан, а уважение к нему переходило часто все разумные границы. Для этого были основания: он владел всеми знаниями той эпохи. Аристотель учил обратному: процесс деления яблока можно продолжить бесконечно, по крайней мере в принципе. (Справедливости ради следует признать, что идея бесконечной делимости вещества для неискушенного ума выглядит более естественно, чем
Аристотель мысль о существовании принципиального
предела делимости материи.) Учение Аристотеля стало господствующим, Демокрита забыли на многие века, а его сочинения уничтожались с тщанием, достойным лучшего применения. Поэтому учение Демокрита сохранилось только во фрагментах и свидетельствах современников, а Европа узнала о нем из поэмы древнеримского поэта Тита Лукреция Кара (99—55 гг. до н. э.) «О природе вещей».
Бессмысленно винить древних за такой выбор — для них обе системы были равно разумны и приемлемы: цель своей науки они видели не в практических применениях (они их стыдились), а в том, чтобы с помощью умозрения достигнуть того чувства гармонии мира, которое сообщает человеку всякая законченная философия.
Чтобы освободиться от заблуждений великого авторитета, потребовались две тысячи лет. В XVII веке впервые возникла наука физика, которая вскоре вытеснила древнюю натуральную философию.
Наука опиралась не на чистое умозрение, а на опыт и математику. Окружающую природу стали не просто
наблюдать, а
изучать, то есть ставить сознательные опыты для проверки гипотез и записывать результаты этой проверки в виде чисел. Идея Аристотеля не выдержала такого испытания, а гипотеза Демокрита окрепла и дала начало атомной теории.
После двадцати веков забвения идею об атомах возродил к жизни французский философ и просветитель Пьер Гассенди (1592—1655): в 1647 г. появилась его книга с изложением идей атомизма. В то время это было сопряжено с известным риском: традиции средневековья преследовали не только гипотезы, но и строгие факты науки, если они противоречили общепризнанным догматам. (В Париже, например, в 1626 г. учение об атомах запретили под страхом смертной казни.) Тем не менее атомную гипотезу приняли все передовые
ученые того времени. Даже Ньютон с его знаменитым девизом «Hypothesis non fingo» («гипотез не строю») поверил в нее и изложил по-своему в конце третьего тома «Оптики».
Однако до тех пор, пока гипотезу об атомах не подтвердили опытом, она оставалась, несмотря на всю свою привлекательность, только гипотезой.
В правоте Демокрита впервые наглядно мог убедиться шотландский ботаник Роберт Броун (1773—1858). В 1827 г. это был уже немолодой директор ботанического отдела Британского музея. В юности он провел четыре года в экспедициях по Австралии и привез оттуда около 4 тысяч видов растений. Двадцать лет спустя он все еще продолжал изучать коллекции экспедиции. Летом 1827 г. Броун обратил внимание на то, что мельчайшая пыльца растений произвольно двигается в воде под действием неизвестной силы. Он тут же опубликовал статью, заглавие которой очень характерно для той неторопливой эпохи: «Краткий отчет о микроскопических наблюдениях, проделанных в июне, июле и августе 1827 г. над частицами, содержащимися в пыльце растений; и о существовании активных молекул в органических и неорганических телах».
Сначала его опыт вызвал недоумение. Это недоумение усугубил сам же Броун, пытаясь объяснить обнаруженное явление некой «живой силой», которая якобы присуща органическим молекулам. Естественно, такое прямолинейное объяснение «броуновского движения» не удовлетворило ученых, и они предприняли новые попытки изучения его особенностей. Среди них особенно много сделали голландец Карбонэль (1880 г.) и француз Гуи (1888 г.). Они поставили тщательные опыты и выяснили, что броуновское движение не зависит от внешних воздействий: времени года и суток, добавления солей, вида пыльцы и «...наблюдается одинаково хорошо ночью в деревне и днем вблизи многолюдной улицы, где проезжают тяжелые экипажи». Оно не зависит даже от вида частичек, а только от их размеров и массы и, что самое главное, никогда не прекращается. (Почти за двадцать веков до Броуна свойства этого движения мысленно представил себе и подробно описал в своей поэме Лукреций Кар.)
Надо сказать, что первое время странное движение не обратило на себя должного внимания. Большинство физиков о нем вообще не знали, а те, кто знал, считали его неинтересным, полагая, что это явление аналогично движению пылинок в солнечном луче. Лишь сорок лет спустя впервые оформилась мысль о том, что видимые в микроскоп беспорядочные движения пыльцы растений вызваны случайными толчками
И
маленьких невидимых частиц жидкости. После работ Гуи в это поверили почти все, и гипотеза об атомах приобрела множество последователей.
Конечно, и до Броуна немало людей были убеждены, что все тела построены из атомов. Для них некоторые свойства атомов были очевидны уже без дальнейших исследований. В самом деле, все тела в природе, несмотря на огромные различия между собой, имеют массу и размеры. Очевидно, у атомов этих тел также должны быть и масса, и размеры. Именно эти их свойства положил в основу своих рассуждений Джон Дальтон (1766—1844) —скромный учитель математики и натуральной философии в городе Манчестере и великий ученый, определивший развитие химии примерно на сто лет вперед* В 1804 г., тщательно анализируя известные в то время данные о химических соединениях, Джон Дальтон сформулировал понятие о
химическом элементе', вещество, которое состоит из атомов одного типа.
При этом сразу же возникал вопрос: не означает ли многообразие веществ такого же многообразия атомов, как это утверждал Демокрит? Оказалось, что нет. Вскоре выяснилось, что элементов в природе не так уж много: в то время их знали около 40 (сейчас 105). Все остальные вещества построены из молекул — разнообразных сочетаний этих атомов. Сами атомы разных элементов также различаются между собой, и прежде всего массой. Самые легкие из них — атомы водорода, атомы кислорода тяжелее их в 16 раз, железа — в 56, и т. д. Так в науку об атоме впервые проникли числа.
Однако по-прежнему об абсолютных размерах и массах атомов ничего не было известно.
Первой удавшейся научной попыткой оценить размер и массу атомов следует считать работу преподавателя физики Венского университета Йозефа Лошмидта (1821 —1895). В 1865 г. он нашел, что размеры всех атомов примерно одинаковы и равны 10
-8 см, то есть 0,00000001 см, а масса атома водорода составляет всего 10
-24 г.
Впервые мы встречаемся здесь с такими малыми величинами, и у нас просто нет необходимых навыков, чтобы их осмыслить. Самое большее, на что мы способны, это сказать: тонкий, как паутина, или — легкий, как пух. Но толщина паутины (10
-3 см) в сто тысяч раз больше самого большого атома, а пуховая подушка — это уже нечто весомое и вполне реальное. Чтобы хоть как-то заполнить провал между здравым смыслом и малостью этих чисел, обычно все же прибегают к сравнениям, хотя они, как правило, мало помогают и еще меньше объясняют, поскольку для столь малых объектов само понятие о размере как о величине, измеряемой прикладыванием масштаба, теряет свой первичный смысл. Поэтому лучше с самого начала оставить попытки представить себе эти числа наглядно. Важно только понимать, что, несмотря на свою чрезвычайную малость, эти числа не произвольны: именно та

кие малые диаметры и массы нужно приписать атомам, чтобы свойства веществ, которые из них состоят, оказались такими, какими мы их наблюдаем в природе.
Число молекул газа в объеме 1 см
3 при нормальном давлении и температуре таяния льда
£ = 2,68676-10
19 см“
3
сейчас известно с большой точностью и называется постоянной Лошмидта. Она примерно в десять раз превышает значение, найденное им впервые.
волны
Железо, как и всякое вещество, состоит из атомов. Если один конец железного лома поместить в печь, он, разумеется, начнет нагреваться. Мы теперь хорошо знаем, что тепло — это энергия движущихся атомов и увеличение их энергии при нагревании просто обнаружить, коснувшись, например, другого конца лома. Но это далеко не все. По мере нагревания постепенно меняется
цвет нагретого железа: от вишневокрасного до ослепительно белого. Причем к лому теперь нельзя не только прикоснуться, но и просто подойти близко. Последнее уже непонятно, если пользоваться только представлением о движении атомов: действительно, мы не касались лома, атомы железа не ударялись о нашу руку — почему же нам стало жарко?
Здесь мы впервые встречаемся с новым явлением и должны ввести соответствующее ему понятие —
излучение, которое на первый взгляд никак не связано с идеей атома.
Мы говорим: лучи солнца осветили поляну, то есть свет — это излучение. Но мы говорим также: греться в лучах солнца. Следовательно, и тепло может распространяться в виде лучей. Вообще, с излучением мы имеем дело постоянно: когда сидим у костра, наблюдаем закат, вращаем ручку настройки приемника или проходим флюорографию. Тепло, свет, радиоволны и рентгеновские лучи — различные проявления одного и того же электромагнитного излучения.

Однако мы все-таки их различаем не только качественно и субъективно, но и количественно. По какому признаку? У электромагнитного излучения их много, но нам особенно важен сейчас один из них — волновая природа излучения.
Явление распространения волн настолько привычно каждому из нас, что пояснять его вновь кажется излишним. Тем не менее мы все-таки напомним здесь основные свойства волнового движения, по той же самой причине, по которой даже в солидные академические словари иностранных слов помещают вполне понятные обиходные слова.
«Волна» — одно из самых необходимых слов физики. Каждый представляет себе ее по-разному: один сразу же видит волны от брошенного в пруд камня, другой — синусоиду. Поскольку синусоиду рисовать проще — воспользуемся ею. У этой схематической волны четыре свойства: амплитуда
А, длина волны X, частота v и скорость распространения
v. Амплитуда волны — это наибольшая ее высота. Что такое длина волны — понятно из рисунка. Скорость ее распространения, по-видимому, особых пояснений не требует.
Чтобы выяснить, что такое частота, проследим за движением волны в течение секунды. При скорости
и (см/с) она за это время пройдет расстояние
v (см). Подсчитав, сколько длин волн уместилось на этом отрезке, мы найдем частоту излучения: v = u/X (с
-1).
Важнейшее свойство волн — их способность
интерферировать,то есть способность волн уничтожать или усиливать друг друга, например, при отражении, и это именно то свойство, по которому волну всегда можно безошибочно отличить от потока частиц.
Еще одно свойство волны, которое отличает ее от частиц,—
дифракция — состоит в ее способности огибать препятствия, если его размеры соизмеримы с длиной волны. Если препятствие невелико, то благодаря дифракции волна может разделиться, обойти его и, складываясь снова, усилить или погасить себя точно так же, как при сложении прямой и отраженной волн.
Именно таким способом, обнаружив интерференцию и дифракцию у рентгеновского и других видов излучения, установили, что все они — волны, только разной длины. Длина волны излучения и есть тот основной признак, по которому мы количественно различаем разные виды электромагнитного излучения. Наибольшая длина у радиоволн: от нескольких километров до нескольких сантиметров. У тепловых лучей она короче — от 1 до 10
-2 см. Еще короче волны видимого света, примерно 4-10
-5—8-Ю
-5 см. Наконец, у рентгеновских лучей длина волны составляет лишь 10~
7 — 10“
8 см. Все виды излучения распространяются с одной и той же скоростью — со скоростью света с = 3-1О
10 см/с. Отсюда по формуле v=c/X очень просто вычислить частоту каждого вида излучения. Очевидно, для рентгеновского излучения она будет наибольшей, а для радиоволн — наименьшей.
Очень важно отдавать себе отчет в том, что, конечно, любое излучение — это не синусоида, изображенная на рисунке, а
физический процесс, основные характеристики которого (например, периодичность), по счастью, можно выразить на языке таких простых моделей. У каждого вида излучения свои особенности. Сосредоточимся пока на том его виде, который для нас наиболее важен и привычен,— на солнечном излучении.
Когда вы греетесь на солнце, вы, наверное, не задумываетесь о сложном составе солнечного излучения, хотя иногда солнечные ожоги и напоминают вам об этом. Исаак Ньютон (1643—1727) жил в Англии, где солнце светит не так уж ярко, тем не менее он захотел узнать, из чего состоит солнечный свет. Чтобы выяснить это, Ньютон поставил в 1666 г. опыт, знакомый теперь каждому школьнику: пропуская луч солнца сквозь призму, он обнаружил позади нее на стене радугу —
спектр солнечного света. Впоследствии его соотечественник Томас Юнг (1773—1829) выяснил, что каждому цвету радуги-спектра соответствует своя длина волны солнечного излучения: самые длинные волны у красного цвета — 650 нм; у зеленого короче — 520 нм; еще короче у фиолетового— 400 нм (1 нм = 10
-7 см).

Спектр излучения любого тела — будь то Солнце или раскаленный железный лом — полностью известен, если мы, во-первых, знаем, из каких волн он состоит и, во-вторых, какую долю они составляют в общем потоке излучения. В частности, цвет раскаленного тела определяют те волны, которых больше всего в спектре его излучения. При изменении температуры тела спектральный состав его излучения также меняется. Пока температура тела невысока, оно излучает, но не светится, то есть испускает только тепловые волны, невидимые для глаза. При повышении температуры оно начинает светиться: сначала красным, затем оранжевым, желтым и т. д. цветом. Например, при температуре 6000 °C больше всего’ излучается желтых лучей (именно по этому признаку определили температуру поверхности Солнца).
В конце прошлого века законы теплового излучения тел стали предметом пристального внимания ученых. В значительной мере это было обусловлено потребностями металлургии и, в частности, изобретением в 1856 г. Генрихом Бессемером (1813—1898) нового способа производства стали, получившего впоследствии название бессемеровского.
Спектральный состав излучения принято описывать с помощью
спектральной функции и (у, Т), которая показывает, чему равна доля излучения с частотой v в его общем потоке при заданной температуре тела
Т. Типичная спектральная функция
и (v,
Т) изображена на рисунке: примерно так выглядит спектральный состав излучения Солнца.
При попытке более детально изучить законы' теплового излучения вначале нужно было принять во внимание тот факт, что даже при одной и той же температуре спектр излучения и, следовательно, спектральная функция
и(у,Т) зависят от вещества нагретого тела. В этом нетрудно убедиться, нагревая в темноте два одинаковых по размеру шара — каменный и стальной: первый из них будет светиться намного ярче. Вскоре выясни

ли, однако, что если вместо сплошных шаров нагревать полые, а их излучение наблюдать через небольшое отверстие в стенке шара, то спектральный состав этого излучения уже не будет зависеть от вещества шара. Такой спектр назвали
спектром абсолютно черного тела. Происхождение этого несколько необычного названия легко по-
нять. Представьте, что вы не нагреваете шар, а, наоборот, освещаете его снаружи. В этом случае вы всегда увидите перед собой одинаково черное отверстие — независимо от вещества шара, поскольку почти все лучи, попавшие внутрь полости, многократно в ней отражаются и наружу практически не выходят.
Универсальная спектральная функция
и(у,Т), описывающая спектр излучения абсолютно черного тела, была введена в научный обиход выдающимся немецким физиком Густавом Робертом Кирхгофом (1824—1887) в 1859 г. Измерить ее оказалось не так просто: это удалось лишь Сэмюэлю Лэнглею (1834—1906), который в 1884 г. изобрел болометр — прибор для измерения энергии излучения. Важность функции u(v,T) поняли сразу же, но в течение 40 лет не удавалось найти для нее теоретическую формулу, которая бы правильно воспроизводила результаты измерений. Однако попытки эти никогда не прекращались: по-видимому, поиски абсолютного всегда привлекательны для человеческого ума.
КВАНТЫ
В самом конце прошлого века Макс Планк (1858—1947), как и многие до него, искал универсальную формулу для спектральной функции
и(у,Т) абсолютно черного тела. Ему повезло больше, чем другим,— вначале он ее просто угадал, хотя явилась она ему не вдруг: два года напряженных размышлений потребовались Планку, чтобы скрепить в одной формуле разрозненные куски единой картины явления теплового излучения.
19 октября 1900 г. происходило очередное заседание Немецкого физического общества, на котором экспериментаторы Генрих Рубенс (1865—1922) и Фердинанд Курлбаум (1857—1927) докладывали о новых, более точных измерениях спектра абсолютно черного тела. После доклада состоялась дискуссия, в ходе которой экспериментаторы сетовали на то, что ни одна из теорий не может объяснить их результаты. Планк предложил им воспользоваться своей формулой. В ту же ночь Рубенс сравнил свои измерения с формулой Планка и убедился, что она правильно, до мельчайших подробностей описывает спектр абсолютно черного тела. Наутро он сообщил об этом своему коллеге и близкому другу Планку и поздравил его с успехом.
Однако Планк был теоретик и потому ценил не только окончательные результаты теорий, но и внутреннее их совер-
17 шенство. К тому же он не знал еще, что открыл новый закон природы, и верил, что его можно вывести из ранее известных. Поэтому он стремился теоретически обосновать закон излучения, исходя из простых посылок кинетической теории материи и термодинамики. Последовало два месяца непрерывной работы и предельного напряжения сил. Ему это удалось. Но какой ценой!
В процессе вычислений он вынужден был предположить, что энергия излучения
Е испускается порциями (или
квантами), которые определяются формулой
E = hv,
где v — частота излучения, а мировая константа
h называется с тех пор постоянной Планка. В этом — и только в этом — случае удавалось вывести правильную формулу для спектральной функции
и(у,Т).
Формально предположение Планка было предельно ясным и простым, но по существу противоречило всему прежнему опыту физики и годами воспитанной интуиции. Вспомните, мы много раз подчеркивали, что излучение — это волновой процесс. А если так, то энергия в этом процессе должна передаваться непрерывно, а не порциями — квантами. Это неустранимое противоречие Планк сознавал как никто другой. Когда он вывел свою знаменитую формулу, ему было 42 года, но почти всю остальную жизнь он страдал от логического несовершенства им же созданной теории. У последующих поколений физиков это чувство притупилось: они уже знали готовый результат и перестали над ним задумываться. Но сам Планк был воспитан на традициях классической физики и целиком принадлежал ее строгому неторопливому миру. А вышло так: разрешив многолетнюю проблему в теории излучения, он нарушил тем самым логическую стройность классической физики. Для Планка это было большим потрясением. Вновь и вновь он задавал себе один и тот же вопрос: «Не слишком ли дорогой ценой достигнуто решение этой, в сущности, очень частной проблемы?» Двадцать лет спустя в докладе, который Планк произнес по случаю вручения ему Нобелевской премии по физике, он вспоминал, что в то время признание реальности квантов было для него равносильно «нарушению непрерывности всех причинных связей в природе». И даже в 1933 г. в письме к Роберту Вуду он назвал свою тогдашнюю гипотезу «актом отчаяния».
Ощущение произвола, которое испытывает неискушенный человек при первом знакомстве с формулой Планка и с исто-/5
рией ее открытия, на самом деле обманчиво. Гипотеза о квантах — не результат умозрения, она возникла как следствие тщательного анализа и обобщения точных опытов. Конечно, чтобы придумать ее, одного анализа мало: необходима еще и сила мысли, и взлет фантазии, и смелость перед лицом неожиданных предсказаний теории.

Ученые Рэлей, Джинс, Вин и до Планка предлагали различные формулы для описания спектра абсолютно черного тела. (Среди этих попыток следует вспомнить и работу поразительно совпадала с результатами опытов, хоть и не становилась от этого более понятной. Только четверть века спустя новая наука — квантовая механика — объяснит истинный смысл революции, которую, подчиняясь логике научного исследования и во многом вопреки своей воле, совершил в физике Макс Планк.
Владимира Александровича Михельсона (1860—1927), которая решительным образом повлияла на направление исследований Вина.) Но каждый раз экспериментаторы Отто Люммер (1860—1925) и Эрнст Принсгейм (1859—1917) после тщательных измерений решительно отвергали их как несовершенные. Только формула Планка удовлетворила ученых: она
В пятницу 14 декабря 1900 г. в зале заседаний Немецкого физического общества родилась новая наука — учение о квантах. Сухо и обстоятельно ординарный профессор физики Макс Карл Эрнст Людвиг Планк прочел перед небольшой аудиторией сугубо специальный доклад «К теории закона распределения энергии в нормальном спектре». В тот день мало было людей, которые понимали величие момента: плохая погода или логические противоречия теории, вероятно, занимали аудиторию больше. Признание пришло потом, и лишь много позже осмыслили значение постоянной Планка для всего атомного мира. Она оказалась очень
| маленькой: |
/г=6,626075-10~27 эрг-с, |
но именно она открыла дверь в мир квантовых явлений. И всегда, когда мы из мира привычного и классического хотим перейти в мир необычный и квантовый, мы должны пройти через эту узкую дверь.
До и после Демокрита
Корни и истоки идей атомизма до сих пор остаются загадкой для историков науки, хотя некоторые факты можно считать вполне надежно установленными. Индийский мудрец Канада, что в переводе означает «пожиратель атомов», жил задолго до Демокрита. В VII веке до н. э. он основал философско-религиозное учение, в котором понятие атома было основным. Согласно Канаде, познание достигается при посредстве шести положительных категорий: субстанция, действие, различие, внутренняя связь, качество и общность. Субстанция, в свою очередь, существует в девяти видах: пяти материальных (земля, вода, воздух, свет, эфир) и четырех нематериальных (время, пространство, душа, сознание). Пять материальных видов субстанции построены из атомов, мельчайшая частичка в природе — это пылинка в солнечном луче: она состоит из шести атомов, причем каждые два соединены попарно «волею бога или еще чем-либо».
При всей наивности конкретных представлений об атомах следует отдать должное четкости постановки самой проблемы и тщательности выделения философских категорий. В частности, Канада отчетливо понимал, что «о существовании атомов мы узнаем не восприятием, а рассуждением», и приводил пример таких рассуждений: если бы материя была делима до бесконечности, то не было бы качественного различия между горой и горчичным зерном, ибо «бесконечное всегда равно бесконечному».
Знал ли Демокрит об учении Канады? Вполне вероятно: он много и долго путешествовал и, по некоторым свидетельствам, посещал Индию. Был ли он в таком случае оригинален? Несомненно. Чтобы убедиться в этом, достаточно представить себе разницу эпох, в которые жили оба мыслителя, различие традиций, духовного склада и стиля мышления Востока и Запада.
Среди предшественников Демокрита называют также финикиянина Мосха Сидонского, жившегб в XII веке до н. э., во времена Троянских войн, и учителя Демокрита Левкиппа из Милета. О сути учения Мосха ничего достоверного не известно, но если история на протяжении более трех тысячелетий сохраняет имя человека, который не был ни царем, ни полководцем, то, похоже, он действительно оставил после себя
нечто важное, хотя и утраченное впоследствии. О Левкиппе не известно практически ничего: ни время его рождения, ни труды, написанные им. Аристотель называет Демокрита учеником-другом Левкиппа и повсюду упоминает учителя в связи с его учеником. История сохранила традицию.
Учение Демокрита воспринял и умножил античный философ Эпикур (341—270 гг. до н. э.), который оставил после себя школу, или, точнее, братство единомышленников, просуществовавшее около шести веков. Труды Эпикура точно так же, как и трактаты Демокрита, не сохранились, и о его естественно-научной философии мы узнаем теперь из поэмы римского поэта и философа Лукреция.
Тит Лукреций Кар
Знаменитая поэма Лукреция «De rerum natura» — «О природе вещей», как и многие достижения древности, была забыта на много веков и лишь в 1473 г. напечатана в Италии. С тех пор ученые и философы не устают удивляться ей. Причин тому две: во-первых, это единственное систематическое изложение учения материалистов античности, оригиналы трудов которых утрачены, по-видимому, навсегда; во-вторых, это первый известный и законченный образец научно-художественного жанра, как мы его теперь понимаем.
Лукреций был не только истинным поэтом, он был поэтом-мыслителем и обладал редкой способностью превращать отвлеченные абстракции философского мышления в зримые и чувственные образы.
Как ему это удавалось, дают представление приведенные ниже отрывки из его поэмы.
«...Выслушай то, что скажу, и ты сам, несомненно, признаешь, Что существуют тела, которых мы видеть не можем.
Ветер, во-первых, морей неистово волны бичует, Рушит громады судов и небесные тучи разносит, Или же, мчась по полям, стремительным кружится вихрем... Стало быть, ветры — тела, повторяю, незримые нами, Раз и по свойствам они, и по действиям могут сравниться С водами мощными рек, обладающих видимым телом.
Далее, запахи мы обоняем различного рода,
Хоть и не видим совсем, как в ноздри они проникают. Также палящей жары или холода нам не приметить Зреньем своим никогда, да и звук увидать невозможно. Но это все обладает, однако, телесной природой, Если способно оно приводить наши чувства в движенье: Ведь осязать, как и быть осязаемым, тело лишь может.
И, наконец, на морском берегу, разбивающем волны, Платье сыреет всегда, а на солнце вися, оно сохнет; Видеть, однако, нельзя, как влага на нем оседает, Как и не видно того, как она исчезает от зноя. Значит, дробится вода на мельчайшие части, Что недоступны они совершенно для нашего глаза. Так и кольцо изнутри, что долгое время на пальце Носится, из году в год становится тоньше и тоньше, Капля за каплей долбит, упадая, скалу; искривленный Плуга железный сошник незаметно стирается в почве; И мостовую дорог, мощёную камнями, видим Стертой ногами толпы; и правые руки у статуй Бронзовых возле ворот городских постепенно худеют От припадания к ним проходящего мимо народа.
Нам очевидно, что вещь от стиранья становится меньше, Но отделение тел, из нее каждый миг уходящих, Нашим глазам усмотреть запретила природа ревниво».
«...Если не будет, затем, ничего наименьшего, будет Из бесконечных частей состоять и мельчайшее тело: У половины всегда найдется своя половина. И для деленья нигде не окажется вовсе предела. Чем отличишь ты тогда наименьшую часть от вселенной?..»
«...Вот посмотри: всякий раз, когда солнечный луч проникает В наши жилища и мрак прорезает своими лучами,
Множество маленьких тел в пустоте, ты увидишь, мелькая, Мечутся взад и вперед в лучистом сиянии света... Знай же: идет от начал всеобщее это блужданье.
Первоначала вещей сначала движутся сами, Следом за ними тела из малейшего их сочетанья, Близкие, как бы сказать, по силам к началам первичным, Скрыто от них получая толчки, начинают стремиться Сами к движенью, затем понуждая тела покрупнее. Так, исходя от начал, движение мало-помалу Наших касается чувств, и становится видимым также Нам и в пылинках оно, что движутся в солнечном свете, Хоть незаметны толчки, от которых оно происходит...»
Ньютон об атомах
«Мне кажется вероятным, что Бог вначале создал материю в виде сплошных, массивных, твердых, непроницаемых, движущихся частиц таких размеров и форм и с такими другими свойствами и в таких пропорциях к пространству, которые наилучшим образом служат той цели, для которой Он их создал, и что эти простейшие частицы, будучи твердыми, несравненно прочнее, чем любые другие тела, составленные из них; даже настолько прочны, что никогда не изнашиваются и не разбиваются на куски: никакие обычные силы не в состоянии разделить то, что Бог создал сам в первый день творения...»
22

|
|
И. Ньютон
|
само существова
ние этих вещей; их достоверность очевидна нам через явле
«Мне кажется очевидным, что эти частицы имеют не только свойство инерции вместе с такими пассивными законами движения, которые естественно следуют из этих сил, но что они движутся согласно определенным действующим принципам, подобным гравитации, и которые являются причиной возбуждения и сцепления тел. Эти принципы я рассматриваю не как оккультные качества, предположенные для того, чтобы вывести результаты, исходя из специфических форм вещей, но как общие законы природы, которым обязано ния, хотя их причины пока что не открыты».
Глава 2
Анубис
Даже дикари на низшей ступени развития уже имеют свою историю. С ее утратой исчезает связь времен и сообщество людей распадается,— точно так же, как необратимо деградирует человек, утративший память.
В истории человечества интересны не имена государей и не даты их правления (хотя представить себе историю без них довольно трудно). В истории мы стремимся проследить рождение, расцвет и упадок цивилизаций, эволюцию и существо идей, которые столетиями направляют волю людей, мы хотим понять причины обновления идей и обстоятельства их угасания. Точно так же история физики — это не просто хронологически упорядоченный набор фактов, а связная картина возникновения и развития идей, без которых наука может показаться изощренным набором опытов и чисел, формул и понятий. Истины плодотворны только тогда, когда между ними существует внутренняя связь, а связь эту можно проследить только в развитии.
Для физика история его науки — необходимый элемент образования, без которого он рискует остаться ремесленником. Чтобы понять законченность и красоту построений современной физики, необходимо проследить их истоки и путь развития. Только после этого они смогут стать вам близкими и понятными. Память о первых шагах науки никогда не тускнеет и дорога нам, как воспоминания детства.
Знаменитый математик Феликс Клейн говорил как-то, что самый быстрый и надежный способ овладеть любой наукой — пройти самому весь путь ее развития. Это не самый простой способ, но самый интересный, и мы избрали именно его.
СПЕКТРЫ
Солнечный луч над колыбелью ребенка во все времена был символом покоя. Но луч несет с собой не только ласковое тепло: в нем заключена обширная информация об огненных
24

бурях и взрывах на Солнце, об элементах, из которых оно состоит,— надо только научиться ее понимать. Если пропустить луч Солнца через призму, то позади нее он «дробится» в набор разноцветных полос. Возникает
спектр — явление всегда удивительное, хотя за двести лет к нему основательно привыкли. На первый взгляд, между отдельными частями спектра нет резких границ: красный постепенно переходит в оранжевый, оранжевый в желтый и т. д. Так и думали до тех пор, пока в 1802 г. английский врач и химик Уильям Хайд Волластон (1766—1828) не разглядел его более пристально. Он построил первый спектроскоп со щелью и благодаря ему обнаружил несколько резких темных линий, которые без видимого порядка пересекали спектр Солнца в разных местах. Он не придал им особого значения, полагая, что их появление зависит либо от призмы, либо от источника света, либо от других .побочных причин. Да и сами линии считал интересными только потому, что они отделяют друг от друга цветные полосы спектра. Впоследствии эти темные линии назвали
фраунгоферовыми, как это часто бывает, по имени их настоящего исследователя, а не первооткрывателя.
Иосиф Фраунгофер (1787—1826) прожил недолго, но у него была удивительная судьба. В 11 лет, после смерти родителей, он пошел в ученье к шлифовальных дел мастеру. Работать приходилось так много, что на школу уже не оставалось времени, и потому до 14 лет он не умел ни читать, ни писать. Однажды дом хозяина рухнул, и Фраунгофера с трудом извлекли из-под его обломков. Случилось так, что как раз в этот момент мимо ехал наследный принц. Он пожалел юношу и вручил ему значительную сумму денег. Их оказалось достаточно, чтобы Иосиф смог купить себе шлифовальный станок и даже начать учиться грамоте.
То было время наполеоновских войн и больших перемен в Европе. А Фраунгофер между тем в заштатном городке Бенедиктбейрене шлифовал оптические стекла и тщательно изучал темные линии в спектре Солнца. Он насчитал их там 574, дал главным из них названия и указал их точное местоположение в спектре. Постепенно он убедился, .что положение их было строго неизменным, и с успехом использовал этот факт для контроля качества ахроматических линз: недаром телескопы Фраунгофера славились по всей Европе.
Среди многочисленных линий солнечного спектра Фраунгофер особо отметил несколько наиболее ярких, одна из которых — резкая двойная D-линия — всегда появлялась в желтой части спектра. В дальнейшем он обнаружил, что в

спектре пламени спиртовки в том же месте шкалы спектроскопа видна точно такая же двойная, но уже не темная, а ярко-желтая линия. Смысл и значение этого наблюдения оценили только много лет спустя.
В 1819 г. Фраунгофер переехал в Мюнхен, стал там профессором, членом Академии наук и хранителем физического кабинета. Продолжая свои исследования темных линий в спектре Солнца, он убедился, что их причина — не оптический обман, а сама природа солнечного света. Побуждаемый странной природой этих линий к дальнейшим наблюдениям, он открыл их затем в спектре Венеры и Сириуса. Иосиф Фраунгофер умер и похоронен в Мюнхене в 1826 г. На его могиле — надпись: «Approximavit sidera» — «Приблизил звезды». Но лучший памятник ему — его открытия.
Среди них для нас особенно важно сейчас его наблюдение двойной D-линии. Тогда, в 1814 г., когда он опубликовал свои исследования, на них особого внимания не обратили. Однако мысли его не пропали: прошло 43 года, и Уильям Сван (1828—1914) установил, что двойная желтая D-линия в спектре пламени спиртовки возникает в присутствии металла натрия. (Его следы в составе поваренной соли почти всегда можно найти в различных веществах и в спиртовке — тоже.) Как и многие до него, Сван не понял значения своего открытия и потому не сказал решающих слов: «эта линия
принадлежит металлу натрию».
К этой простой и важной мысли пришли только два года спустя, в 1859 г., два профессора: Густав Роберт Кирхгоф (1824—1887) и Роберт Вильгельм Бунзен (1811 —1899), В Гейдельберге, в старой университетской лаборатории, они поставили несложный опыт. До них через призму пропускали либо только солнечный свет, либо только свет от спиртовки. Кирхгоф и Бунзен пропустили и то и другое одновременно и обнаружили явление, о котором стоит рассказать подробно.

Если на призму падал только луч Солнца, то на шкале спектроскопа они видели спектр с темной линией на своем обычном месте. Темная линия по-прежнему оставалась там же и в том случае, когда исследователи ставили на пути света горящую спиртовку. Но если на пути солнечного света помещали экран и освещали призму только светом спиртовки, то на месте темной D-линии четко «проявлялась» яркая желтая D-линия натрия. Кирхгоф и Бунзен убирали экран — D-линия вновь становилась темной. Они заменяли луч Солнца светом от раскаленного тела — результат был всегда тот же: если через пламя спиртовки пропустить яркий луч, то на месте двойной ярко-желтой линии спектра спиртовки возникала точно такая же, но темная. То есть всегда
пламя спиртовки поглощает те лучи, которые оно само испускает.
Чтобы понять, почему это событие взволновало двух профессоров, проследим за их рассуждениями.
Ярко-желтая D-линия в спектре пламени спиртовки возникает в присутствии натрия.
В спектре Солнца на этом же месте находится темная линия неизвестной природы.
Спектр излучения раскаленного тела — сплошной, и в нем нет темных линий. Однако если пропустить его через пламя спиртовки, то в его спектре также возникает темная линия и на том же самом месте. Но природу
этой темной линии мы уже почти знаем, во всяком случае мы можем догадываться, что она принадлежит натрию. Следовательно, в зависимости от условий наблюдения D-линия натрия может быть либо ярко-желтой, либо темной на желтом фоне. Но в обоих случаях присутствие этой линии (все равно какой — желтой или темной!) означает, что в пламени спиртовки есть натрий. А поскольку такая линия спектра пламени спиртовки в проходящем свете совпадает с темной D-линией в спектре Солнца, то значит и на Солнце есть натрий. Причем он находится в газовом внешнем облаке, которое освещено изнутри раскаленным ядром Солнца.
Короткая заметка (всего две страницы), которую написал Кирхгоф в 1859 г., содержала сразу четыре открытия: каждому элементу присущ свой
линейчатый спектр, то есть строго определенный набор спектральных линий;
эти линии можно использовать для анализа состава веществ не только на Земле, но и на звездах;
Солнце состоит из горячего ядра и сравнительно холодной атмосферы раскаленных газов;
на Солнце есть натрий.
Все эти открытия были вскоре подтверждены, в том числе и гипотеза о строении Солнца: экспедиция, которую Французская академия наук в 1868 г. во главе с астрономом Жансеном снарядила в Индию, обнаружила, что при полном солнечном затмении — в тот момент, когда его раскаленное ядро закрыто тенью Луны и светит только корона,— все темные линии в спектре Солнца вспыхивают ярким светом.
Сами Кирхгоф и Бунзен уже в следующем году с помощью спектроскопа открыли два новых элемента: рубидий и цезий.
В дальнейшем из скромного наблюдения над желтой двойной D-линией натрия родился
спектральный анализ, с помощью которого мы сейчас можем узнавать химический состав далеких галактик, измерять температуру и скорость вращения звезд и многое другое.
Все это действительно интересно, но сейчас нам важно понять другое: что дали открытия Кирхгофа и Бунзена для науки об атоме и какова их связь с нашими прежними знаниями о нем?
Мы знаем теперь два вида спектров: сплошной (или тепловой) и линейчатый. Тепловой спектр содержит все длины волн, излучается он при нагревании твердых тел и не зависит от их природы. (Именно этот спектр описывается формулой Планка.) Линейчатый спектр состоит из набора отдельных резких линий, возникает при нагревании газов и паров (когда малы взаимодействия между атомами), и — что особенно важно — этот набор линий уникален для любого элемента. Более того, линейчатые спектры элементов не зависят от вида химических соединений, которые из этих элементов составлены. Следовательно, причину и объяснение спектров надо искать в свойствах атомов.
То, что элементы однозначно и вполне определяются видом линейчатого спектра, вскоре признали все; но то, что этот же спектр характеризует отдельный атом, осознали не сразу, а лишь в 1874 г. благодаря работам знаменитого английского астрофизика Нормана Локьера (1836—1920), хотя еще раньше те же мысли высказывали Максвелл (1860 г.) и Больцман (1866 г.). А когда осознали, сразу же пришли к неизбежному выводу: если линейчатый спектр возникает как следствие процессов внутри атома, то
атом должен иметь структуру!
ионы
В 1865 г., когда появились работы Йозефа Лошмидта, об атомах знали немного: их представляли себе в виде твердых шариков с диаметром 10“
8 см и массой от 10
24 до 10“
22 г. Каждому такому «шарику» приписывали «атомный вес» — число, которое показывает, во сколько раз он тяжелее атома водорода. Например, атомный вес кислорода равен 16, а гелия — 4. Отсюда просто заключить, что в I г водорода, в 4 г гелия или в 16 г кислорода содержится одинаковое число атомов водорода, гелия, кислорода. Это число = = 6,022* 10
23 (названное числом Авогадро в честь итальянского ученого XIX века) связано с числом Лошмидта соотношением
N
A = L*22 414,l,
то есть число Авогадро равно числу молекул газа в объеме 22,4 л при температуре таяния льда и нормальном атмосферном давлении.
Представлений об атомах — твердых шариках — было достаточно для объяснения многочисленных фактов из химии, теории теплоты и строения материи. Однако уже к 1870 г. вполне оформилась мысль, что атом состоит из еще более простых частиц, и физики принялись их искать. Прежде всего они стали исследовать электрические свойства атома.
Все вещества, как правило, электрически нейтральны (если, конечно, специально не натирать стекло шелком, янтарь шерстью и тому подобное). Однако при некоторых условиях они обнаруживают электрические свойства, например в явлениях электролиза.
Если в расплав какой-либо соли (например, поваренной NaCl) опустить два электрода и подключить их к полюсам батареи, то в расплаве произойдут изменения: на катоде (электроде, который подключен к отрицательному полюсу батареи) начнет выделяться чистый металл натрий, на аноде — газ хлор. Это означает, что в расплаве атомы натрия
заряжены положительно, а атомы поэтому под действием электрического поля они двигаются в противоположных направлениях.
хлора — отрицательно, и

Майкл Фарадей (1791 —1867) в 1834 г. установил количественные законы этого явления. Оказалось, что если через растворы различных веществ, молекулы которых построены из одновалентных атомов, пропускать одно и то же количество электричества, равное
96 485 Кл =2,895*10
14 ед. СГСЭ,
то на электродах всегда выделяется одинаковое число атомов, равное 6,022*10
23. Масса выделившегося вещества будет при этом, конечно, разной, поскольку массы атомов различаются между собой. Например, из расплава соли при этом выделится 23 г металла натрия и 37,5 г газа хлора. Величина, равная произведению постоянной Авогадро
Nk на элементар-‘ ный электрический заряд электрона
е, называется постоянной
Фарадея:
F = N
A е=96 485,3 Кл/моль.
Закон электролиза Фарадея легко понять, если предположить, что в расплаве NaCl с каждым атомом связан определенный заряд, причем для ионов Na
+ и Сl
- эти заряды равны и противоположны по знаку. (Название
ион — «странник» — таким «заряженным» атомам дал Фарадей по совету известного историка науки Уильяма Уэвелла (1794—1866), автора знаменитой «Истории индуктивных наук», который предложил также термины анион и катион и столь привычные теперь анод и катод.)
Зная закон Фарадея, не составляет труда вычислить заряд, который переносит с собой каждый одновалентный ион; легко сообразить, что он равен
e=F/NA=4,806*10
-10 ед. СГСЭ.
Это значение очень мало, но мы уже немного привыкли к таким малым числам. Более удивительно другое: заряда меньшего, чем этот элементарный заряд
е, обнаружить в природе до сих пор не удалось. С легкой руки Джонстона Стонея (1826—1911) в 1891 г. это наименьшее количество заряда получило название «электрон».
ЛУЧИСТАЯ МАТЕРИЯ
Первоначально со словом «электрон» не связывали понятия о частице. Оно служило лишь для обозначения того наименьшего количества заряда, которое может переносить с собой ион любого атома. Однако подспудно мысль о том, что электрон — частица, всегда жила. Действительно, проследите мысленно процесс электролиза: вот ион натрия Na+, двигаясь
в расплаве под действием электрического поля, подходит к катоду; на катоде избыток отрицательных зарядов, поэтому в момент, когда ион Na
+ его касается, он забирает от катода один отрицательный заряд и, не меняя массы, выделяется в виде нейтрального атома натрия. Попробуйте теперь вообразить сам момент перехода отрицательного заряда от катода к иону Na
+ : что добавляется к иону, когда он
без изменения массы становится нейтральным?
Представить себе этот процесс довольно трудно, если не предположить при этом, что элементарный заряд может существовать и вне атома. Эту трудность сознавали, конечно, все, но признать атомарное строение электричества было еще труднее, ибо при этом рушились удобные и привычные представления об электричестве как о неком тонком флюиде, который без труда проникает во все тела. Уже Максвелл в своем знаменитом трактате «Электричество и магнетизм» (1873 г.) допускал, что в электролите молекулы заряжены определенным количеством электричества, однако тут же добавлял, что «эта соблазнительная гипотеза приводит к очень большим затруднениям».
16 февраля 1881 г. в Королевском институте на собрании Химического общества, посвященном чествованию памяти Майкла Фарадея, Герман Людвиг Фердинанд фон Гельмгольц (1821 —1894) прочел доклад «Современное развитие взглядов Фарадея на электричество». В докладе Гельмгольц впервые отчетливо сформулировал мысль о «молекулярном строении электричества»: «Если мы примем гипотезу, что простые вещества состоят из атомов, мы не можем избежать заключения, что и электричество, как положительное, так и отрицательное, разделяется на определенные элементарные порции, которые ведут себя подобно атомам электричества».
Конечно, сама по себе эта мысль даже в то время не была новой. Еще в 1749 г. великий американец Бенджамен Франклин (1706—1790) подозревал нечто похожее, хотя тогда его догадка, в сущности, не имела никаких оснований, а потому и не привела к новым следствиям. В 1871 г. к мысли Франклина возвратился немецкий физик Вильгельм Эдуард Вебер (1804—1891), но сочувствия не встретил: в его время об электричестве знали уже так много, что на веру гипотез не принимали. Нужны были экспериментальные доказательства идеи об электроне. Их стали искать в явлениях проводимости газов.
Представьте себе стеклянную трубку, наполненную каким-либо газом (например, неоном) и запаянную с обоих концов вместе с проволочками (обычно — плати новыми )>
31
Если мы обе эти проволочки присоединим к разным полюсам батареи: одну к отрицательному (катоду), а другую — к положительному (аноду), то по цепи пойдет ток совершенно так же, как и в случае с электролитом. Вероятно, именно эта аналогия с явлениями электролиза и побудила Фарадея в 1838 г. построить прообраз такой трубки («электрическое яйцо» Фарадея). Как мы увидим позже, аналогия была чисто внешней, но явление проводимости газов оказалось настолько интересным, что многие исследователи посвятили жизнь изучению его свойств.
Примерно в середине прошлого века Юлиус Плюккер (1801 —1868) оставил свои занятия геометрией и принялся изучать явление проводимости газов. Прежде всего Плюккер установил, что проводимость газа зависит от его плотности в трубке и возрастает, если часть газа из трубки откачать. При этом каждый газ начинает светиться своим характерным цветом. (Когда вы следите сегодня за игрой световых реклам, вы обязаны этим зрелищем профессору математики в Берлине и Бонне. Именно Плюккер в 1858 г. изобрел эти светящиеся трубки.) При увеличении разрежения в трубке вблизи катода появляется темное пространство («катодное пятно»), которое при дальнейшем откачивании газа расширяется и, наконец, заполняет всю трубку: она перестает светиться. Но это темное пространство живет: его пронизывают какие-то «лучи», хоть и невидимые для глаза (как невидима летящая пуля, пока не встретит препятствия на своем пути).
Ученик Плюккера Евгений Гольдштейн (1850—1931) в 1876 г. дал им название:
катодные лучи. Еще раньше, в 1869 г., другой его ученик, Иоганн Вильгельм Гитторф (1824—1914), обнаружил отклонение этих лучей в магнитном поле, и, наконец, в 1879 г. Кромвель Вэрли (1828—1883) показал, что они заряжены отрицательно.
Вначале пытались понять эти явления на языке волновых представлений (хотя Вэрли еще в 1871 г. предпочитал

корпускулярную точку зрения). Такое стремление объясняется просто: все еще слишком хорошо помнили знаменитый спор Ньютона и Гюйгенса о природе света и потому всякую попытку объяснить наблюдаемые явления корпускулярным излучением воспринимали как возвращение к средним векам.
Поставьте себя на место этих исследователей в 70-е годы XIX века: у вас в руках набор интересных фактов, однако связи между ними не видно. С одной стороны, явление проводимости газов очень напоминает процессы электролиза, но, с другой,— происходят вещи совсем непонятные: например, проводимость растет с уменьшением плотности газа в трубке. Кроме того, обнаружен только поток отрицательных «лучей» и не обнаружено положительных. Нужна была руководящая идея.
Такая идея возникла под влиянием блестящих опытов, которые поставил Уильям Крукс (1832—1919) — английский физик и химик. Это был интересный человек, наделенный, к тому же, редким даром — предвидеть фундаментальные открытия.
Прежде всего, используя более совершенный насос, он гораздо сильнее откачал воздух из трубки. При этом от катода отделилось еще одно, более темное пространство, которое также постепенно заполнило всю трубку, после чего анод вспыхнул зеленоватым светом. Тот день 1878 г., когда это произошло, можно считать днем рождения электронно-лучевой трубки — основной части современного телевизора. Уже за одно это Круксу обеспечено признание потомков. Но для самого Крукса это было только началом — он стал тщательно изучать свойства «лучистой материи» (этот термин ввел все тот же Фарадей еще в 1816 г.). Крукс чувствовал, что столкнулся с совершенно новым явлением природы, и предлагал назвать его «четвертым состоянием вещества», которое «ни жидко, ни твердо, ни газообразно». Он писал:
«Изучая четвертое, лучистое состояние материи, мы, как мне кажется, имеем под руками и в сфере наших исследований те первичные атомы материи, из которых, как вполне основательно предполагают, состоят все тела природы. Мы видим, что лучистая* материя по одним своим свойствам так же материальна, как вот этот стол, по другим — она скорее похожа на лучистую энергию. Мы действительно коснулись той пограничной области, где материя и энергия переходят друг в друга. Я думаю, что величайшие задачи будущего найдут свое разрешение именно в этой пограничной области; более того, здесь, как мне кажется, лежит граница всего реального мира».
Чтобы оценить смелость Крукса, надо вспомнить, что в то время весь мир разделяли на материю и эфир и при этом противопоставляли их друг другу: с материей отождествляли частицы, а с эфиром — среду, колебания которой мы воспринимаем как лучи света. Таким образом, «лучистая материя» Крукса должна была совмещать в себе свойства несовместимые: волны и частицы. Через полстолетия все могли убедиться, насколько он был прав, но в то время (по словам Оливера Лоджа — современника и соотечественника Крукса) «предположение Крукса имело судьбу тех проблесков мысли, которые иногда разрешаются авторам, но подвергаются насмешкам со стороны ортодоксальной науки их времени».
Независимо от смысла, который Крукс вкладывал в понятие «лучистая материя», он бесспорными опытами обнаружил у нее такие свойства: она распространяется прямолинейно; вызывает свечение тел и может их даже расплавить; отклоняется в электрическом и магнитных полях; проникает сквозь твердые тела, а в воздухе проходит путь 7 см, в то время как атомы — только 0,002 см. Опираясь на эти факты, Уильям Крукс утверждал: катодные лучи, или «лучистая материя»,— это поток быстрых отрицательных частиц, размер которых значительно меньше размеров атомов. Легко убедиться, что одна эта гипотеза проясняла все свойства катодных лучей. В частности, таким способом можно было легко объяснить появление темного пространства у катода: его размер определялся просто средним расстоянием, которое пролетают электроны, не сталкиваясь с атомами газа. Очевидно, это расстояние растет по мере выкачивания газа из трубки. Но главное значение гипотезы в другом: именно она стала той руководящей идеей, которая позволила почувствовать себя устойчиво в море фактов, накопленных к тому времени.
Физики знали теперь, куда идти и что искать: необходимо было выделить этот гипотетический «атом электричества»
и определить его свойства: заряд, массу и размеры.
На это понадобилось почти 20 лет и усилия таких больших физиков, как Джозеф Джон Томсон (1856—1940), Джон Таунсенд (1868—1957), Вильгельм Вин (1864—1928), Джордж Фитцджеральд (1851 —1901), Эмиль Вихерт (1861 — 1928), Жан Перрен (1870—1942), Роберт Эндрюс Милликен (1868—1953). У нас нет возможности рассказать сейчас об остроумии и тонкости опытов, которые придумали эти и многие другие ученые. Поэтому проследим просто, как гипотетический «атом электричества» обретал постепенно реальные свойства, пока не стал, наконец, основой физики.
Прежде всего, Жан Перрен в 1895 г. окончательно доказал: заряд катодных лучей отрицателен. В течение последующих двух лет выяснили: их скорость равна около одной десятой скорости света, то есть примерно в 10 тыс. раз больше скорости ружейной пули и скорости теплового движения атомов. Кроме того, эти и все остальные их свойства не зависят
от

состава газа в трубке. А это означало, что катодные частицы — непременная составная часть всех атомов. И, наконец, в 1897 г. Дж. Дж. Томсону удалось определить заряд
е и массу
tn отдельного «атома электричества»: оказалось, что масса этих частиц примерно в тысячу раз меньше массы атома водорода, а заряд равен заряду иона водорода, измеренному при изучении явления электролиза.
Это было неожиданно. Посудите сами: явления электролиза и проводимости газов изучали разные науки, которые развивались независимо друг от друга, и в них на протяжении десятилетий сформировались свои понятия. И вдруг они оказались тесно связанными. «Такие факты в истории науки,— говорил ученик Планка, лауреат Нобелевской премии по физике Макс Лауэ,— самое сильное доказательство ее истинности». Для физиков это всегда праздник.
История электрона — хороший способ усвоить логику открытий нынешней физики: исходя из наблюдений, ученые выдвигают на их основе гипотезы, которые вновь проверяют опытом, и, наконец, процесс этот завершается теорией, то есть сжатым объяснением частных явлений на основе немногих общих принципов.
Гипотеза об электроне возникла из наблюдений Фарадея, Плюккера и Крукса. Плодотворность ее была проверена и доказана в опытах Дж. Дж. Томсона и других физиков. И, наконец, Гендрик Антон Лоренц (1853—1928) настолько поверил в реальность электрона, что создал на основе этой гипотезы теорию, следствия из которой вновь можно было проверить. Процесс этот беспределен, но это — единственный способ движения науки.
В очередную пятницу 30 апреля 1897 г. на вечернем заседании Королевского института Джозеф Джон Томсон доложил о своих исследованиях. После сорока лет усилий в физике получила права гражданства первая «элементарная частица» — электрон. Это было самое важное событие
со времени признания реальности атома.
В тот год узнали, что существуют частицы значительно меньше атомов; что они входят в состав всех атомов; что не только материя,
но и электричество имеет атомистическую структуру. Все это означало, что
в природе реально существует материальный носитель наименьшего заряда.
Как и атом, электрон признали далеко не сразу. Еще в 1902 г. Оливер Лодж писал: «...электрон — это чисто гипотетический заряд, изолированный от атома». И даже в 1920 г. великий Рентген продолжал сомневаться в его существовании.
Физики, которые сразу поверили в реальность электронов, начали тщательно измерять его характеристики: заряд
е и массу
т. Благодаря их трудам (особенно трудам Роберта Милликена, который с 1909 по 1940 гг. периодически возвращался к этой задаче), мы сейчас знаем значения этих величин с большой точностью:
т = 9,109389-10~
28 г,
е=4,803207 -10~
10 ед. СГСЭ = 1,602177 -10 “
19 Кл.
А размер? Каковы размеры электрона? Увы, нам это неизвестно до сих пор. Мы не уверены даже, имеет ли вообще этот вопрос четкий смысл. В самом деле, о свойствах электрона мы узнаём, изучая его взаимодействия с другими частицами и полями. Но для понимания результатов всех этих опытов нам достаточно знать только массу и заряд электрона и совершенно не нужны его размеры. Не исключено, что такого свойства у электронов и вправду нет. Ведь нельзя же указать толщину экватора, хотя длину его измерить можно. Или, быть может, размер электрона зависит от условий опыта? Такую возможность тоже нельзя отрицать заранее: ведь изменяет же комета свои размеры, приближаясь к Солнцу, хотя масса ее при этом остается постоянной. Все это — не праздные вопросы, и мы к ним еще возратимся.
АТОМЫ, ЭЛЕКТРОНЫ, ВОЛНЫ
Мы только что повторили тот сложный путь, который прошли исследователи в конце прошлого столетия. Это было время, когда обилие новых явлений заслоняло простые связи между ними, когда нужна была большая вера в гармонию природы, чтобы не потеряться в хаосе пестрых фактов и разноречивых гипотез.
Истинно великое открытие не только отвечает на старые вопросы, но и порождает новые. Открытие электрона вызвало воодушевление физиков. Однако вскоре на смену ему пришли новые заботы: как электроны связаны в атоме? Сколько их там? Покоятся они или движутся? И как эти движения связаны с излучением атомов? Форма и характер вопросов меня-
36
лись, но постепенно все они свелись к задаче: необходимо узнать число, размеры и расположение электронов в атоме, а также их влияние на процессы излучения.

В то время было еще не ясно, имеют ли вообще такие вопросы смысл. К тому же в конце века отнюдь не все верили в существование атомов, а потому и попытки понять их внутреннее устройство воспринимались тогда как некая игра ума. Большинство, не утруждая себя фантазией, представляло ^ебе электрон маленьким шариком диаметром 10“
13 см, который «как-то» закреплен внутри атома либо летает там наподобие мухи в соборе. Для начала хотели понять главное: почему атом излучает спектральные линии строго определенной длины волны и почему этих линий так много (у атома железа, например, только в видимой части спектра свыше 3000). Как всегда, в отсутствие глубоких идей мыслили аналогиями: все хорошо помнили, что частота колебаний пружины с грузиком зависит от ее упругости, следовательно, рассуждала часть физиков, и в атоме электроны связаны какими-то «пружинами» различной упругости. Когда мы возбуждаем атом, электроны начинают колебаться и при этом излучают свет с частотой колебания пружинок. Отсюда, по мысли Локьера, сразу следовало, что число электронов в атоме равно числу линий в спектре элемента. Кроме того, атом с подобным устройством будет наиболее охотно поглощать именно то излучение, которое он сам испускает. А ведь именно это и обнаружили Кирхгоф и Бунзен в своем знаменитом опыте с парами натрия!
Несмотря на эти успехи модели атома с упруго связанным электроном, многие понимали ее логическое или, точнее, эстетическое несовершенство. А вскоре обнаружились и прямые противоречия с опытом. Дж. Дж. Томсон, изучая рассеяние рентгеновского излучения на атомах различных элементов, пришел к выводу, что число электронов в атоме сравнительно невелико и равно примерно половине атомной массы элемента. В 1904 г. Дж. Дж. Томсон предложил свою модель атома, развив гипотезу Уильяма Томсона (лорда Кельвина): внутри положительного равномерно заряженного атома-шара диаметром 10“
8 см плавают отрицательные электроны, квазиуп-руго с ним связанные. Число электронов равно заряду шара, так что в целом атом оказывается нейтральным, как это и следует из опыта. В начале века почти все физики приняли модель Томсона, и лишь немногие предлагали другие модели. Но все чувствовали: в науке об атоме наступает новая эпоха.
Открытие спектрального анализа
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
Слово «спектр» в физику ввел Ньютон. На классической латыни, которой он пользовался в своих научных трудах, слово «spectrum» означает «дух», «привидение», что довольно точно отражает суть явления: возникновение праздничной радуги при прохождении бесцветного солнечного света через прозрачную призму. Почти два столетия эти «духи» позволяли молча себя разглядывать, пока ученые не заставили их заговорить на языке квантовой физики.
Открытие спектрального анализа вызвало живой интерес даже у публики, далекой от науки, что по тем временам случалось весьма не часто. Как всегда в таких случаях, досужие любители отыскали множество других ученых, которые якобы все сделали задолго до Кирхгофа и Бунзена. Называли французского ученого Жака Бернара Леона Фуко (1819— 1868), предложившего аналогичный опыт за десять лет до них, знаменитого астронома Джона Фредерика Гершеля (1792—1871), изобретателя фотографии на бумаге Уильяма Генри Фокса Тальбота (1800—1877) и многих других. Англичане еще долгое время спустя утверждали, что спектральный анализ открыл их знаменитый соотечественник Джордж Габриэль Стокс (1819—1903), который в разговоре с Уильямом Томсоном (1824—1907) высказывал предположение, что D-линия в спектре Солнца возникает при прохождении белого солнечного света через пары натрия в газовой оболочке Солнца. Сам Стокс с присущим ему благородством отказывался от подобных притязаний, хотя и признавал, что излагал похожие мысли студентам на лекциях, считая, однако, их общеизвестными и не особенно важными. (Кстати, именно в то время у Питера Тэта (1831—1901) возникла идея научных обзоров: он упрекал Стокса и Уильяма Томсона за беспечность и плохое знание литературы, которые помешали им опубликовать очевидную идею.) Пожалуй, следует упомянуть здесь и Юлиуса Плюккера, который знал, что каждый газ светится своим характерным цветом, но выводов и обобщений из этого наблюдения не сделал.
В отличие от многочисленных предшественников, Кирхгоф и Бунзен сразу же поняли значение своего открытия. Они впервые отчетливо уяснили себе (и потому так легко убедили в этом других), что спектральные линии — это характеристика атомов вещества, а не особенностей строения призмы или свойств солнечных лучей. Кирхгоф немедленно стал составлять подробный атлас фраунгоферовых линий солнечного спектра и определил химический состав Солнца. За этой работой он испортил себе зрение и уже в 1861 г. вынужден был ее оставить.
История и существо открытия спектрального анализа могут составить предмет увлекательного повествования, на что мы сейчас, к сожалению, не можем отвлечься. Напомним только один любопытный случай, имевший место вскоре после открытия Кирхгофа и Бунзена.
18 августа 1868 г. французский астроном Пьер Жюль Сезар Жансен (1824—1907) во время солнечного затмения в Индии наблюдал в спектре солнечной короны желтую линию неизвестной природы. Два месяца спустя английский физик Джозеф Норман Локьер (1836—1920) научился наблюдать корону Солнца, не дожидаясь солнечных затмений, и при этом обнаружил в ее спектре ту же самую желтую линию. Неизвестный элемент, который ее испускал, он назвал
гелием, то есть солнечным элементом. Оба ученых написали о своем открытии письма во Французскую академию наук, оба письма пришли туда одновременно и были зачитаны на заседании академии 26 октября 1868 г. Такое совпадение поразило академиков, и они решили в честь этого события выбить памятную золотую медаль: с одной стороны профили Жансена и Локьера, с другой — бог Аполлон на колеснице и надпись: «Анализ солнечных протуберанцев».
На Земле элемент гелий был открыт в 1895-г. Уильямом Рамзаем в минералах тория.
У истоков телевидения
Прототип современного телевизора, который — наряду с автомобилем, самолетом и телефоном — наиболее отчетливо представляет лицо современной цивилизации, следует искать в тихих лабораториях середины прошлого века.
В 1854 г. немецкий стеклодув и механик из Бонна Генрих Гейсслер (1815—1879) изобрел масляный насос, что позволило улучшить вакуум в закрытых стеклянных трубках, и научился впаивать в них электроды. Примерно в то же время базельский механик Генрих Даниэль Румкорф (1803— 1877) выпустил в продажу индукционные аппараты (так называемая «катушка Румкорфа», изобретенная в 1838 г. американским врачом Пейджем (1812—1868)), которые позволяли получать искры длиной в несколько сантиметров. Вначале оба эти изобретения служили в основном для развлечения: картина свечения газоразрядных трубок при включении их в цепь катушки Румкорфа настолько красива, что может привлечь к себе даже праздное любопытство. Но и ученые не остались равнодушными к новому явлению.
В 1856 г. из Лейпцига в Бонн переехал математик Юлиус Плюккер, которому на новом месте работы было предписано также читать лекции по физике («координаты Плюккера» известны теперь каждому математику, но в то время его работы не нашли признания среди современников).
В Бонне Плюккер увлекся опытной физикой, подолгу экспериментировал с трубками Гейсслера и занимался их усовершенствованием. Вскоре их стали называть трубками Плюккера, еще тридцать лет спустя — трубками Крукса, Гитторфа, Ленарда, а после исследований Дж. Дж. Томсона и открытия электрона появится «трубка Брауна» — прототип электронно-лучевой трубки, которую построил в 1897 г. Карл Фердинанд Браун (1850—1918), немецкий физик, удостоенный за свои работы в 1909 г. Нобелевской премии по физике.
Уильям Крукс
Родился Крукс в семье торговца на Риджен-стрит. Был он старшим из 16 детей от второго брака, и в семье росло еще 5 детей от первого брака. Как он сам говорил, в его доме вряд ли знали слово «наука», и первоначальное образование он получил у дяди, дверь книжной лавки которого находилась рядом с магазином отца.
В 19 лет он оканчивает только что открытый Королевский химический колледж и там же продолжает работать ассистентом. Одновременно с этим он посещает в Королевском институте лекции Фарадея, которые произвели на него незабываемое впечатление. В 1861 г. он открыл элемент таллий, а в 1863 г. его избрали членом Королевского общества, где 30 ноября 1878 г. он докладывал о свойствах катодных лучей.
Ходил упорный слух, что он был близок к открытию рентгеновских лучей. Дело в том, что во время экспериментов с катодными лучами он постоянно обвинял компанию Ильфор-да в том, что она поставляет ему засвеченные фотопластинки. (Как мы теперь понимаем, рентгеновские лучи, возникающие при столкновении электронов со стенками трубки, вполне могут засветить фотопластинки даже в закрытой коробке.) Слух не подтвердился, во всяком случае сам Крукс об этом нигде не упоминал публично.

Крукс был удивительно богатой натурой: изобретатель, биржевой делец, издатель журнала «Химические новости» и чистый исследователь — в одно и то же время. Человек он был приветливый, уравновешенный, преданный своей семье и осмотрительный с людьми посторонними. Крукс нигде не служил, всецело был предан науке, что не помешало ему, однако, верить в спиритизм и в 1913 г. стать президентом Королевского общества.
История его занятий спиритизмом такова. В 1867 г. в Гаване от желтой лихорадки умер его младший брат Филипп, которого он горячо любил. Ученик Крукса Кромвель Вэрли посоветовал ему пообщаться с умершим братом с помощью спиритизма. В 1874 г. Крукс прекратил эти занятия, хотя так и не отказался от своих убеждений.
«Это был исключительно независимый, оригинальный и мужественный ум, он смотрел на явления по-своему и не боялся высказывать мнения, в корне отличные от утверждений всех прежних ортодоксов»,— говорил о нем впоследствии Дж. Дж. Томсон.
Кинетическая теория газов
Подобно ученым XIX века мы стремимся в нашем изложении проникнуть в глубь атома. Но наряду с этими попытками в том же XIX веке пробовали объяснить физические свойства тел, не входя в детали внутреннего строения атомов. Мысль, лежащая в основе этих попыток, предельно проста:
атомы, из которых состоят вещества в природе, не покоятся, а находятся в постоянном движении.
Оказалось, что подобное представление, если сформулировать его на языке математики, приводит к большому числу наблюдаемых следствий.
Такие попытки неоднократно предпринимались, начиная с Ньютона, который хотел объяснить газовый закон Бойля — Мариотта.
Уже Фрэнсис Бэкон утверждал, что теплота есть движение, и Роберт Бойль был с ним в этом согласен. Однако создателем кинетической теории материи следует считать Даниила Бернулли (1700—1782). Он родился в семье выходцев из Голландии, которая дала миру более ста выдающихся и знаменитых ученых, артистов, литераторов и государственных деятелей. Вопреки воле отца Даниил обучился математике у своего старшего брата Николая и затем закончил образование в Италии. В 1725 г. вместе с Николаем он едет в Петербург, куда петровские реформы привлекли многих иностранцев. Спустя восемь месяцев Николай умирает, а Даниил — профессор математики — прожил в Петербурге еще семь лет — до тех пор, пока мог переносить русский климат и образ жизни. Там он написал свою «Гидродинамику», которую напечатал в 1738 г. в Базеле, через пять лет после возвращения.
Примерно в то же время и в том же Петербурге сходные мысли развивал Л4ихаил Васильевич Ломоносов.
Кинетическую теорию газов постигла странная судьба. «Гидродинамику» Бернулли не заметили и обнаружили только спустя 120 лет, в 1859 г. А работы Ломоносова, написанные в 1742—1747 гг., стали известны лишь в 1904 г.
В XIX веке произошло второе рождение кинетической теории газов, поначалу тоже неудачное. В 1821 г. школьный учитель из Бристоля Джон Херэпет (1790—1868) высказывает вновь кинетическую гипотезу, но ее опять оставляют без внимания. Четверть века спустя, в 1845 г., морской инструктор Ост-Индской компании в Бомбее Джон Джеймс Уотерстон (1811—1883) прислал в Лондон в Королевское общество обширный трактат по кинетической теории газов. Это сочинение не напечатали, поскольку рецензенты оценили его как «нелепость, негодную даже для чтения перед Королевским обществом». Только в 1892 г. лорд Рэлей отыскал рукопись Уотерстона в архивах и опубликовал ее.
Причину такого единодушного забвения этих трудов следует искать в мировоззрении физиков того времени. Отчасти тому виной были тогдашние философские учения: в середине XIX века почти все философы отрицали существование атомов. (Что само по себе очень странно, поскольку для философов XVIII века факт существования атомов' был не только очевидным, но даже тривиальным.)
Тем не менее идеи Херэпета и Уотерстона не погибли: они решающим образом повлияли на работы Джеймса Прескотта Джоуля (1818—1889), который в 1851 г. впервые оценил скорость молекул газа. Она оказалась неожиданно большой: например, молекулы водорода при комнатной температуре движутся со скоростью 1800 м/с — вдвое быстрее артиллерийского снаряда.
В дальнейшем развитие кинетической теории материи пошло быстрее: ее переоткрыли Крёниг (1856 г.) и Клаузиус (1857 г.), развили почти до современного состояния Максвелл (1860 г.) и Больцман (1878 г.) Но уже десять лет спустя она вновь «вышла из моды», работам Больцмана «больше удивлялись, чем признавали их», его самого называли «последней опорой атомистики», да и сам он с грустью признавал: «Я последний, кто отрицает возможность построения любой иной картины мира, кроме атомической». Эта новая волна недоверия проникла в учебники и научные статьи. Например, в известном учебнике П. Г. Тэта (1885 г.) читаем: «Твердый атом... живет (в виде невероятной, но все еще не опровергнутой гипотезы) и поднесь... Однако несравненно правдоподобнее теория, по которой материя непрерывна, то есть не состоит из частиц с промежутками». И даже в 1898 г. в одном из научных журналов писали, что «теория кинетическая так же ошибочна, как и механическая теория гравитации».
Однако лавина открытий начала XX века смела без следа эти запоздалые сомнения, и с тех пор
кинетическая теория — одна из осноеных наук о строении материи, с помощью которой объяснили теплоемкость и теплопроводность твердых тел, упругость и вязкость газов к многое другое.
Михаил Васильевич Ломоносов
Первый русский ученый Михайло Васильевич Ломоносов родился 8 ноября 1711 г. в далекой северной деревне Дени-совке на одном из островов Северной Двины вблизи города Холмогоры. Зимой 1731 г., двадцати лет от роду, он пришел с обозом в Москву и только здесь начал учиться. 4 апреля 1765 г. он умер русским академиком и почетным членом академий Стокгольмской и Болонской.
Мощь натуры, широта интересов, сила творческого гения — все поражает в Ломоносове. Он был первым, кто начал читать научные лекции на русском языке. Для этого необходимо было разработать научную терминологию — и он создал ее. Он написал первый русский учебник по минералогии и заложил основы современного русского стихосложения; руководил составлением карты России и писал сочинения «О размножении и сохранении Российского народа»; создавал мозаичные картины из приготовленных им самим цветных стекол и снаряжал экспедицию для отыскания морского пути в Индию вдоль северного берега России; изготовлял инструменты для морской навигации и построил первую химическую лабораторию в России.
В 1755 г. при активном участии Ломоносова в Москве был открыт первый русский университет, названный впоследствии его именем.

|
|
М. В. Ломоносов
|
Естественнонаучные взгляды Ломоносова стояли на уровне века, а зачастую и впереди него. Он был последовательным сторонником атомистики и столь же непримиримым противником теплорода. За 40 лет до Лавуазье Ломоносов систематически использовал весы в химических исследованиях, знаменитый опыт с прокаливанием металлов в запаянных ретортах он осуществил на 17 лет раньше Лавуазье и за 30 лет до Гершеля открыл атмосферу на Венере.
Ему приходилось нелегко: в то время Россия была феодальной неграмотной страной и занятия наукой не считались в ней почетным делом. Ломоносов был вынужден искать покровителей при дворе, заниматься множеством не относящихся к науке дел, но своим ученикам внушал: «Что может быть приятнее и полезнее потомству, чем физико-химические опыты, проделанные в свободное от более важных дел время».
Причину тепла и холода Ломоносов видел «во взаимном движении нечувствительных физических частичек». В 1744 г. он представил Петербургской академии наук диссертацию «Размышления о причине тепла и холода».
В протоколах Академии об этой работе сохранился отзыв, в котором сказано, что «адъюнкт Ломоносов слишком рано принялся за сочинение диссертаций». Низкая культура тогдашней Петербургской академии и прогрессирующая в дальнейшем изоляция России привели к тому, что научные труды Ломоносова не оказали влияния на последующее развитие мировой науки. Они были забыты, и в течение полутора столетий даже на родине о нем помнили почти исключительно как о придворном поэте. Лишь позже, к двухсотлетию со дня его рождения, постепенно извлекли из архивов научные труды Ломоносова и оценили величие этого воистину российского таланта.
ГЛАВА 3
Ганеша
Примерно половину знаний о внешнем мире человек приобретает в возрасте до пяти лет. В последующие десять лет он узнает о мире почти все и свои дальнейшие познания о нем (за исключением специальных) пополняет очень медленно. Быть может, потому, что к этому времени он уже успевает приобрести взрослую привычку — узнавая что-либо новое, обязательно спрашивать: «А для чего это?» При знакомстве с квантовой физикой эта вредная привычка очень мешает, потому что на первых порах не ясны ни суть атомных явлений, ни их относительная важность в общей картине. В этой ситуации надо поступать подобно детям, которые учатся говорить. Вначале они слышат непонятные им звуки, затем бессмысленно перебирают и повторяют слова и, наконец, замечают, что между ними существуют логические связи. Постепенно они убеждаются, что сами по себе слова часто ничего не означают, но иногда обретают неожиданный смысл, если произнести их в определенном порядке. Конечно, пройдет немало времени, пока они научатся улавливать самые тонкие оттенки мыслей и настроений за простыми сочетаниями обыденных слов. По существу, только тогда дети и становятся взрослыми.
В этой главе мы узнаем довольно много новых фактов об атомах, волнах и квантах. Быть может, выбор фактов и та уверенность, с которой мы будем их толковать, покажутся вначале не очень обоснованными — как ребенку поступки взрослого человека. Но с этим ничего нельзя поделать. Узнавая впервые непривычную реальность атомной физики, все мы поневоле становимся похожими на детей, вступающих в новый для них мир. Без фактов — нет науки. И чтобы наилучшим образом усвоить их — станем на время детьми, которые всегда больше знают, чем понимают.
* Конец прошлого и начало нашего века часто называют героическим периодом физики. Это было время, когда каждый год приносил неожиданные открытия, фундаментальность которых очевидна даже сейчас, более полувека спустя. Одно из таких открытий связано все с той же трубкой Крукса.
8 ноября 1895 г. в лаборатории университета в Вюрцбурге Вильгельм Конрад Рентген (1845—1923), изучая катодные лучи, обнаружил новое излучение, которое возникало в том месте анода, куда падал пучок электронов. Свойства этого излучения были пугающе необычны: оно без труда пронизывало человеческое тело и даже закрытые дверцы сейфов.
Одного этого открытия было бы достаточно, чтобы нарушить привычный рабочий распорядок многих лабораторий мира. Но эпоха открытий только начиналась. Несколько месяцев спустя, в марте 1896 г., Антуан Анри Беккерель (1852—1908) открыл новый тип излучения, еще более странный: оно возникало самопроизвольно в куске урановой руды. Последующие опыты показали, что оно состояло из электронов, гамма-квантов и положительно заряженных частиц, которые Резерфорд назвал а-частицами.
Некоторые вещества (например, ZnS) начинали светиться, если на них попадал пучок а-частиц. Это позволило все тому же Уильяму Круксу в 1903 г. изобрести спинтарископ — прибор, который позволял видеть вспышки от единичных а-частиц, попадавших на экран из сернистого цинка.
Теперь эти два открытия хорошо известны, но мы о них все-таки напомнили, ибо без них история атома была бы все-таки неполной.
ПЛАНЕТАРНЫЙ АТОМ
В начале века в физике бытовали самые разные и часто фантастические представления о строении атома. Например, ректор Мюнхенского университета Фердинанд Линдеман (ему принадлежит доказательство трансцендентности числа л) в 1905 г. утверждал, что «атом кислорода имеет форму кольца, а атом серы — форму лепешки». Продолжала жигь и теория «вихревого атома» лорда Кельвина, согласно которой атом устроен подобно кольцам дыма, выпускаемым изо рта опытным курильщиком. (О ней Кирхгоф говорил: «Это прекрасная теория, потому что она исключает любую другую».)
Но большинство физиков склонялось к мысли, что прав Дж. Дж. Томсон: атом — это равномерно положительно заряженный шар диаметром 10~
8 см, внутри которого плавают отрицательные электроны (или
корпёсли, как писали в русских изданиях начала века), размеры которых 10"
13 см. Сам Джи-Джи — как его называли ученики — относился к своей модели без энтузиазма, а часть физиков представляла себе атом совсем иначе.
Одни об этом говорили вслух. Среди них были Джонстон Стоней, предполагавший еще в 1891 г., что «электроны движутся вокруг атома, подобно спутникам планет»; Жан Перрен, пытавшийся в 1901 г. представить себе «нуклеарнопланетарную структуру атома»; японский физик Хантаро Нагаока, утверждавший в 1903 г., что «пространства внутри атома чрезвычайно громадны по сравнению с размерами самих, образующих его, электрических ядрышек, иными словами, атом представляет своего рода сложную астрономическую систему, подобную кольцу Сатурна». С этими утверждениями были согласны многие: сэр Оливер Лодж, французский физик Поль Ланжевен, норвежский ученый Карл Антон Бьеркнес — этот список можно продолжить.
Другие, как Петр Николаевич Лебедев, доверяли подобные мысли только своему дневнику: в 1887 г. ему казалось, что частота излучения атомов должна определяться частотой вращения электрона по орбите. А голос известного ученого-народника Николая Морозова не был слышен сквозь стены шлиссельбургской крепости.
Но ни один сторонник идеи планетарного атома не мог объяснить главного: устойчивости системы, состоящей из положительной сердцевины и электронов, которые вокруг нее вращаются.
Действительно, на круговой орбите электрон движется ускоренно и, следовательно, по теории Максвелла — Лоренца, должен терять энергию на излучение. Это излучение настолько интенсивно, что уже через 10“
11 с электрон обязан упасть на положительный центр притяжения. (Этот результат, полученный немецким ученым Шоттом в 1904 г., надолго станет решающим аргументом во всех спорах о структуре атома.)
Ничего похожего в природе не происходит: реальный атом не только устойчив, но и восстанавливает свою структуру после разрушений, как будто бы свидетельствуя тем самым в пользу модели Томсона. Однако в физике уже более двухсот лет принято правило: окончательный выбор между гипотезами вправе сделать только опыт. Такой опыт поставил в 1909 г. Эрнест Резерфорд (1871—1937) со своими «мальчиками», как он называл своих сотрудников.

Представьте себе крупного и шумного человека, который принужден сидеть в темной комнате и, глядя в микроскоп, считать на экране спинтарископа вспышки — сцинтилляции (от лат. scintilla — искра) а-частиц. Работа изнурительная: уже через две минуты глаза устают. Ему помогают опытный исследователь Ганс Гейгер (1882—1945) и двадцатилетний лаборант Эрнст Марсден (1889— 1970). Их прибор несложен: ампула с радием-С, испускающим а-частицы, диафрагма, которая выделяет из них узкий пучок и направляет его на экран из сернистого цинка, и микроскоп, через который наблюдают сцинтилляции а-частиц на экране. Место появления очередной сцинтилляции предугадать нельзя — они возникают беспорядочно, но так, что в целом на экране получается довольно резкое изображение щели диафрагмы.
Если на пути а-частиц поставить металлическую фольгу, то вместо резкого изображения щели на экране возникает размытая полоса. Она лишь немного шире изображения щели, получаемого в первом случае: частицы отклоняются от прямолинейного пути в среднем всего на 2°, однако несложный расчет показывает: чтобы объяснить даже такие небольшие отклонения, нужно допустить, что в атомах фольги могут возникать огромные электрические поля напряженностью свыше 200 кВ/см. В положительном шаре атома Томсона таких напряженностей быть не может. Столкновения с электронами — также не в счет: ведь по сравнению с ними а-частица, летящая со скоростью 20 км/с, все равно, что пушечное ядро рядом с горошиной. И все же пути а-частиц искривлялись. В поисках разгадки Резерфорд предложил Марсдену

проверить: а не могут ли а-частицы отражаться от фольги назад? С точки зрения модели Томсона предположение совершенно бессмысленное: пушечное ядро не может отразиться от горошины. Прошло два года. За это время Гейгер и Марсден сосчитали более миллиона сцинтилляций и доказали, что назад отражается примерно одна а-частица из 8 тысяч.
7 марта 1911 г. Манчестерское философское общество — то самое,
президентом которого был когда-то Джон Дальтон,— услышало доклад Резерфорда «Рассеяние а- и р-лучей и строение атома». В тот день слушатели узнали, что атом подобен Солнечной системе: он состоит из ядра и электронов, которые обращаются вокруг него на расстояниях примерно

10“
8 см. Размеры ядра очень малы — всего 10“
13—10“
12 см, но в нем заключена практически вся масса атома. Заряд ядра положителен и численно равен примерно половине атомной массы элемента.
Сравнение с Солнечной системой не случайно: диаметр Солнца (1,4-10
6 км) почти во столько же раз меньше размеров Солнечной системы (6*10
9 км), во сколько размеры ядер (10“
12 см) меньше диаметра атома (10~
8 см).
Мы настолько свыклись с новыми понятиями, что, объясняя понятия электроники, ссылаемся на телевизор, а рассказывая о механике, приводим в пример паровоз. Поэтому сейчас нам трудно понять тогдашнее недоумение людей, по силе ума равных Резерфорду. Действительно, ведь все так прозрачно: просто а-частица отражается от ядер атомов. К этой картине мы привыкаем со школы. Но чтобы нарисовать ее в первый раз, необходима была выдающаяся научная смелость. Прежде чем эта картина попала в учебники, пришлось не только сосчитать свыше миллиона сцинтилляций: нужно было (как вспоминал в конце жизни Гейгер) «преодолеть такие трудности, смысл которых мы сейчас даже понять не в состоянии»; нужно было сначала в течение десяти (!) лет доказывать, что а-частицы — не что иное, как ядра атомов гелия. Обо всем этом постепенно забыли: результат был важнее и проще, чем путь, к нему приведший. О трудностях пути теперь можно было забыть: настало время думать о следствиях этого открытия.
Сообщение Резерфорда физики приняли сдержанно. Сам он в течение двух лет также не очень сильно настаивал на своей модели, хотя и был уверен в безошибочности опытов, которые к ней привели. Причина была все та же: если верить электродинамике, такая система существовать не может, поскольку электрон, вращающийся по ее законам, неизбежно и очень скоро упадет на ядро. Приходилось выбирать: либо электродинамика, либо планетарный атом. Физики молча выбрали первое. Молча, потому что опыты Резерфорда нельзя было ни забыть, ни опровергнуть. Физика атома зашла в тупик. И чтобы выйти из него, нужен был Нильс Бор.
СПЕКТРАЛЬНЫЕ СЕРИИ
Независимо от гипотез о строении атома ученые рано поняли, что знания о нем можно получить, изучая его линейчатый спектр (так музыкант по тону струны определяет ее длину, а по аккорду узнает инструмент). В физике всякое изучение в конечном итоге сводится к измерению. Поэтому прежде всего необходимо было научиться измерять длины волн как можно точнее, то есть еще пристальнее, чем Фраунгофер, исследовать структуру линейчатого спектра.
Первый спектроскоп Кирхгофа был довольно примитивным: две половинки зрительной трубы, коробка из-под сигар и призма, сделанная, правда, самим Фраунгофером. Впоследствии этот спектроскоп был значительно улучшен, но все-таки со временем он должен был уступить место более совершенным приборам с дифракционной решеткой, которые особенно искусно научился делать Генри Роуланд (1848— 1901)—представитель тогда еще молодой американской науки. С помощью этого прибора в течение нескольких десятилетий трудами Карла Рунге (1856—1927), Генриха Кайзера (1853—1940) и особенно лаборатории Фридриха Пашена (1865—1940) в Тюбингене были точно измерены длины волн десятков тысяч спектральных линий различных элементов и аккуратно записаны в длинные таблицы. (К 1913 г. общее число работ по спектральному анализу перевалило за 50 тысяч.) В частности, оказалось, что знаменитая желтая линия
D в спектре натрия состоит из двух очень близко расположенных линий:
D\ =5895,9236 А и />2 = 5889,9504 А. (1 А = 0,1 нм = 10“
8 см — один ангстрем равен примерно диаметру атома.)
Но высшая задача любой науки не в том, чтобы накоплять факты, а в том, чтобы установить связи между явлениями и найти их общую причину. Всем было ясно, что в этих длинных таблицах заключена обширная информация о структуре атома. Но как ее оттуда извлечь? (Вероятно, такие же чувства испытывали египтологи до Шампольона, глядя на иероглифы.)
Первый шаг всегда труден и незаметен. Поэтому об Иоганне Якобе Бальмере (1825—1898), который впервые обнаружил какую-то систему в этом хаосе чисел, мы знаем очень мало. Известно, что родился он 1 мая 1825 г. в маленьком городке Лаузене Базельского кантона, там же окончил среднюю школу, а затем изучал математику в университетах Карлсруэ, Берлина и Базеля. В 1869 г. он стал доктором философии и приват-доцентом Базельского университета, но вскоре оставил профессорское кресло и предпочел преподавать физику в женской гимназии. Бальмеру было уже 60 лет, когда он вдруг заметил, что четыре спектральные линии в видимой части спектра водорода расположены не беспорядочно, а образуют
серию, которую можно описать единой формулой

где % — длина волны спектральной линии, в ангстремах,
k = 3, 4, 5, 6 — целые числа, а постоянная
Ь = 3645,6 А.
Это простое соотношение заслуживает пристального внимания. Дело в том, что оно
точное, в чем каждый желающий может легко убедиться сам. Взгляните на таблицу, которую Бальмер составил в 1885 г.:
| Линия |
1, А (измерено Ангстремом) |
1, А (вычислено Бальмером) |
k
|
|
С
|
6562,10 |
6562,08 |
3 |
|
F
|
4860,74 |
4860,8 |
4 |
|
G
|
4340,1 |
4340,0 |
5 |
|
Н
|
4101,2 |
4101,3 |
6 |
В первом столбце приведены названия спектральных линий, данные им Фраунгофером, во втором — длины волн этих линий, которые незадолго перед этим тщательно измерил шведский физик Ионас Андерс Ангстрем (1814—1874). (Единица длины ангстрем названа в его честь.) В третьем столбце представлены длины волн, вычисленные по формуле Бальмера при целых числах
k, приведенных в четвертом столбце. Совпадение измеренных и вычисленных значений X поразительное. Такие совпадения не могут быть случайными, и потому открытие Бальмера не затерялось в архивах, а привело к целой серии новых исследований.
Иногда Бальмера изображают чудаковатым школьным учителем, который от нечего делать делил и умножал различные числа, пока случайно не набрел на простые связи между ними. Это неверно. Он был глубоко образованным человеком, писал статьи по разным вопросам проективной геометрии и постоянно возвращался к самым сложным проблемам теории познания. Например, в 1868 г. он опубликовал работу, в которой пытался выяснить соотношение между научными исследованиями и системами мировой философии. Сам он с юношеских лет находился под влиянием пифагорейцев с их учением о гармонии и мистической роли целых чисел в природе. Как и древние, Бальмер был убежден, что тайну единства всех наблюдаемых явлений следует искать в различных комбинациях целых чисел. Поэтому, когда его внимание привлек набор четко ограниченных спектральных линий, он подошел к этому явлению природы с уже готовой меркой. Его ожидания оправдались: оказалось, что длины волн спектральных линий связаны между собой простыми рациональными соотношениями.
С открытия Бальмера начинается целая эпоха в науке об атоме. По существу, вся теория атома начинается с его формулы. Тогда этого еще не знали, но, вероятно, почувствовали. Уже в 1886 г. Рунге заметил, что формула Бальмера становится прозрачнее, если ее записать не для длины волны X, а для частоты
у —с/к (здесь
с — 3- 1О
10 см/с — скорость света в вакууме):

А в 1890 г. шведский физик Иоганн Роберт Ридберг (1854— 1919) предложил записывать формулу в том виде, который она сохранила до сих пор:
Здесь
п и
k — целые числа, а постоянная
R— 109 677,58 см
-1 называется с тех пор постоянной Ридберга для атома водорода. Полагая в этой формуле п = 2, можно вычислить всю серию Бальмера, измеренную впоследствии вплоть до
k «50.
Тогда же возникла мысль записывать частоту в виде разности двух величин —
термов Тп и
Tk\
Пока что в такой записи не видно глубокого смысла, да и особых преимуществ тоже. Однако в 1908 г. молодой, рано умерший швейцарский ученый Вальтер Ритц (1878—1909) объяснил преимущества такой формы записи. Продолжая работы Ридберга, он сформулировал так называемый
комбинационный принцип: частоту произвольной линии в спектре

любого атома можно представить как разность двух термов
Тп и
Tk'
Vnk=Tn — Tk
даже в том случае, когда отдельный терм
Тп уже нельзя записать в таком простом виде, как для атома водорода.
На первый взгляд в этом нет никакого выигрыша: просто от набора частот мы перешли к набору термов. Однако это не так: попытайтесь прочесть книгу, в которой отсутствуют промежутки между словами, и вы сразу почувствуете разницу. Особенно если эта книга на неизвестном языке. Кроме того, чисел стало значительно меньше: чтобы определить частоты 50 линий водорода, которые были известны в начале века, достаточно знать десяток термов.
Неожиданно в хаосе чисел обнаружилась система. Беспорядочный набор линий распался на серии. В непонятной книге чисел стали различать отдельные слова. В простейшем случае — атома водорода — удалось разглядеть даже буквы, из которых они составлены. Однако смысл слов и происхождение букв по-прежнему оставались неизвестными: иероглифы спектральных линий еще не заговорили, хотя и не казались теперь столь загадочными. Стремление осмыслить структуру спектра и в самом деле напоминало попытки почти вслепую расшифровать незнакомый текст. Утомительная работа длилась больше четверти века, и отсутствие общей идеи отталкивало от нее глубокие умы. Необходимо было найти ключ к шифру.
Это сделал Нильс Бор в 1913 г.
ФОТОНЫ
Излучение возникает в результате процессов, происходящих в атоме, однако за его пределами существует независимо. Иногда оно состоит из волн одинаковой длины — такое излучение называют монохроматическим. Линейчатый спектр атома состоит из набора монохроматических волн, и наборы эти различны для разных атомов.
До сих пор нас большей частью интересовала только одна характеристика волн — их частота. Однако излучение — сложное явление, и его свойства нельзя свести только к частоте. Солнечный луч прозрачен, но вполне материален, он даже имеет массу: каждую секунду на квадратный метр освещенной поверхности Земли падает 7,3-10
-12 г света.
Действие излучения легче всего сопоставлять с морскими волнами, набегающими на берег: после работ Христиана Гюйгенса (1629—1695) и Огюстена Жана Френеля (1788—1827) такая аналогия стала бесспорной. Каждый год приносил этому новые доказательства в явлениях интерференции и дифракции света. В 1873 г. Джемс Клерк Максвелл (1831 — 1879) теоретически предсказал, что свет, падая на поверхность тел, должен оказывать на них давление (также в полном согласии с нашей аналогией). Световое давление — очень тонкий эффект, но Петр Николаевич Лебедев (1866— 1912) в 1899 г. все-таки обнаружил его экспериментально. Казалось, теперь волновая природа света доказана настолько надежно, что всякие дальнейшие опыты для ее проверки не имеют смысла. «Со времен Юнга и Френеля мы знаем, что свет — это волновое движение... Сомневаться в этих фактах больше невозможно; опровергать эти взгляды непостижимо для физика. С точки зрения рода человеческого волновая теория является очевидностью»,— писал в 1889 г. Генрих Рудольф Герц (1857—1894), трудами которого была экспериментально доказана волновая природа электромагнитного излучения и тем самым — справедливость уравнений Максвелла.
К счастью, опыты в физике ставят не только для проверки теорий. В 1887 г., за два года до того, как Генрих Герц написал приведенные строки, он сам же обнаружил явление, которое можно объяснить только корпускулярной природой излучения. Суть этого явления, которое впоследствии назовут фотоэффектом, пересказать довольно просто.
Если свет ртутной лампы (теперь мы такие лампы называем кварцевыми) направить на металл натрий, то с его поверхности полетят электроны. В конце века большая часть физиков уже ясно сознавала, что атом сложен, и потому само по себе это явление особенно никого не удивило. Довольно быстро все согласились с тем, что электроны в опыте Герца вылетают из атомов натрия под действием излучения кварцевой лампы. Странно и непонятно было другое — законы этого явления. Установлены они были Александром Григорьевичем Столетовым (1839—1896) и Филиппом Ленардом (1862—1947) на рубеже XX века. Эти ученые измеряли число выбитых электронов и их энергию в зависимости от интенсивности и частоты падающего излучения.
Мы уже знаем, что лучи, возникающие внутри атомов, различаются между собой не только длиной волны
к (или, что то же, частотой
у = с/к), но также интенсивностью. Это ясно видно на спектрограммах: некоторые линии там значительно ярче других, например в желтом дублете натрия линия
D<z вдвое ярче линии
D\. Наш предыдущий опыт и знания о волнах подсказывают нам, что действие волн тем заметнее, чем больше их амплитуда, то есть увеличивая амплитуду световых волн, мы тем самым повышаем их интенсивность. Интенсивность излучения можно поднять и по-другому, а именно, увеличивая число излучающих атомов. Поэтому если вместо одной ртутной лампы взять две, три, десять, то интенсивность излучения возрастет во столько же раз. Естественно было бы ожидать, что и энергия выбитых электронов вырастет в такой же пропорции.
Но энергия электронов оставалась прежней, менялось лишь их число. Такова первая несообразность, которая ожидала ученых в конце опытов. Зато энергия электронов зависела от частоты падающего излучения, и притом сильно. Кварцевая лампа излучает фиолетовые и ультрафиолетовые лучи. Оказалось, что если вместо них на поверхность натрия направить пучок красных лучей, то электроны не вылетят вообще, как бы много ламп мы ни взяли.
«Если излучение — волновой процесс (а это строго доказано), такого не может быть»,— утверждали одни.
«Но ведь это происходит!» — возражали другие.
Если бы несколько прибрежных утесов неожиданно обрушились на ваших глазах, почти наверное вы бы стали искать внешние причины такой катастрофы. Конечно, волны моря постепенно размывают берег, и время от времени утесы рушатся, но все знают, как редко это бывает. Однако если, обернувшись к морю, вы обнаружите там военный корабль, который ведет по берегу пальбу из орудий главного калибра, то вы сразу догадаетесь, что причина внезапных разрушений — не волны, а снаряды, хотя их энергия и меньше, чем

общая энергия морских волн. Но энергия волн равномерно распределена по всему побережью, и нужны века, чтобы мы увидели результаты их ежедневной работы. По сравнению с этой работой энергия снаряда ничтожна, зато она сосредоточена в малом объеме и выделяется мгновенно. Еели к тому же снаряд достаточно велик, он разрушит утес. Последнее важно: действительно, все свойства снаряда, кроме размеров, присущи и пуле, однако сокрушить скалу ей не под силу.
Примерно так рассуждал Эйнштейн, когда предложил свое объяснение явления фотоэффекта. Он знал об открытии и сомнениях Планка, но для Эйнштейна с его непредвзятой манерой мышления гипотеза о квантах света не казалась столь ужасной, как самому Планку. Поэтому он был первый, кто не только поверил в нее, но и применил для объяснения новых опытов. Эйнштейн утверждал: свет не только испускается квантами, как того требовала гипотеза Планка, но и распространяется так же — квантами. (Кстати, сам термин «квант» принадлежит ему же: Планк говорил об «элементах энергии»). Поэтому свет, падающий на поверхность металла, подобен не морским волнам, а артиллерийским снарядам. Причем каждый такой снаряд-квант (в 1926 г. Дж. Льюис назовет их фотонами) может выбить из атома только один электрон.
Согласно Планку, энергия кванта равна
hv. По мысли Эйнштейна, какая-то часть ее (назовем ее
Р) расходуется на то, чтобы вырвать электрон из атома, а остальная часть — на то, чтобы разогнать его до скорости у, то есть сообщить ему кинетическую энергию
T = mv2/2. Оба эти утверждения можно коротко записать в виде простого уравнения
, п 1
ту2
ft
v=p
+—
Стоит принять эту гипотезу — и явление фотоэффекта проясняется. Действительно, пока снаряды малы (красный свет), они не могут выбить электрон из атома (ftv<P), как бы много мы их ни посылали. Если же мы начнем увеличивать их величину (то есть частоту излучения, фиолетовый свет), то в конце концов их энергия станет достаточной для выбивания электронов (/rv>
Р). Но по-прежнему энергия каждого «снаряда-кванта» будет зависеть только от их величины (то есть от их частоты v), а не от их числа.
Шестнадцать лет спустя классическую простоту уравнения Эйнштейна Шведская академия наук отметит Нобелевской премией. Но в 1905 г., когда уравнение было написано впервые, на него ополчились все, даже Планк. Он высоко ценил Эйнштейна, искренне хотел ему помочь и потому, убеждая прусское министерство просвещения пригласить его на работу в Берлин, просил «не слишком сильно ставить ему в упрек» гипотезу относительно явлений фотоэффекта.
Планка можно понять: совсем недавно вопреки общепринятым традициям (и даже своему желанию) он ввел в физику квант действия
h. Лишь постепенно пришло к нему осознание неизбежности этого шага. Даже в 1909 г. он признавался Эйнштейну: «Я еще плохо верю в реальность световых квант». Однако дело было сделано: «...Планк посадил в ухо физикам блоху»,— говорил Эйнштейн двадцать лет спустя, и она не давала им покоя, хотя они и пытались ее не замечать. Во всяком случае, Планк постарался ввести квант действия так, чтобы не пострадала волновая оптика — здание чрезвычайной красоты, созданное в течение двух столетий. Поэтому, согласно Планку, свет только испускается квантами, но распространяется по-прежнему, как волна: лишь в этом случае удавалось сохранить все результаты волновой оптики.
А Эйнштейн поступал так, как будто до него вообще не существовало физики, или по крайней мере как человек, ничего не знающий об истинной природе света. Здесь сказалась замечательная особенность Эйнштейна: в совершенстве владея логикой, он больше доверял интуиции и фактам, причем случайных фактов в физике для него не существовало. Поэтому в явлениях фотоэффекта он видел не досадное исключение из правил волновой оптики, а сигнал природы о существовании еще неизвестных, но глубоких законов. Так уж случилось, что исторически сначала были изучены волновые свойства света. Только в явлениях фотоэффекта физики впервые столкнулись с его корпускулярными свойствами. У большинства из них инерция мышления была настолько велика, что они отказались этому верить. «Не может быть!» — повторяли они подобно фермеру, впервые в жизни увидевшему жирафа.
Эйнштейн, конечно, знал историю оптики не хуже других. Но его независимый ум равнодушно относился к ее солидному авторитету. Все прежние заслуги оптики для него не имели значения, если они не могли объяснить единственный, но бесспорный опыт. Он глубоко, религиозно, верил в единство природы, и один такой опыт значил для него не меньше, чем вся история оптики. А его честность не позволила ему пройти мимо неугодного факта.
В науке по-настоящему опасны только неверные опыты: опытам принято верить. Но любую гипотезу — какой бы привлекательной она ни была — всегда тщательно проверяют. Даже если она окажется ложной, опыты, которые ее опровергли, часто приводят к результатам более ценным, чем сама гипотеза. Проверили и гипотезу Эйнштейна — она оказалась истинной.
В 1911 г. Милликен, экспериментально проверяя уравнение Эйнштейна, определил из него значение постоянной Планка
h. Она совпала с тем значением, которое* получил Планк из теории теплового излучения. А вскоре поставили опыт, идея которого в точности аналогична картине разрушения утесов на берегу моря. И снова оказался прав Эйнштейн, а не признанный авторитет волновой оптики.
Конечно, Эйнштейн не отрицал, что волновая оптика все-таки существует. И не оспаривал опытов, доказавших волновую природу света. Просто он довел возникшее противоречие до логического конца и предоставил разрешать его следующему поколению физиков. В 1909 г., выступая в Зальцбурге на собрании Общества немецких естествоиспытателей, он высказывал надежду, что «следующая фаза развития теоретической физики даст нам теорию света, которая будет в каком-то смысле слиянием волновой теории с теорией истечения». Двадцать лет спустя его предвидение сбылось.
Несмотря на единодушные протесты современников, мысль о квантах света не погибла и вскоре дала могучие всходы. Это произошло в 1913 г., когда в лабораторию Резерфорда в Манчестере пришел застенчивый и неторопливый датчанин Нильс Бор.
ПОБЕДА АТОМИСТИКИ
20 мая 1904 г. в Манчестере, где провел лучшие годы своей ученой деятельности Джон Дальтон, с торжественностью, к которой обязывают традиции англичан и значительность события, был отмечен столетний юбилей атомной теории материи.
Победа ее пришла не сразу: даже после работ Дальтона многие долгое время смотрели на атомистику просто как на «любопытную гипотезу, допустимую с точки зрения нашей познавательной способности». Единодушие, с которым философы прошлого века отрицали существование атомов, пошатнуло и у физиков веру в их реальность. Например, Артур Шопенгауэр (1788—1860) отзывался об атомах не иначе, как о «выдумке невежественных аптекарей», а философ и физик Эрнст Мах (1838—1916) называл всех атомистов «общиной верующих» и каждого, кто пытался обратить его в эту веру, прерывал вопросом: «А вы хотя бы один из них видели?» Только в 1910 г., увидав однажды сцинтилляции а-частиц на экране спинтарископа, он сдержанно и с достоинством признал: «Теперь я верю в существование атомов». Маха можно понять: человеку трудно вообразить себе нечто, далее
принципиально неделимое. И все же в начале века идея атома победила окончательно: разум человека вновь оказался способным понять даже то, чего он не в состоянии представить. И случилось это гораздо раньше, чем через 300 лет, как предсказывал Людвиг Больцман (1844—1906), трагически погибший в своем одиночестве, так и не дождавшись понимания современников.
Но победа эта все-таки немного запоздала: после работ Томсона и Резерфорда понятие «атом» потеряло свой прежний смысл. Стало ясно, что атом — это не самая простая частица вещества, хотя его и нельзя расщепить средствами химии. «К сожалению, законы природы становятся вполне понятными только тогда, когда они уже неверны»,— говорил Эйнштейн. Это це означает, конечно, что однажды открытые законы вдруг теряют все свое значение. В истории атома — независимо от дальнейших успехов науки — доказательство его реальности (даже в старом смысле атоцод — «нераз-резаемый») навсегда останется одной из самых важных ее побед.
Окончательное утверждение атомистики также связано с именем Эйнштейна: в том же 1905 г. независимо от польского физика Мариана Смолуховского (1872—1917) он дал математическое описание броуновского движения. Эту теорию подтвердил экспериментально Жан Перрен, который в 1909 г. по совету Ланжевена предпринял систематические и тщательные исследования броуновского движения. И до Перрена многие физики были убеждены, что истинная причина этих движений — толчки молекул жидкости, которые сами невидимы даже в лучший микроскоп. Но удивительные по изяществу опыты Перрена не просто доказали справедливость этих утверждений — из них следовало нечто большее: непонятное движение частиц в жидкости есть точная модель истинного движения невидимых молекул, увеличенная в несколько тысяч раз. Поэтому, изучая броуновское движение частиц, мы тем самым получаем наглядную картину движений невидимых молекул. (Точно так же, как знание свойств радиоволн дает нам представление о волнах света и даже о рентгеновских лучах.) После этих работ гипотезу об атомах признали все, даже ее знаменитый противник Вильгельм Оствальд (1853—1932). А в 1909 г. тот же Резерфорд, который доказал сложную структуру атома, вместе с Ройдсом дал и наиболее убедительное доказательство атомистической структуры вещества. Вот как это произошло.
Уже давно было замечено, что в минералах, содержащих радиоактивные вещества — торий, уран, радий,— скапливается гелий. Измерили даже, что из 1 г радия в состоянии радиоактивного равновесия выделяется 0,46 мм
3 гелия в день, то есть 5,32 -10“
9 см
3/с. После установления природы а-частиц ничего чудесного в этом факте не было. Но Резерфорд и Ройдс на этом не остановились: они
сосчитали число а-частиц, которое вылетает в секунду из 1 г радия. Оно оказалось большим, но вполне определенным: 13,6- 1О
10 с
-1. Все эти а-частицы, вылетевшие за секунду, захватив по два электрона, превращаются в атомы гелия и занимают объем 5,32-10“
9 см
3. Следовательно, число атомов в 1 см
3

Но ведь это и есть та самая постоянная Лошмидта, которую он вычислил на основании молекулярно-кинетической гипотезы! Действительно, один моль гелия (как и любого одноатомного газа при 0 °C и атмосферном давлении) занимает объем 22,4 л и содержит 6,02 • 10
23 атомов, то есть
6,02-Ю
23моль
см
-з
22,4 • 10
3 см
3/моль
Совпадение убедительное.
К 1912 г. насчитывалось уже более десяти способов определения постоянной Авогадро и от ее значения зависело объяснение многочисленных и на первый взгляд не связанных между собой явлений, таких, как броуновское движение и голубой цвет неба, вязкость газов и спектр абсолютно черного тела, радиоактивность и законы электролиза. Число
Na оказалось очень большим, и, чтобы продемонстрировать его огромность, лорд Кельвин предлагал провести мысленный эксперимент: стакан воды с каким-то образом помеченными атомами вылить в океан и, хорошо перемешав его, вновь зачерпнуть воды из океана на другом краю Земли — в стакане окажется 200 меченых молекул воды (в действительности еще больше: около тысячи). Как и количество людей на Земле, число Авогадро не может быть дробным. Более того, это число мы знаем сейчас значительно точнее, чем численность жителей Земли: М
А = 6,022136 • 10
23.
«Если бы в результате какой-то мировой катастрофы все накопленные научные знания вдруг оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза (можете называть ее не гипотезой, а фактом — это ничего не меняет):
все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому.
В одной этой фразе содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
Эти слова принадлежат Ричарду Фейнману, нашему современнику, лауреату Нобелевской премии 1965 г. И хотя они почти дословно повторяют Демокрита,
понятия и
образы, которые мы с этими словами связываем теперь, совсем другие: за 25 столетий об атоме узнали много нового. Это было непросто — просты только результаты науки.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
Неразрезаемый атом
На фоне успехов новейшего знания старые аргументы в пользу существования атомов прочно забыты и представляют теперь только исторический интерес. Однако вспомнить некоторые из них небезынтересно.
Прежде всего верующие в атомы задавали своим противникам простой вопрос: «Каким образом одно и то же количество вещества, если оно не построено из атомов, может занимать разные объемы, как мы это наблюдаем, например, при сжатии и расширении газов?» Далее они приводили доказательства малости атомов и огромности их числа, например: кристаллик красителя индиго может окрасить тонну воды. Вспоминали случай, когда один гран (0,062 г) мускуса наполнял большую комнату запахом в течение 20 лет и при этом остался без видимых изменений.
Развитие точных наук подорвало доверие к рассуждениям, даже правдоподобным,— их заменили количественные оценки.
Уже Ньютон оценил толщину мыльных пленок и показал, что она в 50 раз меньше длины световой волны и составляет 10—
5 см=100 А. Вслед за ним многие (включая и лорда Кельвина) неоднократно обращались к изучению мыльных пузырей, и в начале нашего века было доказано, что толщина самой тонкой мыльной пленки всего в 2 раза превышает размеры молекулы.
С тех пор как Бенджамен Франклин вылил ложку масла на поверхность пруда вблизи Лондона, его опыт многократно повторяли в различных вариантах. В частности, Рэлей приготовлял масляные пленки толщиной до 16 А в Рентгену в 1890 г. удалось довести толщину таких пленок до 5 А, что всего в 5 раз превышает диаметр атома водорода.
Фарадей изготовлял из золота листки толщиной до 10“
6 см, а осаждением из раствора на стекле получал золотые пленки толщиной 10“
7 см, то есть в 10 раз тоньше средних оболочек мыльных пузырей. Такие пленки золота прозрачны, а их толщина всего в 10 раз превышает диаметры атомов.
Среди других попыток определить размеры атомов следует упомянуть несправедливо забытую работу Томаса Юнга (1773—1829): еще в 1805 г., изучая явления капиллярности и поверхностного натяжения жидкостей, он пришел к выводу, что размеры атомов не превышают 10
-8 см.
Дифракционная решетка
Неизвестно, как обернулась бы история атома, если бы физики не изобрели дифракционную решетку. Фраунгофер в своих опытах использовал ее уже в 1822 г., Ангстрем сделал главным инструментом своих исследований, и, наконец, Роуланд придал ей почти современную форму. Принцип действия решетки основан на явлении дифракции, то есть способности волн огибать препятствие, если оно сравнимо с их длиной. Волны различной длины осуществляют это по-разному, что позволяет разделить их и точно измерить. Благодаря этому прибору в спектроскопии достигнуты точности измерений, удивительные даже для физики. Уже в начале века удавалось разделить две линии в видимом спектре, если их
длины волн отличались друг от друга хотя бы на 10“
3 А (сейчас точность повышена до 10
-4 А).
Представьте себе, что вы захотели измерить длину экватора с точностью до метра. Ясно, что в этой попытке нет нужды, да и особого смысла тоже — просто потому, что результат такого измерения будет зависеть от каждого муравейника на пути. Но в спектроскопии подобные усилия представляют не только спортивный интерес, и дальнейшая история атома убедительно это доказала — вопреки недоверию и насмешкам, которыми они подчас сопровождались. Один из примеров — судьба эталона метра.
Знаменитый платино-иридиевый стержень с двумя рисками, отлитый по решению Конвента и хранящийся под стеклянным колпаком в Международном бюро мер и весов в Севре близ Парижа, оказался неточным. Это подозревали давно: уже в 1829 г. Жак Бабине (1794—1872) предлагал за эталон длины принять длину волны какой-либо спектральной линии «как величину, абсолютно неизменную и независимую даже от космических переворотов». Его идею впервые осуществил Альберт Майкельсон (1852—1931) в 1892 г. Но только в 1960 г. был узаконен такой эталон метра: 1 650 763,73 длины волны красно-оранжевой линии изотопа криптона-86 в вакууме. (В 1983 г. принято новое определение метра, в основу которого положены прецизионные измерения скорости света.)
Что сделал Резерфорд?
В начале века мысли о планетарном строении атома не были такой редкостью, как это принято сейчас думать. Достаточно напомнить, что идею эту уже в 1896 г. (за год до открытия электрона!) использовали Лоренц и Лармор для объяснения открытого Зееманом расщепления спектральных линий в магнитном поле. Эти мысли открыто излагались даже на страницах учебников. В качестве иллюстрации приведем несколько выдержек из III тома курса электричества, изданного в 1907 г. профессором Парижского университета Г. Пелла: «...Атом не является неделимой частичкой материи. Испускание света, дающего спектральные линии, характерные для каждого рода атомов, указывает уже на разнородность атомов. Можно было бы предположить, что атом состоит из очень большого числа корпускул, которые притягиваются к какому-нибудь центру, как планеты притягиваются к Солнцу...
Чтобы атом был нейтрален, необходимо, чтобы положительный электрический заряд, который, как мы предположили, находится в центре атома, был равен по абсолютному значению сумме отрицательных зарядов корпускул, вращающихся вокруг него...
Словом, все световые, электрические, тепловые и механические явления можно объяснить, допустив существование двух различных материй: корпускулы, или отрицательного электрона, и положительного электрона, о котором нам почти ничего не известно. Центральный положительный заряд атома состоит из совокупности положительных электронов, число которых изменяется в зависимости от рода атома, но остается вполне определенным для каждого рода атомов...
Лишне было бы доказывать красоту этой теории, которая дает возможность объяснить все известные до сих пор явления и позволяет связать столько явлений и законов, не имевших, казалось, ничего общего между собой».
Год спустя знаменитый французский физик и математик Анри Пуанкаре (1854—1912) писал столь же определенно: «Все опыты над проводимостью газов... дают нам основание рассматривать атом как состоящий из положительно заряженного центра, по массе равного приблизительно самому атому, причем вокруг этого центра вращаются, тяготея к нему, электроны».
После этих цитат многие разочаруются: Резерфорд не придумал ничего нового. Это обычное и частое заблуждение происходит от непонимания различий между наукой и натурфилософией. В науке действует строгое правило: открыл тот, кто доказал. А доказать что бы то ни было в науке можно лишь с помощью опытов и чисел. Все прежние высказывания опирались на чистое умозрение и потому звучали примерно так: атом, вероятно, может иметь такую-то структуру. Только Резерфорд имел моральное право сказать: «Так есть. Я могу доказать это с числами в руках. И каждый, кто захочет, может проверить их, если повторит мои опыты».
«Сказать оно, конечно, все можно, а ты поди демонстрируй»,— любил повторять Менделеев. «Неважно, кто первый высказал идею: важно, кто взял на себя ответственность за ее реализацию»,— с солдатской прямолинейностью говорил Наполеон. Об этом различии между расплывчатой идеей и научным доказательством всегда следует помнить в спорах о приоритете, которые время от времени вспыхивают в истории науки. В таких случаях, как правило, создателями теорий считают не тех, кто их впервые высказал, а тех, чьи работы — в силу глубоких причин или случайных обстоятельств — ока-
64
зали решающее влияние на последующее развитие науки. В этом есть несомненный элемент несправедливости. Но история не мыслит категориями человеческой морали: нравственность истории — ее точность и объективность, а ее задача — не успокоение обид, а установление истинной последовательности причин и следствий.
Световое давление
Гипотеза о световом давлении была известна уже во времена Кеплера, который выдвинул ее в 1619 г. для объяснения происхождения и формы хвостов комет. О величине светового давления не было известно ничего и, как всегда в таких случаях, о нем рассказывали баснословные истории. Например, Николай Гартзокер (одно время он был учителем Петра I) в 1696 г. передавал рассказ путешественников, по словам которых «течение вод Дуная значительно медленнее утром, когда лучи солнца противодействуют его движению, и ускоряется после полудня, когда лучи солнца помогают его течению».
В 1746 г. Леонард Эйлер вновь возвратился к мысли о давлении световых волн на освещаемые ими тела, однако эта мысль была отвергнута всеми авторитетными учеными того времени.
До конца прошлого века многочисленные попытки обнаружить световое давление экспериментально оканчивались полной неудачей. Причина этих неудач стала вполне ясной после теоретических работ Максвелла и успешных опытов Лебедева. Оказалось, что световое давление очень мало. Например, даже в ясный безоблачный день среднее давление солнечного света на 1 м
2 не превышает веса пяти маковых зернышек (2*10“
6 кгс/м
2).
3 Л. И. Пономарев
ГЛАВА 4
Цернун
В свое время почти каждый из нас грезил фрегатами и пиратами. В пылких мечтах мы переживали бои и погони, открывали тайну острова сокровищ и совершали подвиги благородства. Мы видели почти наяву, как по голубому морю фрегаты уходят за горизонт, оставляя за кормою пенный след. Иногда, чтобы увеличить скорость парусника, пираты шли на отчаянный шаг: выбрасывали за борт балласт и лишь благодаря этому благополучно уходили от преследования. Зачастую это им сходило с рук, но время от времени они бывали жестоко наказаны: фрегат, лишенный балласта, становился неустойчивым, как яичная скорлупа под парусами, и первый же шквал опрокидывал его вверх дном.
Эта глава на первый взгляд может показаться настолько сухой и неоправданно сложной, что некоторые читатели сочтут ее ненужным балластом. Но это тот самый балласт, что кладут на дно фрегата, балласт, без которого все паруса нашей фантазии не только бесполезны, но и опасны. Слишком часто в погоне за быстротой и легкостью мы пренебрегаем основательностью и глубиной. Такая беспечность не остается безнаказанной: в какой-то момент переполненная чаша знаний, лишенная опоры точных фактов, опрокидывается, и все приходится начинать сызнова.
В этой главе нет ничего такого, чего бы не смог понять вдумчивый неторопливый читатель. Однако она требует некоторых навыков последовательного логического мышления. Как правило, эти минимальные усилия вознаграждаются впоследствии большей полнотой и «объемностью» приобретаемых познаний. Вполне вероятно, что при первом чтении эта глава вызовет больше вопросов, чем разрешит. Это не беда. Зато она хоть немного позволит заглянуть внутрь «физической кухни», которая обычно скрыта за парадными обедами и здравицами в честь квантовой механики. А главное — лишь после таких экскурсов в глубь новых знаний возникает психологическое ощущение их стройности и устойчивости.
ДО БОРА
> К тому времени, когда Нильс Бор появился в лаборатории Резерфорда в Манчестере, об атоме знали уже довольно мдого. Настолько много, что порой это мешало выделить из груды фактов главные.
На рисунке указаны только те из явлений, которые впоследствии оказались особенно важными для понимания структуры атома.
На основании этих наблюдаемых фактов надо было угадать внутреннее устройство атома — объекта невидимого. У задач подобного типа есть общее название: проблема «черного ящика». Мы знаем характер воздействия на «черный ящик»-атом и его результат, то есть знаем,
что происходит и
отчего. Но мы хотим знать больше:
как все происходит, то есть механизм явлений, протекающих в черном ящике. Добиться этого значительно труднее, чем восстановить действие на сцене по обрывкам музыки и речи.
Даже если мы изучили все внешние проявления внутренних свойств атома, необходимо еще их обобщение, синтез, нужна интуиция, которая через провалы в логических построениях позволяет воссоздать единственно верную первопричину наблюдаемых явлений. Из нашей (далеко не полной) схемы видна сложность задачи: необходимо с единой точки зрения (и непротиворечиво) объяснить все эти — очень разные — опыты. Бор нашел такое объяснение в тот момент, когда ему вдруг стало ясно, что три физические идеи —
атомы, излучение, электроны — связаны между собой понятием
кванта.
До сих пор эти идеи развивались независимо. Химия и кинетическая теория материи доказали существование атомов. Электромагнитная теория Максвелла изучала свойства света. Электродинамика Максвелла — Лоренца осмыс-
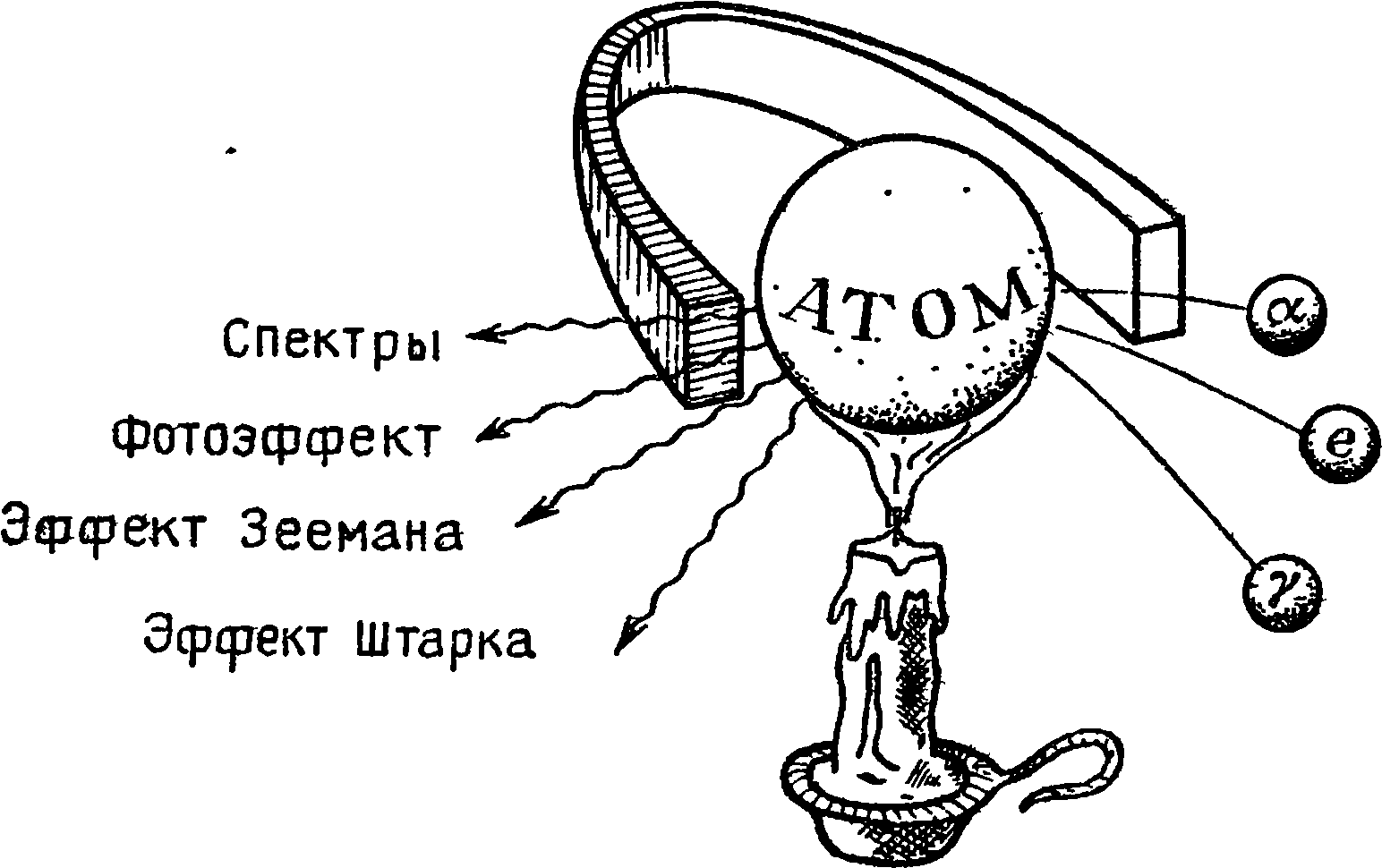

ливала понятие «электрон». Квант действия /г, даже после работ Эйнштейна и Милликена, в Европе мало кто принимал всерьез, хотя отдельные попытки использовать его были. В 1910 г. Артур Эрих Гааз (1884—1941) обратился к соотношению Планка
E = hv при установлении границ и периодов движения электронов в атоме Томсона; в 1912 г. Джон Николь-сон (1881—1955) хотел приспособить идею квантов для анализа спектров Солнца и туманностей, а Вальтер Фридрих Герман Нернст (1864—1941) применил ее для квантования молекулярных вращений.
Скептическое отношение к идее квантов лучше всего выразил сам Планк в докладе, который он прочел в Немецком химическом обществе 16 декабря 1911 г.— почти точно через одиннадцать лет после своего знаменитого сообщения: «Самым простым, так сказать, самым наивным объяснением было бы приписать атомистическую структуру самой энергии... Это последнее предположение делал раньше и я сам, но
теперь я отказался от него, так как нахожу его слишком радикальным...» В книге, которую он написал год спустя, Планк повторяет те же мысли: «Когда подумаешь о полном экспериментальном подтверждении, которое получила электродинамика Максвелла в самых тонких явлениях интерференции, когда подумаешь о невероятных трудностях, которые повлек бы за собой отказ от нее для всей теории электрических и магнитных явлений, то испытываешь какое-то отвращение, когда сразу же разрушаешь эти основы. По этой причине во всем дальнейшем изложении мы оставим в стороне гипотезу квантов света, тем более что ее развитие находится еще в зачаточном состоянии».
АТОМ БОРА
В 1912 г. Нильс Бор уже работал в Манчестере у Резерфорда. Манчестер отделен от Европы Ла-Маншем, и, вероятно, поэтому в лаборатории Резерфорда к гипотезе квантов относились хотя и осторожно, но без предубеждения коллег с континента. Быть может, поэтому, когда Планк писал свою книгу, Бор уже был твердо убежден в том, что «электронное строение атома Резерфорда управляется с помощью кванта
действия». Но прошел еще год упорных размышлений, прежде чем он сформулировал свои знаменитые «постулаты Бора».
Как он должен был при этом рассуждать?
Когда Александр Македонский увидел перед собой узел Гордия, он не стал его распутывать, а просто разрубил мечом — он был полководец и победитель. Бор поступил аналогично.
Ход его мыслей был примерно таким: чтобы электрон в планетарном атоме Резерфорда не упал на ядро, он должен вокруг него вращаться. Но по законам электродинамики он обязан при этом излучать энергию и в конце концов все равно упадет на ядро.
Нужно запретить ему падать на ядро.
— Позвольте,— возражали ему,— как это — запретить? Между электроном и ядром действуют электромагнитные силы?
- Да.
— Они описываются уравнениями Максвелла?
- Да.
— И даже масса
пг и заряд
е электрона определены из электрических измерений?
- Да.
— Значит, движение электрона в атоме также должно подчиняться электродинамике Максвелла?
— Нет.
Согласитесь, что такой способ ведения спора может рассердить даже очень спокойного человека. «Но ведь атом все-таки устойчив! — без конца повторял Бор в ответ на все возражения.— И мы не знаем более простой причины этой устойчивости, кроме той, что она есть». И много лет спустя он вспоминал: «Исходным пунктом для меня была... устойчивость материи, которая, с точки зрения прежней физики, предстает подлинным чудом».
В поисках разумного основания для этого несомненного факта Бор наткнулся на книгу Иоганна Штарка «Принципы атомной динамики» и там впервые увидел формулы Бальмера и Ридберга. «Мне сразу все стало ясно,— вспоминает Бор.— И, после многочисленных попыток использовать квантовые идеи в более строгой форме, ранней весной 1913 г. мне пришло в голову, что ключом к решению проблемы атомной устойчивости являются изумительно простые законы, определяющие оптический спектр элементов».
Теперь он мог сформулировать свои знаменитые постулаты.
1-й постулат — о стационарных состояниях.
В атоме существуют орбиты, вращаясь по которым электрон не излучает.
69
2-й постулат — о квантовых скачках.
Излучение происходит только при перескоке электрона с одной стационарной орбиты на другую. При этом частота излучения v определяется формулой Эйнштейна
hv = NE для квантов света, излучаемых при переходах между уровнями с разностью энергий
&Е = Е1—Е2, где
Е\ и
Е2 — энергии начального и конечного состояний электрона.
Чтобы понять эти постулаты несколько глубже, обратимся к очевидной аналогии между предполагаемым вращением электрона вокруг ядра и вращением спутника вокруг Земли. В свое время Ньютон открыл закон всемирного тяготения, размышляя над вопросом: «Почему Луна не падает на Землю?» Сейчас этот вопрос задают только в старых анекдотах, ибо все знают ответ: «Потому, что она движется, причем со строго определенной скоростью, которая зависит от расстояния ее до Земли». Таким образом, чтобы спутник не упал на Землю и в то же время не улетел в космос, между радиусом его орбиты
г и скоростью
v движения по ней должна существовать определенная связь.
В атоме водорода при движении электрона массой
пг и зарядом
е вокруг ядра атома между скоростью электрона
v на орбите и радиусом орбиты
г существует аналогичная связь, которую можно записать в виде уравнения
mv2 е2
Это уравнение верно всегда — независимо от того, излучает электрон или не излучает. Оно просто отражает известное равенство центробежной и притягивающей сил. Если по законам электродинамики электрон теряет энергию на излучение, то он упадет на ядро, как спутник при торможении в атмосфере. Но если существуют особые —
стационарные — орбиты, на которых он не подчиняется законам электродинамики и потому не излучает, то должны существовать также дополнительные условия, которые выделяют эти орбиты из набора всех возможных. Как появляются эти условия, легче всего показать, продолжив нашу аналогию со спутником.
У кругового движения, кроме радиуса орбиты
г и скорости
о движения по ней, есть еще одна характеристика — момент количества движения /, или, коротко,
орбитальный момент. Он равен произведению массы
m на скорость
и и на радиус орбиты г, то есть
l—mvr, и для спутника может принимать произвольные значения — в зависимости от
г и и. Бор утверждал: электрон в атоме отличается от спутника тем, что его орбитальный момент
I не может быть произвольным —
70
он равен целому кратному от величины
h = (это обозначение
предложил один из создателей квантовой механики Поль Дирак), то есть
 mvr — nh,
mvr — nh,
где
п — целое число: л = 1, 2, 3, ... Это и есть то дополнительное условие Бора, которое выделяет стационарные орбиты (единственно допустимые в атоме) из бесконечного числа всех мыслимых. А поскольку при таком выделении основную роль играет квант действия /г, то и весь подход назвали
квантованием.
Из этих двух условий, используя только правила алгебры, можно через массу электрона
т, его заряд
е и постоянную Планка
h выразить радиус орбиты электрона г, его скорость
v и полную энергию на орбите

равную сумме кинетической энергии электрона и потенциальной энергии кулоновского притяжения электрона к ядру. Эти значения зависят от номера орбиты
п следующим образом:
ft
2 2 в
2 1
me4 1,
'•
=Т7
£-
=^7-
Таким образом, стационарные орбиты (а следовательно, и уровни энергии) нумеруются целыми числами п, которые пробегают бесконечный ряд значений: п=1, 2, 3, ...
Очень важно и чрезвычайно существенно то, что никакие другие, промежуточные значения энергии, кроме набора энергий
Еп, пронумерованных целым числом п, в атоме невозможны. Это отсутствие непрерывности практически всех характеристик движения электрона в атоме — его энергии, скорости, орбитального момента — наиболее характерная черта квантовой теории, которая почему-то наиболее трудно воспринимается.
При переходе с уровня
k на уровень
п электрон излучает энергию
AE = Ek—En, а частота излучения, которое при этом возникает, определяется по формуле Эйнштейна:
ЬЕ ЬЕ
v=---—---.
h
7t

Отсюда сразу же следует знаменитая формула Бора для частоты излучения атома водорода:
_ те4 / 1 1 \
Если мы наблюдаем излучение, которое возникает при переходах электрона со всевозможных уровней
k на какой-то определенный уровень
п, то увидим не просто набор спектральных линий, а
серию. Например, при переходах с уровней £ = 3, 4, 5, ... на уровень
п = 2 воспроизводится серия Бальмера.
Формула, полученная Бором, очень напоминает формулу Ридберга для атома водорода, которую тот нашел эмпирически задолго до Бора и о которой мы подробно рассказали в предыдущей главе:
Сравнивая эти две формулы, можно найти значение
R для атома водорода с бесконечной массой ядра:
=-^_ = 109 737,315 см-
1.
И действительно, ее значение совпало с тем, которое было давно известно из спектроскопических измерений.
Это был первый успех теории Бора, и он произвел впечатление чуда. Но это еще не все. Из теории Бора следовало, что у атома водорода в основном, невозбужденном состоянии (п = 1) радиус
г, = -^- = 0,53- 10~
8см = 0,53 А.
те
Это означает, что размеры атомов (10“
8 см), вычисленные по его формуле, совпадали с предсказаниями кинетической теории материи.
И, наконец, теория Бора объяснила, как свойства линейчатого спектра связаны с внутренним строением атома. Интуитивно эту связь чувствовали всегда. Но только Бору впервые удалось выразить ее количественно. Оказалось, что эту связь осуществляет постоянная Планка
h.
Это было неожиданно. Действительно, квант действия возник в теории теплового излучения и никаким очевидным образом не был связан ни с атомами, ни с лучами, которые эти атомы испускают. И тем не менее именно он позволил вычислить абсолютные размеры атома и предсказать частоту света, излучаемого им. Угадать эту связь Бору, как и многим до него, помогла глубокая вера в единство природы.
Постулаты Бора (как и всякие постулаты) нельзя обосновывать логически или вывести из более простых. Они остаются произвольными творениями человеческого разума до тех пор, пока опыт не подтвердит следствий, которые из них вытекают. Тогда на их основе развиваются теории, наиболее удачные из которых называют законами природы.
Мы ограничимся только упомянутыми тремя следствиями теории Бора — на самом деле их значительно больше, и все они демонстрируют несомненную силу непонятных постулатов. Конечно, Бор пришел к ним несколько иначе, чем мы сейчас: когда человек впервые поднимается на незнакомую вершину, трудно надеяться, что он придет на нее самым простым путем. Только поднявшись на вершину, он сможет увидеть кратчайшую тропу к ней.
ПОСЛЕ БОРА
Несмотря на необычность постулатов Бора, его теория нашла довольно быстрое признание и достаточно много талантливых и сильных последователей. Если бы потребовалось определить отношение к ней физиков в те годы, то, пожалуй, следовало бы назвать чувство облегчения, чувство освобождения от того постоянного напряжения, в котором все они до тех пор находились, пытаясь удержать в памяти разрозненные факты и хоть как-то связать концы с концами. Теперь все атомные явления естественно группировались вокруг непонятной, но простой модели; часть из них блестяще ею объяснялась, а другая требовала дальнейшего развития модели.
В частности, теперь очень просто можно было объяснить опыт Кирхгофа и Бунзена с парами натрия. Действительно, когда свет проходит через пары натрия, атомы которого находятся в основном состоянии, он переводит их в возбужденное состояние и затрачивает на это энергию кванта
Е = hv, частота которого v как раз и совпадает с частотой D-линии натрия. Поэтому прошедший свет уже не содержит лучей с этой частотой, и на шкале спектроскопа мы видим сплошной спектр, перерезанный в желтой части темной линией D. В обратном процессе, когда атомы натрия переходят из возбужденного состояния в основное, они излучают свет с той же частотой v, которую прежде поглотили, то есть ту же D-линию, но теперь уже ярко-желтую.
Несмотря на все успехи теории Бора, физики вначале принимали ее скорее как удобную модель, но не очень верили в реальность такой энергетической лестницы в атоме. Это сомнение разрешили Джеймс Франк (1882—1964) и Густав Людвиг Герц (1887—1975) (племянник знаменитого Генриха Гёрца) в том же 1913 г. Как всякая ясная идея, гипотеза Бора не только объясняла старые факты, но также подсказывала пути для своей проверки.
Арнольд Иоганн Вильгельм Зоммерфельд (1868—1951), замечательный физик и блестящий педагог, был одним из первых в Европе, кто сразу же поверил в постулаты Бора и развил их дальше, «следуя, как когда-то Кеплер при изучении планетной системы, внутреннему чувству гармонии». Он рассуждал так: если атом подобен Солнечной системе, то электрон в такой системе может вращаться не только по окружности, как в модели Бора, но и по эллипсам, причем ядро должно находиться в одном из фокусов эллипса.
Эллипсы с одинаковой большой полуосью принадлежат одному и тому же значению
главного квантового числа п, так как энергии электрона на таких орбитах равны между собой (Зоммерфельд знал доказательство, а нам придется просто поверить в это). Эллипсы различаются по степени сплющенности, которая зависит от орбитального момента /. Вполне в духе идей Бора Зоммерфельд предположил, что при заданном
п эллипсы могут быть сплющены не произвольным образом, а только так, чтобы
орбитальное квантовое число I, которое их различает, принимало целые значения Z = 0, 1, 2, ...,
п — 1, то есть число допустимых эллипсов равно числу п, нумерующему стационарные состояния.
Бор и Зоммерфельд показали даже нечто большее: если учесть теорию относительности Эйнштейна, то окажется, что энергии электронов, движущихся по эллипсам с одинако-
74
выми
п, но разными
L, немного различаются между собой, а потому уровни энергии в атоме необходимо нумеровать двумя квантовыми числами:
п и
I. По той же причине спектральные линии, возникающие при переходах электрона между уровнями
k и
п, должны иметь
тонкую структуру, то есть расщепляться на несколько компонентов. По просьбе Зоммерфельда, Фридрих Пашен проверил и подтвердил это следствие теории на примере линии иона гелия Х=468,3 нм, которая соответствует переходу с уровня £ = 4 на уровень п = 3. Внимательно рассмотрев фотографию спектра Не
+, он обнаружил, что эта линия в действительности состоит из тринадцати тесно расположенных линий. Это удивительное совпадение в то время (1916 г.) сравнивали с вычислениями Леверье и Адамса, которые предсказали, в какой точке неба астрономам следует искать планету Нептун.

«Пространственное квантование кеплеровских орбит является одним из самых неожиданных следствий квантовой теории. По простоте вывода и результатов оно похоже на волшебство»,— писал Зоммерфельд в 1916 г. (тогда же он ввел термин
квантовое число, вместо правил целочисленности Бора).
Но даже два квантовых числа
п и
I не объяснили всех особенностей спектров. Например, если поместить излучающий атом в магнитное поле, то спектральные линии расщепляются совсем по-другому. Явление расщепления открыл Питер Зееман (1865—1943) еще в 1896 г. Теперь его стали толковать следующим образом: электрон, движущийся по замкнутой орбите, подобен витку в обмотке электромотора и, подобно этому витку, в магнитном поле орбита электрона поворачивается. Однако, в отличие от витка, она может занимать в атоме не любые положения, а лишь строго определенные. Эти допустимые положения орбит в атоме задает
магнитное квантовое число т, которое (снова в духе идей Бора!) может принимать только целые значения
т=— I, — (/—1), .... —1, 0, 1, — 1),
I — всего, как легко видеть, 2/-J-1 значений. А это означает, что в магнитном поле каждый уровень с заданными значе* ниями пи/ расщепится еще на 2/ +1 подуровня, каждый из которых однозначно определяется заданием трех целых квантовых чисел:
п, I и
tn.
Усложняясь, теория Бора постепенно теряла свое первоначальное изящество и наглядность. На ее место пришла
формальная модель атома, от которой требовалось лишь одно: дать правильную систематику спектров и термов. Термин «квантование» постепенно потерял свой прежний смысл: им обозначили теперь формальный способ сопоставления целых
(квантовых) чисел n,
I и
m каждому уровню энергии в атоме, а точнее — тому типу движения, в котором находится электрон. Квантовые числа
п, I и
m определяют стационарные орбиты в атоме. Внешние поля (электрическое и магнитное) влияют на движение электрона в атоме (расщепление уровней энергии), а это сразу же сказывается на структуре светового сигнала, который испускает атом (расщепление спектральных линий).
ФОРМАЛЬНАЯ МОДЕЛЬ АТОМА
Популяризация, как и всякий жанр, имеет свои границы. Как правило, они определяются тем, что с некоторого момента для объяснения научных фактов становится невозможным использовать понятия и образы повседневной жизни. Для того чтобы эту границу преодолеть, нужно перейти на язык формальных понятий науки, для начала хотя бы примитивный. При всех попытках уйти от этого шага неизбежны потери информации и искажение ее смысла, а самая суть науки остается скрытой. Наоборот, преодолев минимальные затруднения, вы можете почувствовать силу логических построений науки и оценить красоту их следствий. Как правило, эти технические затруднения ничуть не больше тех, с которыми сталкивается любой школьник при изучении химии: довольно быстро он убеждается в том, что проще (а главное —понятнее) написать формулу Н
2О, чем каждый раз говорить: «молекула, которая состоит из двух атомов водорода и одного атома кислорода».
Нечто похожее на химические формулы принято и в теории спектров, где главное квантовое число
п обозначают цифрами:
п = 1, 2, 3, ..., а орбитальный момент / — буквами, причем ряду чисел / = О, 1, 2, 3, ... поставлен в соответствие ряд букв
I = s, p,
d, f, ... Поэтому уровень с квантовыми числами
п = 3,
I = 0 обозначают 3s, а уровень с
п = 3,
1=1 обозначают Зр.




В невозбужденном атоме натрия электрон находится в состоянии 3s. А темная D-линия возникает в том случае, если при возбуждении атома электрон переходит в состояние Зр. При обратном переходе 3p->3s он излучает энергию и возникает ярко-желтая D-линия.
А что произойдет, если излучающий натрий поместить в магнитное поле? Вначале, следуя Зоммерфельду, предполагали, что при этом верхний уровень Зр должен расщепиться на 3 компоненты 2/ + 1 = 2-1 + 1 =3, а нижний останется без изменения. В итоге каждая из
D\ и D
2^hhhA должна расщепиться на 3 компоненты.
Опыт противоречит такому заключению: в действительности Di-линия расщепляется на 4 компоненты, a D
2^hhhh — на 6. Это явление — частный случай так называемого
аномального эффекта Зеемана. Чтобы понять его причину, необходимо немного возвратиться назад и уяснить себе вопрос, которого мы раньше сознательно избегали: почему даже без магнитного поля D-линия натрия состоит из двух тесно расположенных компонент
D\ и D
2?
Мучительно размышляя над этим вопросом, ученик Зом-мерфельда Вольфганг Паули (1900—1958) пришел в 1924 г. к открытию спина электрона. Он рассуждал примерно так: обе Di- и D
2- линии соответствуют одному и тому же переходу с уровня
п = 3,
I = 1 на уровень
п = 3,
I = 0. Но их все-таки две! Значит, существует не один, а два верхних уровня Зр и еще какое-то дополнительное квантовое число, их различающее. Свойство, которому соответствует это четвертое квантовое число s, он назвал «неклассической двузначностью электрона» и предположил, что оно может принимать только два значения: +1/2 и —1/2. Паули считал, что наглядное представление этого свойства невозможно.
Но уже в следующем году Джордж Юджин Уленбек (р. 1900 г.) и Сэмюэл Абрахам Гаудсмит (1902—1978) придумали наглядную модель для объяснения этого свойства электрона, предположив, что он вращается вокруг своей оси. Такая модель прямо следовала из аналогии между атомом и Солнечной системой: ведь Земля вращается не только по эллипсу вокруг Солнца, но еще и вокруг своей оси (эту аналогию отмечал Комптон уже в 1921 г., но Паули резко против нее восстал).
Уленбек и Гаудсмит утверждали: кроме орбитального момента
I электрону присущ внутренний момент враще-
+ 1/2
|
I
|

|
ния, или спин s (от англ, spin — веретено), равный по величине s=l/2. Складываясь с орбитальным моментом /, этот внутренний момент 5 может его увеличить или уменьшить. В результате возникает
полный момент j, равный либо /1 = = /—1/2, либо j
2 = /+l/2 — в зависимости от взаимной ориентации векторов
I и 5. Если / = 0, то полный момент и спин совпадают (/=5 = 1/2).
Теперь все встало на свои места: с учетом спина электрона уровень 35 в атоме натрия останется без изменения, так как соответствует моменту / = 0, но уровень Зр с моментом /=1 расщепится на два: 3pi/2 и Зрз/2, энергии которых немного различны. (Значения / = /-|-5 и
j = 1— 5 условились писать справа внизу у символа терма, поэтому 3pi/2 соответствует полному моменту / = 1/2, а Зрз/2 — моменту / = 3/2.) В соответствии с этим вместо одной D-линии натрия мы увидим две тесно расположенные спектральные линии, причем линия Di соответствует переходу 3pi/2 З51/2, а линия D2 —
переходу Зр
3/2 -> 35i
/2.
В магнитном поле каждый из уровней с полным моментом /, как и в случае момента /, расщепляется еще на 2/+ 1 компонент, которые различаются значениями магнитного квантового числа т. Таким образом, каждый из уровней 3pi/2

и 3$i/2 расщепится еще на 2 подуровня, а уровень Зрз/2 — на 4. В результате возникает та схема уровней и переходов между ними, которая изображена на рисунке.
Из рисунка видно, как постепенно усложнялась первоначальная модель Бора, в которой существовал только один уровень сп=3. Когда приняли во внимание теорию относительности, он расщепился на два: 3р(п=3, /=1) и 3s (п = 3,
1 = 0). С учетом спина электрона уровень Зр расщепляется еще на 2 подуровня: 3pi/2 (п = 3, / = 1, / = 1/2) и Зрз/2 (п = 3, /= 1, j = 3/2). И, наконец, в магнитном поле мы получим систему уровней и переходов между ними, которая объясняет картину спектральных линий, наблюдаемую на опыте.
Гипотеза о спине электрона — одна из самых глубоких в физике, и вполне осмыслить ее значение не удалось до сих пор. Паули был, конечно, прав, предостерегая от прямолинейных попыток представлять электрон как вращающийся волчок. И дело даже не в том, что в этом случае скорость вращения на «экваторе» электрона должна превышать скорость света. (На это обстоятельство сразу же обратил внимание Лоренц, когда ему принесли на отзыв рукопись статьи Уленбека и Гаудсмита.) Дело в том, что влияние спина на физические процессы в атоме и на его строение проявляются иногда самым неожиданным образом. Одна из таких особенностей спина составляет содержание знаменитого принципа запрета Паули:
в атоме не может быть двух электронов с одинаковыми квантовыми числами п, I, m, s. В дальнейшем мы увидим, что только этот принцип позволил найти рациональную основу периодической системы элементов Менделеева и объяснить суть периодического закона.
Даже по стилю изложения вы, наверное, сейчас заметили, насколько формальная модель атома беднее образами по сравнению с первоначальной моделью Бора, насколько труднее рассказать о ней привычными словами и представить наглядно без привлечения хотя бы простейших формул. И тем не менее вы, вероятно, ощутили ее силу: с ее помощью можно объяснить и предсказать довольно тонкие особенности спектров. Она помогла привести в относительный порядок то устрашающее количество спектральных линий, которое было накоплено за полвека. Теперь, чтобы однозначно определить любую линию в спектре атома, достаточно было задать 8 квантовых чисел: 4 для исходного уровня излучающего электрона (п<, Д-,
si} и 4 для конечного (я*,
Ik, Sk). К 1925 г. эта героическая работа была закончена. Иероглифы были расшифрованы, что позволило нарисовать первую и пока еще грубую картину внутреннего строения атома.
Конечно, расшифровать спектр какого-либо элемента — задача даже сегодня не особенно легкая, и вполне квалифицированно сделать это могут только специалисты; в конце концов научиться читать даже расшифрованные иероглифы не так уж просто, и к тому же не обязательно уметь это делать всем. Но поскольку ключ к шифру известен, то усвоить его может любой. И теперь уже никого не устрашают длинные таблицы спектральных линий, как не пугают зоологов и ботаников миллионы видов растений и животных: после трудов Линнея, Ламарка и Дарвина все они подчинены строгой систематике.
Со спектральными линиями произошло то же самое, что и с настоящими, египетскими иероглифами: пока их не прочли, ими занимались только египтологи, остальные интересовались этим лишь издали. Но когда иероглифы и спектры расшифровали, одним удалось прочесть историю целого народа, другим — узнать устройство атома. А это уже интересно всем.
Несмотря на все успехи формальной модели атома, она уже не удовлетворяла тому критерию логической простоты, которая производит впечатление очевидности (и которой так выгодно отличалась исходная модель Бора). Она стала слишком сложна, что вызывало недоверие к ней и некоторое чувство усталости, очень похожее на то, какое владело физиками до схемы Бора. К тому же все попытки распространить модель Бора на более сложные атомы кончались неудачей. Это приводило к тому, что физики стали подвергать сомнению все: справедливость закона Кулона, применимость электродинамики и механики в атомных системах и даже закон сохранения энергии. Все в общем понимали, что кризис этот возникает от формального соединения эмпирических данных с принципами теории квантов и остатками классических представлений, отказаться от которых пока было нельзя, поскольку взамен их не было предложено ничего определенного. Поэтому при изучении квантовых явлений исследователи продолжали пользоваться представлениями классической физики. Но у атомных объектов не было свойств, которые бы этим понятиям соответствовали, и потому природе задавали, в сущности, незаконные вопросы. Или — точнее — вопросы на языке, которого она не понимала. Тогда начались поиски общего принципа, из которого бы логически следовали и формальная модель атома, и другие особенности атомных объектов. «Пусть вначале этот единый принцип будет непонятным, но пусть он будет один» — таково было общее желание.
В ответ на это стремление в 1925 г. возникла квантовая механика — наука о движении электронов в атоме. Ее создало новое поколение физиков. По игре случая все они родились почти одновременно: Вернер Гейзенберг — в 1901 г., Поль Адриен Морис Дирак — в 1902 г., Вольфганг Паули — в 1900 г. Немного старше их были Луи де Бройль (1892 г.) и Эрвин Шрёдингер (1887 г.). Им выпало счастье записать образы и понятия атомной механики на языке формул.

ВОКРУГ КВАНТА
Нильс Хенрик Дэвид Бор
Как и всякое истинно великое открытие, открытие Бора трудно сделать, но легко понять. Сила идей Бора в их простоте и доступности. В главной своей сути они понятны любому грамотному человеку. Бор дал
образ, который позволял ориентироваться среди необычных
понятий квантовой механики, образ, ставший символом нашего века. Если учесть к тому же, что при всей своей простоте образ этот верно отражает основные свойства атомов, то сразу станет ясна его исключительность.
3 марта 1972 г. космическая станция «Пионер-10» стартовала к Юпитеру. Кроме приборов, на ее борту находится пластинка, на которой выгравировано самое важное, что люди Земли решили сообщить другим цивилизациям: силуэты мужчины и женщины, место Земли в Солнечной системе и схема атома водорода.
Из ста физиков, взятых наугад, сегодня, пожалуй, только один или два читали знаменитые статьи Бора, напечатанные в 1913 г. Однако любой из них подробно объяснит идеи, которые в них изложены. Это означает, что сейчас идеи Бора уже не предмет науки, а необходимый элемент культуры — самое высшее, чего может достичь любая теория.
«Человек, которому было суждено одарить мир великой созидательной идеей, не нуждается в похвале потомства. Его творчество даровало ему более значительное благо». Эти слова Эйнштейна о Планке — в равной мере и о Боре.
На склоне лет Бор приехал в нашу страну и посетил Грузию. В один из дней среди гор в долине Алазани он отдыхал с группой физиков. Неподалеку от них расположились крестьяне из окрестного селения и по старинному обычаю во главе с тамадой пили вино и пели песни. Нильс Бор — человек не только великий, но и любознательный — подошел к ним и был принят с традиционным радушием. «Это знаменитый ученый Нильс Бор...» — начали объяснять физики. Но тамада жестом остановил их и, обращаясь к сотрапезникам, произнес тост: «Друзья! К нам в гости приехал самый большой ученый мира профессор Нильс Бор. Он создал атомную физику. Его труды изучают школьники всех стран. Он приехал к нам из Дании, пожелаем же ему и его спутникам долгих лет жизни, счастья, крепкого здоровья. Пожелаем его стране мира и благополучия». Речь тамады тихо переводили Бору, и когда тот кончил говорить, с земли поднялся старик, взял обеими руками руку Бора и бережно ее поцеловал. Следом за ним поднялся другой горец, наполнил чашу вином и, поклонившись Бору, выпил ее.
Нильс Бор всю жизнь провел среди парадоксов квантовой механики. Но даже его поразила нереальность происходящего: он заплакал от удивления и благодарности.
Опытное доказательство постулатов Бора
Опыт Франка и Герца, по существу, очень похож на опыт Кирхгофа и Бунзена, только атомы натрия в нем они заменили атомами ртути, а вместо солнечного луча направили на них пучок электронов, энергию которых можно было изменять. При этом Франк и Герц наблюдали интересное явление: пока энергия электронов была произвольной, число электронов, прошедших через атомы ртути, было равно числу электронов исходного пучка. Однако когда энергия их достигала определенного значения (в опытах
она равнялась 4,9 эВ, или 7,84-10'
12 эрг), число электронов в прошедшем пучке резко падало — они рассеивались атомами ртути. Одновременно с этим в парах ртути вспыхивала яркая фиолетовая линия с длиной волны X = 253,6 нм, то есть с частотой v = с/Х = = 1,18-10
15 с”
1. Энергию кванта с такой частотой легко вычислить:
hv= (6,62-10“
27 эрг.с). (1,18-Ю
15 с'
1) =7,82.10'
12 эрг,
то есть она почти точно равна затраченной энергии электрона. Очевидно, это излучение возникает при обратном переходе атома ртути из возбужденного состояния в основное.
Легко видеть, что наблюдаемая картина — прямое опытное доказательство обоих постулатов Бора: в атоме реально существуют стационарные состояния, и поэтому он неспособен поглощать произвольные порции энергии. Переходы электрона между уровнями в атоме возможны только скачками, а частота излучаемых квантов определяется разностью энергий уровней и вычисляется по формуле Эйнштейна
x — \E/h. Конечно, «легко видеть» это только сейчас, а в 1913 г. даже сами Франк и Герц объяснили свой опыт совсем по-другому.
50 лет спустя Джеймс Франк вспоминал: «...Поскольку в то время среди физиков господствовало откровенное недоверие к попыткам сконструировать модель атома при тогдашнем уровне знаний, то мало кто давал себе труд внимательно прочитать посвященную этому работу. Особо следует отметить, что Густав Герц и я вначале были неспособны понять огромное значение работы Бора...»
ГЛАВА 5
Тот ***
Представьте, что вы решили изучить жизнь клетки. Вы ставите над нею всевозможные опыты: нагреваете, облучаете, разрушаете и тщательно рассматриваете в микроскоп. Однако все ваши знания о ней будут неполными, пока вы не вспомните, что клетка — это часть живого организма и только в нем проявляет всю полноту своих свойств.
Нечто похожее произошло и в науке об атоме. До сих пор мы намеренно пытались изолировать атом и отбирали только те опыты, которые могут прояснить свойства отдельного атома. Однако задолго до опытов, доказавших сложную структуру атома, Дмитрий Иванович Менделеев (1834—1907) установил, что атомы различных элементов образуют единый организм —
естественную систему элементов.
Свое название «элементы» получили по буквам /,
т, п латинского алфавита. Все слова состоят из букв, а их совокупность образует алфавит. Точно так же все вещества в природе построены из небольшого числа химических элементов, а сами они являются членами единой системы — алфавита элементов.
Надо сказать, что химиков никогда не могла удовлетворить мысль о независимом множестве качественно различных элементов. Поэтому они всегда стремились представить себе элементы как различные скопления частиц одного и того же рода. Такие попытки предпринимались уже в древности и в дальнейшем развивались по двум направлениям.
Демокрит верил, что все вещества в природе построены из атомов, а свойства веществ зависят от различных сочетаний атомов. Аристотель утверждал, что все сущее состоит из элементов, которые являются носителями определенных качеств.
Отголосок этого давнего спора дошел даже до наших дней: при слове «атом» у нас невольно возникает зрительный образ чего-то твердого, имеющего форму и размеры; при словах «химический элемент» мы пытаемся представить себе некое чистое качество безотносительно к его носителю. Быть может, поэтому учение о химических элементах вначале развивалось совершенно независимо от идеи об атомах. Впоследствии эти два учения так переплелись, что их перестали различать, но и поныне не удалось преодолеть психологический барьер, разделяющий их в нашем сознании. Пока что мы подробно проследили «физические истоки» науки об атоме. Теперь пришло время отыскать ее «химические истоки».
УЧЕНИЯ ДРЕВНИХ
Философы ионической школы, знаменитым представителем которой был Фалес Милетский (630—550 гг. до н. э.), признавали только один элемент — воду, «на которой покоится земля и которая дала начало всему, что есть». Впоследствии Эмпедокл (490—430 гг. до н. э.) добавил к воде еще три элемента: землю, огонь и воздух. Наконец, Аристотель (384— 322 гг. до н. э.) к этим четырем элементам присоединил пятый, духовный — quinta essentia,— воспоминание о котором сохранилось до сих пор в слове «квинтэссенция».
вещества, воздействующие на наши органы чувств, в Ин
дии элементы представляли себе как некие проявления единого духовного начала. Этих
Нечто похожее было создано и в индийской философии. Но в отличие от греков, которые под элементами понимали проявлений-элементов в индийской философии тоже было пять — по числу чувств, способных их воспринять: эфир—слух, ветер — осязание, огонь — зрение, вода — вкус и земля — обоняние.
В средние века учение об элементах возродили алхимики, среди которых обычно отмечают египтянина Зосима, араба Ге-бера (VIII век) и Альберта Великого (XIII век). Под элементами алхимики (вслед за Аристотелем) понимали не вещества, а
качества, или «принципы». Ртуть служила «принципом» металлического блеска, сера — горючести, соль — растворимости. Они были убеждены, что,


смешав эти «принципы» в надлежащих пропорциях, можно получить любое вещество в природе.
Как правило, со словом «алхимия» связывают сказки о превращении ртути в золото, о получении эликсира жизни и прочие чудеса. На этом основании укрепилось снисходительно-пренебрежительное отношение ко всей истории алхимии. А ведь
она насчитывает несколько веков! И трудно поверить, что ее тщательно разработанная философия и практические рецепты состояли только из одних заведомых глупостей. Мало кто знает, что алхимики изобрели спирт и, быть может, одним этим оправдали свое существование. Основная же их заслуга состоит в том, что стихийное экспериментирование, которому они предавались, привело постепенно к накоплению фактов, без которых наука химия никогда бы не возникла.
ПЕРВЫЕ ПОПЫТКИ
В XVII веке алхимия вместе с натурфилософией уступила место химии и физике. В 1642 г. появилось сочинение Иоахима Юнгиуса (1587—1657) «Диспуты о принципах материи», которое он вполне в духе века заканчивает словами: «Какие принципы должны быть признаны первичными для однородных тел, может быть познано не путем догадок, а только на основании добросовестных, детальных и прилежных наблюдений».
В 1661 г. вышла в свет знаменитая книга Роберта Бойля (1627—1691) «Химик-скептик», в которой он определил химические элементы как «некоторые примитивные или простые или совершенно несмешанные вещества».
По существу, это первое и почти современное определение элемента: элемент — это прежде всего вещество, а вовсе не «принцип», субстрат или идея. Оставалось пока неясным, как выделять эти элементы из природных веществ и по какому признаку можно отличить чистые элементы от их смеси или соединения. Например, сам Бойль полагал, что вода чуть ли не единственный чистый элемент, в то время как
86
золото, медь, ртуть и серу относил к химическим соединениям и смесям.
Антуан Лоран Лавуазье (1743—1794) принял целиком учение Бойля об элементах, но он жил столетием позже и пошел дальше: он научился выделять элементы из химических соединений. По-видимому, Лавуазье был одним из первых, кто использовал весы не для приготовления порошков и смесей, а для целей исследования. Он исходил из предположения, которое сейчас кажется тривиальным, но в эпоху флогистона требовало немалой смелости:
каждый элемент соединения весит меньше, чем все соединение в целом. Последовательно применяя этот принцип, он составил первую таблицу, содержащую около 30 элементов.
Взгляды Лавуазье настолько противоречили общепринятым в то время воззрениям, что рьяные последователи теории
ELEMENTS
| О |
Hydrogen |
|
О |
Strontian |
W<-,
|
| ф |
.Axote |
|
о |
Barytes |
6s
|
| • |
Carton.
|
<< |
|
Iron |
so
|
| о |
Oxygen |
7 |
© |
ZdUC |
|
|
Phosphorus |
|
© |
Copper |
s6
|
| ф |
Sulphur |
|
© |
Lead |
|
| ф |
Magnesia |
|
© |
Silver |
|
|
Lime |
24 |
|
Gold |
|
| © |
Soda |
28 |
© |
Platina |
tyo
|
| ф |
Potash. |
4*1 |
|
Mercury |
ft
|
флогистона в Германии устроили публичное сожжение его портрета. Лавуазье не закончил своих исследований: по обвинению в государственной измене 8 мая 1794 г. после полудня на площади Революции в Париже ему отрубили голову, а тело погребли в общей могиле. Наутро после казни Лагранж говорил с горечью: «Чтобы снять эту голову, достаточно было мгновения, а чтобы создать другую, ей подобную, не хватит, быть может, и столетия».
Последующие сто лет были заполнены трудами химиков, которые постепенно дополняли таблицу Лавуазье. Среди них вызывает восхищение фигура «короля химиков» Йенса Якоба Берцелиуса (1779—1848): за свою жизнь он изучил свыше 2 тысяч веществ, с большой точностью определил атомные массы 46 из 49 известных тогда элементов и сам открыл селен, торий, литий, ванадий и некоторые из редкоземельных элементов. (Кстати, именно он в 1814 г. ввел современные обозначения химических элементов по первым буквам их латинских и греческих названий.)
К середине XIX века было известно уже около 60 элементов — не так много, как предполагал Демокрит, но и не так мало, чтобы считать их все независимыми. Постепенно окрепло убеждение, что элементы образуют единую систему, и начались поиски этой системы. В сущности, они никогда не прекращались — даже в то время, когда были явно преждевременными. Например, Марне уже в 1786 г. был уверен, «что все существующее в природе связано в один беспрерывный ряд» и что «от мельчайшей пылинки солнечного луча до святейшего серафима можно воздвигнуть целую лестницу творений...» В 1815 г. английский врач и химик Уильям Праут (1786—1850) развил идею Марне о родстве элементов и предложил простую гипотезу, согласно которой все элементы образовались из легчайшего элемента водорода путем его последовательной конденсации.
Сейчас не время и не место подробно изучать все попытки найти систему элементов, которые в разное время предприняли Деберейнер (1817 г.), Петтенкоффер (1850 г.), Гладстон (1853 г.), Одлинг (1857 г.), Бегюэ де Шанкуртуа (1863 г.), Ньюленде (1865 г.) и особенно Лотар Мейер (1830—1895). Значительно важнее проследить идеи и побудительные причины, которые всеми ими двигали.
В основе любой науки лежит человеческая способность удивляться. А существование элементов всегда вызывало и будет вызывать удивление; в самом деле, разве не странно, что весь этот мир, наполненный красками, запахами, звуками и человеческими страстями, построен всего из нескольких
88
десятков элементов. Причем, как правило, эти элементы невзрачны на вид и ничем не напоминают красочного мира, который из них построен.
Однако вслед за удивлением в сознании ученых возникает потребность упорядочить впечатления, которые их поразили. Это чисто человеческое качество заложено в каждом из нас очень глубоко: ребенок радуется, сложив из груды кубиков правильную фигуру, скульптор — вырубив из глыбы мрамора статую, музыкант — упорядочив звуки в мелодию.
При всякой попытке привести что-либо в систему сразу же возникает вопрос: «А по какому признаку?» Если у вас в коробке навалены в беспорядке кубики с номерами, то упорядочить их не составляет труда: достаточно расставить их в порядке номеров. А теперь представьте, что вместо кубиков у вас в руках пробирки с химическими элементами. В этих пробирках вещества разного цвета и запаха, жидкие и твердые, тяжелые и легкие. Какое из этих качеств следует взять за основу классификации? Например, пробирки можно расставить на полке так, что их цвета образуют радугу. Это будет красиво, но для науки об элементах бесполезно: всякая систематика имеет смысл лишь в том случае, если она позволяет выявить глубокие свойства или особенности строения. (Такова, например, систематика зоологических видов.)
Чем вообще полезна любая система, кроме того, что она удовлетворяет наше инстинктивное стремление к простоте? Прежде всего — и это самое важное — без нее невозможна никакая наука. Мозг ученого — лишь небольшая часть природы, и он может надеяться познать всю природу только в том случае, если научится выделять в ней главные черты среди нагромождения деталей.
У химических элементов очень много свойств, что вполне понятно: ведь из них построен весь мир. Самое важное из них — способность вступать в химические реакции. Казалось бы, именно это свойство элементов и нужно положить в основу их классификации. Однако это не так: нет способа точно измерить (и даже строго определить) реакционную способность элементов. А без этого любая систематика ненадежна: чтобы не быть произвольной, она должна опираться на число, то есть элементы нужно классифицировать по тому их свойству, которое поддается точному измерению.
Но и здесь не все просто: плотность веществ мы можем измерить очень точно, однако положить ее в основу систематики нельзя — хотя бы потому, что среди элементов есть и газы, и жидкости, и твердые тела.
Многочисленные неудачные попытки найти систему элементов помогли, наконец, понять, что среди различных их свойств, доступных непосредственному наблюдению,
нет того единственного, благодаря которому была найдена система элементов. Это свойство —
атомная масса элемента — лежит вне химии и целиком принадлежит физике. Тот момент, когда это впервые поняли, можно считать началом современного учения о химических элементах. Этот решающий шаг сделал Джон Дальтон.
ЭЛЕМЕНТЫ И АТОМЫ
Среди ученых своего времени Джон Дальтон — очень своеобразная фигура. В начале XIX века уже все уверовали в науку и поняли секрет ее могущества: она имеет дело с числами, а числа не обманут. Поэтому превыше всего в то время ценили искусство ставить точные опыты. Дальтон этим качеством решительно не обладал и потому при жизни подвергался нападкам маститых ученых. По складу ума это был типичный теоретик, как мы себе представляем сейчас эту профессию. Поэтому не следует слишком строго судить неточности измерений в его работах: на их основе он высказал светлые и плодотворные мысли, которые определили развитие химии на последующие сто лет. Суть его открытия состоит в том, что он указал экспериментальный путь проверки атомной гипотезы.
Дальтон определил элемент как
вещество, состоящее из атомов одного вида. Атомы различных веществ различаются между собой по массе и при всех превращениях вещества остаются неизменными — происходит лишь их перегруппировка. «Мы с таким же успехом можем стараться прибавить новую планету в Солнечную систему, как уничтожить или создать атом водорода»,— писал Дальтон. Он не только твердо поверил в атомную гипотезу, но стал искать вытекающие из нее и притом
наблюдаемые следствия. Ход его рассуждений состоял примерно в следующем.
Допустим, что все элементы состоят из атомов Тогда, скажем, в 16 г кислорода содержится
N атомов кислорода. Предположим теперь, что мы сжигаем в этом кислороде водород. Легко измерить, что для сжигания 2 г водорода надо затратить 16 г кислорода, в результате чего получается 18 г воды. Первая мысль, которая приходит при этом в голову стороннику атомной гипотезы, состоит в том, что каждый атом кислорода О соединяется с одним атомом водорода
96

Н, образуя молекулу воды НО. Именно так думал и Дальтон. В дальнейшем Берцелиус доказал, что он немного неправ, а именно: с каждым атомом кислорода соединяются два атома водорода и поэтому формула воды принимает привычный для нас вид: НгО. Но здесь самое важное — идея: с каждым атомом кислорода соединяется
целое число атомов водорода. Поэтому если в 16 г кислорода содержится
N атомов, то в 2 г водорода —
2N атомов. А это означает, что один атом кислорода в 16 раз тяжелее атома водорода.
Таким образом, появилась возможность сравнивать между собой массы атомов различных элементов. Ввели понятие
атомная масса — число, которое показывает, во сколько раз атом какого-либо элемента тяжелее атома водорода, атомную массу которого по определению приняли за единицу.
К этим результатам Дальтон пришел в 1804—1805 гг., а в 1808 г. вышла его знаменитая книга «Новая система химической философии», открывшая в науке новую эпоху. Его выводы тут же проверил английский врач и химик Уильям Волластон (тот самый, который впервые обнаружил темные линии в спектре Солнца) и убедился в их справедливости.
Оставалось сделать последнее: научиться определять атомные массы элементов. Для этого нужно было выбрать простейшие вещества. Прежде всего обратили внимание на газы. Почти сразу же, в 1809 г., бывший ассистент Бертолле французский ученый Джозеф Луи Гей-Люссак (1778— 1850) — мы знаем его по «газовому закону Гей-Люссака» — сделал очень важное открытие: объемы двух газов, вступающих в реакцию, всегда относятся друг к другу как простые целые числа. Не
массы, а
объемы. Как мы скоро увидим, это очень важно. Например, чтобы получить воду, нужно в одном объеме кислорода сжечь ровно два объема водорода. Отсюда уже сам напрашивается вывод: в равных объемах газов содержится одинаковое число атомов.
Именно к такому выводу пришел в 1811 г. итальянский ученый Амедео Авогадро (1776—1856), только сформулировал его точнее: в равных объемах газов содержится одинаковое число
молекул. Теперь мы знаем, что молекулы большинства газов (водорода, кислорода, азота и т. д.) состоят из двух атомов (Н2, О2, N2). После этого уже ничего не стоит

понять классический опыт по сжиганию водорода в кислороде. Известно, что при этом из 1 объема кислорода и 2 объемов водорода образуется 2 объема водяного пара. Коротко этот факт записывают уравнением
2Нг Ог = 2НгО.
В чем значение открытий Гей-Люссака и Авогадро и почему мы так подробно остановились на этих простых фактах?
Проследим еще раз цепочку рассуждений. В равных объемах газов содержится одинаковое число молекул. Известно, что 2 г водорода занимают объем 22,4 л; обозначим число молекул, которое содержится в этом объеме, через Мд- Те же самые А
а молекул кислорода занимают тот же объем 22,4 л, но масса их при этом не 2 г, а 32 г. Отсюда следует, что каждый атом кислорода в 16 раз тяжелее атома водорода; это означает, что, измерив плотность какого-либо газа и сравнив ее с плотностью водорода, мы сразу же определим его
атомную массу.
Нигде до сих пор реальность атомной гипотезы не была видна так явно. Действительно, плотность — величина легко измеримая и привычная, поскольку она воздействует на наши органы чувств. Поразительно то, что таким простым способом можно измерить атомную массу — величину, недоступную непосредственному восприятию.
Число молекул А\, которые помещаются в 22,4 л любого газа при О °C и давлении 1 атмосфера, называют теперь постоянной Авогадро. Это одна из основных постоянных физики — подобно скорости света
с или постоянной Планка
h. Чтобы определить ее, достаточно знать абсолютную массу
М одного атома водорода. И поскольку в 22,4 л содержится 2 г таких атомов, то число
N^ — 2/М.
Гипотеза Авогадро была вскоре забыта, и лишь полстолетия спустя, в 1858 г., ей возвратил жизнь другой итальянский ученый — Станислао Каниццаро (1826—1910). Это было как нельзя более кстати, поскольку между химиками той поры не было согласия: почти каждый из них признавал только свою собственную таблицу атомных масс, органики не доверяли неорганикам, а созванный в 1860 г. в Карлсруэ съезд самых знаменитых химиков ни к какому соглашению не пришел. (Впрочем, резолюцией от 4 сентября 1860 г. он все-таки закрепил различие между атомом и молекулой.)
Только теперь, наконец, были достаточно правильно определены атомные массы элементов и можно было приступить к их классификации.
ТАБЛИЦА ЭЛЕМЕНТОВ
Довольно часто можно услышать рассказ о том, как Менделеев, выписав все элементы на оборотной стороне визитных карточек, долго раскладывал их, как пасьянс, пока не забылся кратким дневным сном. Во время этого-то сна к нему и пришло решение проблемы. Быть может, история эта не вполне достоверна, но даже те, кто относится к ней с полным доверием, должны все-таки понимать, что счастливому дню 1 марта 1869 г. предшествовало много других дней и ночей — бессонных и бесплодных, когда проблема казалась безнадежной.
В чем состояла трудность задачи? Вспомните пример с беспорядочной грудой пронумерованных кубиков — расставить их по порядку не составляет труда. Но на химических элементах нет ярлыков с номерами — это просто вещества разного цвета, твердые, жидкие, газообразные. Мы знаем только, что каждому из них можно поставить в соответствие число — атомную массу. Это число возрастает монотонно от элемента к элементу, и потому именно его приняли за основу классификации. Самое простое — многие именно так и поступали — расположить все элементы в порядке возрастания атомных масс, но это — занятие, достойное ремесленника, а не мастера. Прежде всего, откуда известно, что мы знаем уже все элементы? А без этой уверенности какой смысл располагать их по возрастающим атомным массам?
Проблема в действительности напоминает известную детскую игру в кубики, на которых изображены части картины и нужно сложить их все вместе так, чтобы эту картину воспроизвести. Теперь представьте, что часть кубиков утеряна, а на части других рисунки искажены. В этом случае изображение все равно можно восстановить, хотя, конечно, и с большим трудом. Нужно только стремиться представить себе именно
картину, всю целиком, а не надеяться, что она сама собой получится, если произвольно и бездумно комбинировать между собой кубики. Менделеев владел как раз этим даром синтетического мышления. Он с самого начала представлял себе элементы не как набор случайных веществ, а как части единой системы. И в поисках этой системы элементов он не ограничился только их физическим свойством — атомной массой (хотя и положил его в основу систематики), а держал в памяти и комбинировал все остальные их — химические — свойства.
Во времена Менделеева было известно 63 элемента. В таблице, которую он составил в 1869 г., только 36 из них под-

|
|
Д. И. Менделеев
|
чинялись принципу возрастания атомных масс. Для 20 элементов этот принцип был нарушен, а для оставшихся 7 элементов Менделеев исправил атомные массы на основании своей таблицы. Он настолько верил в найденную систему, что предсказал на ее основе открытие еще 5 элементов: скандия (Sc), германия (Ge), галлия (Ga), технеция (Тс) и рения (Re), оставив для них пустые места в своей таблице. Эти элементы и в самом деле были вспоследствии открыты: скандий (№ 23) в 1875 г., галлий (№ 31) в 1879 г., германий (№ 32) в 1886 г., рений (№ 75) в 1925 г., а технеций (№ 43) был синтезирован только в 1937 г.
В каком-то смысле можно сказать, что Менделеев открыл свою систему не на основании фактов, а вопреки им. Он как будто видел заранее всю таблицу и принимал во внимание лишь те факты, которые ей не противоречили. Как в загадочной картинке «Найди охотника!», Менделеев в нагромождении линий вдруг увидел четкие контуры другой, осмысленной картины. А различив ее однажды, не замечать ее в дальнейшем уже невозможно. (Это свойство человеческой психики каждому хорошо знакомо.) Здесь Менделеев обнаружил ту сторону своего ума, которая отличает гения от таланта: большую интуицию — редкий дар природы, позволяющий увидеть истину сквозь шелуху неверных фактов.
В периодической системе элементов Менделеева нашел, наконец, успокоение давний спор между представлениями

Аристотеля и Демокрита о природе элементов. По горизонтали таблицы изменяется ненаблюдаемое свойство атома Демокрита — атомная масса (количество); по вертикали элементы естественно группируются в семейства с аналогичными химическими свойствами: валентность, способность вступать в реакции и т. д. Эти свойства наблюдаемы, воздействуют на наши органы чувств и сродни древним «качествам» Аристотеля.
Лагранж как-то сказал: «Счастлив Ньютон, ибо систему мира можно установить лишь однажды». Менделеев установил систему химического мира. Это тоже можно сделать только один раз. Поэтому его имя, как и имя Ньютона, никогда не будет забыто в истории науки.
ПЕРИОДИЧЕСКИЙ ЗАКОН
При взгляде на таблицу Менделеева возникает (и всегда возникал) вопрос: что это — удобный способ запоминания элементов или фундаментальный закон природы? Понимающему взгляду химика таблица говорит очень много, но сейчас мы не в состоянии обо всем этом рассказать. Мы попытаемся понять только главное: если это закон природы, то:
что определяет порядок расположения элементов в таблице?
В чем причина их периодических свойств?
От чего зависит длина периодов?
Ответить на эти вопросы пытались в течение полувека — от Менделеева до Паули. За это время таблицу элементов многократно переписывали, разрезали и снова склеивали, на плоскости и в пространстве, всеми возможными и невозможными способами. Но, как всегда, причина явления лежала вне его самого: объяснить таблицу смогла только физика после создания теории атома.
Уже Менделеев знал, что атомная масса лишь приблизительно определяет положение элементов в таблице. И все же каким-то одному ему известным способом он сумел их упорядочить, а уже затем пронумеровал. Но имеет ли подобная нумерация глубокий смысл? Ведь с таким же успехом мы можем пронумеровать кубики из нашей детской игры-мозаики для того, чтобы можно было всегда и быстро восстановить всю картину. Это, конечно, удобно, однако глубокого смысла не имеет, поскольку номера кубиков никак не связаны с тем, что на этих кубиках изображено, и могут быть заменены другими значками, например, буквами алфавита.
95

|
|
Г. Мозли
|
Существует ли глубокая внутренняя связь между химическими свойствами элемента и его
порядковым номером в таблице? Или же это внешний и произвольный его признак, вроде номера дома на улице? Если это действительно так, то нумерацию пришлось бы менять с открытием каждого нового элемента, точно так же, как меняют нумерацию домов при дополнительной застройке улицы. Одним словом: порядковый номер элемента в таблице — это удобный способ найти его там или же это его внутренняя характеристика, которая няется в пользу последнего предположения: за сто с лишним лет существования таблицы нумерация элементов в ней ни разу не изменялась.
присуща ему независимо от всяких таблиц? Истина скло
Разгадку такой устойчивости таблицы удалось найти лишь через 44 года. В 1913 г. голландец Ван ден Брук (1870—1926) написал короткую заметку, в которой высказал предположение:
порядковый номер элемента в таблице Менделеева равен заряду ядра его атомов.
В том же году, изучая рентгеновские спектры различных элементов, эту гипотезу доказал один из лучших учеников Резерфорда Генри Гвин Джеффрис Мозли (1887—1915). Работа Мозли стала главным событием в физике даже в те, полные открытий, годы. Ему не удалось ее завершить: в солнечный день 10 августа 1915 г. в бухте Сува на Дарданеллах в окопах под Галлиполи офицер связи саперной роты Генри Мозли был убит прямым попаданием в голову.
После него остались его труды, из которых следовало, что все известные элементы в таблице расставлены верно, а пустые клетки оставлены как раз на месте еще неоткрытых элементов. Такая окончательность утверждений всегда обладает необъяснимой притягательной силой. Она приобретает особое значение, когда речь идет о системе мира. После работ Мозли система химических элементов была, наконец, установлена окончательно и оставалось только понять ее особенности.
Природа позаботилась о том, чтобы как можно дальше упрятать от глаз естествоиспытателей свои главные характеристики: заряд ядра атома надежно укрыт шубой из электронов и недоступен измерению никакими химическими и большинством физических методов. Это свойство атомов нащупали только после того, как начали обстреливать их такими снарядами, как а-частицы. Вместе с тем именно это, так глубоко запрятанное, свойство определяет структуру атома и все наблюдаемые свойства элементов, состоящих из этих атомов. И если мы хотим по-настоящему узнать, что представляет собой атом, то вначале должны докопаться до его ядра. (Как в сказке о Кащее Бессмертном: высоко на горе растет дуб, на дубу — сундук, в сундуке — заяц, в зайце — утка, в утке — яйцо, в яйце — игла, а в кончике той иглы — жизнь и смерть Кащея.)
В согласии с законами ядер-яой физики заряд ядра атома примерно вдвое меньше, чем ei располагая элементы в порядке возрастания их атомных масс, мы более или менее правильно выстроим их в порядке возрастания зарядов ядер их атомов. Менделеев не знал о существовании ядер, но он почувствовал, что у атомов есть еще какое-то свойство, более глубокое, чем атомная масса, и поэтому, расставляя элементы в таблице, доверял больше интуиции, чем атомным массам. Он как бы заглянул под электронную оболочку атомов, пересчитал там положительные заряды в ядре и затем это число присвоил элементу (впоследствии Ван ден Брук назовет его порядковым номером, а Резерфорд — атомным номером). Очевидно, порядковый номер — внутренняя характеристика элемента, и, конечно, он не зависит от нашего произвола, как, например, номер дома на улице. (Если продолжить нашу аналогию с детской игрой-мозаикой, то можно сказать, что все ее кубики в действительности оказались пронумерованными. Только номера эти были запрятаны внутри кубиков.)
Теперь, наконец, можно дать точное определение элемента:
элемент — это вещество, состоящее из атомов с одинаковым зарядом ядра.
Нам осталось выяснить последнее: почему
монотонное изменение заряда ядра атомов приводит к
периодическим изменениям их химических свойств? Изменяются при этом не только химические, но и физические свойства: плотность, твердость и даже агрегатное состояние. Очевидно, причину периодического изменения свойств элементов следует искать не в ядре, а в окружающей его электронной оболочке. Первая мысль, при этом возникающая, состоит в том, что электроны вокруг ядра расположены не беспорядочно, а слоями-оболочками. Начало заполнения новой оболочки совпадает с началом нового периода, и как раз в этот момент скачком изменяются химические свойства элементов. После работ Бора подобная мысль казалась очень естественной, и он сам же ее впервые высказал.
Однако приведенные соображения не подсказывают способа вычислить длину периода. На первый взгляд длина периодов в таблице меняется весьма прихотливо: в I периоде — 2 элемента, во II и III — 8, в IV и V — 18, в VI — 32. Но еще в 1906 г. Иоганн Ридберг заметил, что ряд чисел 2, 8, 18, 32 подчиняется простой формуле: 2п
2. Эту закономерность удалось объяснить Паули только в 1924 г. после открытия им принципа запрета.
Ход рассуждений Паули легко понять. В самом деле, движение электронов в атоме описывается четырьмя квантовыми числами, о которых мы подробно говорили в предыдущей главе и которые напомним теперь еще раз:
п — главное квантовое число, которое может принимать значения 1, 2, 3...
I — орбитальное квантовое число, которое при заданном
п принимает значения
/=0, 1, 2, ..., п-1.
tn — магнитное квантовое число; при заданных пи/ оно пробегает ряд значений
/п=-/, -(/-1), ..., -1, 0, 1, ..., (Z-1), /.
s — спиновое квантовое число, принимающее два значения + 1/2 и — 1/2.
Принцип запрета Паули гласит:
в атоме не может быть двух электронов с одинаковыми квантовыми числами.
Сосчитаем вслед за Паули, сколько электронов помещается в слое с номером п. В слое п==1 возможны только значения / = 0 и m = 0, a s равно +1 /2 и — 1 /2, то есть на первой оболочке может поместиться только 2 электрона. В соответствии с этим в I периоде — только 2 элемента, водород и гелий.
В следующей оболочке с номером
п — 2 орбитальный момент
I может принимать два значения: / = 0 и /=1. При каждом
I магнитное квантовое число принимает 2Z+1 значений, то есть одно при /=0 и три при /=1. При каждом из этих значений возможны два спина: +1/2 и — 1/2, то есть в состоянии с / = 0 помещается 2 электрона, а в состоянии с Z = 1 шесть электронов. Всего же на оболочке
п — 2 помещается 2 + 6 = 8 электронов; именно такова длина II перио
да — от лития до неона.
Точно так же легко сосчитать, что в слое
п = 3 помещается 18 электронов, то есть не более
2п2 электронов в слое с номером
п. Теперь удалось также понять и существование особой группы элементов — лантаноидов — в VI периоде таблицы.
Каждый период в таблице Менделеева начинается щелочным металлом и заканчивается инертным газом, химические свойства которых резко различны. Теперь легко понять и причину их различия. Инертные газы гелий, неон, аргон и т. д. отличаются от всех остальных элементов тем, что у них электронные оболочки полностью заполнены.
Атомы щелочных металлов Li, Na, Кит. д., которые в таблице расположены следом за инертными газами, содержат
по одному электрону в следующей, более высокой оболочке. Эти электроны связаны с ядром много слабее, чем остальные, поэтому атомы щелочных металлов легко их теряют и стано
вятся положительными однозарядными ионами: Li
+ , Na
+ , К
4* я т. д.
Наоборот, в атомах фтора (F), хлора (Ci), брома (Вг) недостает одного электрона, чтобы замкнуть их внешнюю оболочку до оболочки благородного газа. Поэтому-то галогены так охотно присоединяют электрон, образуя отрицательные ионы F“, С1“, Вг“ и т. д. Когда атомы натрия и хлора встречаются, то натрий отдает свой внешний электрон хлору, в результате чего возникают ионы Na
+ и С1“. Ионы эти притягиваются, образуя молекулы NaCl, из которых состоит хорошо известная всем поваренная соль.
В прошлом веке числа 2, 8, 18, 32 вызывали недоумение и получили название «магических». Объяснить их пытались по-разному, например вспоминали, что октаэдр — самый прочный многогранник и что в буддийской философии есть учение о восьми путях добра. Но вряд ли кто предполагал, что для них существует такое простое и рациональное объяснение.
Эта гармония знания основана на квантовой механике, к знакомству с которой теперь и перейдем.
ВОКРУГ КВАНТА
Атомы и люди
Роберт Бойль (1627—1691) был незаурядным человеком. Решающее влияние на него оказала философия Фрэнсиса Бэкона с его учением об опыте как основном мериле истины. Быть может, поэтому он установил один из первых количественных законов в физике, известный теперь как газовый закон Бойля — Мариотта. Любопытно, что по стилю своей работы Бойль ближе к нам, чем к своей эпохе: он не писал статей, а диктовал их секретарю, он не делал сам опытов, а поручал их ассистенту (с которым ему, впрочем, повезло: им был знаменитый впоследствии Роберт Гук).
Бойль был четырнадцатым ребенком и седьмым сыном в богатой семье. С детских лет его мучили камни в почках, что, вероятно, во многом определило его образ жизни. Бойль не был женат, отличался религиозностью и, по свидетельству друзей, знавших его в течение сорока лет, никогда не произносил слово «Бог» без благоговейной паузы. В течение 16 лет (1661 —1677) он возглавлял знаменитую Ост-Индскую компанию и на этом посту больше всего заботился о деятельности миссионеров в колониях. Примерно треть его ученых трудов посвящена теологии. Он самолично финансировал переводы библии на турецкий, арабский, малайский языки и даже на язык американских индейцев. Вместе с тем Бойль стал одним из основателей Королевского общества и одним из первых его членов.
Это был высокий, худой человек, к концу жизни бледный и изможденный. Несмотря на свою известность, он вел простую жизнь, был дисциплинирован, благороден и предельно учтив. Когда ему в 1680 г. пожаловали звание пэра, он отказался от такой чести, поскольку его принципы не позволили ему принести необходимую в таких случаях присягу. Умер Бойль в постели за правкой корректуры своей книги «Очерки общей истории воздуха».
Джон Дальтон (1766—1844) родился 5 сентября 1766 г. в семье бедного ткача в Камберленде, на севере Англии. Когда пришло время, его отправили в сельскую школу. В 12 лет, после того, как учитель этой школы ушел в отставку, он сам открыл школу сначала в своем доме, а затем в местном доме собраний квакеров и преподавал там два года. Факт этот сам по себе необычный, но комментариев и воспоминаний о нем не сохранилось.
Еще год он работал на ферме и в возрасте 15 лет уехал к старшему брату Джонатану. Вместе с ним они открыли школу и преподавали в ней 12 лет, пока в 1793 г. его не пригласили в Манчестерский новый колледж, где он еще 6 лет преподавал математику и физику. Здесь Дальтон вступает в Манчестерское литературное и философское общество и читает научные доклады. Первый его доклад был посвящен цветовому дефекту зрения, которым он сам страдал и который известен теперь под названием «дальтонизм». В Манчестере он прожил до конца своих дней и умер в 1844 г., разбитый параличом за семь лет до этого.
Дальтон происходил из семьи квакеров, одной из самых строгих протестантских сект. Быть может, именно это обстоятельство усугубило природные черты его характера. Он жил размеренной жизнью, его день никогда не менялся: соседи с точностью до минут узнавали время, когда он поутру выходил записывать показания термометра и барометра. Рабочий день Дальтона заканчивался в 9 часов вечера. Он ужинал и, закурив трубку, сидел в кругу семьи, лишь изредка вставляя краткие замечания.
Каждый четверг после обеда он шел не на работу, а на лужайку для игры в шары, примыкавшую к таверне «Собака и куропатка». Здесь он неожиданно утрачивал свои размеренные манеры, к удивлению окружающих возбужденно жестикулировал и с неожиданным энтузиазмом бросал шары. Несколько умеренных пари, всегда точно рассчитанных, чай и неизменная трубка заканчивали этот день. В воскресенье, одетый в квакерские бриджи до колен, серые чулки и башмаки с пряжками, он дважды прсещал публичное богослужение, хотя по вопросам веры никогда не высказывался.
Он почти ничего не читал и часто хвастал, что «может унести всю свою библиотеку на спине и что даже из этих книг он не прочел и половины». «Как у всех самоучек, в нем было меньше развито желание знать то, что сделали другие, чем твердая уверенность в правильности найденного им самим»,— писал о нем один из биографов.
На современников его человеческие качества действовали удручающе. Они вспоминали впоследствии: «Его вид и манеры были отталкивающими... голос у него был резкий и сварливый, а походка жесткая и неуклюжая». Тем не менее члены Манчестерского философского общества за научные заслуги избрали Дальтона в 1817 г. своим президентом. К концу жизни он признан повсюду: в 1822 г. его избирают членом Королевского общества, а в 1830 г.— одним из восьми иностранных членов Парижской академии, вместо умершего за год до этого Хэмфри Дэви.
Последующие поколения, как правило, полностью равнодушны к личным недостаткам ученого. Они помнят только лучшее в нем — его идеи. Быть может в этом и состоит одна из причин человеческого прогресса.
Антониус Иоганнес Ван ден Брук (1870—1926) был но профессии юристом, а наукой занимался в свободное от работы время. Уже само по себе в XX веке это было редкостью, но и в остальном Ван ден Брук был личностью незаурядной: он знал несколько языков, хорошо играл на фортепиано, профессионально интересовался архитектурой и философией. О своих занятиях наукой он избегал говорить с окружающими: без регулярных контактов с профессиональными физиками он имел основания сомневаться в научной ценности своих изысканий, и, кроме того, они могли повредить его репутации юриста и отпугнуть клиентов.
Когда Резерфорду рассказали о гипотезе Ван ден Брука, он с раздражением заметил, что «...только любитель может позволить себе высказывать забавы -ради много догадок сразу без достаточных на то оснований». Следы этой корпоративной неприязни сохранились надолго и даже в 1934 г. он продолжал утверждать, что первым идею тождественности порядкового номера элемента и заряда ядра выдвинул Бор и «...только по странной оплошности приписал эту мысль Ван ден Бруку».
Только в конце жизни Ван ден Брук был повсеместно признан научным сообществом и смог всецело отдаться любимому занятию. В 1923 г., за три года до смерти, по рекомендации Г. А. Лоренца и других коллег он был избран членом Голландской академии наук.
«Наука состоит из фактов, как дом из камней. Но собрание фактов еще не
наука, точно так же как куча камней еще не дом.»
Анри Пуанкаре
«Не совсем верно, что ученый преследует истину, скорее истина следует за ним.»
Сорен Кьеркегор
«Что дополнительно понятию истина? Ответ: ясность.»
Нильс Бор
«Несчастны те люди, которым все ясно.»
Луи Пастер
Идеи
ГЛАВА 6
Теория Бора глазами современников. Явление, образ, понятие, формула. Матричная механика Гейзенберга.
Вокруг кванта
ГЛ А В А 7
Луи де Бройль. Волны материи. Оптико-механическая аналогия. Волновая механика Шрёдингера.
Вокруг кванта
ГЛАВА 8
Уравнение Шрёдингера. Смысл ф-функции. Образ атома. Квантовая истина.
Вокруг кванта
ГЛАВА 9
Корпускулярно-волновой дуализм. Соотношение неопределенностей. Принцип дополнительности.
Вокруг кванта глава ю
Игра в «орел — решку» и стрельба в тире. Дифракция электронов. Волны вероятности. Электронные волны. Атом и вероятность. Вероятность и спектры атомов. Причинность и случайность, вероятность и достоверность.
Вокруг кванта гл а в а п
Что такое атом? Что такое кван-. товая механика? Физическая реальность.
Вокруг кванта
ГЛАВА 6
Линъюй
Значение слов определяется традицией и привычкой, но их истинный смысл выясняется только в контексте. Так происходит всегда: в науке и искусстве, в технике и политике. Узнавая новые явления, человек называет их старыми словами, но вкладывает в них другой смысл; смысл, который нельзя понять, если не знать происхождения новых понятий и их связей с прежними. Это стремление хоть как-то отделить нужное значение слов от привычного объясняет появление жаргона в науке, который, как правило, противоречит нормам литературного языка. Дилетанты от науки впадают в другую крайность: они воспринимают все ее утверждения буквально, не зная той сложной системы условностей, которыми окружена словесная формулировка любого научного результата. Сплошь и рядом из-за этого возникают недоразумения — смешные для физиков, огорчительные для самих дилетантов.
В конце прошлого — начале нашего века физики открыли новый мир — мир атома. Их ошеломило богатство новых явлений, они наскоро придумали им названия, но не вполне понимали, какой смысл в них надо вкладывать. Когда Бор впервые произнес слова «стационарное состояние» и «квантовый скачок», вряд ли кто, включая и его самого, мог объяснить, что же они, в сущности, означают.
Рассказ о квантовой физике мы начали с определения: квантовая физика — это наука о строении и свойствах квантовых объектов и явлений. Сразу же выяснилось, что мы не вполне понимаем, что означают слова «квантовый объект», одним из которых является и атом. Вполне однозначно понятие «атом» мы не можем определить и сейчас, хотя знаем о нем гораздо больше, чем вначале.
Под влиянием опытов умозрительные образы сменялись более сложными, менее наглядными, но зато и более адекватными представлениями об атоме. Ученые постепенно доказали, что атом действительно существует, но совсем не похож на атом Демокрита. Узнали, что он состоит из ядра и электронов. Выяснили, что он может испускать электромагнитные волны. Установили, что его излучение связано с движением электронов в атоме. Необходимо было найти законы этого движения.
И тогда изобрели квантовую механику.
Начал создавать ее Нильс Бор; его постулаты, хотя и противоречили духу и традициям всей прежней физики, внесли неожиданный порядок в первозданный хаос опытных фактов.
Но наука ничего не принимает на веру — даже если это постулаты Бора. Надо было либо отбросить их, либо устранить их противоречия.
ТЕОРИЯ БОРА
ГЛАЗАМИ СОВРЕМЕННИКОВ
В 1949 г. Альберт Эйнштейн вспоминал об эпохе создания квантовой механики: «Все мои попытки приспособить теоретические основы физики к новым результатам потерпели полную неудачу. Это было так, точно из-под ног ушла земля и нигде не видно было твердой почвы, на которой можно было бы строить. Мне всегда казалось чудом, что этой колеблющейся и полной противоречий основы оказалось достаточно, чтобы позволить Бору — человеку с гениальной интуицией и тонким чутьем — найти главнейшие законы спектральных линий и электронных оболочек атомов, включая их значение для химии. Это мне кажется чудом и теперь. Это — наивысшая музыкальность в области мысли».
«Пусть это и безумие, но в нем есть метод»,— цитировал юный Гейзенберг, говоря о постулатах Бора в 1920 г. Сорок лет спустя он писал по-другому: «Язык образов Бора — это язык поэзии, который лишь отчасти имеет отношение к изображаемой им действительности и который нельзя никогда понимать буквально.... Постулаты Бора подобны кисти, и краскам, которые сами по себе еще не составляют картины, но с их помощью можно ее создать».
Издали всегда много легче и надежнее оценивать значение открытий. Современникам гораздо труднее. Они еще слишком мало знают, чтобы отличить достоинства теории от ее недостатков. Современники Бора, несмотря на все успехи его гипотезы, были глубоко неудовлетворены. То, что они писали и говорили в то время, для нас непривычно и поучительно.
«Если это правильно, то это означает конец физики как науки» (А. Эйнштейн, 1913 г.).
«Я убежден, что это учение является роковым для здорового развития науки» (А. Шустер, 1913 г.).
«Атом существует вечно, мы это бесспорно знаем. Но понимаем ли мы это? Нет, не понимаем. Наше непонимание мы прикрываем непонятными же квантовыми условиями. Процесс лучеиспускания — это акт возрождения разрушенного атома. Механизм его нам непонятен. Свое непонимание мы вновь прикрываем непонятным квантовым условием, второй гипотезой Бора... Весь этот метод Бора основан на квантовании — совершенно слепом, мало логическом процессе мысли, на формальной, если можно так выразиться, интуиции» (Д. С. Рождественский, 1919 г.).
«Теория квантов подобна другим победам в науке: месяцами вы улыбаетесь им, а затем годами плачете» (Г. Крамере, 1920 г.).
«Законы квантования в своей теперешней формулировке носят до некоторой степени теологический характер, для натуралиста совершенно неприемлемый, так что многие ученые по справедливости возмущаются этими Bauern-Regeln (крестьянскими законами)» (П. Эпштейн, 1922 г.).
«Мы неизмеримо далеки от такого описания атомного механизма, которое позволило бы проследить, например, все движения электрона в атоме или понять роль стационарных состояний...
Теорию квантов можно сравнить с’ лекарством, излечивающим болезнь, но убивающим больного» (Г. Крамере, X. Гольст, 1923 г.).
«Все это очень красиво и крайне важно, но, к сожалению, не очень понятно. Мы не понимаем ни гипотезы Планка об осцилляторах, ни запрета нестационарных орбит, и мы не понимаем, как же в конце концов образуется свет согласно теории Бора. Не подлежит сомнению, что механику квантов, механику дискретного, еще предстоит создать» (Г. А. Лоренц, 1923 г.).
«Физика теперь снова зашла в тупик, во всяком случае для меня она слишком трудна, и я предпочел бы быть комиком в кино или кем-нибудь вроде этого и не слышать ничего о физике!» (В. Паули, 21 мая 1925 г.).
Отто Штерн вспоминал много лет спустя, что в то время они с Лауэ поклялись оставить занятие физикой, если «в этой боровской бессмыслице хоть что-то есть». А Лоренц сетовал, что не умер пятью годами ранее, когда в физике еще сохранялась относительная ясность.
Даже у самого Бора тогдашнее положение теории вызывало «чувство грусти и безнадежности».
Это единодушное недовольство трудно понять тем, кто совсем незнаком со структурой и методологией физики, и чтобы осознать его причину, надо хотя бы в общих чертах представлять себе внутреннюю логику естественных наук.
В учебнике квантовой механики человека неискушенного прежде всего поражает обилие формул и уравнений. Довольно скоро он убеждается, что это необходимая, но не самая* трудная часть науки об атоме. Гораздо сложнее понять,
что скрывается за формулами, или, как принято говорить, «понять физический смысл формул». Трудности эти не следует преувеличивать, но, поскольку они все-таки реально существуют, помнить о них полезно.
Их суть в том, что многие слова, привычные нам с детства, в квантовой механике мы вынуждены использовать в необычном смысле.
ЯВЛЕНИЕ, ОБРАЗ, ПОНЯТИЕ, ФОРМУЛА
Всякое познание природы начинается с ощущений: ребенок трогает рукой деревянную лошадь, слушает голос матери, сосет соску — словом, с первых дней жизни он попадает в мир
явлений, которые рождают у него свои
образы. Для этих явлений и образов у него нет пока даже названий — лишь постепенно он начинает узнавать
слова, им соответствующие. Некоторое время спустя он догадывается, что одни и те же слова рождают у разных людей различные образы, и, наконец, выясняет, что существуют слова (или группы слов), которые не связаны непосредственно с образами, хотя и появились благодаря им. Это —
понятия.
Понятия обобщают коллективный опыт, они намеренно лишены деталей, присущих конкретным образам, и потому пригодны для общения разных людей между собой. Однако и понятия не вполне однозначны — хотя бы потому, что могут вызвать у разных людей различные образы. Даже в повседневной жизни это часто приводит к недоразумениям. В науке это еще опаснее: ее результаты претендуют на объективный смысл, который не должен зависеть от капризов воображения или непостоянства человеческих мнений. Поэтому в науке почти каждому понятию поставлена в соответствие формула — набор символов и чисел, и заданы правила

действий над ними. Этим достигается та однозначность науки, которая позволяет общаться между собой ученым разных стран и поколений.
Связь
явление —образ —понятие —формула можно изобразить схематически и пояснить на примере возникновения понятия «волна».
Люди наблюдали различные явления: волны на море и круги от брошенного в пруд камня, распространение света и колебания струн. У них при этом возникали вполне конкретные образы. Постепенно им стало ясно, что этим разным явлениям присуще нечто общее: все они связаны с некоторым
периодическим процессом, характерные признаки которого — явления интерференции и дифракции. Так в физике возникло новое понятие —
волна. А чтобы сделать его вполне однозначным, >с ним связали четыре характеристики: амплитуду
А, скорость распространения v, длину волны X и частоту v.
Точно так же понятие
частица не предполагает, что у вас при этом возникает конкретный образ песчинки или макового зернышка. Физику вполне достаточно знать, что частица — это некий объект, внутренним строением которого он не интересуется, важно только, что у него есть масса т, скорость v, импульс
p = mv и траектория движения, которую физик может проследить.
Траектория — еще одно понятие, которое необходимо использовать, определяя «движение частицы». На первый взгляд процесс этот беспределен: чтобы определить понятие, нужно использовать другое, а его, в свою очередь, тоже определять и т. д. Однако это не так. В физике существует несколько первичных понятий, которые можно определить без ссылок на другие, а именно — задав точные рецепты измерения величин, этим понятиям соответствующие. Таковы понятия: время
t, координата х, заряд
е и т. д.
Траектория движения частицы х(/) задана, если в каждый момент времени
t мы можем указать ее координату
х. Для этого нужно либо измерить координаты
xt в моменты времени
tiy либо вычислить их. Первую задачу решает экспериментальная физика, вторую — теоретическая, причем вторую задачу можно решить лишь в том случае, если известны физические законы, по которым частица движется.
Физический закон — это постоянная связь явлений и соответствующих им величин, записанная с помощью математических символов в виде уравнений. Для каждой группы явле-
нии существуют свои законы движения: в механике—одни законы (уравнения Ньютона), в электродинамике—другие (уравнения Максвелла). А все вместе, взятое в совокупности, т— понятия, физические законы, формулы, их выражающие, и следствия из них — принято называть точной наукой.
Каждая законченная наука должна быть логически непротиворечивой. Это означает, в частности, что каждое понятие в рамках этой науки можно употреблять только в одном, строго определенном смысле. Добиться этого трудно, но необходимо, поскольку ученые, как и все люди, общаются между собой-не формулами, а с помощью слов. Формулы нужны им для однозначной записи результатов исследований.
Примером логически завершенной науки долгое время служила механика, которую теперь называют классической. Механика — это наука о движении тел. Ее законам подчиняются почти все видимые движения в природе — будь то порхание мотылька или полет ракеты. Классическое совершенство механики долгое время гипнотизировало ученых, и они пытались объяснить с ее помощью не только механическое, но и все другие движения в природе. «Все единодушно признают, что задачей физики является подведение всех явлений природы под простые законы механики»,— писал Генрих Герц даже в 1894 г., на пороге революции в физике.
Движение — одно из самых сложных понятий физики. С ним воображение вольно связывать самые разные образы — от шелеста листьев до бегущего носорога. Однако даже самые фантастические картины движения содержат нечто общее: перемещение одних объектов относительно других с течением времени. После введения понятия траектории понятие движения становится более определенным, вероятно потому, что при этом оно вновь приобретает черты наглядности. Условия развития и воспитания человека таковы, что ему трудно вообразить иное движение, кроме механического, поэтому и все другие движения он пытается осмыслить также с помощью понятия о траектории. Это ему, естественно, не удается, например при попытке осмыслить электрические движения. Можно, конечно, представить себе высоковольтную линию передач или междугородний телефон и вообразить, что провода и есть «траектория» электрических сигналов, однако реального смысла такие образы не имеют: электромагнитные волны — это не жидкость, текущая по проводам.
Определить понятие движения в квантовой механике еще сложнее. Более того: именно тот день, когда его удалось определить непротиворечиво, можно считать днем рождения современной квантовой механики.
НО
МАТРИЧНАЯ
МЕХАНИКА ГЕЙЗЕНБЕРГА
Когда прошел восторг первых успехов теории Бора, все вдруг трезво осознали простую истину: схема Бора противоречива. От этого факта некуда было укрыться, и им объясняется тогдашний пессимизм Эйнштейна, равно как и отчаяние Паули. Физики вновь и вновь убеждались, что электрон при движении в атоме не подчиняется законам электродинамики: он не падает на ядро и даже не излучает, если атом не возбужден. Все это было настолько необычно, что не укладывалось в голове: электрон, который «произошел» от электродинамики, вдруг вышел из-под контроля ее законов. При любой попытке найти логический выход из этого порочного круга ученые всегда приходили к выводу: атом Бора существовать не может.
Однако природе нет дела до наших логических построений; атомы устойчивы вопреки всякой логике и, насколько мы знаем, существуют вечно. А если законы электродинамики не могут объяснить устойчивость атома — тем хуже для них, значит, движение электрона в атоме подчиняется каким-то другим законам. Впоследствии оказалось, что постулаты Бора — это удачная догадка о тогда еще не известных, но фундаментальных законах, которые чуть нозже назовут законами квантовой механики.
Квантовая механика — это наука о движении электронов в атоме. Она первоначально так и называлась: атомная механика. А Вернер Карл Гейзенберг — первый из тех, кому выпало счастье эту науку создавать.
Весной 1925 г., по приглашению Бора, Гейзенберг приехал в Копенгаген из Гёттингена, где он работал ассистентом Макса Борна после окончания университета в Мюнхене под руководством Зоммерфельда. В Дании он сразу же попал в обстановку научных споров, в среду людей, для которых квантовая физика стала главным делом жизни. Полгода прошли в работе и бесконечных дискуссиях все о том же: почему электрон — объект электродинамики — не подчиняется в атоме ее законам, в чем причина удивительной силы нелогичных постулатов Бора и, наконец, что означает в этом случае само понятие «движение»?
Напряженные размышления Гейзенберга разрешились неожиданной догадкой, которая мало-помалу сменилась уверенностью: движение электрона в атоме нельзя представлять себе как движение маленького шарика по траек-

тории. Нельзя, потому что электрон не шарик, а нечто более изощренное, и проследить за движением этого «нечто» столь же подробно, как за движением бильярдного шара, невозможно. Поэтому, пытаясь определить траекторию электрона в атоме, мы задаем природе незаконные вопросы. Вроде тех, которые задавали в древности: «На чем держится Земля?», «Где у нее край?», а немного позднее: «Где у нее верх и низ?»
Гейзенберг утверждал: уравнения, с помощью которых мы хотим описать движение в атоме, не должны содержать никаких величин, кроме тех, которые можно измерить на опыте. Из опытов следовало, что атом устойчив, состоит из ядра и электронов и может излучать, если его вывести из состояния равновесия. Это излучение имеет строго определенную длину волны и, если верить Бору, возникает при перескоке электрона с одной стационарной орбиты на другую. При этом схема Бора ничего не говорила о том, что происходит с электроном в момент скачка, так сказать, «в полете» между двумя стационарными состояниями. А все, и Гейзенберг в том числе, по привычке добивались ответа именно на этот вопрос. Но в какой-то момент ему стало ясно: электрон не бывает «между» стационарными состояниями, такого свойства у него просто нет!
А что есть? Есть нечто, чему он не знал пока даже названия, но был убежден: оно должно зависеть только от того,
куда перешел электрон и
откуда он пришел.
До сих пор, исходя из уравнений электродинамики, все пытались найти гипотетическую траекторию
x(t) электрона в атоме, которая непрерывно зависит от времени и которую можно задать рядом чисел
Xi, х
2, хз, отмечающих положение электрона в моменты времени 6, /
2, /з, ... Гейзенберг утверждал: такой траектории в атоме нет, а вместо непрерывной кривой
x(t) есть набор дискретных чисел
xnky значения которых зависят от номеров
k и
п — начального и конечного состояний электрона.
Это очень важное и довольно сложное утверждение можно пояснить простой аналогией. Представьте, что перед вами шахматная доска, по которой ползет муха. При желании можно очень подробно проследить ее путь, если в каждый момент времени
Ь отмечать ее положение X/. По этим измерениям вы затем легко сможете начертить кривую х(/),
то есть траекторию движения мухи. Если у вас нет такого желания, достаточно указать квадраты, I

которые посетила муха на своем 1
пути. Это тоже даст некую инфор-
ц мацию о ее перемещении, но легко сообразить, что с точки зрения классической механики такое описание будет неполным.
Теперь представьте, что вы за той же доской играете в шахматы и решили, например, сделать традиционный ход е2 — е4. В этом случае результат вашего хода совершенно не связан с тем, по какому пути вы передвинули пешку. Это и понятно: правила шахматной игры не зависят от законов механики, а потому и не нуждаются в понятии траектории.
Гейзенберг сообразил, что «правила атомной игры» тоже не требуют знания траектории. В соответствии с этим он представил состояние атома в виде бесконечной шахматной доски, в каждом квадрате которой написаны числа Естественно, что значения этих чисел зависят от положения квадрата на «атомной доске», то есть от номера
п строки и номера
k столбца, на пересечении которых стоит число
xnk-
Никого не удивляет тот факт, что запись шахматной партии позволяет воспроизвести ее даже много лет спустя. Конечно, при этом мы не узнаем, как долго она длилась в действительности, что переживали тогда шахматисты и как именно двигали они пешки и фигуры. Но это и неважно, коль скоро нам интересна только игра сама по себе.
Точно так же, если нам известны числа
xnk — эта своеобразная запись «атомной игры»,— мы знаем об атоме все необходимое, чтобы предсказать его наблюдаемые свойства: спектр атома, интенсивность его спектральных линий, число и скорость электронов, выбитых из атома ультрафиолетовыми лучами, а также многое другое. Числа
хпь нельзя назвать координатами электрона в атоме. Они заменяют их, или, как стали говорить позже,
представляют их. Но что означают эти слова — на первых порах не понимал и сам Гейзенберг.
Действительно, вместо квадратной таблицы чисел
xnk с таким же успехом можно нарисовать все, что угодно, скажем куб, и сказать, что именно он представляет движение электрона в атоме. Однако тут же с помощью Макса Борна удалось понять, что таблица чисел
хпь не просто таблица, а
матрица.
Что означает это слово? Математика имеет дело с числами и символами, и каждый символ в ней подчиняется своим правилам действия. Например, числа можно складывать и вычитать, умножать и делить, и результат этих действий не зависит от того, в каком порядке мы их производим:
54-3 = 34-5 и 5-3 = 3-5.
Но в математике есть и более сложные объекты: отрицательные и комплексные числа, векторы, матрицы и т. д. Матрицы — это таблицы величин типа
Xnk, для которых определены свои операции сложения и умножения, непохожие на правила действий с обыкновенными числами. Например, складывать и вычитать матрицы, как и обычные числа, можно в произвольном порядке. Однако результат умножения двух матриц зависит от порядка умножения, то есть
%nk * Pkn Pnk • Xkn‘
Например, произведение матриц
а, -°.) ;)
явно отличается от такого же произведения, но в котором порядок умножаемых матриц обратный:
Правило умножения матриц может показаться странным и подозрительным, но никакого произвола в себе не содержит. По существу, именно оно отличает матрицы от других величин. Конечно, математики о матрицах знали задолго до Гейзенберга и умели с ними работать. Однако для всех было полной неожиданностью, что эти странные объекты с непривычными свойствами соответствуют чему-то реальному в природе. Заслуга Гейзенберга и Борна в том и состоит, что они преодолели психологический барьер, нашли соответствие между свойствами матриц и особенностями движения электронов в атоме и тем самым основали новую,
атомную, квантовую, матричную механику.
Атомную — потому, что она описывает движение электронов в атоме.
Квантовую — ибо главную роль в этом описании играет понятие кванта действия
h.
Матричную — поскольку необходимый для этого математический аппарат — матрицы. -
В новой механике каждой характеристике электрона: координате х, импульсу р, энергии
Е — ставились в соответствие матрицы
Xnk, Pnk, Enk, и уже для них (а не для чисел) записывали уравнения движения, известные из классической механики. А затем надо было только проследить, чтобы все действия над величинами
xnk, pnk, Enk не нарушали правил математики.
Макс Борн установил даже нечто большее: он выяснил,
что квантовомеханические матрицы координаты
xnk и импульса
pnk — это не любые матрицы, а только те из них, которые подчиняются перестановочному (или коммутационному) соотношению
Хдй •
Pkn Pnk * Xkn = /Д,
где — 1 — мнимая единица, a
h = h/2n.
В новой механике это перестановочное соотношение играло точно такую же роль, как условие квантования Бора
в старой механике. И точно так же, как условия Бора выделяли стационарные орбиты из набора всех возможных, коммутационные соотношения выбирают из множества всех матриц только квантовомеханические. Не случайно, что в обоих случаях — ив условиях квантования Бора, и в перестановочных соотношениях — всегда присутствует постоянная Планка
h: она непременно входит во все уравнения квантовой механики, и по этому признаку их можно безошибочно отличить от всех других уравнений.
Новые уравнения, которые нашел Гейзенберг, не были похожи ни на уравнения механики, ни на уравнения электродинамики и потому никак не могли их нарушить. На языке новых уравнений состояние атома полностью задано, если известны все числа
xnk и
pnk, то есть известны матрицы, соответствующие координате и импульсу электрона.
Обратите внимание: в наших рассуждениях мы нигде не использовали понятие «движение электрона в атоме». Теперь
оно просто не нужно. Согласно Гейзенбергу, движение — это не перемещение электрона-шарика по какой-либо траекто-
рии вокруг ядра, а изменение состояния системы «атом» во времени, которое описывается матрицами
xnk и
pnk- Вместе
с вопросами о характере движения электрона в атоме сам собой отпал и вопрос об устройчивости атома. С новой точки зрения в-невозбужденном атоме электрон покоится, а потому
и не должен излучать.
Можно и дальше пытаться без формул излагать следствия механики Гейзенберга. Однако это будет так же неестественно, как попытка пересказать словами музыку. Чтобы постигнуть суть и детали квантовой механики, необходимо изучать математику, учиться работать с матрицами — одним словом, надо овладевать ремеслом физика. В матрицах нет ничего мистического или непостижимого; изучить их значительно проще, чем усвоить, скажем, латынь. Но этому, как и музыке, не следует учиться на ходу. Иначе неприятный осадок полузнания отравит даже то удовольствие, которое доступно каждому: без формул и вычислений почувствовать красоту образов и законченность понятий любой глубокой науки.
Появление матричной механики Гейзенберга физики встретили с облегчением: «Механика Гейзенберга снова вернула мне радость жизни и надежду. Хотя она и не дает решения загадки, но я верю, что теперь снова можно продвигаться вперед»,— писал Паули 9 октября 1925 г. Свою веру он вскоре сам же и оправдал: применив новую механику к атому водорода, он получил те же формулы, что и Нильс Бор на основании своих постулатов. Конечно, при этом возникли новые проблемы, однако это уже были трудности роста, а не безнадежность тупика.

ВОКРУГ КВАНТА
Фундамент физики
Основные понятия физики — длину, время, массу, заряд и т. д. — нельзя определить однозначно с помощью слов по двум причинам: во-первых, эти понятия первичны и ни к чему другому, более простому, не сводятся; во-вторых, физика — наука количественная и понятиям сразу же необходимо соотнести числа. Существует только один способ сделать такие понятия однозначными: задать точный рецепт измерения величин, которые им соответствуют.
Мы уже определяли понятие «длина»: метр — это такая длина, на которой укладывается 1 650 763,73 длины волны красно-оранжевой линии спектра Кг-86 в вакууме (изотоп криптона с массовым числом 86). Принятая за эталон спектральная линия соответствует переходу электрона с уровня 2рю на уровень 5t/s. Определенный таким образом метр приближенно равен 1/40 000 000 части парижского меридиана, принятой первоначально в 1800 г. за эталон метра.
Единица массы килограмм определяется как масса плати-но-иридиевого цилиндра специальной формы (его высота 39 мм равна диаметру основания), который изготовлен в 1789 г. Эта масса приближенно совпадает с массой 1 л дистиллированной воды при 4 °C.
Чтобы определить единицу времени, надо использовать какой-нибудь стабильный циклический процесс, например вращение Земли вокруг Солнца. Секунда — это 1 /31 556 925,9747 часть тропического года, который равен промежутку времени между двумя одинаковыми положениями Земли относительно звезд. Однако продолжительность тропического года медленно меняется (на 0,5 с в столетие) из-за прецессии земной оси и других возмущений, поэтому в эталоне принята продолжительность 1900 г., а точнее — года, который начался в 12 ч дня 31 декабря 1899 г.
С течением времени убедились, однако, что единицу времени, так же как и единицу длины, лучше всего определять на основе спектроскопических измерений. В 1967 г. XIII Генеральная конференция по мерам и весам дала новое определение секунды, .согласно которому секунда — это продолжительность 9 192 631 770 периодов излучения, соответствующего переходу электрона между двумя уровнями сверхтонкой структуры основного состояния изотопа цезия с массовым числом 133 (цезиевый стандарт частоты).
Переход к атомным стандартам длины и времени был неизбежен не только потому, что спектроскопия — самый точный раздел физики. Дело в том, что атомные стандарты необычайно стабильны: они практически не зависят ни от температуры, ни от давления, ни даже от космических катастроф, чего нельзя сказать о первоначально принятых эталонах. (Например, «стандартный метр» хранят под стеклянным колпаком, при постоянной температуре, в железном шкафу, в глубоком подвале, три ключа от которого хранятся у трех разных должностных лиц, и с прочими предосторожностями.) Еще хуже обстоят дела с секундой. В самом деле, если через Солнечную систему неожиданно пролетит какое-то небесное тело, то период обращения Земли вокруг Солнца необратимо изменится, а вместе с ним изменится и продолжительность секунды. Ничто подобное не грозит атомным стандартам: они устойчивы и неизменны, как сам атом, на свойствах которого они основаны.
Три единицы — метр, килограмм, секунда — образуют часть системы единиц СИ и достаточны для описания всех механических движений. В физике традиционно используется другая система единиц — СГС, в основу которой положены сантиметр, грамм, секунда. Электромагнитная теория требует измерения еще двух фундаментальных величин: заряда
е и скорости света
с. А чтобы описать атом-
ные явления, необходимо знать также значение постоянной Планка
h.
Для точного определения фундаментальных физических констант в 1875 г. создано Международное бюро мер и весов, которое раз в шесть лет собирает генеральные конференции мер и весов. На них тщательно оговариваются все технические подробности условий, в которых происходят измерения: температура, давление, высота над уровнем моря и т. д. Столь же скрупулезно перечисляются все детали приборов для измерения этих величин.
Отметим важную особенность таких измерений: только в редких случаях удается определить одну величину независимо от других. В остальных случаях необходимо использовать законы физики. Скажем, если скорость
v частицы постоянна, то можно определить ее, измеряя расстояние Дх, которое частица пройдет за время Д/:
Дх
и наоборот: эталон метра можно определить по формуле / = сД/,
где Д/=1/<? секунд, £ = 299 792 458 м/с — скорость света в вакууме, что и было принято в 1983 г. Это — простой пример того, что все фундаментальные константы в некотором смысле взаимосвязаны. Существует специальный и довольно сложный раздел физики — метрология, задача которого — непротиворечиво определить весь набор физических констант, учитывая одновременно все данные об их измерениях.
Самый трудный вопрос — о границах применимости понятий, определенных таким способом. Легко сообразить, что единицы измерения — метр, килограмм, секунда — выбраны естественно, поскольку они соизмеримы с размерами самого человека. Действительно, 1 м — это рост пятилетнего ребенка, 1 кг — масса буханки хлеба, 1 с — один удар сердца. Сохраняют ли эти понятия свой прежний смысл при переходе к очень большим и очень малым расстояниям, массам и промежуткам времени?
Общего ответа на этот вопрос пока не существует. Например, у нас был случай убедиться, что к электрону понятие размера уже неприменимо. В теории атома, где понятие «движение» пришлось заменить новым, прежние понятия «длина», «масса», «время» все еще сохраняют свою силу. Это означает, что по крайней мере расстояние 10
-8 см = = 10“
10 м, масса 10
-24 г— 10
-27 кг (размер и масса атома)
118 и промежуток времени 10“
17 с (период обращения электрона в атоме) еще можно понимать в их обычном смысле.
Аналогичная проблема возникает и в астрономии при попытке осмыслить огромные расстояния до галактик. Пожалуй, здесь она даже труднее, чем в теории элементарных частиц. Действительно, никто не может с легким сердцем утверждать, что он вполне понимает слова «расстояние в один миллиард световых лет». Формально все предельно просто: это расстояние, которое проходит луч света за 10
9лет, то есть расстояние в 10
9- (3,15 • 10
7 с) • (3-10
8м/с) = = 10
25 м. Но как понять или хотя бы почувствовать, что в действительности скрывается за этим символом?
Воистину прав Паскаль: «Человек распят между двумя бесконечностями».
ГЛАВА 7
Русалка
В свои 23 года венгерский офицер Янош Бойаи открыл неевклидову геометрию и был счастлив этим до тех пор, пока не узнал, что где-то на границе Азии и Европы Николай Иванович Лобачевский обнародовал ту же геометрию несколькими годами ранее. И тогда жизнь Яноша стала походить на кошмар: повсюду ему чудились шпионы и соглядатаи, он подозревал всех, даже своего отца, всю жизнь посвятившего той же проблеме. Наверное, Фаркаш Бойаи не был так гениален, но он был человечнее и мудрее сына. Умирая, он говорил ему: «Не отчаивайся: когда приходит весна — все фиалки расцветают сразу».
В науке об атоме такая весна наступила в 1925 г.: всего за два года появилась, расцвела и даже дала первые плоды новая наука — квантовая механика. Ее основы с тех пор не изменились; так внезапно среди океана возникает вулканический остров й затем уже не меняется столетиями. Конечно, все это — и остров в океане, и весна — неожиданны лишь для тех, кто не следил за подземными толчками и равнодушно проходил мимо набухших почек. В первой части мы стремились почувствовать именно эти глухие толчки новых фактов, разглядеть то незаметное движение идей, с которых и началась весна квантовой механики.
Статья Гейзенберга с изложением идей матричной механики появилась осенью 1925 г. Это была первая последовательная теория атома, объяснившая его устойчивость. Но (вполне по законам весны!) всего полгода спустя Эрвин Шрёдингер создал еще одну,
волновую механику, которая на первый взгляд была совсем непохожа на матричную механику, но столь же хорошо объясняла строение атома. Впоследствии оказалось, что и матричная, и волновая механики — просто разные формы записи единой квантовой механики. А еще через несколько лет станет ясно, что квантовая механика — не просто одна из наук, а основа всего современного научного знания.
ЛУИ ДЕ БРОЙЛЬ
Гейзенберг родился в тот год, когда была напечатана знаменитая работа Планка. Когда он заканчивал гимназию, его родина Германия воевала со всем миром: с Россией — родиной Менделеева, с Англией — родиной Резерфорда, с Францией, где в 1892 г. родился принц Луи Виктор де Бройль (1892—1987) —потомок королей и будущий Нобелевский лауреат. Как и многие в то время, де Бройль воевал и лишь после войны стал работать в лаборатории своего старшего брата Мориса, который изучал рентгеновские спектры элементов. Кроме того Морис был лично знаком с большинством ведущих физиков того времени и в его лаборатории не только хорошо знали работы Бора, но и были в курсе всех последних событий в атомной физике.
Луи де Бройля занимал все тот же вопрос: «Почему атомы устойчивы?
И почему на стационарных орбитах электрон не излучает?» Первый постулат Бора выделял эти орбиты из набора всех мыслимых орбит квантовым условием, которое связывает радиус орбиты г, скорость
о и массу
т электрона с целым числом
п квантов действия Й = /г/2л:
mvr = nh.
Де Бройль хотел найти разумные основания для этого условия, то есть стремился объяснить его с помощью других, более привычных понятий, или, другими словами, пытался понять его физический смысл.
Когда ищут объяснение непонятным фактам, как правило, прибегают к аналогиям. Точно так же поступил и де Бройль. В поисках выхода из тупика противоречивых представлений об атоме он догадался, что трудности эти сродни тем, которые возникли при попытках понять противоречивые свойства света. Со светом дело запуталось окончательно в 1923 г., когда Артур Комптон поставил свой знаменитый опыт и доказал, что рассеяние рентгеновских лучей на электронах нисколько не похоже на рассеяние морских волн, зато в точности напоминает столкновение двух бильярдных шаров, один из которых — электрон с массой /и, а другой — световой квант с энергией
E — hv. После опыта Комптона и объяснения, данного им самим и Петером Йозефом Вильгельмом Дебаем (1884—1966), уже нельзя было сомневаться в том, что в природе реально существуют световые кванты — фотоны с энергией
E = hvy импульсом
p — hy/c и длиной волны X = c/v, которой эти кванты соответствуют.
|
| Луи де Бройль |
дуализма в природе, но в то время де Бройлю пришлось
Ни де Бройль, ни его современники не могли объяснить, что означают слова: «световые кванты соответствуют световой волне». Однако у них не было оснований подвергать сомнению эксперименты, из которых следовало, что в одних условиях световой луч ведет себя как волна с длиной X и частотой v, а в других — как поток частиц — фотонов с энергией
E = hv и импульсом
p^h/'k (раньше их называли
корпускулами). Года через три-четыре все поймут, что это явление — лишь частный случай всеобщего
корпускулярно-волнового находить верную дорогу ощупью.
ВОЛНЫ МАТЕРИИ
Де Бройль верил в единство природы, верил искренне и глубоко — как все великие ученые до него. Поэтому он не мог допустить, что луч света — нечто особенное и ни на что другое в природе не похожее. Де Бройль предположил: не только луч света, но и
все тела в природе должны обладать и волновыми, и корпускулярными свойствами одновременно. Поэтому, кроме световых волн и частиц материи, в природе должны реально существовать и корпускулы света, и волны материи.
Такое простое и сильное утверждение нелегко высказать — для этого нужны смелость и вера. Еще труднее его понять — на это способен лишь непредвзятый ум, привычный к абстрактному мышлению.
И вряд ли можно это наглядно представить — природа, доступная восприятию наших пяти чувств, не создала зримых образов, которые помогли бы в этих усилиях. В самом деле, при слове «частица» вам может прийти на память все, что угодно — песчинка, бильярдный шар, летящий камень, но вы никогда не вспомните морские волны или колеблющуюся струну. Для нормального человека это настолько несовместимые образы, что объединить их в один кажется противоестественным.
Всякий рассказ о рождении новой физической теории эаведомо неточен даже в устах ее автора: такой рассказ, как правило, использует готовые понятия, которых в момент создания теории не было. У ныне живущих физиков понятие «волна материи» вызывает в сознании некий сложный образ, который ни с чем привычным в окружающем нас мире сравнить нельзя. Образ этот складывается постепенно, при работе с формулами квантовой механики, при решении квантовых задач, и рассказать о нем словами довольно трудно. Понятно, что такого сложного и совершенного образа в 1923 г. у де Бройля не было. Чтобы пояснить его тогдашние рассуждения, мы также используем подходящий заменитель, а именно образ волны, которая возникает при колебаниях струны.
Хорошо известно, что при ударе по натянутой струне она начинает звучать и звук этот зависит от натяжения и от длины струны. Механизм появления звука также хорошо известен: колебания струны передаются воздуху, и мы воспринимаем уже его колебания, а не струны. Однако между ними существует однозначная связь. Например, если мы слышим ноту «ля» первой октавы, то в этот момент струна колеблется с частотой v = 440 Гц, то есть 440 колебаний в секунду. А поскольку скорость звука в воздухе равна у —344 м/с, то длина этих звуковых волн равна X = z?/v = = 0,78 м.
При колебаниях струны мы слышим основной тон — такое колебание, когда вся струна колеблется как целое. Однако при ее возбуждении возникают и дополнительные колебания — обертоны. Картина колебаний усложняется, на струне появляются «узлы», то есть такие точки, которые остаются неподвижными в процессе колеб соблюдается одно условие: на длине струны умещается целое число полуволн Х/2. Для основного тона на длине струны укладывается ровно половина волны Х/2. Для первого обертона — две половины волны, между которыми расположен неподвижный «узел», и т. д.
Дальнейшее — сравнительно просто. Свернем наши струны в кольцо и представим себе, что это орбиты электрона в атоме. Теперь заменим движение электрона по ним колебаниями волн, которые «соответствуют электрону»,— де Бройль был убежден, что это разумно,— и предположим, что
| . Но всегда строго |

|
движение электрона будет устойчивым тогда — и /только тогда! — когда на длине орбиты укладывается целое число
п «волн электрона» X. Отсюда
следует простое условие:
2лг = пХ.
Теперь достаточно сравнить это условие с первым постулатом Бора
2nmvr — nh
и найти отсюда «длину волны электрона»:
х=-^.
ти
Вот и все. Это действительно просто. Но это так же просто, как формула Планка
E — hv, как постулаты Бора, как закон всемирного тяготения Ньютона, — это гениально просто. Такие открытия просты, ибо требуют самых простых понятий. Но они меняют самые основы нашего мышления. В истории развития человеческого духа их считанное число.
И никогда нельзя до конца понять,
как они были совершены. Это — всегда чудо, объяснить которое не под силу даже самим создателям. Они могут лишь вслед за Ньютоном повторить: «Я все время об этом думал».
Де Бройлю было 30 лет, когда он нашел свою формулу. Но искать ее он начал за двенадцать лет до этого — с тех самых пор, как его брат Морис приехал из Брюсселя, где он был секретарем I Сольвеевского конгресса. Того самого конгресса 1911 г., на котором Планк рассказал о развитии «гипотезы квант». Значительность открытий, живые впечатления старшего брата от общения с великими физиками настолько поразили воображение младшего, что он не смог забыть их даже на войне. Постоянное напряжение мысли разрешилось, наконец, в 1923 г. гипотезой о волнах материи. Теперь де Бройль смог дать новое определение понятию «стационарная орбита»: это такая орбита, на которой укладывается целое число «волн электрона» \ —
Если это действительно так, то проблемы устойчивости атома не существует, ибо в стационарном состоянии он подобен струне, колеблющейся в вакууме без трения. Такие колебания не затухают, а потому без внешнего воздействия электрон останется в стационарном состоянии навсегда.
Самое трудное — высказать гипотезу. Это всегда процесс нелогический. Но как только она высказана, законы логики позволяют извлечь из нее все следствия. Главное из них очевидно: если «волны материи» существуют, то их можно обнаружить и измерить. Через четыре года их действительно нашли и доказали их реальность с той степенью строгости, какая принята в физике.
Свои формулы де Бройль написал за два года до работ Гейзенберга и Шрёдингера. Их простота и прозрачность основной идеи очень напоминали постулаты Бора. И точно так же, как постулаты Бора, идеи де Бройля еще не давали теории атома — для этого их необходимо было записать на языке уравнений. Когда Вернер Гейзенберг создал матричную механику, он тем самым превратил идеи Бора в точные формулы и строгие уравнения. Идеи де Бройля стали началом волновой механики, которую создал Эрвин Шрёдингер.
ОПТИКО-МЕХАНИЧЕСКАЯ АНАЛОГИЯ
Говорим ли мы об атомах или о квантах — мы вновь и вновь обращаемся к свойствам света. Это не случайно: по существу, в них надо искать истоки почти всей нынешней физики. Сейчас мы еще раз — и более пристально — взглянем на его свойства. Для этого нам нужно возвратиться к Исааку Ньютону и вспомнить смысл его спора с Христианом Гюйгенсом о природе света.
Всегда, во все времена, все знали, что луч света в пустоте распространяется прямолинейно. В учебниках этот факт изображают обычно прямой линией, соединяющей источник света и глаз наблюдателя, то есть рисуют воображаемую траекторию светового луча.
И по смыслу и по возникающим образам эта траектория ничем не отличается от траектории движения частицы. На этом основании во времена Ньютона луч света представляли себе как поток очень маленьких частиц. Конечно, путь этих «световых частиц», как и путь обычных частиц, может искривляться, скажем, при переходе из воздуха в воду, но понятие траектории при этом все равно сохраняется. В повседневной жизни представление о траектории светового луча очень полезно и не приводит к недоразумениям: оно помогает избегать автомобилей на улицах, конструировать фотоаппараты и определять положение звезд на небе.
С развитием экспериментальной физики люди раздвинули узкие границы повседневного опыта и обнаружили новые свойства светового луча: оказывается, он полностью теряет свои привычные свойства, если им осветить «очень маленькое препятствие». Физика — наука количественная, и в ней такое неопределенное утверждение не имеет смысла. «Маленькое» — по сравнению с чем?
Христиан Гюйгенс представлял себе распространение света как колебания некоего «светоносного эфира». Образ, возникающий при этом в сознании, напоминает круги от брошенного в пруд камня либо же бесконечные ряды морских волн. В правомерности этих образов окончательно перестали сомневаться после трудов Максвелла и Герца, которые доказали, что свет — это просто частный случай электромагнитных волн.
Вспомним (мы об этом говорили в первой главе): главная характеристика всякого волнового процесса — это его частота или длина волны. Теперь наше утверждение приобретает строгий смысл: «луч света теряет свои привычные свойства, если размеры препятствия соизмеримы с длиной его волны». В этом случае луч света уже не распространяется прямолинейно — происходит явление дифракции. Кроме того, отдельные волны начинают взаимодействовать между собой — усиливать и гасить друг друга, или, как принято говорить в физике, начинают интерферировать. Оба явления —
дифракция и
интерференция — в конечном итоге дают на экране интерференционную картину, которую с точки зрения Ньютона понять довольно трудно. Волновая теория света объясняет ее вполне естественно, и это в конечном счете определило ее победу.
Со временем к волновцм свойствам света настолько привыкли, что они превратились в некий эталон для всех волновых процессов в физике. Теперь, если в каком-либо процессе замечали вдруг явления интерференции и дифракции,

то уже не сомневались в его волновой природе. Потому, собственно, все сразу и признали гипотезу де Бройля о волнах материи, увидев первые снимки дифракции электронов.
Для нынешнего поколения физиков волновые свойства электрона уже не вопрос веры, а факт точного знания и даже средство для технических приложений.
В стройной теории волновой оптики оставалась одна неувязка: луч света мы воспринимаем все-таки как луч, а не как волну. Как объяснить такой факт с точки зрения волновой оптики? Эту задачу решил Огюстен Жан Френель (1788—1827), и его объяснение можно найти теперь в любом учебнике физики. Оказывается, интерференция приводит к тому, что все волны от источника света гасят друг друга, кроме тех, которые находятся внутри узкого канала, соединяющего источник света и глаз наблюдателя. Толщина этого канала равна половине длины волны света, то есть равна Z/2^2-10”
5 см. Если мы пренебрежем толщиной этого «светового канала», то получим ту самую траекторию светового луча, к которой все мы привыкли в обычной жизни.
Известен даже способ ее построения: сначала нужно провести линии через все гребни волн — как говорят в физике, отметить
фронт волны, а затем от источника света провести линию, которая перпендикулярна к фронту волны. Это и будет траектория светового луча. Если вблизи препятствия фронт волны искажается, то одновременно с этим искривляется и траектория луча — луч света огибает препятствие, происходит дифракция.
В 1834 г. Уильям Роуан Гамильтон (1805—1865), знаменитый на весь мир профессор астрономии в Дублинском университете, занимался непонятной для современников задачей. Он хотел доказать, что формальная аналогия между траекторией движения частицы и траекторией светового луча имеет строгий математический смысл. Мы уже знаем: в физике понятию закона движения соответствуют формулы — уравнения движения. Для волн и частиц они совершенно
различны: решая одни, мы вычисляем траекторию частицы,
решая другие, находим форму и скорость фронта волны. Но мы также знаем, что в оптике можно нарисовать траекторию светового луча, зная движение фронта его волны. Гамильтон доказал, что в механике можно сделать нечто противоположное: заменить траекторию движения частицы распространением фронта некоторой волны. Или, более точно, уравнения движения механики можно записать в таком виде, что они полностью совпадут с уравнениями геометрической оптики, которые описывают распространение луча света без учета его волновых свойств. Тем самым Гамильтон доказал
оптико-механическую аналогию: движение частицы по траектории можно представить как распространение луча света без учета его волновых свойств.
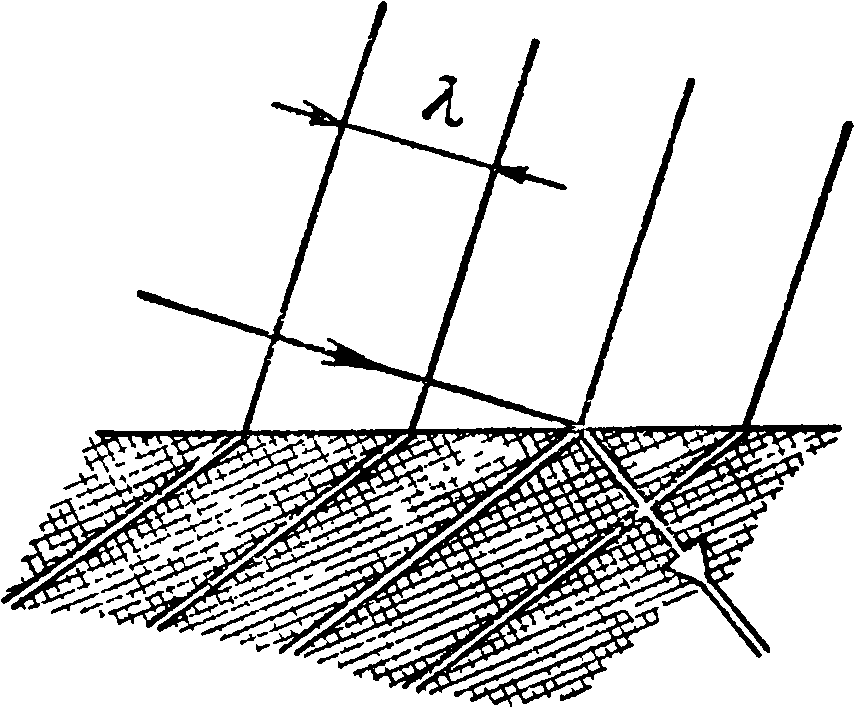
В свое время эти исследования Гамильтона (как и многие другие, например, исчисление гиперкомплексных чисёл — кватернионов) не были по достоинству оценены современниками. Лишь почти столетие спустя эти работы нашли достойное продолжение в трудах Шрёдингера и Дирака.
ВОЛНОВАЯ МЕХАНИКА ШРЕДИНГЕРА
Эрвин Шрёдингер (1887—1961) в 1911 г. окончил Венский университет, еще хранивший традиции Доплера, Физо, Больцмана и весь дух классических времен физики: основательность при изучении явлений и неторопливый к ним интерес. В 1925 г. он был уже немолодым профессором Цюрихского университета, сохранившим, однако, юношеское стремление понять самое главное в тогдашней физике: «Как устроен атом?
И как в нем движутся электроны?»
В конце 1925 г. в одной из статей Эйнштейна Шрёдингер прочел несколько слов похвалы в адрес де Бройля и его гипотезы. Этих немногих сведений ему оказалось достаточно:
он поверил в гипотезу о волнах материи и развил ее до логического конца (что всегда трудно, и не только в науке). Ход его рассуждений легко понять, по крайней мере теперь, более полувека спустя. Вначале он вспомнил оптико-механическую аналогию Гамильтона. Он знал, что она доказана лишь в пределе геометрической оптики — тогда, когда можно пренебречь волновыми свойствами света. Шрёдингер пошел дальше и предположил: оптико-механическая аналогия остается справедливой также и в случае волновой оптики. Это означает, что всегда
любое движение частиц можно уподобить распространению волн.

Как и всякое глубокое открытие, гипотеза Шрёдингера ниоткуда логически • не следовала. Но, как всякое истинное открытие, логические следствия она имела. Прежде всего, если Шрёдингер прав, то движение частиц должно обнаруживать волновые свойства в тех областях пространства, размеры которых сравнимы с длиной волны этих частиц. В большой мере это относится и к движению электрона в атоме: сравнив формулы де Бройля
\ = h/mv и Бора
mvr = h/2ny легко усмотреть, что радиус атома
г — — Х/2л примерно в шесть раз меньше, чем длина волны электрона X. Если эту длину отождествить с размером электро-

|
|
Э. Шрёдингер
|
на в атоме, то становится сразу очевидным, что представлять его в атоме частицей невозможно, ибо тогда придется допустить, что атом построен из таких частиц, которые больше его самого. Отсюда сразу, и немного неожиданно, следует уже известный нам из предыдущей главы постулат Гейзенберга: не существует понятия траектории электрона в атоме.
Действительно, не может нечто большее двигаться внутри чего-то меньшего, и притом по траектории. Но тогда не существует и проблемы устойчивости атома, так как электродинамика запрещает электрону двигаться в атоме лишь по траектории и не отвечает за явления, которые происходят при других типах движений. Все это означает, что в атоме электроны существуют не в виде частиц, а в виде некоторых волн, смысл которых вначале был не очень понятен и Шрёдингеру. Но ему было ясно: какова бы ни была природа этих электронных волн, их движение должно подчиняться
волновому уравнению. Шрёдингер нашел это уравнение. Вот оно:
dx2
^[Е-У(х)]ф = 0.
h
Для тех, кто видит его впервые, оно абсолютно непонятно и может возбудить лишь любопытство или чувство инстинктивного протеста, причем последнее — без серьезных оснований.
В самом деле, рисунок на с. 130 столь же непонятен, как и уравнение Шрёдингера, однако мы принимаем его без внутреннего сопротивления. Мы совсем успокоимся, узнав, что перед нами герб города Парижа. Только самые дотошные станут допытываться, почему он выглядит именно так, а не иначе. Как и в уравнении Шрёдингера, в этом гербе каждая

черта и каждый символ исполнены смысла. Вверху — королевские лилии, которые появились в геральдических знаках Франции уже в конце V века — после победы короля Хлодвига над гуннами у берегов реки Ли. (По преданию, воины Хлодвига, возвращаясь домой, украсили свои шлемы и щиты цветами белых лилий «ли-ли», что в переводе с галльского означает «белый-белый».) Внизу герба — корабль, похожий очертаниями на Ситэ — остров посреди Сены, где в древности обитало племя паризиев, по имени которых назван Париж. А форма герба напоминает парус — в память об основном занятии древних обитателей Парижа. Как видите, понять символику герба несложно, хотя по-настоящему близка и естественна она только парижанам.
Подойдем к уравнению Шрёдингера точно так же. Примем его вначале просто как символ квантовой механики, как некий герб квантовой страны, по которой мы теперь путешествуем, и постараемся понять, почему он именно таков. Некоторые символы в этом гербе нам уже понятны:
т — это масса электрона,
К — постоянная Планка Л, деленная на 2л,
Е — полная энергия электрона в атоме, V(x) — его потенциальная энергия,
х — расстояние от ядра до электрона. Несколько сложнее понять символ дифференцирования
d2/dx2, но с этим пока ничего нельзя поделать, вначале придется просто запомнить, что это символ второй производной от функции ф, из-за которого уравнение Шрёдингера — не простое, а дифференциальное.
Самое сложное — понять, что собой представляет ф-функция (пси-функция): достаточно сказать, что вначале даже сам Шрёдингер истолковал ее неверно. Мы также поймем это несколько позднее, а пока что просто поверим в то, что ф-функция «как-то» представляет движение электрона в атоме. По-другому, чем матрицы Гейзенберга
Xnk и
pnkt но все-таки представляет, и притом — хорошо. Настолько хорошо, что с ее помощью все задачи квантовой механики можно решать значительно проще и быстрее, чем с помощью матриц Гейзенберга. Физики довольно быстро оценили преимущества волновой механики: ее универсальность, изящество и простоту — и с тех пор почти забросили механику матричную.
Жизнь...
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
Руджер Иосип Бошкович (1711 —1787) сейчас известен только узкому кругу специалистов, но в начале прошлого века он был знаменит, а его теория атома оказала влияние даже на мировоззрение таких людей, как Фарадей и Максвелл.
Бошкович родился и провел детские годы в Далмации, в Дубровнике (в то время Рагуса). Он был восьмым ребенком из девяти и самым младшим из шести сыновей в семье крупного торговца. То было время, когда любая деятельность людей получала смысл и признание лишь в том случае, если она была освящена церковью или связана с нею. Уже с 8 лет Бошкович учился в местном иезуитском колледже, а в 14 лет отправился на родину матери, в Рим, и после двух лет искуса был принят в Collegium Romanum. Там он отличился в математике, физике и астрономии и в 1736 г. опубликовал первую научную работу о солнечном экваторе и периоде вращения Солнца. В 29 лет он стал преподавателем, а в 33 — священником и членом общества Иисуса. В продолжение четырнадцати лет он преподает физику и математику, изучает аберрацию света и форму Земли, создает карту Ватикана. В 1760 г. Петербургская академия наук избрала его своим иностранным членом.
Бошкович был не только ученый, но и поэт: в 1779 г. он посвятил поэму Людовику XVI, в которой предсказывал ему царствование без солнечных затмений. Яркие качества его богатой натуры в сочетании с блестящим интеллектом открыли ему доступ в высшие духовные, академические и дипломатические круги Европы.
В 1757 г. он едет в Вену в составе посольства и там за 11 месяцев пишет книгу «Теория натуральной философии, приведенная к единому закону сил, существующих в природе», которую он обдумывал в течение двенадцати лет. После возвращения из Вены он отправился в четырехлетнее путешествие в Париж, Лондон, Константинополь, затем читал лекции, работал в обсерватории в Милане, снискал ненависть коллег независимостью взглядов и в 1772 г. оказался в Венеции без средств к жизни. Друзья выхлопотали ему место в Париже, где он прожил десять лет и лишь в 1783 г. возвратился в Италию — умирать. В конце 1786 г. он почувство-
вал признаки умственного расстройства, которое перешло в патологическую меланхолию. После попытки самоубийства он сошел с ума и 13 февраля 1787 г. закончил свою полную страстей жизнь.
...и атом Бошковича
Из тех немногих, кто в XVIII веке верил в атомы,- Бошко-вич — единственный, кто не верил в атомы — твердые шарики. Поэтому его воззрения ближе к нам, чем все атомные теории XIX века.
Свое недоверие к несжимаемым атомам-шарикам Бошко-вич обосновывал тем, что с помощью таких атомов нельзя объяснить кристаллическую структуру тел и их упругость, плавление твердых веществ, испарение жидкостей, а тем более химические реакции между веществами, построенными из этих круглых, твердых и непроницаемых атомов.
Бошкович представлял себе атом как центр сил, которые меняются в зависимости от расстояния до этого центра. Близко к центру — силы отталкивающие, что соответствует отталкиванию атомов при тесном сближении или при их столкновении. При удалении от центра отталкивающая сила сначала уменьшается, затем обращается в нуль и, наконец, становится притягивающей — как раз в этот момент, по мысли Бошковича, образуются все жидкие и твердые тела. Но если мы еще удалимся от центра сил, то силы вновь станут отталкивающими — в этот момент тела начнут испаряться. Наконец, совсем далеко от атома силы всегда притягивающие, как того и требует закон всемирного тяготения Ньютона.
Таким образом, каждый атом Бошковича «простирается вплоть до границ Солнечной системы», а поскольку центры сил нельзя ни уничтожить, ни создать, то его атомы вечны — так же, как и атомы Демокрита. Именно эта часть учения Бошковича была особенно близка Фарадею: нетрудно усмотреть его аналогию с представлениями Фарадея о силовых линиях электромагнитного поля. И даже на рубеже XX века лорд Кельвин еще раз обратился к атому Бошковича в попытке объяснить на этом языке природу радиоактивности.
Атом Бошковича значительно ближе к современному атому, чем атом Демокрита. Например, как и современный атом, он не имеет определенных геометрических размеров. Зато с его помощью можно понять разнообразие форм кристаллов и всевозможные химические превращения, в которых эти атомы участвуют. Конечно, атом Бошковича — это умозрительная схема, которая не опирается ни на опыт, ни на
132
математику, а лишь на здравый смысл и внимательные наблюдения над природой. Сам Бошкович писал: «Существуют, однако, определенные вещи, связанные с законом сил, относительно которых все мы невежды... Только Он один, кто создал Вселенную, имел перед своими глазами целое».
Квантовая механика позволяет вычислить закон изменения сил между двумя атомами без всякого произвола и ссылок на божественное провидение. С помощью этого закона сил можно предсказать спектр молекулы водорода, предвидеть, что произойдет, если смешать водород, например, с хлором, и что изменится, если облучать эту смесь ультрафиолетовыми лучами.
Мы в состоянии рассчитать форму кристаллов и даже предсказать цвет химических соединений. Конечно, все это доступно только тем, кто владеет довольно сложной математикой квантовой физики. Однако понять многие особенности строения и свойства веществ может каждый, кто хоть немного знаком с ее образами.
Пауль Эренфест (1880—1933)
Кроме пророков, науке нужны апостолы. Кроме одиноких гениев, которые меняют ее русло, науке необходимы люди, хранящие ее огонь и способные зажечь его в душах неофитов. Такие люди создают вокруг себя атмосферу интеллектуальной красоты и духовного подъема, в которой стремительно расцветают таланты и крепнут дарования. Учеными такого редкого типа были Арнольд Зоммерфельд в Германии, Поль Ланжевен во Франции, Леонид Исаакович Мандельштам в России.
Таким человеком был Пауль Эренфест. Он родился и вырос в Вене, учился в Венском университете у Людвига Больцмана и в Гёттингенском — у Феликса Клейна. Завершив образование, пять лет жил в России и в 1912 г., по предложению Лоренца сменил его на кафедре теоретической физики в Лейденском университете. Здесь в течение двадцати лет он каждый вторник открывал семинар, на котором рассказывали о своих работах все великие и знаменитые ученые, за четверть века перестроившие заново основы физики. На этом семинаре родилась и окрепла гипотеза о спйне электрона, и Эренфест был ее повивальной бабкой и крестным отцом. Он был инициатором и организатором знаменитой полемики между Бором и Эйнштейном. Он жил в центре «физических событий» того времени и много способствовал их успешному завершению.
|
|
П. Эренфест
|
Эренфест был человеком редких душевных качеств. Бор, Планк, Гейзенберг, Паули, Шрёдингер были его частыми гостями. Эйнштейн писал ему: «Мы созданы природой друг для друга. Я нуждаюсь в твоей дружбе еще больше, чем ты в моей». Но что-то надломилось в душе Эренфеста, и 25 сентября 1933 г. он покончил с собой.
Пауль Эренфест оставил после себя физические идеи, пережившие память его учеников и друзей. Он построил мост через пропасть, которая в сознании его современников отделяла квантовые явления от классических. Суть теоремы, им доказанной, состоит в следующем.
Мы многократно повторяли, что уравнения квантовой механики отличны от уравнений классической механики. Поэтому движения квантовых объектов ни описать, ни представить в классических понятиях и образах нельзя. Примерно так же, как нельзя отметить на глобусе все движения пассажира, пересекающего на пароходе Атлантику. Однако как бы волны ни качали корабль и чем бы ни занимался при этом пассажир, в среднем он все-таки перемещается в соответствии с заданным курсом.
Нечто похожее справедливо и в квантовом'мире. Пусть мы не можем представить себе квантовых движений. Пусть неясно, как понимать координату и импульс электрона. Но точно известно, что
средние значения квантовых величин подчиняются уравнениям классической механики. В этом суть
принципа соответствия, который в 1918 г. сформулировал Нильс Бор и в 1927 г. доказал Пауль Эренфест.
Несколько позднее физики поняли, что Эренфест доказал нечто большее, чем предельное соответствие квантовой и классической механик. В самом деле, всегда молчаливо принимали предположение (а многие и до сих пор отстаивают его вслух), что динамические законы классической механики — это первичные, настоящие законы, а статистические закономерности квантовой механики — это законы второго сорта, которыми мы вынуждены пользоваться по причине особой сложности атомных объектов. Из работ Эренфеста следует, что такое убеждение (или, лучше сказать, предубеждение) — не более чем предрассудок, ибо уравнения движения классической механики суть предельный случай более общих уравнений квантовой механики.
ГЛАВА 8
Сфинкс
«Может быть, естествоиспытателя, покидающего область непосредственных чувственных восприятий с целью открытия более общих взаимосвязей, можно сравнить с альпинистом, который хочет подняться на вершину самой высокой горы для того, чтобы обозреть лежащую перед ним местность во всем ее многообразии. Альпинисту тоже необходимо покинуть плодородные населенные долины. По мере того как он поднимается, перед ним все шире и шире раскрывается окрестность, но вместе с тем все реже он видит вокруг себя признаки жизни. Наконец, он попадает в ослепительно яркую область льда и снега, где уже нет никакой жизни и дышать становится почти невозможно. Только пройдя эту область, он может достигнуть вершины. Но когда он взойдет на вершину, наступит момент, что вся расстилающаяся перед ним местность станет ему видна совершенно отчетливо, и, может быть, тогда область жизни не будет слишком далека от него...»
Эти слова Гейзенберга хорошо поясняют тот качественный скачок, который произошел в сознании людей, когда они перешли от наблюдения явлений, непосредственно воздействующих на их органы чувств, к изучению квантовых объектов. Этот перелом произошел в начале века, и он настолько важен, что мы еще раз поясним его на конкретном примере.
Представьте, что перед вами звучит натянутая струна. Вы слышите звук, видите вибрирующую струну, можете прикоснуться к ней рукой, и на основании этих данных в сознании у вас формируется
образ физического
явления, происходящего перед вами.
Понятие «волновой процесс» возникает позднее, при наблюдении других, похожих явлений. Чтобы сделать это понятие однозначным, его закрепляют
формулой, уравнением, позволяющим заранее предсказать весь процесс колебания струны. Это предсказание мы можем проверить на
опыте, запечатлев, например, колебания струны на кинопленке...
Мы сознательно еще раз проследили цепочку
явление —образ понятие формула -*• опыт
которая лежит в основе первоначального физического знания. Последнее звено в этой цепи — опыт — проверяет, насколько правильно мы представляем себе явление в целом на основе частичных знаний о нем.
Но эта простая схема не поможет нам ответить на вопрос «Что такое атом?» просто потому, что явление «атом» не воздействует непосредственно на наши органы чувств, и они не могут дать нам никакого, даже приблизительного «образа атома». Поэтому вначале понятие «атом» возникло чисто умозрительно, без ссылок на органы чувств, и в течение двадцати веков оставалось не более чем любопытной гипотезой, которая ничем не лучше других гипотез о строении материи.
Настоящая история атома началась с приходом науки, когда люди научились полагаться не только на свои органы чувств, но также доверять показаниям приборов. С их помощью они наблюдали, что происходит при растворении веществ, при пропускании через раствор электрического тока, при нагревании, при освещении и при многих других воздействиях. Ученые не просто наблюдали эти явления, но
изучали их, то есть
измеряли температуру тел, длину волны излучаемого ими света, его интенсивность и многое другое, о чем мы уже знаем. Результаты этих измерений они записывали в виде
чисел. Вот эти-то числа и заменили физикам непосредственные ощущения, которые доставляли им ранее органы чувств. Числа — единственное, чему они стали доверять, начав изучать явления, недоступные непосредственному чувственному восприятию. Имея в руках эти числа, они стали находить между ними связи и записывать их в виде формул.
Но люди общаются с помощью слов, а не формул, и, чтобы рассказать о новых связях в природе, придумывают понятия, которые соответствуют этим формулам. Иногда эти понятия очень необычны, но люди к ним быстро привыкают, учатся правильно пользоваться ими и даже создают для себя какие-то образы, связывая их с новыми понятиями. Привычная схема познания переворачивается и приобретает вид
явление образ*-понятие*— формула *— опыт
I_________________________________,________________________________f
В истории атома эту цепочку можно легко проследить. Фраунгофер, Кирхгоф и Бунзен обнаружили, что каждый атом испускает строго определенный набор спектральных линий (явление) и каждой спектральной линии соответствует число — длина волны X (опыт). Бальмер, Ридберг и Ритц нашли между этими числами простые связи (формула), а Бор показал, что их формулы следуют из единого принципа, который назвали квантованием (понятие). Наконец, на основе этих опытов, формул и понятий возник образ — атом Бора.
Но опыты продолжались, они приносили новые числа и факты, которые уже не вмещались в рамки прежних формул, понятий и образов. И тогда возникла квантовая механика — единый принцип, из которого следовали все прежние эмпирические формулы и удачные догадки.
До сих пор мы довольно много узнали об опытах атомной физики и о понятиях, которые необходимо использовать, чтобы их объяснить. Но мы хотим большего: на этом новом, более высоком уровне знаний создать зрительный
образ атома. Для этого нам нужно несколько подробнее познакомиться с формулами квантовой механики. Это необходимо — в конце концов красота логических построений в науке много важнее, чем эффекты неожиданных ассоциаций, обусловленные ее простыми следствиями.
УРАВНЕНИЕ ШРЕДИНГЕРА
Все предыдущее должно было убедить нас в том, что электрон — не точка, он не занимает определенного положения в атоме и не может двигаться там по какой-либо траектории. Взамен этого мы пока что усвоили довольно туманную идею о том, что при движении в атоме электрон «расплывается». Эту расплывчатую идею Шрёдингеру удалось выразить весьма точно на однозначном языке формул. Уравнение Шрёдингера, как и всякий глубокий закон природы, нельзя вывести строго из более простых. Его можно только угадать. (Шрёдингер впоследствии признавался, что сам не вполне понимает, как ему это удалось.) Но после того как уравнение угадано, надо еще научиться им пользоваться: надо знать, что означают все символы в уравнении и какие явления в атоме они отображают.
Уравнение Шрёдингера мы однажды уже выписывали: -^+^[f-V(x)W = 0,
и объясняли входящие в него символы:
h — постоянная Планка А, деленная на 2л,
m — масса электрона,
Е — полная энергия электрона в атоме, a
V(x) — потенциальная энергия взаимодействия электрона и ядра, удаленных друг от друга на расстояние
х. Но нам по-прежнему не ясен смысл волновой функции ф. Чтобы понять его, обратимся снова к аналогии с колеблющейся струной.
Уравнение ее колебаний, хорошо известное в классической физике,
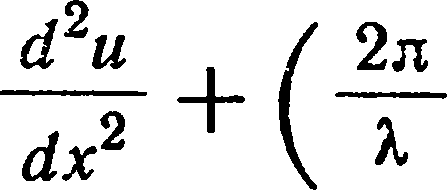
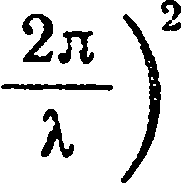
очень похоже на уравнение Шрёдингера. Несколько решений этого уравнения — функции
Uk(x) — изображены на рисунке. Это обычные, знакомые всем синусоиды, и смысл их очевиден: они изображают
форму струны в какой-то момент времени, то есть моментальную фотографию процесса ее колебания. Форма колебаний струны зависит от числа узлов
k, то есть числа точек, остающихся неподвижными в процессе колебания. Им соответствует бесконечный набор решений мл(х), которые различаются между собой числом узлов
k. Очень важно то, что никаких других, промежуточных, типов колебаний, кроме пронумерованных индексом
k, не существует.
По форме уравнение Шрёдингера лишь несущественно отличается от уравнения струны. Чтобы последнее утверждение не выглядело голословным, введем обозначение

|
|
^2т[Е- И(х)] ’
|
после чего уравнение Шрёдингера примет вид, неотличимый от уравнения колебаний струны:

Если потенциал взаимодействия V(x) = 0, то есть электрон движется свободно вдали от ядра, то энергия
Е равна его кинетической энергии,
E = mv2/2, и, следовательно, длина его волны постоянна: и равна длине волны де Бройля. В этом случае уравнение Шрёдингера в точности совпадает с уравнением струны. При движении в атоме электрон взаимодействует с протоном по закону Кулона, поэтому
V(х) = —-е
2/х, где
е — заряд
электрона и протона. Теперь уже «длина волны электрона»
__h_______
V2m[£-V(x)]
не имеет определенного значения и меняется от точки к точке. Однако и в теории колебаний струны такой случай — не новость: если вместо однородной струны колеблется неоднородная, то есть со всевозможными грузами и утолщениями на ней, то ее колебания будут описываться именно таким уравнением. Решения его лишь отдаленно напоминают правильные синусоиды, но они сохраняют главное свойство прежних решений: для них характерно наличие узлов, неподвижных в процессе колебаний, по числу которых эти решения можно пронумеровать.
Таким образом, формально уравнение Шрёдингера ничем не отличается от уравнения нагруженной струны, но смысл их решений, конечно, различен. Вся его сложность — в понятиях, которые мы связываем с величинами, удовлетворяющими этому уравнению.
Взгляните на рисунок, где рядом с синусоидами струны
Uk(x) изображены решения ф
л(х) уравнения Шрёдингера для атома водорода. Они очень похожи.
И если даже никаких реальных колебаний, подобных движениям струны, в атоме не происходит, то аналогия не становится от этого менее полезной.
Отмеченная аналогия позволяет пронумеровать решения ф
я(х) целым числом
п точно так же, как решения
Uk(x) нумеруются целым числом
k, причем никаких других решений, кроме этих,
собственных решений в уравнении Шрёдингера не содержится. Более того, целое число
п — это и есть то самое непонятное
квантовое число, которым Бор нумеровал орбиты электрона в атоме. Теперь оно потеряло свой мистический оттенок:
п — это не что иное, как число узлов волновой функции, увеличенное на единицу:
п = k + 1.
Первый постулат Бор
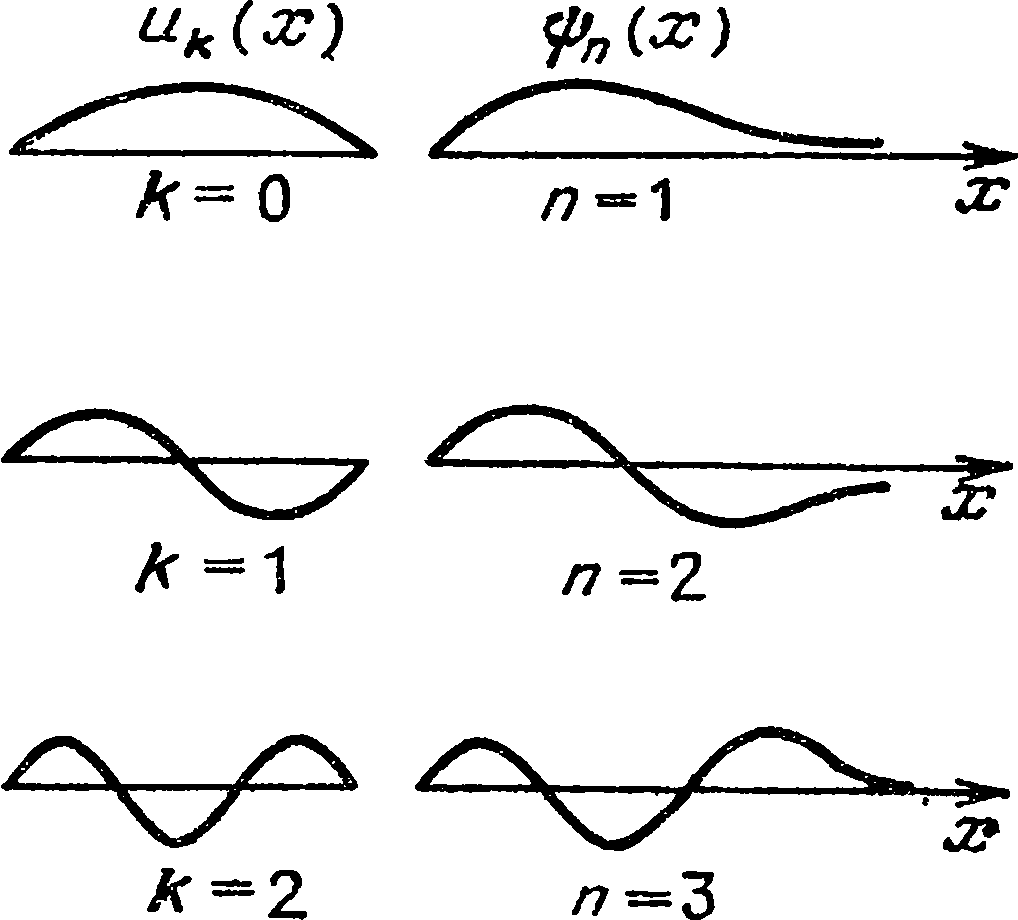
а неким «усилием воли» предписывал электронам двигаться только по тем орбитам в атоме, которые удовлетворяют квантовому условию:
mvr = nh. Это был плодотворный, но неестественный для физики принцип, и потому он вызвал у современников сложную смесь восхищения и
недовольства. Требование Шрёдингера значительно понятнее: как бы хитро ни двигался электрон в а‘томе, он должен все-таки находиться внутри атома. Поэтому ф-функция, которая это движение «представляет», независимо от своей природы должна быть сосредоточена вблизи ядра. Вот из этого единственного и естественного
граничного условия однозначно следует, что уравнение Шрёдингера имеет решение не всегда, а только при определенных значениях энергии
Еп, которым соответствуют собственные функции ф
л(х). Возможные значения энергии электрона в атоме водорода можно найти, решив уравнение Шрёдингера с потенциалом е
2
V(x)=--.
Эти
дискретные значения энергии
4 1
me 1
2Й2 п2
стационарных состояний нумеруются целым числом
п. Легко видеть, что эти значения в точности совпадают с энергией электрона на стационарных орбитах в атоме Бора, и поэтому надобность в постулатах Бора отпадает — при сохранении всех положительных результатов его модели.
В свое время эти следствия теории Шрёдингера покорили многих своей простотой и естественностью, в уравнение Шрёдингера поверили и стали выяснять последнее: что представляет собой сама функция ф
л(х). И если функция
Uk(x) изображает форму колеблющейся струны, то форму
чего изображает ф-функция?
СМЫСЛ -ФУНКЦИИ
Это один из самых сложных вопросов квантовой механики, на который даже сам Шрёдингер вначале ответил неправильно. Но его ответ так удобен и так близок к истине, что мы им на первых порах воспользуемся.
Электрон в атоме не существует как частица. Он расплывается там в некое облако. Форма и плотность этого облака определяются волновой функцией ф(х), причем на расстоянии
х от ядра плотность р(х) электронного облака равна квадрату этой функции:
p(x)=|i|)(x)|
2.
Чтобы пояснить эту мысль, попытаемся представить себе, например, арбуз и изобразить на рисунке его плотность р(х)
140
в зависимости от расстояния
х до центра арбуза. Очевидно, что функция р(х) для арбуза везде примерно постоянна, она лишь несколько падает к краям (кожура легче мякоти) и, наконец, резко обрывается на границе арбуза. Взглянув на рисунок, человек, даже ни разу не видавший арбуза, может схематически представить себе, как он устроен внутри. Правда, при этом он не будет иметь ни малейшего представления о его вкусе, цвете и аромате, а также о тысяче мелких признаков, которые отличают один арбуз от другого.
Пытаясь проникнуть внутрь атома, все мы оказываемся в положении человека, который никогда в жизни арбуза не видел, но хочет представить его себе по функции р(х). Для атома функцию р(х) можно вычислить из уравнения Шрёдингера и затем с ее помощью нарисовать распределение
электронного облака в атоме. Именно эти картины заменяют
тот зрительный образ атома, к которому все бессознательно
стремятся.
На следующей странице представлены объемные изображения атома водорода в различных состояниях возбуждения с квантовыми числами и, /, /и, построенные по функциям р(х), вычисленным из уравнения Шрёдингера. Это и есть тот новый образ атома, к которому мы так долго шли и к которому теперь надо привыкать. В дальнейшем этот образ изменится лишь немного — точнее не сам он, а наше отношение к нему.
Теперь все самое сложное позади, и мы можем, не торопясь, подвести итоги. Прежде всего — и на новом уровне знаний — мы вновь обратимся к вопросу: «Что такое атом?»
ОБРАЗ АТОМА
Вспомните модель Томсона: большой положительный шар, и в нем плавают маленькие отрицательные электроны. В действительности все оказалось строго наоборот: в центре
атома расположено очень маленькое положительное ядро, окруженное отрицательным облаком электронов. Форма этого облака не произвольна — она определяется законами квантовой механики. Конечно, это не шарик с резкими границами, но в целом невозбужденный атом водорода в состоянии Iso очень похож на шар (это Демокрит угадал правильно).

Однако форма возбужденных атомов уже отличается от сферической, и тем больше, чем сильнее возбужден атом. Возбуждая атом, мы затрачиваем энергию как раз на пере-
стройку его электронного облака. Каждой форме облака соответствует своя, вполне определенная энергия. Поэтому, чтобы перевести атом из одной формы в другую, мы должны затратить строго отмеренное количество энергии — квант ftv, как того и требует второй постулат Бора.
До сих пор мы говорили только об атоме водорода. По существу, это единственный атом, который физик знает сейчас во всех деталях и может представить себе его правдоподобный образ. Форма электронного облака в сложных атомах в целом также не очень сильно отличается от наших рисунков. Но рассчитать ее достаточно точно удалось лишь после работ советского физика Владимира Александровича Фока (1898—1974) и английского ученого Дугласа Хартри (1897—1958). Это очень сложная задача, которая под силу только современным вычислительным машинам.
Говоря о форме тел, мы, как правило, предполагаем, что у них есть также и размеры. Это не всегда верно: у бильярдного шара есть и форма и размеры, но о размерах облака говорить уже трудно, хотя форма его обычно не вызывает сомнений. Самое неожиданное следствие новой модели атома состоит в том, что
атом не имеет определенных геометрических размеров. Размеров в том смысле, какой мы вкладываем в это понятие, имея перед глазами, например, бильярдный шар. Конечно, поскольку атом имеет определенные очертания, можно выделить из него ту его часть, в которой плотность электронного облака максимальна, и назвать эту часть его размером. Такое определение правомерно, и мы его исполь-
142
зуем (мы постоянно говорим о размерах атома), но при этом следует помнить, что определить строго размеры облака нельзя — это всегда вопрос разумного соглашения.
Уже одно это следствие квантовой механики позволяет объяснить многие наблюдаемые свойства тел. Например, разнообразие геометрических форм кристаллов не должно нас теперь особенно удивлять: из одинаковых кирпичей построены самые разные дома, но нам не кажется странным, что кирпичи — это не дом в миниатюре, а просто кирпичи. У тел, окружающих нас, есть цвет, запах, есть размеры, но атомы, из которых построены эти тела, не обладают ни одним из этих качеств. Точно так же у них нет определенной формы. Неизменны лишь законы квантовой механики, которые управляют этой формой.
Но почему атом, у которого даже нет определенных размеров, так устойчив? Нас не должно удивлять и это: Земля ведь не стоит на трех китах, а наоборот, повиснув в пустоте, уже миллионы лет сохраняет свою орбиту неизменной. Секрет ее устойчивости — в движении и в неизменности динамических законов, которые этим движением управляют. В этом же причина устойчивости атомов, хотя законы, управляющие движением электронов, совсем не похожи на законы небесной механики.
Справедливости ради следует заметить, что квантовая устойчивость значительно надежнее, чем динамическая устойчивость классической механики: разрушенный атом восстанавливает свою структуру, но орбита Земли уже никогда не станет прежней, если однажды ее нарушит внезапное вмешательство инородного космического тела.
Атомы различных элементов разнятся между собой массой и зарядом ядра. Но по какому признаку различить два атома одного и того же элемента? Для арбузов такой вопрос неактуален: никто никогда не видел двух совершенно
одинаковых арбузов. Отличить один кирпич от другого уже много сложнее, и только в том случае, если кирпичи битые, задача немного упрощается.
С атомами дело обстоит точно так же. Если их массы и заряды ядер равны, то различить их можно только по форме электронного облака, которая зависит от степени возбуждения атомов. Все невозбужденные атомы одного и того же элемента неразличимы между собой, как кирпичи из одной формы. Роль такой формы для атомов играют динамические законы квантовой механики, для всех них одинаковые.
Портреты атома на рисунках отражают наш нынешний уровень знаний о нем. Это и есть тот современный образ
атома, который заменил собой модели Демокрита, Томсона и Бора. Конечно, и теперешние «портреты» не следует понимать слишком буквально: это отнюдь не «фотографии атомов», подобные фотографиям колеблющейся струны. Ни простыми, ни сложными приборами мы не можем прямо измерить распределение электронной плотности внутри атома, потому что это неизбежно разрушит его (даже арбуз, чтобы проверить его качества, необходимо предварительно разрезать).
И все же у нас есть много оснований, чтобы верить найденной картине: с ее помощью мы можем последовательно объяснить все опыты, которые привели нас к такому образу атома.
Теперь нас не должно удивлять, что а-частицы в опытах Резерфорда беспрепятственно пролетали сквозь миллиарды атомов, как через пустоту. Ведь пронизывая кометные хвосты, Земля тоже никогда не отклоняется от своей орбиты. Понятен должен быть нам и механизм появления спектральных линий: просто атом скачком изменяет форму распределения электронного облака, излучая при этом квант энергии. Мы должны теперь понимать и причину расщепления спектральных линий в электрическом (эффект Штарка) и в магнитном (эффект Зеемана) полях: электронное облако заряжено, и различные его формы под воздействием полей немного изменяются, расщепляясь на близкие «подформы», а вместе с ними изменяется и энергия кванта, которую необходимо затратить, чтобы перевести облако из одной формы в другую, и длина волны спектральной линии, которая этому кванту соответствует. Используя уравнения квантовой механики, эти простые качественные рассуждения можно подтвердить точными расчетами и убедиться, что они совпадают с экспериментальными фактами.
Можно и дальше на основе новой модели атома продолжать анализ многочисленных опытов атомной физики. Но сейчас нам важнее понять другое: а почему мы уверены, что найденный нами образ атома соответствует истине?
КВАНТОВАЯ ИСТИНА
Прежде всего, о какой истине пойдет речь? И что понимают под истиной в квантовой механике? Если бы речь шла об арбузе, все было бы просто. Например, мы бы сразу сказали, что знания одного только распределения плотности внутри арбуза нам недостаточно — это еще далеко не вся истина о нем. Лишь когда мы увидим, потрогаем, съедим, наконец,
144
арбуз, мы сможем сказать, что он собой на самом деле представляет. Но даже такое, по мнению большинства людей, полное знание для людей науки весьма предварительно. Ученые начнут рассматривать арбуз под микроскопом, и скажут, что он состоит из клеток. Немного позже они заявят, что клетки построены из молекул, а молекулы — из атомов... Круг замкнулся. Чтобы узнать до конца арбуз, мы снова должны ответить на вопрос: «Что такое атом?»
В действительности дело обстоит не так плохо: понятие «арбуз» сформировалось за много веков до появления всякой науки и не очень зависит от прошлых и будущих ее достижений, поскольку опирается только на наши ощущения. Это понятие может измениться лишь в том случае, если вдруг у всех людей одновременно появится еще одно — шестое чувство. Полагая это нереальным, мы с легким сердцем можем сказать, что знаем об арбузе всю истину, если подвергли его испытанию своих пяти чувств. (Вспомните, как вы сами покупаете арбузы: сначала выбираете издали один из них, потом берете его в руки, иногда подносите к уху, чтобы услышать легкий треск, и, наконец, надрезав его, пробуете на вкус.)
Можно ли с такой же меркой подходить к понятию «атом»? Ведь число опытов, на основе которых мы строим образ и понятие «атом», безгранично, и в принципе каждый из них добавляет к нашим знаниям нечто новое. Мы не можем остановиться на этом пути и сказать: «Хватит с нас опытов, мы уже построили для себя образ атома, и дальнейшие опыты могут его только испортить». Наоборот, мы радуемся каждому новому опыту и особенно тем из них, которые не укладываются в рамки нами же придуманных образов. Именно такие опыты помогли нам отказаться от атомов — твердых шариков и найти для них более совершенный образ. Почему же мы теперь уверены, что наш образ атома окончателен и полностью соответствует истине?
Надо признаться, что физики в этом вовсе не уверены. Зато они честно и с достоинством могут сказать: «За последние 100 лет не сделано ни одного опыта, который противоречил бы созданной нами картине. Поэтому лучше говорить не об ее истинности, а об ее плодотворно
сти — о том, насколько она помогает нам объяснять и предсказывать особенности атомных явлений».
И здесь выясняется поразительная вещь: нам не так уж необходимо знать, «как выглядит атом на самом деле». Нам достаточно изучить уравнения квантовой механики и прави-

ла обращения с ними. После этого мы можем предсказать все: как изменится цвет тела при нагревании, какие спектральные линии оно при этом испустит и как изменится их частота, если поместить тело в электрическое или магнитное поле. Мы можем предсказать форму кристаллов, их теплоемкость и электропроводность. Мы можем, наконец, построить атомную электростанцию и атомный ледокол — и они будут исправно работать. И все это — без малейших ссылок на истинную форму атома.
На этом основании многие (с легкой руки Гейзенберга) предлагают обходиться в квантовой механике вообще без наглядных образов. Целесообразность такой крайности можно оспаривать, но отрицать ее возможность безоговорочно нельзя. На вопрос: «Что такое атом?»— сторонники крайних мер отвечают лаконично: «Атом есть система дифференциальных уравнений». К сожалению, в этой шутке много правды. По сравнению с целым арбузом «атом арбуза» очень беден свойствами. Однако свойства эти противоречивы и слить их воедино без насилий над логикой и здравым смыслом можно только в уравнениях квантовой механики.
Квантовая механика — это математическая схема, позволяющая вычислять физически измеримые характеристики атомных явлений. Если бы задача физики заключалась только в этом, то построение механики атома можно было бы считать законченным. Однако физика призвана дать нам нечто большее — рациональную картину мира. Выполнить столь обширную программу с одними формулами и числами нельзя — для этого необходимо найти образы и сформулировать понятия, им соответствующие. Особенно важно это для всех нефизиков, которые не знают и не понимают формул квантовой механики. Для них язык образов и понятий — единственный способ проникнуть в глубь атома. Со времен Демокрита мы продвинулись на этом пути довольно далеко и сейчас нарисовали себе более или менее удовлетворительную картину атома. Однако до совершенства ей не хватает нескольких штрихов.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
Опыт Комптона
Представьте, что вы стоите перед зеркалом в зеленом свитере и вдруг замечаете, что ваше отражение в зеркале одето в красный свитер. Прежде всего вы, вероятно, протрете глаза,
146 а если это не поможет, пойдете к врачу. Потому что «так не бывает». В самом деле, зеленые лучи — это волны, длина которых Х = 550 нм. Встретив на пути препятствие — зеркало, они отражаются, но при этом никак не могут изменить свою длину и стать, например, красными (Х = 650 нм). А Комптон наблюдал именно это явление: направив на мишень пучок рентгеновских лучей с длиной волны X, он обнаружил, что длина волны V рассеянных лучей больше длины волны падающих, то есть рассеянные лучи действительно «краснее» первоначальных!
Чудо это можно понять, если вспомнить гипотезу Эйнштейна о квантах света, которую он предложил для объяснения явлений фотоэффекта. Следуя ему, вместо рентгеновских волн с длиной X и частотой v = c/X нужно представлять себе поток частиц-квантов с энергией
E — hv и импульсом
p = hv/c. Сталкиваясь с электронами атомов мишени, они выбивают их оттуда (затратив энергию Р), разгоняют до скорости
v (дополнительно затратив энергию /пу
2/2), а сами рассеиваются с меньшей энергией
E' = hv' и меньшей частотой. В силу закона сохранения энергии
. г , п , mv2
hv =е
hv' + Р + —2^ •
Если атом полностью поглотцт квант света (Е'=0), то мы увидим обычное явление фотоэффекта, а уравнение Комптона* превратится в уравнение Эйнштейна (мы его уже приводили) :
, _ , ти2
AV=P+—.
Оба эти опыта можно провести в камере Вильсона, проследить путь каждого выбитого электрона и тем самым наглядно представить процесс столкновения световых квантов с электронами.
Но в таком случае, что нам мешает увидеть себя в красном свитере? Оказывается, все те же квантовые законы, которые запрещают электрону поглощать произвольные порции энергии. Электрон на стационарной орбите в атоме может поглотить только такой квант, который либо перебросит его из одного стационарного состояния в другое (вспомните опыт Франка и Герца), либо выбросит его из атома (опыты Ленарда, Столетова, Милликена). Энергия «зеленых квантов» (2,5 эВ) слишком мала, чтобы вырвать электрон из атома (Р«10 эВ). Поэтому они упруго (без потери энергии)* отразятся от атомов зеркала и при этом нисколько не «покрас-
147
неют». Энергия рентгеновских волн (Х«1 А) примерно в 5—10 тысяч раз больше, и потому явления, которые с ними происходят,— иные. Например, они вовсе не отражаются от зеркала, а свободно через него проходят, срывая по пути электроны с его атомов.
Конечно, даже простой процесс отражения зеленого света от зеркала несколько сложнее, чем мы это сейчас представили. Но существует еще одна — главная — трудность: в нашей стройной картине, где вместо волн света сплошь одни только кванты света, нет места опытам Фридриха, Книппинга и Лауэ, которые открыли дифракцию рентгеновских лучей и тем самым доказали их волновую природу. Как примирить эти несовместимые представления: лучи — волны и лучи — кванты? Квантовая механика справилась и с этой задачей.
Дифракция электронов
Как и многие открытия в физике, дифракция электронов была обнаружена во многом «случайно», хотя, как любил повторять Пастер, «случай говорит только подготовленному уму». В 1922 г. по заказу американской фирмы «Белл-телефон» Клинтон Джозеф Дэвиссон (1881 —1958) и его сотрудник Кансмен изучали отражение электронных пучков от поверхности металлов и вдруг заметили какие-то аномалии. В 1925 г., после работ де Бройля, ученик Макса Борна Вальтер Эльзассер (р. 1904 г.) предположил, что эти аномалии объясняются электронными волнами. Дэвиссон прочел эту заметку, но не придал ей значения. В 1926 г. он приехал в Европу и показывал свои графики Максу Борну и Джеймсу Франку в Гёттингене, а также Дугласу Хартри в Оксфорде. Все они единодушно признали в них волны де Бройля, хотя и не убедили в этом Дэвиссона. Вскоре после его возвращения в Америку случилась авария на его установке: лопнула вакуумная трубка и нагретый в это время кристалл при соприкосновении с кислородом воздуха изменил свою структуру. Эта досадная авария обернулась неожиданной удачей: после этого спектры отраженных электронов стали отчетливо напоминать спектры рассеянных рентгеновских лучей, в волновой природе которых тогда уже не сомневались. Продолжая свои опыты, Дэвиссон совместно с Лестером Альбертом Джермером (1896—1971) к концу 1927 г. убедился в реальности волн материи, связанных с электронами.
Дж. П. Томсон подошел к проблеме с другой стороны. Он с самого начала относился к гипотезе де Бройля с большим сочувствием и вскоре после посещения Англии Дэвиссоном
начал обдумывать способы доказать ее на опыте. В Англии после работ Крукса и Дж. Дж. Томсона опыты с катодными лучами стали непременным и привычным элементом образования. Быть может, поэтому Дж. П. Томсон прежде всего задумался: а нельзя ли приспособить их для новых опытов? Почти сразу же отыскалась подходящая готовая установка в Абердине, с которой работал студент Эндрью Рейд. (Он вскоре погиб в автомобильной катастрофе в возрасте 22 лет.) Уже через два месяца они получили на этой установке прекрасные фотографии дифракции электронов, которые в точности напоминали дифракцию рентгеновских лучей. Это было естественно, поскольку в их опытах электроны ускорялись потенциалом V=150 В (обычное напряжение городской сети). Длина волны таких электронов 1 А = 10“
8см,
то есть сравнима с длиной волны рентгеновских лучей и размерами атомов.
30 апреля 1897 г. Джозеф Джон Томсон (1856—1940) сделал доклад в Королевском институте о своих исследованиях свойств катодных лучей. При желании этот день можно считать днем рождения электрона — первой элементарной частицы в физике. По иронии судьбы, почти ровно тридцать лет спустя, в мае 1927 г., его сын Джордж Паджет Томсон (1892—1975) доказал, что электрон — это волна.
И оба они правы, оба отмечены Нобелевской премией за свои открытия.
ГЛАВА 9
 Кентацр
Кентацр
В начале 20-х годов физики Макс Борн и Джеймс Франк
и математик Давид Гильберт организовали в Гёттингене «Семинар по материи», на котором задолго до работ Гейзенберга и Шрёдингера стали употреблять термин «квантовая механика». В нем принимали участие и признанные в то время ученые, и знаменитая впоследствии молодежь. Почти каждый семинар Гильберт начинал вопросом: «Итак, господа, подобно вам, я хотел бы, чтобы мне сказали точно — что такое атом?»
Сейчас мы знаем об атоме больше, чем все участники семинара тех лет, однако ответить Гильберту с полным знанием дела мы еще не готовы. Нам известно теперь довольно много фактов квантовой физики, но пока еще недостает понятий, чтобы эти факты правильно истолковать.
Благодаря Нильсу Бору даже сейчас, много лет спустя, при слове «атом» непроизвольно приходит на ум именно «планетарный атом», то есть маленькая планетная система из ядра и электронов. Только потом усилием воли мы заставляем себя вспомнить, что атому присущи также и волновые свойства. Сейчас, как и прежде, обе идеи — «электрон-волна» и «электрон-частица» существуют в нашем сознании независимо, и невольно мы пытаемся от одной из них избавиться. «Частица или волна?»— к этому вопросу в 20-х годах физики возвращались постоянно: стремление к определенности заложено в человеке очень глубоко.
К весне 1926 г. в атомной физике сложилось любопытное положение: порознь и независимо возникли сразу две квантовые механики, исходные посылки которых резко различались. Гейзенберг вслед за Бором был убежден, что электрон — частица, и свои матричные уравнения написал в этом убеждении. Шрёдингер смог вывести свое дифференциальное уравнение, лишь поверив вместе с де Бройлем в волновые свойства электрона.
Гейзенберг требовал, чтобы в уравнения входили только те величины, которые можно непосредственно измерить на опыте: частоты спектральных линий и их интенсивности. На этом основании он исключил из теории понятие «траектория электронов в атоме» как величину принципиально ненаблюдаемую. Шрёдингер тоже не использовал понятия траектории, однако записал свое уравнение для ф-функции, которая сама по себе измерена быть не может и физический смысл которой поначалу не был ясен никому, включая и самого Шрёдингера.
Опыт — последний судья во всех спорах — вначале решительно был на стороне матричной механики. В самом деле, из опытов Фарадея следовала неделимость электрического заряда, и дальнейшие опыты Крукса и Дж. Дж. Томсона определенно это доказали. Таким свойством может обладать только частица. Опыты Милликена и фотографии следов электрона в камере Вильсона устранили последние в этом сомнения. Но планетарный атом неустойчив, то есть представления об электроне-частице резко противоречили факту удивительной стабильности атома. Постулаты Бора были специально придуманы для того, чтобы обеспечить устойчивость атома при условии, что электрон — это частица. Де Бройль и Шрёдингер пошли другим путем и показали, что наиболее естественно устойчивость атома можно объяснить, допустив, что электрон — это волна, а не частица. Эту гипотезу вскоре подтвердили прямыми опытами Дэвиссон, Джермер и Дж. П. Томсон, обнаружив у электрона способность к интерференции и дифракции.
Опытам принято верить. Но как поверить сразу двум опытам, если они исключают друг друга? Возникшая ситуация имела примеры в истории физики и все же была настолько необычна, что вначале никто не подозревал о единстве двух механик, а потому все стремились доказать истинность одной из них и ложность другой. Между сторонниками обеих теорий шли ожесточенные споры: одни отстаивали право первородства матричной механики, другие — предпочитали математическую простоту волновой. Конец этим спорам положил Шрёдингер в начале 1926 г., доказав, что обе механики
математически эквивалентны. Для каждого физика это означало, что они эквивалентны также и физически, то есть — что перед нами одна и та же механика —
механика атома, но записанная в разных формах. Это означало также, что верны исходные предпосылки обеих механик: представления матричной механики'об электроне-частице и представления волновой механики об электроне-волне.
КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ
Чем больше ученые узнавали об атоме, тем менее категоричными становились вопросы, которые они задавали природе. Во времена Планка и Эйнштейна хотели знать: «Луч света — это волна или поток частиц-квантов?» После работ де Бройля по-прежнему пытались выяснить: «Электрон — что это: волна или частица?» Лишь постепенно и с большим трудом оформилась простая мысль: «А почему или? Почему эти свойства — волны и частицы — должны исключать друг друга?» По трезвом размышлении оказалось, что логических оснований для альтернативы «или — или» нет. А единственная причина, по которой от нее не отказывались,— все та же инерция мышления, благодаря которой мы всегда пытаемся осмыслить новые факты с помощью старых понятий.
Существует еще одна трудность — психологическая. В повседневной жизни мы привыкли, что предметы тем проще, чем они меньше. Например, из 33 матрешек, вложенных одна в другую, самая маленькая — самая простая, бильярдный шар значительно проще шара земного, а целое всегда состоит из более простых частей. Когда, сидя у моря, Демокрит делил яблоко, он мог представлять себе атом каким угодно, но вряд ли ему приходило в голову, что он устроен сложнее, чем все яблоко. Это и в самом деле не так. Но случается, что одни и те же свойства очевидны у малых предметов и совсем незаметны у предметов больших. Точно так же при дроблении вещества (которое мы по традиции мыслим себе построенным из частиц) у него не появляются новые, волновые свойства — они
проявляются — просто раньше мы их не замечали.
С явлениями подобного типа мы сталкиваемся значительно чаще, чем сознаем это. Бильярдный шар и шар земной — прежде всего шары и этим похожи. Однако немало людей пострадало за эту истину, прежде чем Земля для всех стала шаром. А форма бильярдного шара не вызывала сомнений даже у отцов инквизиции. Все дело в соотношении явления и наблюдателя. Земля — точно так же, как и каждый ее электрон,— обладает свойствами волны. Однако если попытаться описать ее движение с помощью уравнения Шрёдингера, то при массе Земли 5-10
27 г и скорости, с которой она движется вокруг Солнца, 3-10
6 см/с, придется приписать этой «частице» волну де Бройля длиной в 4«10“
61 см — число настолько малое, что даже неизвестно, как его понимать. Однако мы не можем только на этом основании утверждать, что Земля не обладает волновыми свойствами. Ведь с помощью циркуля и линейки нельзя измерить ее кривизну, но Земля-то все-таки круглая...

Все эти примеры приведены здесь для того, чтобы легче понять конечный итог размышлений о проблеме «волна — частица»: вопрос «волна
или частица?» неправильно поставлен: атомный объект —
«и волна,
и частица» одновременно. Более того,
все тела в природе обладают одновременно и волновыми, и корпускулярными свойствами, и свойства эти — лишь различные проявления единого
корпускулярно-волнового дуализма. К этой мысли пришли еще в 1924 г. Бор, Крамере и Слэтер. В совместной работе они с определенностью заявили, что «волно
вой характер распространения света, с одной стороны, и его поглощение и испускание квантами, с другой, являются теми экспериментальными фактами, которые следует положить в основу любой атомной теории и для которых не следует искать каких-либо объяснений».
Непривычное, но несомненное единство свойств «волна — частица» отражено в формулах Планка
(E = hv) и де Бройля
(k = h/mv). Энергия
Е и масса
т — характеристики частицы; частота v и длина волны X — признаки волнового процесса. А единственная причина, по которой мы не замечаем этого дуализма в повседневной жизни,— малость постоянной Планка. Даже если это случайное обстоятельство, с ним надо считаться.
Если бы мы жили в мире, где значение постоянной Планка сравнимо с его привычными масштабами, наши представления об этом мире резко отличались бы от нынешних. Предметы в нем не имели бы определенных границ, их нельзя было бы двигать произвольно, и нельзя было бы заранее планировать встречи друзей. К счастью, этот мир — гипотетический, поскольку постоянную Планка мы не мбжем менять по своему произволу — она всегда неизменна и очень мала. Но атомы тоже очень малы, поэтому для них этот необычный мир реально существует, и его непривычную логику нам предстоит теперь понять — точно так же, как Гулливеру пришлось постигать образ мыслей лилипутов.
СООТНОШЕНИЕ НЕОПРЕДЕЛЕННОСТЕЙ
Предположим, что мы настолько прониклись идеей неделимости свойств «волна — частица», что захотели записать свое достижение на языке формул. Эти формулы должны установить соотношение между числами, которые соответствуют понятиям «волна» и «частица». В классической механике эти понятия строго разделены и относятся к совершенно различным явлениям природы. В квантовой механике корпускулярно-волновой дуализм вынуждает нас использовать оба понятия одновременно и применять их к одному и тому же объекту. Этот необходимый шаг не дается даром — мы за него должны платить, и, как оказалось, платить дорого.
Вполне ясно это стало в 1927 г., когда Вернер Гейзенберг догадался, что понятия «волна» и «частица» применительно к квантовым объектам можно определить строго только порознь.
В физике слова «определить понятие» означают: «указать способ измерения величины, которая этому понятию соответствует». Гейзенберг утверждал: нельзя одновременно и при этом точно измерить координату
х и импульс
р квантового объекта. С учетом формулы де Бройля
x=Jl
= A
mv р
это означает: нельзя одновременно и в то же время точно определить положение
х атомного объекта и длину его волны X. Следовательно, понятия «волна» и «частица» при
одновременном их использовании в атомной физике имеют ограниченный смысл. Гейзенберг нашел численную меру такого ограничения. Он показал, что если мы знаем положение
х и импульс
р квантового объекта (например, электрона в атоме) с погрешностями Дх и Др, то мы не можем уточнять эти значения беспредельно, а лишь до тех пор, пока выполняется неравенство —
соотношение неопределенностей:
&x-&p^h/2.
Этот предел мал, но он существует, и это — принципиально.
Соотношение неопределенностей — строгий закон природы, который никак не связан с несовершенством наших приборов. Он утверждает: нельзя —
принципиально нельзя — определить одновременно и координату, и импульс частицы точнее, чем это допускает неравенство Дх«Др>Й/2. Точно так же, как нельзя превысить скорость света или достичь
абсолютного нуля температур. Нельзя — как нельзя поднять самого себя за волосы или вернуть вчерашний день.
И ссылки на всемогущество науки здесь неуместны: сила ее не в том, чтобы нарушать законы природы, а в том, что она способна их открыть, понять и использовать.
Нам кажется это немного странным: мы привыкли к всесилию науки и утверждение «нельзя» молчаливо исключили из ее лексикона. Замечательно, однако, что высший триумф любой науки достигается именно в моменты установления таких запретов. Когда сказали: «Невозможно построить вечный двигатель»,— возникла термодинамика. Как только догадались, что «нельзя превысить скорость света»,— родилась теория относительности. И лишь после того, как поняли, что различные свойства квантовых объектов нельзя измерить одновременно с произвольной точностью, окончательно сформировалась квантовая механика.
Причину инстинктивного сопротивления, которое мы испытываем при первом знакомстве с соотношением неопределенностей, объяснил Гейзенберг. Для этого ему пришлось отбросить еще одну идеализацию классической физики — понятие наблюдения: оказалось, что в квантовой механике его нужно пересмотреть — точно так же, как и понятие движения.
Подавляющую часть своих знаний о мире человек приобретает с помощью зрения. Эта особенность восприятия человека определила всю его систему познания: почти у каждого слово «наблюдение» вызывает в сознании образ внимательно глядящего человека. Когда вы смотрите на собеседника, то абсолютно уверены, что от вашего взгляда ни один волос не упадет с его головы, даже если вы смотрите пристально и у вас «тяжелый взгляд». В сущности, именно на этой уверенности основано понятие наблюдения в классической механике. Она выросла из астрономии и, поскольку никто не сомневался, что, наблюдая звезду, мы никак на нее не воздев етвуем, то в этом не усомнились и в случае других наблюдений.
Понятия «явление», «измерение» и «наблюдение» тесно связаны между собой, но не совпадают. Древние наблюдали явления — в этом состоял их метод изучения природы. Из своих пристальных наблюдений они затем извлекали следствия с помощью чистого умозрения. По-видимому, с тех пор укоренилась уверенность, что явление существует независимо от наблюдения.
Мы много раз подчеркивали главное отличие нынешней физики от античной: она заменила умозрение опытом. Тепе-
1А5
решняя физика не отрицает, что явления в природе существуют независимо от наблюдения (так же, как и от нашего сознания). Но она утверждает: объектом наблюдения эти явления становятся лишь тогда, когда мы укажем точный способ измерения их свойств.
В физике понятия «наблюдение» и «измерение» неразделимы.
Всякое измерение есть взаимодействие прибора и объекта, который мы изучаем. А всякое взаимодействие нарушает первоначальное состояние и прибора, и объекта — так что в результате измерения мы получаем о явлении сведения, которые искажены вмешательством прибора. Классическая физика предполагала, что все подобные искажения можно учесть и по результатам измерения восстановить «истинное» состояние объекта, независимое от измерений. Гейзенберг показал, что такое предположение есть заблуждение:
в атомной физике «явление» и «наблюдение» неотделимы друг от друга. По существу, «наблюдение» — тоже явление, и далеко не самое простое.
Как и многое в квантовой механике, такое утверждение непривычно и вызывает бессознательный протест.
И все же попытаемся его понять или хотя бы почувствовать.
Ежедневный опыт убеждает нас: чем меньше объект, который мы исследуем, тем легче нарушить его состояние. Ничего меньше квантовых объектов — атома, электрона, ядра — мы в природе не знаем. Определить их свойства усилием воли мы не можем. В конце концов, мы вынуждены измерять свойства этих объектов с помощью их самих. В таких условиях прибор неотличим от объекта.
Но почему нельзя добиться, чтобы в процессе измерения один атомный объект лишь незначительно влиял на другой?
Дело в том, что оба они — и прибор, и объект — находятся в одном и том же квантовом мире и поэтому их взаимодействие подчиняется квантовым законам. А главная особенность квантовых явлений — их дискретность. В квантовом мире ничего не бывает чуть-чуть — взаимодействия там происхо

дят только квантом: или — все, или — ничего. Мы не можем как угодно слабо воздействовать на квантовую систему — до определенного момента она этого воздействия вообще не почувствует. Но коль скоро воздействие выросло настолько, что система готова его воспринять,—
она скачком переходит в новое (тоже квантовое) состояние или же просто гибнет.
Процесс наблюдения в квантовой механике напоминает скорее вкус, чем зрение. «Для того чтобы узнать свойства пудинга, его необходимо съесть»,— любили повторять создатели квантовой механики.
И подобно тому как, съев однажды пудинг, мы не в состоянии еще раз проверить свое впечатление о его достоинствах, мы не можем беспредельно уточнять наши сведения о квантовой системе: ее разрушит, как правило, уже первое измерение. Гейзенберг не только понял впервые этот суровый факт, но и сумел записать его на строгом языке формул.
Соотношение неопределенностей — одна из самых важных формул квантовой механики, в ней как бы сконцентрированы ее самые существенные особенности. После его открытия пришлось пересмотреть не только основы физики, но и теорию познания. Этот последний шаг оказался под силу лишь Нильсу Бору, который счастливо сочетал в себе могучий интеллект настоящего ученого и философский склад ума истинного мыслителя. В свое время он создал систему образов квантовой механики, теперь, четырнадцать лет спустя, он тщательно оттачивал систему ее понятий. После Бора стало ясно, что и соотношение неопределенностей, и корпускулярно-волновой дуализм — лишь частные проявления более общего принципа —
принципа дополнительности.
ПРИНЦИП . ДОПОЛНИТЕЛЬНОСТИ
Принцип, который Бор назвал дополнительностью,— одна из самых глубоких философских и естественнонаучных идей нашего времени, с которой можно сравнить лишь такие идеи, как принцип относительности или представления о физическом поле. Его общность не позволяет свести его к какому-либо одному утверждению — им надо овладевать постепенно, на конкретных примерах. Проще всего (так поступил в свое время и Бор) начать с анализа процесса измерения импульса
р и координаты
х атомного объекта.
Нильс Бор обратил внимание на очень простой и понятный факт: координату и импульс атомной частицы нельзя измерить не только одновременно, но и с помощью одного и того же прибора. В самом деле, чтобы измерить импульс
р атомной частицы и при этом не очень сильно его изменить, необходим очень легкий подвижный «прибор». Но именно эта подвиж-
157 ность приводит к тому, что его положение весьма неопределенно.
Когда мы говорим в микрофон, то звуковые волны нашего голоса преобразуются там в колебания мембраны. Чем легче и подвижнее мембрана, тем точнее она следует за колебаниями воздуха. Но тем труднее определить ее положение в каждый момент времени. Для измерения координаты
х мы должны поэтому взять другой, очень массивный прибор, который не шелохнется при попадании в него частицы. Но как бы ни изменялся в этом случае ее импульс, мы этого даже не заметим. Это — простейшая экспериментальная иллюстрация к соотношению неопределенностей Гейзенберга: нельзя в одном и том же опыте определить обе характеристики атомного объекта — координату
х и импульс р. Для этого необходимы два измерения и два принципиально разных прибора, свойства которых дополнительны друг другу.
Дополнительность — вот то слово и тот поворот мысли, которые стали доступны всем благодаря Бору. До него все были согласны, что несовместимость двух типов приборов непременно влечет за собой противоречивость свойств, измеряемых с их помощью. Бор отрицал такую прямолинейность суждений и разъяснял: да, свойства эти действительно несовместимы, но для полного описания квантового объекта оба они равно необходимы и поэтому не противоречат, а дополняют друг друга.
В действительности с такой ситуацией мы встречаемся повсеместно. Всем нам памятно детство, когда в солнечный день мы с помощью линзы поджигали бумагу и сухие былинки. Это — одна характеристика солнечного луча: он несет энергию в виде фотонов. Но если тот же солнечный луч пропустить не через линзу, а через призму, то мы увидим спектр. Это — другая, дополнительная характеристика того же луча: он состоит из волн различной длины. Линза и призма — различные приборы, которые позволяют нам наблюдать различные физические явления, характеризующие разные дополнительные свойства единого квантового объекта. Эти свойства нельзя наблюдать одновременно, в одном и том же опыте, с одним и тем же прибором, но они равно необходимы, чтобы представить себе сущность солнечного луча во всей его полноте.
Приведенное рассуждение о дополнительности двух несовместимых измерений можно пояснить простой аналогией. Представьте, что вы хотите узнать содержимое «черного ящика», который устроен специальным образом, а именно — наподобие хорошо известной камеры-обскуры. Эта камера,
в отличие от обычной, имеет два отверстия и соответственно две фотопластинки на противостоящих им стенках ящика. Пока оба отверстия закрыты, мы ничего не знаем о предмете в ящике, он для нас попросту не существует. Открывая их поочередно, мы получим на фотопластинках две проекции изучаемого предмета. Каждая из них, взятая в отдельности, недостаточна, однако обе они равно необходимы для воссоздания объемной картины изучаемого объекта.
Две различные проекции предмета соответствуют двум разным, дополнительным типам измерений в квантовой механике. Очевидно, осуществить оба измерения одновременно мы не можем, поскольку при одновременном открывании отверстий в нашей камере-обскуре, кроме тени от предмета, создаваемой нужным отверстием, на каждую из фотопластинок попадет свет от другого, «дополнительного» отверстия и оба изображения будут испорчены. Ясно также, что если изучаемый объект очень мал, то уже при первом измерении-наблюдении мы нарушим его первоначальное состояние, например сдвинем его или повернем. А это означает, что при открывании второго отверстия мы получим на другой фотопластинке не истинную, а искаженную проекцию предмета. В этих условиях объемную картину можно восстановить лишь приблизительно, но это все-таки лучше, чем хотя и точное, но плоское изображение. Квантовая механика утверждает, что для воссоздания «объемной картины» атомного объекта достаточно двух его «плоских проекций», то есть двух дополнительных измерений, например измерений координаты и импульса.
В переводе на язык абстрактных понятий предыдущие аналогии можно обобщить следующим образом. Квантовый объект — это «вещь в себе», пока мы не указали способа его наблюдения. Различные свойства объекта требуют разных способов наблюдения, иногда несовместимых между собой. В действительности понятия «объект» и «наблюдение» — лишь удобные абстракции, необходимые для описания более общего .понятия «экспериментальная ситуация». Физическая наука изучает не объекты сами по себе, а конкретные реализации экспериментальной ситуации, которые мы называем «явлениями». С точки зрения опыта любое явление — это упорядоченный набор чисел, которые суть результаты измерений реакции объекта на воздействие прибора избранного типа. Выбирая разные, дополнительные приборы, мы меняем экспериментальную ситуацию; реализуя ее, воздействуем на разные характеристики объекта; наконец, наблюдая следствия этого воздействия, мы получаем различные наборы чисел, то
159 есть изучаем разные явления. И хотя дополнительные явления невозможно изучить одновременно, в одном опыте, тем не менее они характеризуют единый квантовый объект и равно необходимы для полной его характеристики.
Всегда было важно, какие вопросы мы задаем природе. Задавая вопросы природе квантовой, мы должны быть особенно внимательны, ибо от их выбора зависит способ расчленения единой природы на две части: объект + наблюдатель. Принцип дополнительности утверждает, что существует по крайней мере два качественно различных способа такого расчленения. В знакомой нам цепочке познания новейшей физики:
явление —образ понятие формула ->■ опыт
принцип дополнительности сказывается прежде всего на системе понятий квантовой механики и на логике ее умозаключений. Дело в том, что среди основных положений формальной логики существует «правило исключенного третьего», которое гласит: из двух противоположных высказываний одно истинно, другое — ложно, а третьего быть не может. В классической физике не было случая усомниться в этом правиле, поскольку там понятия «волна» и «частица» действительно противоположны и несовместимы по существу. Оказалось, однако, что в квантовой физике оба они одинаково хорошо применимы для описания свойств одних и тех же объектов, причем для полного описания необходимо использовать их одновременно. Люди, воспитанные на традициях классической физики, восприняли эти требования как некое насилие над здравым смыслом и поговаривали даже о нарушении законов логики в атомной физике. Бор объяснил, что дело здесь вовсе не в законах логики, а в той беспечности, с которой без всяких оговорок используют классические понятия для объяснения квантовых явлений. А такие оговорки необходимы, и соотношение неопределенностей Гейзенберга
Ах-Ар /г/2
— запись этого требования на языке формул.
Причина несовместимости дополнительных понятий в нашем сознании глубока, но объяснима. Дело в том, что познать атомный объект непосредственно, с помощью наших пяти чувств, мы не можем. Вместо них мы используем довольно сложные приборы, которые изобретены сравнительно недавно. Для объяснения результатов опытов нам нужны слова и понятия, а они появились задолго до квантовой механики
160
и никоим образом к ней не приспособлены. Однако мы вынуждены ими пользоваться — у нас нет другого выхода: язык и все основные понятия мы усваиваем значительно раньше, чем узнаем о существовании физики.
Принцип дополнительности Бора — удавшаяся попытка примирить ограниченность устоявшейся системы понятий
с прогрессом наших знаний о мире. Этот принцип расширил возможности нашего мышления, объяснив, что в квантовой физике меняются не только понятия, но и сама постановка вопросов о сущности физических явлений. (Паули одно время даже предлагал назвать квантовую механику «теорией дополнительности» — по аналогии с теорией относительности.) Но значение принципа дополнительности выходит далеко за пределы квантовой механики, где он возник первоначально. Лишь позже — при попытках распространить его на другие области науки — выяснилось его истинное значение для всей системы человеческих знаний. Можно спорить о правомерности такого расширения, но нельзя отрицать его плодотворности во многих случаях, даже далеких от физики.
Сам Бор любил приводить пример из биологии, связанный с жизнью клетки, роль которой вполне подобна значению атома в физике. Если атом — последняя частица вещества, еще сохраняющая его свойства, то клетка — это самая малая часть любого организма, которая все еще представляет жизнь в ее сложности и неповторимости. С точки зрения науки изучить жизнь клетки — значит узнать все элементарные процессы, в ней происходящие, и при этом понять, как их взаимодействие приводит к совершенно особому состоянию материи — к жизни.
При попытке выполнить эту программу оказывается, что одновременное сочетание такого анализа и синтеза неосуществимо. В самом деле, чтобы проникнуть в детали механизма жизнедеятельности клетки, мы рассматриваем ее в микроскоп — сначала обычный, затем электронный,— нагреваем клетку, пропускаем через нее электрический ток, облучаем, разлагаем на составные части... Но чем пристальнее мы станем изучать жизнь клетки, тем сильнее будем вмешиваться в ее функции и в ход естественных процессов, в ней протекающих. В конце концов мы ее разрушим и поэтому ничего не узнаем о ней как о целостном живом организме. Тем не менее ответ на вопрос «Что такое жизнь?» требует и анализа, и синтеза одновременно. Процессы эти несовместимы, но не противоречивы, а дополнительны, и необходимость учитывать их одновременно — лишь одна из причин, по которой до сих пор не существует ответа на вопрос о сущности жизни.
Как и в живом организме, в атоме важна целостность его свойств «волна — частица». Конечная делимость
материи породила не только конечную делимость атомных
явлений — она привела также к пределу делимости
понятий, с помощью которых мы эти явления описываем.
Часто говорят, что правильно поставленный вопрос — уже половина ответа, и это не просто эффектный афоризм. Правильно поставленный вопрос — это вопрос о тех свойствах явления, которые у него действительно есть. Поэтому он уже содержит в себе все понятия, которые необходимо использовать в ответе. На идеально поставленный вопрос можно ответить коротко: «да» или «нет». Бор показал, что вопрос «волна или частица?» в применении к атомному объекту неправильно поставлен. Таких раздельных свойств у атома нет, и потому он не имеет однозначного ответа «да»
или «нет». Точно так же, как нет ответа у вопроса «Что больше: метр или килограмм?» и у других подобных вопросов.
Квантовый объект — это не частица, и не волна, и даже ни то, ни другое одновременно. Квантовый объект — это
нечто третье, не равное простой сумме свойств волны и частицы,— точно так же, как мелодия — больше, чем сумма составляющих ее звуков, а кентавр — не простая сумма коня и человека, а нечто качественно новое. Это квантовое «нечто» не дано нам в ощущении, и тем не менее оно, безусловно, реально. У нас нет образов и органов чувств, чтобы вполне представить себе свойства этой реальности. Однако сила нашего интеллекта, опираясь на опыт, позволяет все-таки ее познать. Два дополнительных свойства квантовой реальности нельзя разделить, не разрушив при этом полноту и единство явления природы, которое мы называем, например, атомом, точно так же, как невозможно разрезать на две части кентавра, сохранив при этом в живых и коня, и человека.
Когда Гейзенберг отбросил идеализацию классической физики — понятие «состояние физической системы, независимое от наблюдения», он тем самым предвосхитил одно из следствий принципа дополнительности, поскольку «состояние» и «наблюдение» — дополнительные понятия. Взятые по отдельности, они неполны и поэтому могут быть определены только совместно, друг через друга. Говоря строго, они вообще не существуют порознь: мы всегда наблюдаем не вообще нечто, а непременно какое-то состояние. И наоборот: всякое состояние — это вещь в себе до тех пор, пока мы не найдем способ его наблюдения.
Сами по себе понятия «волна» и «частица», «состояние» и «наблюдение системы» суть некие идеализации, равно
162
необходимые для понимания квантового мира. Классические картины дополнительны в том смысле, что для полного описания сущности квантовых явлений необходимо их гармоническое сочетание. Однако в рамках привычной логики они могут сосуществовать без противоречий лишь в том случае, если области их применимости взаимно ограничены.
Много размышляя над этими и другими похожими проблемами, Бор пришел к выводу, что это не исключение, а общее правило:
всякое истинно глубокое явление природы не может быть определено однозначно с помощью слов нашего языка и требует для своего определения по крайней мере двух взаимоисключающих дополнительных понятий. Это означает, что при условии сохранения нашего языка и привычной логики мышление в форме дополнительности ставит пределы точной формулировке понятий, соответствующих истинно глубоким явлениям природы. Такие определения либо однозначны, но не полны, либо полны, но тогда неоднозначны, поскольку включают в себя дополнительные понятия, несовместимые в рамках обычной логики. К таким понятиям относятся понятия «жизнь», «квантовый объект», «физическая система» и даже само понятие «познание природы».
С давних пор известно, что наука — это лишь один из способов изучить окружающий мир. Другой, дополнительный способ воплощен в искусстве. Само совместное существование искусства и науки — одна из иллюстраций принципа дополнительности. Можно полностью уйти в науку или всецело жить искусством — оба эти подхода к жизни одинаково правомерны, хотя, взятые по отдельности, и не полны. Стержень науки — логика и опыт. Основа искусства — интуиция и прозрение. Но искусство балета требует математической точности, а «вдохновение в геометрии столь же необходимо, как и в поэзии». Они не противоречат, а дополняют друг друга: истинная наука сродни искусству — точно так же, как настоящее искусство всегда включает в себя элементы науки. В высших своих проявлениях они неразличимы и неразделимы, как свойства «волна — частица» в атоме. Они отражают разные, дополнительные стороны человеческого опыта и лишь взятые вместе дают нам полное представление о мире. Неизвестно только, к сожалению, «соотношение неопределенностей» для сопряженной пары понятий «наука — искусство», а потому и степень ущерба, который мы терпим при одностороннем восприятии жизни.
Конечно, приведенная аналогия, как и любая аналогия, и неполна и нестрога. Она лишь помогает почувствовать единство и противоречивость всей системы человеческих знаний.
Дуализм и неопределенность
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
В пору становления квантовой механики даже хорошие физики с горечью шутили, что теперь им приходится по понедельникам, средам и пятницам представлять электрон частицей, а в остальные дни — волной. Нильс Бор с присущим ему юмором в 1924 г. говорил: «Даже если Эйнштейн пришлет мне телеграмму с сообщением об окончательном доказательстве реальности световых квантов, то и тогда она дойдет до меня только благодаря существованию радиоволн».
«Это в высшей степени парадоксально и способно привести в замешательство,— писал Дэвиссон в своей знаменитой статье 1928 г. с характерным названием «Существуют ли электронные волны?» — Мы должны поверить не только в то, что в определенном смысле кролики суть кошки, но также в то, что в неком смысле кошки суть кролики».
Такой способ мышления приводил к множеству парадоксов, от которых мы будем избавлены, если сразу же заставим себя не разделять в электроне свойства «волна — частица». Только после этого соотношение неопределенностей Гейзенберга перестанет быть чем-то странным и превратится в простое следствие корпускулярно-волнового дуализма.
В волновой оптике давно знали, что ни в какой микроскоп нельзя разглядеть частицу, если ее размеры меньше чем половина длины волны света, которым она освещена. В этом не видели ничего странного: волны света существуют сами по себе, частица — сама по себе. Но когда выяснилось, что частице тоже можно приписать длину волны, тогда это утверждение волновой оптики превратилось в соотношение неопределенностей: не может частица сама себя локализовать точнее, чем на половине длины своей волны.
Поэты и принцип дополнительности
Сам по себе принцип дополнительности, взятый вне физики,— изобретение древнее. По существу, он — довольно известная категория диалектической логики и в разных видах неоднократно высказывался различными философами во все времена. Аристотель говорил, например, что «гармония — это смешение и сочетание противоположностей», а за тысячу лет до него в Древнем Китае возникла философия Тао, целиком основанная на принципе дополнительности (ее символ «инь-янь» помещен вверху предыдущей страницы). Любопытно вспомнить, как принцип дополнительности переоткрыли для себя поэты. В 1901 г. Валерий Брюсов написал статью под названием «Истины», в которой мы читаем следующее: «Для мышления нужна множественность,— независимо от того, будет ли она дроблением
я или предстанет как что-то внешнее. Мысль, и общее — жизнь, возникает из сопоставления по меньшей мере двух начал. Единое начало есть небытие, единство истины есть безмыслие. Не было бы пространства, не будь правого и левого; не было бы нравственности, не будь добра и зла...»
«В истине ценно лишь то, в чем можно сомневаться. «Солнце есть» — в этом нельзя сомневаться... Это истина, но в ней нет самостоятельной ценности. Она никому не нужна. За нее никто не пойдет на костер. Даже, говоря яснее, это не истина, а
определение. «Солнце есть» — только особое выражение вместо: такой-то предмет я называю солнцем».
«Истина получает ценность, лишь когда становится частью возможного миросозерцания. Но в то же время она становится оспоримой, по крайней мере является возможным спорить о ней... Мало того, ценная истина непременно имеет прямо противоположную, соответствующую ей истину; иначе сказать — суждение, прямо противоположное истине, в свою очередь истинно...»
Уместно вспомнить здесь и Паскаля, который в свое время писал: «Все принципы пирронистов, стоиков, атеистов и т. д. истинны, но их заключения ложны, потому что и противоположные принципы тоже истинны».
Знаменательно, что многие из этих утверждений почти дословно предвосхищают формулировки Бора. Не все знают, что и Бор пришел к своему принципу дополнительности не «от физики», а «от философии». Идея дополнительности созрела в нем еще в юношеские годы под влиянием философии Кьеркегора. В дальнейшем она крепла и уточнялась, пока не нашла, наконец, достойного применения в квантовой физике.
ГЛАВА 10
Куй
Представьте себе, что где-то в поезде между Новосибирском и Красноярском вы познакомились с хорошим человеком. Теперь вообразите, что год спустя случайно встречаете его в Москве у кинотеатра «Россия». Как бы вы ни были рады встрече — прежде всего она вызовет у вас удивление: вы ведь знаете, насколько такое событие
маловероятно.
Мы постоянно употребляем слова «вероятно», «вероятнее всего», «по всей вероятности», «невероятно», не отдавая себе отчета, насколько строго определены понятия, им соответствующие. В науке такое положение недопустимо, поэтому там понятие «вероятность» имеет смысл лишь в том случае, если мы можем ее
вычислить.
Это не всегда просто. Например, предсказать вероятность возможной встречи с вашим случайным знакомым в гавани Сингапура довольно трудно: слишком сложны законы, управляющие действиями людей. Поэтому во всех учебниках с завидным постоянством объясняют законы случая на примере бросания монеты.
ИГРА В «ОРЕЛ — РЕШКУ» И СТРЕЛЬБА В ТИРЕ
Любое
событие, вероятность которого можно вычислить, является одним из
исходов некоторой серии
испытаний.
Условимся: если какое-либо испытание имеет несколько исходов, то полная вероятность произойти хоть какому-то событию равна
единице. Это условие ниоткуда не следует, но оно общепринято, и мы тоже не станем изменять традиции. Поэтому слова «событие произойдет с вероятностью единица» означают, что оно произойдет наверняка.
Отсюда ясно также, что вероятность какого-то одного исхода всегда меньше единицы. В примере с монетой каждое испытание — бросание монеты — имеет только два исхода:
она может упасть либо гербом вверх, либо гербом вниз. (Мы исключаем неправдоподобно редкие случаи, когда монета при падении останется стоять на ребре.) Если монета сделана без хитростей, то оба исхода бросания
равновероятны. Отсюда просто заключить, что вероятность монете упасть гербом вверх равна 1/2. Столь же легко вычислить вероятность появления, скажем, 3 очков при бросании игральной кости: очевидно, она равна 1/6.
Число аналогичных примеров каждый легко умножит сам, но все они во многом похожи.
Во-первых, каждое последующее испытание (бросание кости или монеты) не зависит от предыдущего.
Во-вторых, результат каждого испытания есть
случайное событие, то есть мы не знаем (или не можем учесть) всех причин, которые приводят к тому или иному исходу события.
Последнее особенно важно. В самом деле, монета — не атом и ее движение подчиняется хорошо известным законам классической механики. Используя их, мы можем заранее предвидеть все детали движения монеты и предсказать, как она упадет: гербом вверх или вниз. Мы можем даже нарисовать ее траекторию движения. Конечно, это очень трудно: нужно принять во внимание сопротивление воздуха, форму монеты, упругость пола, на который она упадет, и еще много других важных мелочей. И — самое главное — для этого необходимо точно задать
начальное положение и
скорость монеты.
Однако учесть все мыслимые причины, влияющие на исход испытания, не всегда возможно. Например, в случае с монетой мы никогда не знаем достаточно точно ее начального положения и скорости. А всякое, даже очень небольшое, их нарушение может изменить результат бросания на противоположный. И тогда уже нельзя быть уверенным, что при
этом бросании монета упадет гербом вверх. Можно только сказать: при
любом бросании вероятность появления герба равна 1/2.
Простые примеры, которые мы привели, не объясняют пока, почему так важно понятие вероятности в квантовой механике. Но прежде чем это станет ясным, познакомимся хотя бы бегло с основными законами теории вероятностей. Законы случая (несмотря на странное сочетание этих слов) такие же строгие, как и все другие законы математики. Однако они имеют некоторые непривычные особенности и вполне определенную область применимости. Например, легко можно проверить, что при большом числе бросаний герб выпа-
/67 дет примерно в половине случаев и закон этот выполняется тем точнее, чем больше испытаний мы проведем. Тем не менее это знание не поможет нам предсказать исход каждого отдельного бросания монеты. В этом и состоит главная особенность законов случая: понятие вероятности применимо к
отдельному событию и мы можем
вычислить заранее число, которое этому понятию соответствует. Однако
измерить его можно только при
многократном повторении
однотипных испытаний.
Очень важно, чтобы испытания были действительно однотипными, то есть полностью неразличимыми, поскольку только тогда измеренное число-вероятность можно использовать для характеристики каждого отдельного случайного события, которое является одним из возможных исходов испытания.
Непривычные особенности законов случая имеют естественное объяснение. В самом деле, бросание монеты — очень непростой процесс. Мы не хотим или не умеем изучать его во всей сложности и стремимся узнать только конечный результат испытания. Такое пренебрежение к деталям процесса не проходит даром — теперь достоверно мы можем предсказать только усредненный результат многочисленных однотипных испытаний, а для каждого отдельного случайного события мы в состоянии указать лишь вероятный его исход.
Широко бытует заблуждение, что вероятностное описание движения менее полно, чем строго причинное, классическое, с его понятием траектории. С точки зрения классической механики это действительно так. Однако, если мы откажемся от части ее жестких требований (например, от знания начальных координат и импульсов частиц), тогда классическое описание становится сразу же бесполезным. На смену ему приходит вероятностное описание, и в новых условиях оно будет столь же исчерпывающим, поскольку сообщает нам все сведения о системе, которые можно узнать о ней с помощью опыта.
При игре в «орел — решку» мы намеренно не хотим знать начальные положение и скорость монеты и целиком полагаемся на волю случая. Наоборот, приходя в тир, мы всегда стремимся попасть в центр мишени. Но, несмотря на это — достаточно сильное — желание, мы никогда заранее не знаем, в какое место мишени попадет каждая из пуль. После стрельбы отверстия в мишени группируются в довольно правильный овал, который принято называть «эллипсом рассеяния». Его форма зависит от многих причин.
Для того чтобы все пули, вылетающие из винтовки, попадали всегда в одну и ту же точку мишени, необходимо им
168
всем в момент вылета иметь одни и те же начальные координаты
Xq и скорости
V0 (или импульсы Ро). А это возможно лишь в том случае, если вы целитесь безошибочно и, кроме того, заряд пороха во всех патронах в точности одинаков. Ни то, ни другое обычно не достижимо. Поэтому распределение отверстий от пуль на мишени всегда подчиняется законам случая, и можно говорить лишь о вероятности попадания в «десятку» или «девятку» мишени, но никогда нельзя быть уверенным в этом заранее.

Как и при игре в «орел — решку», эту вероятность можно измерить. Допустим, мы произвели 100 выстрелов и 40 раз попали в «десятку», 30 раз — в «девятку», 15 — в «восьмерку» и так далее — до нуля. Тогда вероятность попадания в «десятку», «девятку», «восьмерку» и т. д. соответственно
IFio = 4O/1OO = O,4,
№
9 = 0,3, 1^8 = 0,15 и т. д.
Можно даже построить диаграмму эллипса рассеяния, отложив по горизонтали числа 1, 2, 3, ..., а по вертикали — вероятности попадания в соответствующие им области мишени.
Если мы возьмем теперь точно такую же мишень и вновь 100 раз по ней выстрелим, то расположение отверстий на ней будет совсем другим, чем на первой мишени. Но число попаданий в «десятку», «девятку» и т. д. останется примерно тем же самым, а следовательно, и диаграмма эллипса рассеяния также останется без изменений. Конечно, для разных стрелков диаграммы различны: для опытного стрелка она уже, для неопытного — шире. Но для каждого отдельного стрелка она остается неизменной, так что опытный тренер по одному виду мишени может установить, кому из его учеников она принадлежит.
Даже на этом простом примере видно, что «законы случая» — не пустая игра слов. Конечно, каждая из пуль попадает в случайную точку мишени, которую нельзя предсказать заранее. Однако при большом числе выстрелов попадания образуют настолько закономерную картину, что мы воспринимаем ее как достоверную и совершенно забываем о вероятности, лежащей в ее основе.
ДИФРАКЦИЯ ЭЛЕКТРОНОВ
Простой пример со стрельбой напоминает опыты квантовой механики значительно больше, чем это может показаться на первый взгляд. Чтобы убедиться в этом, заменим ружье «электронной пушкой», мишень — фотопластинкой, а между ними поместим тонкую металлическую фольгу.
«Электронная пушка» — не шутка, а научный термин, который обозначает устройство для получения пучка электронов — примерно такое же, как в телевизионной трубке. Из этого пучка с помощью диафрагм мы можем выделить очень узкий луч, в котором все электроны движутся с одинаковой скоростью. Направим теперь его через металлическую фольгу на фотопластинку и затем проявим ее. Какое изображение мы увидим? Точку? Эллипс рассеяния, как при стрельбе в тире? Или что-нибудь еще? Ответ известен еще со времен опыта Дж. П. Томсона: на фотопластинке мы увидим дифракционные кольца. Теперь можно понять и причину их появления.
В самом деле, электрон — не только частица, но также и волна. И если до сих пор мы еще не привыкли к этому факту, то, во всяком случае, должны были его запомнить. Поэтому сама по себе дифракция электронов не должна нас особенно удивлять: явление дифракции возникает всегда, если через вещество проходит волна, длина которой сравнима с расстоянием между атомами. Вопрос в другом. Волна
чего проходит вместе с электроном через фольгу?
По морю гуляют морские волны — они состоят из воды. Космос пронизывают электромагнитные волны — они представляют собой колебания электрического и магнитного полей. Но из чего состоит волна электрона, если сам он неделим и не имеет внутренней структуры?
Прежде чем ответить на эти вопросы, поставим мысленно опыт с пучком электронов немного по-другому. Станем выпускать электроны по одному (как пули из винтовки) и каждый раз менять фотопластинку за фольгой. После проявления всех фотопластинок на каждой из них обнаружится точка — след от упавшего электрон^. (Уже один этот факт, если бы не было других доказательств, мог бы убедить в том, что электрон — все-таки частица.) На первый взгляд черные точки на пластинках расположены совершенно беспорядочно, и, конечно, ни одна из них ничем не напоминает дифракционную картину. Но если мы сложим все пластинки в одну стопку и посмотрим ее на просвет, то с удивлением обнаружим все те же дифракционные кольца. Стало быть, черные следы от
iro
электронов разбросаны на пластинках не так уж беспорядочно, как это может показаться вначале.

Конечно, вовсе не обязательно для каждого электрона брать отдельную пластинку, вполне достаточно одной пла
Этот простой по идее опыт прост настолько, что может даже обидеть некоторых читателей своей тривиальностью. Не случайно, что он был поставлен лишь в 1949 г.: до такой степени физики не сомневались в его исходе, хотя и признавали его желательность и убедительность. (Этот опыт, технически довольно сложный, поставил советский ученый Валентин Александрович Фабрикант.) стинки-мишени, только по-прежнему надо пускать электроны-пули поодиночке. Как и прежде, мы не можем заранее предсказать, в какую точку пластинки попадет каждый следующий электрон. Это —
случайное событие. Однако если мы выпустим достаточно много электронов, то получим
закономерную дифракционную картину.
С такими явлениями мы уже сталкивались при игре в «орел — решку», при бросании кости, при стрельбе в тире. Эта аналогия приводит к естественному предположению: процесс рассеяния электронов подчиняется законам теории вероятностей. При дальнейшем размышлении и после знакомства с идеями Макса Борна эта догадка сменяется уверенностью.
ВОЛНЫ ВЕРОЯТНОСТИ
Макс Борн (1882—1970) преподавал физику в признанном центре немецкой науки — Гёттингене. Он пристально следил за развитием теории атома и был одним из первых, кто придал квантовым идеям Гейзенберга строгую математическую форму. В середине 1926 г. он заинтересовался опытами по дифракции электронов. Само по себе это явление после работы де Бройля уже не казалось ему удивительным: взглянув на дифракционную картину, он мог теперь объяснить ее появление с помощью гипотезы о «волнах материи»

и даже вычислить их длину. Однако по-прежнему не удавалось объяснить, что следует понимать под словами «волны материи». Пульсацию электрона-шарика? Колебания какого-то эфира? Или вибрацию чего-либо еще более гипотетического? То есть насколько материальны сами «волны материи»?
Летом 1926 г. Макс Борн пришел к следующему выводу:
«волны материи» — это
«волны вероятности». Они характеризуют движение отдельного электрона и в частности вероятность его попадания в определенную точку фотопластинки.
Всякая новая и глубокая идея не имеет логических оснований, хотя нестрогие аналогии, которые к ней привели, можно проследить почти всегда. Поэтому вместо того, чтобы логически доказывать правоту Борна (это невозможно), попытаемся почувствовать естественность его гипотезы. Обратимся снова к игре в «орел — решку» и вспомним причины, которые вынудили нас тогда применить теорию вероятностей. Их три:
независимость каждого последующего бросания монеты от предыдущего;
полная неразличимость отдельных бросаний; случайность исхода любого отдельного бросания, которая проистекает от полного незнания начальных условий каждого опыта, то есть от неопределенности начальных координаты и импульса монеты.
Все три условия выполняются в атомных явлениях, и в частности в опытах по рассеянию электронов. В самом деле:
электрон как частица должен рассеиваться независимо от других;
электроны так бедны свойствами (заряд, масса, спин — и это все), что в квантовой механике они неразличимы, а вместе с тем неразличимы и отдельные акты рассеяния;
и, наконец, главное: точные значения координат и импульсов электронов нельзя задать в принципе, поскольку это запрещено соотношением неопределенностей Гейзенберга.
В таких условиях бессмысленно искать траекторию каждого электрона. Вместо этого мы должны научиться вычислять вероятность р(х) попадания электронов в определенное
место
х фотопластинки (или, как принято говорить в физике, вычислить функцию распределения р(х)).
При игре в «орел — решку» это очень просто: даже без вычислений ясно, что вероятность выпадания «орла» равна 1 /2. В квантовой механике дело немного осложняется. Чтобы вычислить функцию р(х), описывающую распределение электронов на фотопластинке, необходимо решить уравнение Шрёдингера.
Макс Борн утверждал: вероятность р(х) найти электрон в точке
х равна квадрату волновой функции ф(х): p(x)=|t|>(x)|
2.
График функции р(х) выглядит сложнее, чем диаграмма эллипса рассеяния при стрельбе в тире. Но если вид эллипса нам предсказать не под силу, то функцию р(х) мы можем вычислить заранее. Ее вид однозначно определяется законами квантовой механики; несмотря на свою необычность, они все-таки существуют, чего нельзя сказать с уверенностью о законах поведения человека, от которого зависит эллипс рассеяния.
ЭЛЕКТРОННЫЕ ВОЛНЫ
Когда мы стоим на берегу моря, то у нас не возникает сомнений, что на берег набегают волны, а не что-либо иное. И нас не удивляет тот достоверный факт, что все они состоят из огромного числа частиц-молекул.
Волны вероятности — такая же реальность, как и морские волны.
И нас не должно смущать то обстоятельство, что они построены из большого числа отдельных независимых и случайных
событий.
Морской воде присущи и свойства волн, и свойства частиц одновременно. Это нам кажется естественным. И если мы удивлены, обнаружив такие же свойства у вероятности, то наше недоумение по крайней мере нелогично.
Когда дует ветер, то в море из беспорядочного скопления отдельных молекул возникают правильные ряды волн. Точно так же, когда мы рассеиваем пучок электронов, то отдельные случайные события — следы электронов — закономерно группируются в единую волну вероятности, описывающую распределение этих следов.
Чтобы убедиться в реальности морских волн, необязательно попадать в кораблекрушение,— достаточно взглянуть на море. Чтобы обнаружить волны вероятности, нужны
173
специальные приборы и тщательные опыты. Конечно, эти опыты сложнее, чем простой взгляд с прибрежного утеса к горизонту, но ведь нельзя же только на этом основании отрицать само существование вероятностных волн. В таком случае впору усомниться в существовании вирусов, генов, атомов, электронов — короче, всех явлений, недоступных непосредственному восприятию.
Полистав толстые учебники гидродинамики, можно убедиться, что пути молекул, из которых состоит морская волна, ничем не напоминают волновых движений: они движутся по кругам и эллипсам вверх и вниз и вовсе не участвуют в поступательном движении волны. Они составляют волну, но не следуют за ее движением. Форму этой волны определяют законы гидродинамики.
Точно так же движение отдельных электронов в атоме вовсе не похоже на те колебания, которым мы уподобили их раньше. Но в целом ненаблюдаемые пути электронов принадлежат единому наблюдаемому ансамблю — волне вероятности. Форму этой волны диктуют законы квантовой механики.
Аналогии такого рода можно продолжать и дальше, но сейчас важнее понять другое: как теперь надо понимать слова «электрон — это волна»? Ведь если это не материальная волна, а волна вероятности, то ее даже нельзя обнаружить, проводя опыт с отдельным электроном.
Иногда волновой характер квантовомеханических явлений трактуют как результат некоего особого рода взаимодействия большого числа частиц между собой. Это объяснение мотивируют как раз тем, что волновые и статистические закономерности атомных явлений вообще нельзя обнаружить, если проводить опыты с отдельно взятой атомной частицей. Ошибка таких рассуждений объясняется элементарным непониманием природы вероятностных законов:
вычислить волновую функцию ф(х) и распределение вероятностей р(х) можно для
отдельной частицы. Но
измерить распределение р(х) можно только при
многократном повторении однотипных испытаний с одинаковыми частицами. (Сам Борн говорил об этом так: «Движение частиц следует законам вероятности, сама же вероятность распространяется в согласии с законами причинности».)
Все предыдущие примеры и рассуждения помогают нам понять, что представляет собой электрон вне атома и почему эта частица наделена также свойствами волны. Как же эти свойства — волны и частицы — можно совместить без логических противоречий
внутри атома?
АТОМ И ВЕРОЯТНОСТЬ
До сих пор мы нигде не пытались определить форму #тома непосредственно на опыте. Мы ее вычислили из волнового уравнения Шрёдингера и поверили в нее, поскольку то же самое уравнение позволяет правильно предсказать самые тонкие особенности наблюдаемых спектров атома. Сейчас эта форма атомов общепризнана, и немного ранее мы привели несколько силуэтов, дающих представление о ней. Глядя на них, трудно отрешиться от мысли, что электрон в атоме представляет собой некое заряженное облако, форма которого зависит от степени возбуждения атома. По многим причинам, однако, эта картина неудовлетворительна.
Прежде всего, электрон — все-таки частица, и в этом нетрудно убедиться, наблюдая его след в камере Вильсона. А если вспомнить и явление фотоэффекта, то, право, трудно удержаться от категорических утверждений о его истинной природе. Сейчас мы ударились в другую крайность и утверждаем, что электрон в атоме — это некое заряженное облако. Такое представление наиболее удобно, когда мы пытаемся понять факт устойчивости атома, однако оно совершенно бесполезно для объяснения фотоэффекта. Действительно, никто никогда не видел, чтобы из атома вылетал кусок электронного облака — всегда вылетает целый электрон. Как же происходит мгновенное собирание электронных облаков разной формы всегда в одну и ту же неделимую частицу? Понятие о волнах вероятности позволяет понять и этот парадокс.
Поставим мысленный опыт по определению формы атома водорода. Возьмем, как и прежде, «электронную пушку», но теперь будем обстреливать из нее не фольгу, а отдельно взятый атом водорода. Что мы при этом должны увидеть? Большинство электронов «прошьет» атом водорода, как снаряд рыхлое облако, не свернув с пути. Но, наконец, один из них, столкнувшись с электроном атома, вырвет его оттуда и при этом сам изменит направление своего движения. Теперь позади атома мы увидим не один, а два электрона: один — из пушки, другой — из атома. Допустим, что мы так точно измерили их пути, что можем восстановить точку их встречи в атоме. Можем ли мы на этом основании утверждать, что электрон в атоме водорода находился именно в этой точке? Нет, не можем. Мы не в состоянии даже проверить своего допущения, поскольку атома водорода больше не существует: наше измерение его разрушило.
Этой беде, однако, легко помочь: все атомы водорода неразличимы между собой, и, чтобы повторить опыт, можно взять любой из них. Повторный опыт нас разочарует: мы обнаружим электрон в атоме водорода совсем не там, где ожидали его найти. Третье, пятое, десятое измерение только укрепит нашу уверенность в том, что электрон в атоме не имеет определенного положения: каждый раз мы будем находить его в новом месте. Но если мы возьмем очень много атомов, проведем очень много измерений и при этом всякий
раз будем отмечать точкой место электрона в атоме, найденное
в каждом отдельном опыте, то в конце опытов мы с удивлением обнаружим, что точки эти расположены не беспорядочно, а группируются в уже знакомые нам силуэты, объемные прообразы которых мьг вычислили ранее из уравнения Шрёдингера.
Этот факт нам уже знаком из опытов по дифракции электронов. В самом деле, тогда мы не знали, в какое место фотопластинки попадет электрон, теперь мы не знаем, в каком месте атома мы его найдем. Как и прежде, сейчас мы можем указать только вероятность обнаружения электрона в каком-то определенном месте атома. В одной точке атома эта вероятность больше, в другой — меньше, но в целом распределение вероятностей образует закономерный силуэт, который мы и принимаем за форму атома.
Ничего другого нам не остается. Можно, конечно, возразить, что это не отдельный атом, а некий обобщенный образ многих атомов. Но это слабый аргумент: ведь все атомы в одном и том же квантовом состоянии неразличимы между собой. Поэтому точечные картинки, полученные в опыте по рассеянию электронов на
многих, но
одинаковых атомах, определяют одновременно форму и
одного, отдельно взятого атома.
Здесь, как и везде, где справедливы законы случая, необходимо учитывать их особенности. Для каждого отдельного атома функция р(х) указывает лишь распределение вероятностей найти электрон в точке
х атома. Именно в этом смысле можно говорить о «вероятностной форме отдельного атома». Но картина эта достоверна, поскольку она совершенно однозначна для любой совокупности одинаковых атомов.
Надо признать, что психологически нам легче мыслить электрон частицей. Поэтому заключение о вероятностной природе его волновых свойств мы воспринимаем с некоторым облегчением: оно не вызывает у нас такого инстинктивного протеста, как прямолинейное утверждение «электрон — это волна».
Сейчас мы достигли предела, доступного всем, кто пытается проникнуть в глубь атома без формул и уравнений. Новый образ атома верен теперь во всех деталях. Не пользуясь «математической кухней» квантовой механики, нельзя предсказать ни одного атомного явления, однако объяснить кое-что теперь можно, если использовать новый образ грамотно и помнить о его происхождении.
Как это ни странно, но создатель античной атомистики Демокрит нацело отрицал роль случайности в явлениях природы. Более того, он исповедовал ту крайнюю форму детерминизма, которую впоследствии свяжут с именем Лапласа. Только Эпикур смягчил крайности его учения, оставляя за атомами свойство и способность (он назвал их «отклонением») варьировать свой путь даже под действием одинаковых сил. (При желании в этом постулате можно усмотреть предвосхищение соотношения неопределенностей и вероятностной трактовки квантовой механики.)
Наша теперешняя картина атома бесконечно далека от представлений Демокрита. В сущности, от них сохранилась лишь исходная идея. Но плодотворные заблуждения всегда лучше, чем бесплодная непогрешимость: не будь их, Колумб никогда бы не открыл Америку.
ВЕРОЯТНОСТЬ И СПЕКТРЫ АТОМОВ
Не только форма атома, но и все процессы в нем подчиняются законам теории вероятностей. Имея дело с отдельным атомом, никогда нельзя сказать наверняка, где находится его электрон, куда он попадет в следующий момент и что произойдет при этом с самим атомом. Однако уравнения квантовой механики всегда позволяют вычислить вероятности всех этих процессов. Вероятностные предсказания можно затем проверить и убедиться, что они достоверны, если провести достаточно много одинаковых испытаний. Даже такие люди, как Резерфорд, далеко не сразу поняли эту особенность квантовых процессов.
Он был первым читателем тогда еще рукописной статьи Бора о строении атомов. Возвращая рукопись, Резерфорд с присущей ему прямотой и резкостью спросил Бора: «А откуда электрон, сидящий на n-й орбите, знает, куда ему надо прыгнуть: на &-ю или на /-ю орбиту?» Тогда, в 1913 г., у Бора не было убедительного ответа. Теперь можно было бы ответить так: электрон ничего не знает заранее — он следует квантовым законам. Согласно этим законам всегда существует строго определенная вероятность перехода электрона из состояния с номером
п в любое другое состояние (например, в состояние
k). Как всегда, вероятность
Wnk такого перехода — это число, значение которого зависит от выбора пары квантовых состояний
пик. Перебирая всевозможные комбинации номеров
пик, получим квадратную таблицу чисел
Wnk, которая представляет внутреннее состояние атома и, как теперь известно, называется матрицей. С ее помощью можно, например, объяснить, почему в желтом дублете D-линии натрия линия
D2 в два раза интенсивнее, чем линия Di. Последовательно используя уравнения квантовой механики, можно понять также и более тонкие особенности строения этих линий, например законы изменения интенсивности внутри них самих. Понятно, однако, что все эти радости доступны только профессионалам.
ПРИЧИННОСТЬ И СЛУЧАЙНОСТЬ, ВЕРОЯТНОСТЬ И ДОСТОВЕРНОСТЬ
Вероятностная интерпретация квантовой механики очень многим пришлась не по душе и вызвала многочисленные попытки возврата к прежней, классической схеме описания. Это стремление во что бы то ни стало использовать старые знания в новых условиях по-человечески понятно, но ничем не оправдано. Оно напоминает желание отставного солдата осмыслить все многообразие жизни с позиций строевого устава. Безусловно, его возмутит беспорядок в дискоклубе, и довольно трудно будет объяснить ему, "что там действуют несколько иные законы, чем на армейском плацу.
Еще не так давно недобросовестные интерпретаторы квантовой механики с подозрительным рвением пытались отменить ее. только на том основании, что она не укладывалась в рамки ими же придуманных схем. Они возмущались «свобо-
178
дой воли», которая якобы дарована электрону, шельмовали соотношение неопределенностей и всерьез доказывали, что квантовая механика — бесполезная наука, коль скоро она толкует не о реальных событиях, а об их вероятностях. Те, кто внимательно проследил предыдущие рассуждения, понимают всю вздорность подобных обвинений. Но даже те, кто относится уважительно к теории атома, не всегда четко сознают, как понимать причинность атомных явлений, если каждое из них случайно, и насколько достоверны ее предсказания, если все они основаны на понятии вероятности.
Житейское понятие причинности — «всякое явление имеет свою причину» — не требует объяснений, но для науки бесполезно. Причинность в науке требует
закона, с помощью которого можно проследить последовательность событий во времени. На языке формул этот закон принимает вид дифференциального уравнения, которое называют уравнением движения. В классической механике такие уравнения — уравнения движения Ньютона — позволяют предсказать траекторию движения частицы, если точно задать ее начальную скорость и координату. Именно такая, бегло очерченная, схема объяснения и предсказания явлений природы всегда составляла идеал причинного описания в классической физике. Она не оставляет места для сомнений и криво-толков, и чтобы подчеркнуть это ее качество, в дальнейшем причинность классической физики назвали
детерминизмом.
Такой причинности в квантовой физике нет. Но там есть своя, квантовомеханическая причинность и свой закон — уравнение Шрёдингера. Закон этот более могуществен, чем уравнение Ньютона, поскольку улавливает и выделяет закономерности даже в хаосе случайных квантовых событий — подобно калейдоскопу, который в случайном сочетании стеклышек позволяет разглядеть фигуры, имеющие смысл и красоту.
Сочетания слов: «статистическая причинность», «вероятностная закономерность» — с непривычки режут слух своей несовместимостью. («Масляное масло» — плохо, но все же разумно, однако «немасляное масло» — это уж слишком.) Они в самом деле несовместимы. Но в квантовой физике мы вынуждены использовать их одновременно при объяснении особенностей квантовых явлений. В действительности никакого логического парадокса здесь нет: понятия «случайность» и «закономерность» — дополнительные понятия. В согласии с принципом дополнительности Бора оба они одновременно и равно необходимы, чтобы определить новое понятие «квантовомеханическая причинность», которая есть нечто большее, чем простая сумма понятий «закономерность» и «случайность». Точно так же, как «квантовый объект» — всегда нечто более сложное, чем бесхитростная сумма свойств «волны» и «частицы».
, Случайность единичных квантовых событий — не результат действия неизвестных причин, а первичный элементарный закон, которому они подчиняются, это — отправная точка теории, а не факт, подлежащий объяснению. Вероятность — свойство и категория, присущие самой квантовой реальности, а не удобный математический прием, используемый для описания результатов эксперимента.
При всей логической красоте таких построений привыкнуть к ним и признать их естественными все-таки довольно трудно. Как всегда в квантовой физике, эти логические трудности объясняются особенностями нашего языка и нашего воспитания. Понятия «закономерность» и «случайность», «достоверность» и «вероятность» возникли задолго до квантовой механики, и смысл, который в них обычно вкладывают, не зависит от желания квантовых физиков.
Проблема вероятности — это проблема наблюдения: что произойдет, если мы проделаем нечто. В классической физике два одинаковых испытания при одинаковых начальных условиях всегда должны приводить к одному и тому же конечному результату. В этом суть классической причинности, или детерминизма. Своеобразие квантовомеханической причинности состоит в том, что даже при неизменных условиях она может указать лишь вероятность исхода отдельного испытания, но зато совершенно достоверно предсказывает распределение исходов при большом числе тех же самых испытаний. С квантовой точки зрения традиционная формулировка закона причинности — «зная точно настоящее, можно уверенно предсказать будущее» — содержит неверную предпосылку:

в силу соотношения неопределенностей мы
в принципе не можем знать настоящее во всех деталях. Заключение же остается верным, если понимать его теперь по-новому.
Можно без конца жонглировать парадоксами «закономерная случайность», «достоверная вероятность», однако это ничего не прибавит к нашим знаниям об атоме. Суть не в этом. Просто нужно понять хотя бы однажды, что вероятностное описание атома — это не результат усреднения пока еще неизвестных субатомных явлений, а принципиальный предел возможностей нынешней науки: пока остается в силе соотношение неопределенностей Гейзенберга, мы не можем беспредельно уточнять наши сведения об индивидуальных квантовых объектах. По существу, нам это и не нужно: все тела в природе состоят из огромного числа атомов, а свойства таких систем квантовая механика предсказывает однозначно и без всякого произвола.
Понятие о вероятности завершило логическую схему квантовой механики. Только с его помощью удалось логически непротиворечиво осуществить высший синтез дополнительных пар понятий: волна — частица, непрерывность —
дискретность, причинность — случайность, явление — наблюдение. Лишь после этого удалось, наконец, установить, что все эти понятия образуют неделимую
систему и каждое из них зависит от контекста других. Точно так же, как нельзя объяснить, кто такой Геракл, не упоминая при этом Зевса, Атланта, Медузу Горгону, кентавра Хирона: только все вместе они образуют неповторимую ткань единого древнего мифа.
Ответы квантовой механики на вопросы, которые мы задаем природе, зависят от того, какую сторону атомного явления мы хотим изучить более пристально.
Изучая природу, мы всегда — сознательно или бессознательно — расчленяем ее на две части: на объект и наблюдателя. Разделение это неоднозначно и зависит от того,
какое явление мы изучаем и
что мы хотим о нем узнать. Если под
явлением мы понимаем движение отдельной
частицы, то это событие
дискретно, случайно и большей частью ненаблюдаемо. Но если явлением мы называем результат
наблюдения за движением многочисленных одинаковых квантовых объектов, то это событие
непрерывно, закономерно и описывается волновой функцией.
Квантовая механика изучает только такие явления и объекты. Для них она дает достоверные и однозначные предсказания, которые до сих пор ни разу не были опровергнуты опытом.
ВОКРУГ КВАНТА
Люди, события, кванты
Результаты науки не зависят от психологии или желаний отдельных людей, в этой объективности — ее сила и ценность. Но наука — дело человеческое, и оттого ее история — это не только накопление новых фактов, создание и уточнение физических понятий и математических методов, но также история человеческих судеб. Рядом с их открытиями любая подробность жизни ученых выглядит значительной: мы всегда стремимся понять, как та или иная мелочь, из которых складывается повседневная жизнь и великих людей, повлияла на дела, их обессмертившие.
Квантовая физика родилась в лоне европейской культуры, а люди, ее создавшие,— лучшие ее представители. Эйнштейн, Борн, Гейзенберг, Эренфест, Лауэ были превосходными музыкантами, а Планк даже читал в университете лекции по теории музыки и в юности намеревался стать профессиональным пианистом. (Он руководил также хором, в котором пел молодой Отто Ган, тридцать лет спустя открывший деление урана.)
Гейзенберг, Паули, Лауэ, Шрёдингер владели древними языками, Луи де Бройль — по профессии историк, а Шрёдингер был глубоким знатоком философии и религии, особенно индийской, писал стихи и в конце жизни издал свой поэтический сборник.
Даже в научной переписке Планк и Зоммерфельд обменивались стихами.
История создания квантовой механики сохранила несколько живых воспоминаний, которые помогают представить ту обстановку напряжения и подъема, в которой люди разных национальностей, возрастов и темпераментов всего за три года построили современное здание квантовой механики.
Быть может, все началось в тот день, когда Зоммерфельд вошел в комнату, где занимался второкурсник Гейзенберг, запретил ему играть в шахматы, дал в руки фотопластинку с фотографией спектра излучения атома в магнитном поле и предложил найти закономерности в расположении спектральных линий. А может — тремя годами позже, в июне 1922 г., во время длительной прогулки Гейзенберга и Бора, который по приглашению Гёттингенского университета читал там цикл лекций по квантовой теории. Или, наконец, в конце мая 1925 г., когда ассистент Вернер Гейзенберг заболел сенной лихорадкой и по совету своего тогдашнего руководителя Макса Борна уехал отдыхать на остров Гельголанд в Северном море. Там он проделал свои знаменитые вычисления и пережил редкий душевный подъем, о чем впоследствии рассказывал: «Наконец настал вечер, когда я смог приступить к вычислению энергии отдельных членов в энергетической таблице или, как говорят сегодня, в матрице энергии. Возбуждение, охватившее меня,... мешало сосредоточиться, и я начал делать в вычислениях ошибку за ошибкой.
Окончательный результат удалось получить лишь к трем ночи. В первый момент я испугался... При мысли, что я стал обладателем всех этих сокровищ — изящных математических структур, которые природа открыла передо мной,— у меня захватило дух. О том, чтобы заснуть, нечего было и думать. Начало уже светать. Я вышел из дому и отправился к южной оконечности острова, где в море выдавалась одиноко стоящая скала... Без особого труда одолев высоту, я дождался восхода солнца на ее вершине».
Уже 5 июня, по возвращении из отпуска, он написал о своих вычислениях Кронигу, 24 июня — подробное письмо Паули, а набросок статьи отдал Максу Борну с просьбой поступить с ней по его усмотрению. Борн одобрил его идею, и 29 июля статья Гейзенберга «О квантовотеоретическом истолковании кинематических и механических соотношений» поступила в редакцию журнала. Сам Гейзенберг, по-видимому, не сразу осознал значение своей работы, поскольку, выступая 28 июля по приглашению «клуба Капицы» в Кембридже, он избрал для доклада другую тему: «О терм-зоологии и Зееман-ботанике».
Макс Борн продолжал упорно думать о смысле работы своего ассистента. «Гейзенберговское правило умножения,— вспоминал он в своей нобелевской речи,— не давало мне покоя, и через восемь дней интенсивных размышлений и проверок в моей памяти воскресла алгебраическая теория, которой учил меня профессор Розанес в Бреслау... Я никогда не забуду того глубокого волнения, которое я пережил, когда мне удалось сконцентрировать идеи Гейзенберга о квантовых условиях в виде таинственного уравнения
pq — — qp = h/2ni».
Как раз в это время Борн по пути в Ганновер поделился в поезде трудностями нового исчисления с коллегой из Гёттингена. По воле случая или прихоти судьбы в том же купе ехал недавний студент Паскуаль Йордан — один из немногих

людей, знавших в то время матричное исчисление, поскольку именно он помогал Рихарду Куранту готовить к печати вышедший в 1924 г. знаменитый курс «Методы математической физики» Куранта и Гильберта. На вокзале в Ганновере Йордан представился Борну и предложил свою помощь. Это было как нельзя более кстати, поскольку Паули сотрудничать с Борном отказался и советовал ему вообще не вмешиваться в развитие событий, искренне считая, что новая наука — это «Knabenphysik», фи
зика для мальчиков (Борну в то время было 42 года — слишком много, по мнению Паули). Борн и Йордан за^ вершили свою статью к осени, вскоре к ним присоединился Гейзенберг, и совместно они дали первое последовательное изложение матричной механики (16 ноября 1925 г. их статья «О квантовой механике» поступила в редакцию журнала).
Чуть раньше, 7 ноября того же года, в редакцию поступила статья Дирака «Основные уравнения квантовой механики», в которой он предложил свое математическое оформление идей Гейзенберга. По образованию Дирак был инженером-электриком, но в годы послевоенной депрессии он не нашел работы по специальности и решил продолжить образование в Кембридже под руководством Фаулера, от которого он и узнал о статье Гейзенберга, после того как в сентябре 1925 г. Фаулер получил ее гранки от Борна.
Той же осенью Борн уехал в длительную командировку в Америку и во время пребывания там зимой 1926 г. совместно с Норбертом Винером — будущим создателем кибернетики — ввел одно из самых важных понятий квантовой механики — понятие
оператора физической величины, который, в частности, может быть представлен и матрицей, как в схеме Гейзенберга.
Той же зимой Вольфганг Паули с помощью матричной механики нашел энергии уровней атома водорода и показал, что они совпадают с энергиями стационарных состояний в модели атома Бора.
Годом раньше, 29 ноября 1924 г., Луи де Бройль защитил диссертацию «Исследования по теории квантов». В 1910 г. он получил в Сорбонне звание лиценциата литературы по разделу истории, однако под влиянием брата, лекций Ланжевена по теории относительности и чтения книг Пуанкаре «Наука и гипотеза», «Ценность науки» он со всем пылом юности отдался изучению физики.
Брат Луи де Бройля Морис был признанным специалистом в физике рентгеновских лучей и много думал над их природой. Он был согласен с Уильямом Брэггом, который еще в 1912 г., сразу после открытия Лауэ и за 10 лет до опыта Комптона, писал: «Проблема теперь состоит не в том, чтобы выбрать между двумя теориями рентгеновских лучей, а в том, чтобы найти... одну теорию, обладающую возможностями обеих».

|
| В 1963 г. Луи де |
Бройль вспоминал: «Мой брат считал рентгеновские лучи некой комбинацией волны и частицы, но, не будучи теоретиком, не имел особенно четких представлений об этом
предмете... Он настойчиво обращал мое внимание на важ
ность и несомненную реальность дуальных аспектов волны и частицы. Эти долгие беседы... помогли мне глубоко понять необходимость обязательной связи волновой и корпускулярной точек зрения».
Уже в своей первой статье 1923 г. Луи де-Бройль высказал предположение, что «пучок электронов, проходящий через достаточно узкое отверстие, также должен обнаруживать способность к интерференции». Тогда на это замечание никто из серьезных экспериментаторов внимания не обратил, хотя уже в то время был известен эксперимент Дэвиссона и Кансмена, а также опыты Карла Рамзауэра (1879—1955) и Джона Таунсенда (1868—1957), из которых следовало, что электроны, проходя через газы при определенных энергиях, почти не рассеиваются — явление, аналогичное эффектам просветленной оптики и противоположное резонансному поглощению, наблюдаемому в опыте Франка и Герца.
Поль Ланжевен, руководитель диссертации де Бройля, относился к его идеям сдержанно, но доброжелательно. В апреле 1924 г. он сообщил их участникам IV Сольвеевского конгресса, а в декабре послал диссертацию на отзыв Эйнштейну, который в свою очередь горячо советовал Максу Борну: «Прочтите ее! Хотя и кажется, что ее писал сумасшедший, написана она солидно». В дальнейшем Эйнштейн сочувственно цитировал ее в своих работах, и Шрёдингер впоследствии благодарил его за то, что он его вовремя «щелкнул по носу, указав на важность идей де Бройля».
Не все приняли идею о волнах материи столь же благосклонно. Планк вспоминал впоследствии, что, услышав от Крамерса на одном из семинаров о работе де Бройля, он «только покачал головой», а присутствовавший при этом Лоренц сказал: «Эти молодые люди считают, что отбрасывать старые понятия в физике чрезвычайно легко!»
В начале 1925 г. Макс Борн обсуждал эти идеи со своим близким другом и коллегой по Гёттингенскому университету Джеймсом Франком. При обсуждении присутствовал студент Борна Вальтер Эльзассер, который тут же предложил провести эксперимент по дифракции электронов. «Это необязательно,— ответил Франк,— эксперименты Дэвиссона уже установили наличие наблюдаемого эффекта» (сам Дэвиссон так не считал и вряд ли хорошо был знаком с идеей де Бройля). Вальтер Эльзассер после этих дискуссий написал короткую заметку, в которой объяснял результаты опытов Дэвиссона и Кансмена, а также эффект Рамзауэра — Таунсенда с помощью представлений о волнах материи.
Заметка Эльзассера была напечатана в июле 1925 г., еще до направления в печать первой работы Гейзенберга, но на нее мало кто обратил тогда внимание: вскоре большинство увлеклось новой матричной механикой.
Эрвину Шрёдингеру в 1925 г. было уже 38 лет, и он не так просто поддавался моде и увлечениям. Подобно Гейзенбергу, он окончил классическую гимназию, где основными предметами были латынь и греческий, а по складу ума он был поэтом и мыслителем. К сожалению, Шрёдингер не оставил после себя, подобно Гейзенбергу, живых воспоминаний об эпохе «Sturm und Drang» квантовой механики. Быть может, потому, что свои главные открытия он сделал в зрелые годы, когда юношеский пыл действия сменяется спокойной мудростью знания, а ликование первооткрывателя смягчается пониманием относительной ценности всего сущего.
О своем тогдашнем впечатлении от теории Гейзенберга — Борна — Йордана Шрёдингер впоследствии вспоминал: «...меня отпугивали, если не сказать отталкивали, казавшиеся мне очень трудными методы трансцендентной алгебры и отсутствие всякой наглядности». Взгляды де Бройля были ему явно ближе, и тут же представился случай изучить их более пристально: в конце 1925 г. Петер Дебай, которого он сменил на кафедре физики в Цюрихском университете, попросил рассказать о работах де Бройля аспирантам знаменитого Цюрихского политехникума. Вскоре после этого появилась первая статья из серии работ Шрёдингера «Квантование как проблема собственных значений» (она поступила в редакцию 27 января 1926 г., примерно в то же время, когда Борн и Винер ввели понятие оператора, а Паули с помощью матричной механики нашел спектр атома водорода). 21 июня 1926 г. Шрёдингер отправил в редакцию шестую статью серии, а уже 25 июня Борн направил в печать сообщение, в котором предлагалась статистическая интерпретация волновой функции. Тем самым построение основ волновой квантовой механики было, по существу, закончено.
Через много лет Макс Борн, говоря об этих работах Шрёдингера, воскликнет: «Что есть более выдающегося в теоретической физике?», а Макс Планк добавит: «Уравнение Шрёдингера в современной физике занимает такое же место, какое в классической механике занимают уравнения, найденные Ньютоном, Лагранжем и Гамильтоном». Но в то время теоретики встретили волновую механику настороженно, поскольку в ней явно отсутствовали квантовые скачки — то, к чему лишь недавно и с большим трудом привыкли и что считалось главной особенностью атомных явлений.
В июне 1926 г. Гейзенберг приехал в Мюнхен навестить родителей и «пришел в совершенное отчаяние», услышав на одном из семинаров доклад Эрвина Шрёдингера и его интерпретацию квантовой механики. «Чем больше я размышляю над физической стороной теории Шрёдингера, тем ужаснее она мне кажется», писал он Паули.
Зато экспериментаторы (Вильгельм Вин и другие), которые называли теорию Гейзенберга «атомистикой» (то есть мистикой атома), приветствовали теорию Шрёдингера с воодушевлением. (Вин к тому же, без сомнения, не забыл, как Гейзенберг провалил ему выпускной экзамен по экспериментальной физике.)
Споры о волновой механике продолжались часами и днями и достигли предельной остроты в сентябре 1926 г., когда Шрёдингер приехал по приглашению Бора в Копенгаген. Шрёдингер настолько устал от дискуссий, что даже заболел и несколько дней провел в доме Бора, который в течение всей болезни почти не отходил от его постели. Время от времени, характерным жестом подняв палец, Нильс Бор повторял: «Но, Шрёдингер, вы все-таки должны согласиться...» Однажды, почти в отчаянии, Шрёдингер воскликнул: «Если мы собираемся сохранить эти проклятые квантовые скачки, то я вообще сожалею, что имел дело с атомной теорией!» — «Зато остальные весьма признательны вам за это»,— ответил ему Бор.
С течением времени точки зрения сторонников матричной и волновой механик сближались. Сам Шрёдингер доказал
их математическую эквивалентность еще в марте 1926 г., и независимо от него к тому же выводу пришли Карл Эккарт в Америке, Корнелиус Ланцош и Вольфганг Паули в Германии.
В августе 1926 г. на съезд Британской ассоциации содействия науке приехал из Америки Дэвиссон и обсуждал свои новые эксперименты по отражению электронов от поверхности кристаллов с Борном, Хартри и Франком. Они снабдили его статьями Шрёдингера, которые он прилежно изучал на обратном пути через океан. Год спустя, продолжая с Джермером свои опыты, он экспериментально доказал реальность электронных волн, а за полгода до этого, в мае 1927 г., Дж. П. Томсон также обнаружил дифракцию электронов — волновая механика обрела прочное экспериментальное основание.
Опыты по дифракции электронов, впервые ставшие известными летом 1926 г., сильно укрепили веру в теории де Бройля и Шрёдингера. Постепенно физики не только поняли, но и смирились с тем, что дуализм «волна — частица» — это твердо установленный факт, а не остроумная гипотеза. Теперь ученые старались понять, к каким следствиям он приводит и какие ограничения накладывает на представления о квантовых процессах. При этом они сталкивались с десятками парадоксов, смысл которых понять зачастую не удавалось.
В ту осень 1926 г. Гейзенберг жил в мансарде физического института в Копенгагене. По вечерам к нему наверх поднимался Бор, и начинались дискуссии, которые часто затягивались далеко за полночь. «Иногда они заканчивались полным отчаянием из-за непонятности квантовой теории уже в квартире Бора за стаканом портвейна,— вспоминал Гейзенберг.— Однажды после одной такой дискуссии я, глубоко обеспокоенный, спустился в расположенный за институтом Фэллед-парк, чтобы прогуляться на свежем воздухе и немного успокоиться перед сном. Во время этой прогулки под усеянным звездами ночным небом у меня мелькнула мысль, не следует ли постулировать, что природа допускает существование только таких экспериментальных ситуаций, в которых... нельзя одновременно определить место и скорость частицы». В этой мысли — зародыш будущего соотношения неопределенностей.
Быть может, чтобы снять напряжение тех дней, в конце февраля 1927 г. Нильс Бор уехал отдохнуть в Норвегию. Оставшись один, Гейзенберг продолжал напряженно думать. В частности, его очень занимал давний вопрос товарища по
188
учебе Борхерта Друде (сына известного физика Пауля Дру-де): «Почему нельзя наблюдать орбиту электрона в атоме при помощи лучей с очень малой длиной волны, например гамма-лучей?» Обсуждение этого эксперимента довольно быстро привело его к соотношению неопределенностей. (Надо думать, что Гейзенберг с благодарностью вспомнил при этом строгого экзаменатора Вилли Вина, который хотел его прогнать с экзамена за незнание предела разрешающей способности микроскопа. Как впоследствии признавался сам Гейзенберг, он был достаточно добросовестным, чтобы все-таки изучить этот раздел оптики после экзамена, который ему зачли лишь благодаря заступничеству Зоммерфельда, и знания эти оказались теперь как нельзя более кстати.)
Через несколько дней возвратился из отпуска Бор с готовой идеей дополнительности, которую он окончательно продумал в Норвегии. Еще через несколько недель напряженных дискуссий с участием Оскара Клейна все пришли к выводу, что соотношение неопределенностей — это частный случай
принципа дополнительности, для которого возможна количественная запись на языке формул. 23 марта 1927 г. статья Гейзенберга «О наглядном содержании квантовотеоретической кинематики и механики» с комментарием Бора поступила в редакцию.
К этому времени квантовую механику изучают уже повсеместно, больше всех, конечно, в Гёттингене и Копенгагене. В зимнем семестре 1926—1927 гг. Давид Гильберт дважды в неделю читал в Гёттингенском университете курс по математическим методам квантовой механики (он был издан уже весной 1927 г.). Ему помогал 23-летний выходец из Венгрии Джон (Янош, Йоханн) фон Нейман (будущий создатель вычислительных машин, теории игр, один из величайших математиков XX века), который два года спустя придаст квантовой теории черты математической строгости и концептуальной независимости.
Со времени появления первой статьи Гейзенберга математический аппарат новой механики непрерывно совершенствовался, а ее интерпретация постепенно дополнялась и уточнялась. Через два года, к осени 1927 г., по квантовой механике было опубликовано более двухсот работ, и значительная их часть не устарела до сих пор. 16 сентября 1927 г. в Комо на Международном конгрессе в честь столетнего юбилея Александра Вольта Нильс Бор прочел доклад «Квантовый постулат и новейшее развитие атомной теории». В нем он впервые последовательно изложил систему понятий новой квантовой физики и ввел термин «дополнительность». Несколько недель спустя, в конце октября 1927 г., в Брюсселе на V Сольвеевский конгресс собрались Планк, Эйнштейн, Лоренц, Бор, де Бройль, Борн, Шрёдингер, а из молодых — Гейзенберг, Паули, Дирак, Крамере. Здесь окончательно утвердилось то представление о квантовой механике и та система понятий, которая впоследствии получила название «копенгагенской интерпретации». Дискуссии на конгрессе стали самой суровой проверкой всех положений квантовой механики. Она ее с честью выдержала и с тех пор не претерпела почти никаких изменений в своих основах.
В те годы в Копенгагене в институте Бора создавалась не только наука об атоме — там выросла интернациональная семья молодых физиков. Среди них были Крамере, Гаудсмит и Розенфельд — из Голландии, Клейн — из Швеции, Дирак — из Англии, Гейзенберг — из Германии, Бриллюэн — из Франции, Паули — из Австрии, Ниш и на — из Японии, Уленбек — из Америки, Гамов и Ландау — из России... Беспримерное в истории науки содружество ученых отличали бескомпромиссное стремление к истине, искреннее восхищение величием решаемых ими задач и неистребимое чувство юмора, так гармонировавшее с общим духом интеллектуального благородства. «Есть вещи настолько серьезные, что о них можно говорить лишь шутя»,— любил повторять Нильс Бор, который стал их учителем и духовным отцом.
В них жила та искра космического чувства, которая отличает людей истинно великих. Это чувство вечности они сохранили даже в гражданских смутах, современниками и участниками которых им пришлось стать. Через много лет политические бури разбросают их по всему миру: Гейзенберг станет главой немецкого «уранового проекта», Ниши-на возглавит японскую урановую программу, сам Нильс Бор, спасаясь от нацистов, окажется в американском центре атомных исследований Лос-Аламосе, а Гаудсмита назначат руководителем миссии «Алсос», которая будет призвана выяснить, что успел сделать Гейзенберг для постройки немецкой атомной бомбы...
Почти никого из этих людей уже нет сейчас в живых: Шрёдингер умер в 1961 г., Бор — в 1962 г., Борн — в 1970 г., Гейзенберг—в 1976 г., Дирак — в 1985 г., де Бройль — в 1987 г.,— и вместе с ними ушла целая эпоха в физике, которую можно сравнить лишь с эпохой Галилея и Ньютона.
ГЛАВА 11
 Атотархо
Атотархо
Формулировка и уточнение понятий — занятие сложное и не всегда безопасное. В свое время Сократ поплатился жизнью за настойчивые попытки уяснить смысл основных морально-этических понятий: добро и зло, истина и заблуждение, справедливость и закон... Сократ жил в античной Греции времен ее наивысшего расцвета. Как истинный мудрец, он проводил свои дни на солнечных площадях Афин и испытывал сограждан вопросами такого рода: «Скажи мне, многоученый Гиппий, что есть прекрасное?» Ученый собеседник с жаром принимался за объяснения, но вскоре убеждался, что не может выйти за круг примеров: он толковал более или менее понятно, что такое прекрасная женщина, прекрасный горшок с кашей или прекрасная лошадь, но объяснить, что есть прекрасное само по себе, ему всякий раз оказывалось не под силу.
Трагизм этой типичной мыслительной ситуации понимали во все времена. Понимали и смирялись: «Истина лежит за пределами сознания и потому не может быть выражена словами»,— говорили в Древней Индии. В своем стремлении ответить на вопрос «Что такое атом?» мы неизбежно приходим к тем же трудностям. На частных примерах мы постепенно убедились, что атом — это не спектральные линии, им испускаемые, и не многообразие кристаллов, которые из атомов построены, не тепло раскаленного железа и не электроны, вылетающие из атомов.
Подобно собеседникам Сократа, мы теперь вынуждены лризнать, что атом — это нечто неопределимое само по себе, некая общая причина квантовых явлений, которые все в той или иной степени необходимы для его определения. Наблюдая раскаленное железо и спектральные линии, кристаллы и процесс электролиза, электроны в трубке Крукса и рассеяние частиц, мы так или иначе касались различных граней атома. Можем ли мы теперь осмысленно ответить на два основных вопроса, которые задали в самом начале?
ЧТО ТАКОЕ АТОМ?
ЧТО ТАКОЕ КВАНТОВАЯ МЕХАНИКА?
Наш рассказ о квантовой механике мы начали с определения: «Квантовая физика — это наука о строении и свойствах квантовых объектов и явлений». Мы его тут же оставили, поскольку бесполезность его очевидна до тех пор, пока не определено само понятие «квантовый объект». Мы обратились к анализу опытов, в которых проявляются свойства атома и других квантовых явлений, и к анализу формул, с помощью которых можно объяснить и предсказать результаты этих опытов.
Постепенно выяснилась интересная особенность: все формулы, которые описывают свойства квантовых объектов, непременно содержат постоянную Планка
h. Более того, если физик видит уравнение, в которое входит квант действия
h, он безошибочно заключает отсюда, что перед ним уравнение квантовой механики.
На этом основании квантовую механику можно было бы определить как систему уравнений, в которых присутствует постоянная Планка
h. Однако такое определение может лишь успокоить наше стремление к однозначности и формальной строгости, но ничего не может дать по существу — название науки должно указывать на предмет ее изучения, а не только на метод, которым эта цель достигается.
Мы могли бы определить атом как физический объект, волновые и корпускулярные свойства которого одинаково существенны для полной его характеристики. Однако и такой подход заведомо не исчерпывает всех свойств квантового объекта, хотя и фиксирует изначально присущий ему дуализм. После многочисленных попыток ответить на вопросы о сущности атома можно было

|
|
192
|
бы, например, сказать, наконец: «Атом — это все то, что мы теперь о нем знаем». Но, конечно, и это не определение, а благовидный предлог его избежать.
Какими словами коротко и без разночтений можно определить
понятие «атом»? Мы неоднократно убеждались, что ни одно слово нашей ре
чи не в состоянии вместить все его многообразие и сложность. Тогда мы обратились к уравнениям квантовой механики и с помощью формул, минуя слова и строгие определения, построили для себя
образ атома. При этом мы сознательно следовали принципам квантовой физики.
Один из них предписывает по возможности избегать разговоров о явлениях самих по себе, безотносительно к способу их наблюдения. Понятия «явление» и «наблюдение» существуют независимо только в нашем сознании, да и то с ограниченной точностью. Для физика оба эти понятия — две стороны одной и той же физической реальности, которую он изучает и в объективное существование которой безусловно верит. Они несовместимы: наблюдение разрушает первозданное явление. Но они равно необходимы: без наблюдения мы вообще ничего не знаем о явлении. Их сложное единство и взаимодействие не позволяет нам постигнуть суть явления самого по себе, но оно помогает нам раскрыть
связи между явлениями.
Эти связи мы можем записать с помощью формул и рассказать о них словами. Однако слова повисают в воздухе, если рядом с ними не написаны формулы. А формулы мертвы до тех пор, пока мы не нашли способа объяснить, что они на самом деле означают. Для полного объяснения «явления — наблюдения» необходимо гармоничное сочетание понятий и формул. Лишь после этого можно создать для себя удовлетворительный образ физического явления.
На этом этапе цепочка познания новой физики явление образ-«- понятиеформула опыт
I__________________________._________________________f
еще раз видоизменяется, усложняется и приобретает вид явление
понятие формула
образ
наблюдение
В продолжение всех попыток определить понятие «атом» мы бессознательно стремились к этой схеме.
Нынешние физики начинают свое обучение с формул. Наверное, это разумно: при изучении любого иностранного языка лучше сразу учиться говорить, а не выяснять каждый раз, почему то или иное слово произносится так, а не иначе. Вслед за формулами физики усваивают слова, которые необходимо при этом произносить и без которых общение между людьми затруднительно. Однако формулы не имеют точных словесных эквивалентов. Поэтому обучение современной

физике состоит в том, чтобы излагать непривычные вещи привычными словами, но каждый раз немного с новой точки зрения. Тем самым добиваются погружения новых понятий из сферы логической и сознательной в сферу интуитивную и подсознательную — необходимое условие всякого творчества.
Такой способ обучения физиков неуловимо деформирует систему их образов, понятий и даже систему ассоциаций. Как всякого человека, хорошо владеющего иностранным языком, физиков коробят безукоризненно правильные словесные конструкции большинства научно-популярных книг: в них они безошибочно различают еле уловимый чужеродный акцент. Невозможно адекватно передать смысл иностранной фразы, не разрушив при этом ее первоначальную структуру. Язык, на котором общаются между собой физики, только по названию и отдельным словам русский, английский или еще какой-то. В действительности это особый язык, словарь и грамматические конструкции которого приводят в отчаяние литературных редакторов. Но при всякой попытке «причесать» корявую физическую фразу по нормам литературного языка она что-то теряет — как иностранные стихи даже в хорошем переводе.
Непричесанная физическая правда состоит в том, что:
квантовая механика — это система формул, понятий и образов, которая позволяет объяснить и предсказать наблюдаемые свойства квантовых объектов;
квантовый объект — это физическая реальность, дуальная в своей первооснове, свойства которой можно описать с помощью уравнений квантовой механики.
Два приведенных определения, поставленные рядом, выглядят как насмешка над здравым смыслом. Их точный
194
смысл и в самом деле нельзя вполне понять, если использовать их порознь: только взятые вместе они становятся осмысленными. Конечно, для того чтобы понять и представить себе все многообразие и единство квантовых явлений, одних формальных определений недостаточно: нужно знать их истоки и эволюцию. Именно поэтому мы так долго и тщательно знакомились с опытами, из которых впоследствии выкристаллизовалось понятие «квантовый объект». Само по себе, в отрыве от этих опытов, оно ничего не означает; оно лишь закрепляет на языке формальной логики тот интуитивный образ, который постепенно формируется в нашем сознании во многом помимо нашей воли. Наше теперешнее определение квантовой механики почти дословно совпадает с тем, которое мы привели в самом начале книги. И если теперь оно звучит для вас совсем по-другому, значит, все остальное вы прочли не напрасно.
Рассказ о квантовой механике на этом можно было бы закончить, если бы не одно важное обстоятельство. Дело в том, что, сказав слова: «Атом — это физическая реальность...», мы невольно коснулись обширной пограничной области между физикой и философией.
Физическая реальность — последнее понятие, к которому неизбежно приходят при любой серьезной попытке объяснить что-либо в физике. В силу своей универсальности оно настолько обширно и всеобъемлюще, что определить его только средствами физики оказывается невозможным. Для этого необходимо привлечь философию с ее понятием объективной реальности.
Как известно, объективная реальность — это все то, что есть и было, независимо от нашего сознания. Однако для науки такое определение недостаточно конкретно, поскольку оно ни к чему не обязывает, кроме веры в объективную сущность познаваемого мира. А в это все ученые верят — иначе они не отдавали бы всю свою жизнь познанию этой реальности. Мнения расходятся лишь о
природе физической реальности, ее истинности и однозначности. Большая часть физиков признает, что физическая реальность — это та часть объективной реальности, которую мы познаем с помощью опыта и нашего сознания, то есть все те факты и числа, которые мы получаем с помощью приборов, а также их обобщения на языке понятий, придуманных учеными.
Мнения — очень зыбкая вещь. Почему же мы уверены, что картина физической реальности, добытая таким путем, истинна? Или более мягко (кто знает, «что такое истина?») — почему мы убеждены, что эта картина единственно возможна?
ФИЗИЧЕСКАЯ РЕАЛЬНОСТЬ
Зайдите в любую физическую лабораторию и попытайтесь с порога определить, какое явление природы в ней изучают. Вы увидите перед собой нагромождение приборов и путаницу проводов, за которыми нельзя разглядеть не то что явление, но даже физиков, которые призваны его изучать. В этой обстановке такие, например, слова: «Мы изучаем здесь расщепление спектральных линий в магнитном поле» — могут вызвать лишь вежливое внимание, но отнюдь не доверие.
Даже когда вам в руки дадут фотопластинку и вы увидите на ней узкие черные линии,— у вас не возникнет никаких ассоциаций с атомами, из недр которых (как станут убеждать вас физики) испущены те самые лучи, которые впоследствии были преобразованы спектроскопом и оставили следы на фотопластинке. Для человека, непричастного к физике, все эти объяснения выглядят очень неубедительно. Ему более или менее понятно, как по стуку мотора механик определяет его неисправность или как врач, выслушав жалобы больного, ставит диагноз. Потому что он знает: всегда можно разобрать мотор — детали его при этом не изменятся — и можно, на худой конец, произвести вскрытие, чтобы убедиться в правильности диагноза. В обоих случаях известны все части, из которых устроено целое. Даже если вы не часовщик, то, разобрав часы, вы сможете понять, как они работают и почему видимое движение их стрелок не похоже на невидимое обычно движение их пружин и колесиков.
С атомами все много сложнее. Мы наблюдаем внешние проявления их свойств: спектры, цвет тел, их теплоемкость и кристаллическую структуру, но мы не можем после этого открыть «крышку часов» и посмотреть, как атом устроен «на самом деле». На основе совокупности фактов, понятий и формул мы создали для себя некоторый образ атома. Но поскольку не существует никакого независимого способа проверить этот образ, то возникает естественный вопрос: а нельзя ли придумать другой образ атома, который, однако, приводил бы к тем же самым наблюдаемым следствиям?
Вопрос этот не праздный, им занимались почти все великие физики. Житейский скептический ум формулирует его несколько проще: «Все, что вы придумали,— неправда, на самом деле все не так!» Такое возражение трудно опровергнуть, потому что понятие «на самом деле» в действительности не определено. В общежитейском смысле «на самом деле» существует лишь то, в чем можно удостовериться, опираясь на показания наших пяти чувств, либо же то, в чем мы можем убедиться с помощью приборов — продолжений наших чувств.
Даже с последним утверждением согласились далеко не сразу: современники Галилея упрекали его в том, что открытия солнечных пятен и спутников Юпитера на самом деле не открытия, а ошибки зрительной трубы, которой он пользовался.
Предположим, что мы ушли вперед со времен Галилея и верим в истинность показаний приборов. Тогда остается еще свобода для толкования этих показаний. Вопрос «на самом деле» теперь означает: «Насколько однозначно толкование опытов относительно явлений, недоступных непосредственному чувственному восприятию?» Здравый смысл человека, даже причастного к науке, должен признать, что такое толкование неоднозначно. После беглого посещения физической лаборатории это априорное убеждение может только укрепиться. Но физики-то знают, что факты и понятия их науки допускают свободу толкования только в процессе их открытия и становления; как только они включены в общую систему физических знаний и согласованы с ними — изменить их почти невозможно, если не переходить при этом границ их применимости. (Попробуйте выбросить фразу из хорошей поэмы, хотя, казалось бы, все это чистейший «поэтический вымысел».)
При углублении и уточнении системы научных знаний мы вынуждены все дальше и дальше отходить от непосредственных чувственных восприятий и от понятий, которые возникли на их основе. Такой процесс абстракции необратим, но не следует огорчаться по этому поводу: мы вправе гордиться тем, что наш разум способен понять даже то, чего мы не в состоянии представить. Абстрактность научных понятий — такая же необходимость, как изобретение буквенного письма взамен древних рисунков и иероглифов. Ни одна буква в слове «носорог» не похожа на носорога, и тем не менее все слово безошибочно вызывает в воображении нужный образ. Всем очевидно, что нынешняя культура немыслима без книгопечатания. Но далеко не каждому ясно, что без дальнейшей абстракции научных понятий развитие науки невозможно. Одним словом, абстрактная наука, как и музыка, требует не оправдания, а глубокого понимания; только с ее помощью можно познать непривычную квантовую реальность, хотя реальность эта совсем иного рода, чем весомые и зримые камни или деревья.
Но даже эту «абстрактную реальность» человек всегда пытается представить
наглядно, то есть свести ее к неболь-

тому числу проверенных образов. Такое стремление заложено в человеке очень глубоко, и поэтому у физиков постепенно развилась своя причудливая система образов, которая почти наверное ничему реальному в природе не соответствует, о ней нельзя рассказать словами, но тем не менее она помогает отыскивать связи между явлениями в моменты наивысшего напряжения мысли.
Те цепочки познания, которые мы рисовали,— от явления, через понятия и формулы, к образам — не более чем схемы, дающие довольно слабое представление о сложных процессах, происходящих в сознании ученого, когда в беспорядочном наборе фактов он пытается увидеть простые связи, определить их словами и найти им место в общей картине природы.
Отдельное слово еще не образует языка,— необходим набор слов и правила грамматики, по которым они сочетаются. Точно так же отдельный научный факт, каким бы важным он ни казался, еще ничего не означает сам по себе, если неизвестно его место в общей системе знаний, и лишь вместе со своим толкованием он получает смысл и значение.
Вспомните историю D-линии натрия. Ее наблюдал уже Фраунгофер, но разве мог он подозревать, что держит в руках ключ ко всей квантовой механике? Он видел, что D-линия расщеплена на два компонента. Но разве знал он, что это — влияние спина электрона? Электрон, квантовая механика, спин — во времена Фраунгофера эти понятия еще не были изобретены. А без них D-линия натрия — просто любопытный факт, не ведущий ни к каким глубоким следствиям. Лишь после опытов Крукса, Резерфорда, Томсона, после создания системы понятий и формул, которую назвали квантовой механикой, стало ясно, что D-линия натрия — это один из тех фактов, понимание смысла которых меняет самую основу наших представлений о природе.
Понятия возникают на основе новых фактов,— с этим согласны все. Однако не все отдают себе отчет в том, насколь-
ко смысл новых фактов зависит от понятий, которые используются для их толкования. Гармонию явлений атомного мира мы можем оценить лишь благодаря теории: всякое описание только экспериментальной установки будет безнадежно скучным и неинтересным. Теория делает картину природы не только связной, но также эстетически приемлемой. «Лишь идеи делают экспериментатора — физиком, хронолога — историком, исследователя рукописей — филологом»,— писал и говорил Планк.
Теория — это интуитивное проникновение в сущность наблюдаемых явлений. Она позволяет описать те их свойства, которые лежат по ту сторону нашего сознания и чувственного опыта, и с их помощью объяснить видимую сложность явлений их невидимой простотой. Именно эта форма мышления гением ученых, подобных Дальтону и Бору, создала современную атомистику.
Сложное переплетение фактов, понятий, формул и образов науки очень трудно, да, пожалуй, и невозможно распутать. При всех попытках подобного рода мы неизбежно придем к сакраментальному вопросу: «Что возникло раньше: яйцо или курица?» Никто никогда не узнает тот первый научный факт и то первое научное понятие, с которых началась нынешняя наука. Поэтому все чаще вместо «объяснения природы» естествоиспытатели говорят об описании природы.
«Мы теперь лучше, чем прежнее естествознание, сознаем, что не существует такого надежного исходного пункта, от которого бы шли пути во все области нашего познания, но что все познание, в известной мере, вынуждено парить над бездонной пропастью. Нам приходится всегда начинать где-то с середины и, обсуждая действительность, употреблять понятия, которые лишь постепенно приобретают определенный смысл благодаря их применению...» Эти слова Гейзенберга близки и понятны каждому физику. «Единственная загадка мира — его познаваемость»,— часто повторял Эйнштейн.
Физическая реальность — очень глубокое понятие и, как все глубокие понятия нашего языка, не имеет однозначного смысла. Это понятие первично, и его нельзя достаточно строго определить логически через более простые. Его необходимо принять, предварительно вложив в него тот смысл, который диктует нам вся наша прежняя жизнь и приобретенные в ней знания. Очевидно, с развитием науки смысл этот меняется — точно так же, как и смысл понятия «атом».
С приходом науки понятие реальности изменилось неузнаваемо, и реальность человека XX века так же далека от реальности древних греков, как современный атом от атома
/99
Демокрита Решающие штрихи в новой картине физической реальности дорисовала квантовая физика. Пожалуй, это главная причина, которая будит желание людей понять, «что такое квантовая механика». Как правило, стремление это глубже, чем естественный
профессиональный интерес. Дело в том, что при изученйи квантовой механики человек приобретает не только специальные навыки, позволяющие ему рассчитать лазер или атомный котел. Знакомство с квантовой механикой — это некоторый эмоциональный процесс, который заставляет заново пережить всю ее историю. Как всякий нелогический процесс, он строго индивидуален и оставляет неистребимые следы в сознании человека. Это абстрактное знание, приобретенное однажды, необратимо влияет на всю последующую жизнь человека — на его отношение к физике, к другим наукам и даже на его нравственные критерии. Вероятно, так же изменяет человека изучение музыки.
Прочитав предыдущие главы, вы узнали только первые ноты квантовой механики и, быть может, научились брать несколько звучных аккордов. Конечно, только музыкант вполне оценит глубину музыкального замысла, и только физик способен испытывать эстетическое удовлетворение от красоты формул и принципов, и те из вас, кто посвятит себя науке, быть может, поймут это со временем. Однако если, не вникая в «законы гармонии» квантовой механики, вы все же почувствовали красоту ее «мелодии» — задача предыдущего рассказа выполнена.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
В поисках последних понятий
На Сольвеевском конгрессе 1927 г., том самом, где квантовая механика в докладе Бора предстала как новая законченная теория атомных явлений, Лоренц говорил: «Для меня электрон является частицей, которая в каждый данный момент находится в определенной точке пространства; и если я воображаю, что эта частица в следующий момент будет находиться в другой точке, то я должен представить себе ее траекторию в виде линии в пространстве... Мне хотелось бы сохранить этот прежний научный идеал — описывать всё происходящее в мире при помощи ясных образов».
Лоренц — выдающийся голландский физик на рубеже веков — выразил общее умонастроение ученых того времени. Само по себе такое направление мыслей легко понять: всякая новая теория неизбежно должна преодолевать инерцию устоявшихся стереотипов мышления. Удивительно другое: как много великих физиков, включая и создателей квантовой механики, сомневались в ее основах и законченности. Среди них Планк, Эйнштейн, Шрёдингер, де Бройль, Лауэ, Ланде... Причем с годами их сомнения крепли — несмотря на впечатляющие успехи квантовой механики. (Вероятно, это было одной из причин, по которой Максу Борну Нобелевская премия была присуждена лишь в 1954 г.— через 28 лет после его знаменитой работы о статистической интерпретации волновой функции.)
Летом 1926 г. Эйнштейн писал Бессо: «К квантовой механике я отношусь восхищенно-недоверчиво». Уже в следующем году, на Сольвеевском конгрессе, его позиция вполне определилась и с годами становилась все более непримиримой.
31 мая 1928 г. он писал Шрёдингеру: «Философия успокоения Гейзенберга — Бора (или религия?) так тонко придумана, что предоставляет верующему до поры до времени мягкую подушку, с которой его не так легко спугнуть. Пусть спит...»
7 ноября 1944 г. он пишет Борну: «Большой первоначальный успех квантовой теории не может заставить меня поверить в лежащую в основе всего игру в кости». («Gott wurfelt nicht!» — «Бог не играет в кости!» — повторял Эйнштейн до конца жизни.)
За три года до смерти, 12 декабря 1951 г., он напишет Бессо: «Все эти пятьдесят лет бесконечных размышлений ни на йоту не приблизили меня к ответу на вопрос: что же такое кванты света? В наши дни любой мальчишка воображает, что ему это известно. Но он глубоко ошибается...» В своих сомнениях Эйнштейн был не одинок.
«Квантовую механику нельзя считать полностью завершенной»,— писал Планк в 1941 г.
Лауэ уже в начале 30-х годов считал толкование Бора основ квантовой механики «дурным паллиативом», а в апреле 1950 г. писал Эйнштейну: «Ты и Шрёдингер — единственные из известных современников, которые в этом деле являются моими единоверцами». Шрёдингер соглашался с ним, и когда ему указывали на успехи квантовой механики и ее повсеместное признание, сердился: «С каких это пор верность научного положения решается большинством голосов?» -писал он Борну в 1950 г.
Знаменательно, что все эти утверждения так или иначе содержат упоминание о вере. Эйнштейн и Шрёдингер, Планк и Лауэ — все они признавали могущество квантовой механики, но
не верили в ее завершенность, хотя все их попытки
доказать ее неполноту или противоречивость заканчивались неудачей. Их позиция требовала мужества: копенгагенская интерпретация довольно быстро стала догмой и любая попытка усомниться в ее основах могла стоить физику его профессиональной репутации. И тем не менее споры о квантовой физике продолжаются по сей день, издается даже несколько специализированных журналов, целиком посвященных проблеме интерпретации квантовой механики.
Своей ожесточенностью и непримиримостью споры эти напоминают иногда вражду религиозных сект внутри одной и той же религии. Никто из спорящих не подвергает сомнению существование бога квантовой механики, но каждый мыслит себе своего бога, и только своего. И, как всегда в религиозных спорах, логические доводы здесь бесполезны, ибо противная сторона их просто не в состоянии воспринять: существует первичный эмоциональный барьер, акт веры, о который разбиваются все неотразимые доводы оппонентов, так и не успев проникнуть в сферу сознания.
Сомнения физиков в основах квантовой механики отнюдь не способствуют укреплению доверия к ней у массы неспециалистов. Но задача истинного ученого не в том, чтобы любой ценой утвердить свои взгляды и авторитет, а в том, чтобы отыскать истину и подчиниться ей, даже если она противоречит его априорным убеждениям.
В чем суть этого нескончаемого спора? Он сродни попыткам отыскать главную истину и последнее понятие, из которых логически следуют все остальные. При всем многообразии сомнений противников ортодоксальной теории и изощренности обсуждаемых ими парадоксов суть их возражений сводится к отрицанию вероятностной интерпретации квантовой механики и принятого в ней определения «состояние физической системы».
Например, хорошо известно, что каждому радиоактивному элементу можно сопоставить характеристику — его период полураспада, то есть время, за которое распадается половина имеющихся ядер. С этим фактом согласны все — благо он легко проверяется. Однако при этом сторонники существующей квантовой механики убеждены, что период полураспада — одновременно и характеристика каждого отдельного ядра; точно так же, как 1/2 — вероятность появления герба в каждом отдельном бросании монеты. Оппоненты не согласны с этим и апеллируют к очевидности: ведь каждое индивидуальное ядро распадается хотя и в случайное, но
вполне определенное,
свое время, не совпадающее со средним временем жизни ядра, которое поэтому — не более, чем удобная фикция, не имеющая отношения к физической реальности. Им отвечают, что квантовая механика запрещает использовать понятия, соответствующие ненаблюдаемым свойствам, подобным времени жизни индивидуального ядра. Но оппоненты отказываются принять это объяснение: для них оно выглядит как насмешка над здравым смыслом.
Одно из наиболее часто дискутируемых явлений — дифракция электронов при прохождении их через два близко расположенных отверстия. Обе стороны соглашаются, что след на фотопластинке может оставить только электрон-частица. Но тогда — и это рассуждение вполне логично — он должен пройти только через одно из отверстий, то есть интерференционная картина становится невозможной, поскольку она является результатом одновременного прохождения волны через оба отверстия. Сторонники традиционной квантовой механики напоминают о дуализме волна — частица и о дополнительных типах приборов. С их точки зрения два отверстия — это прибор, выделяющий волновые свойства электрона, а фотопластинка — прибор, фиксирующий его корпускулярные свойства.
Противников такое объяснение ни в коей мере не убеждает, поскольку квантовая теория
в принципе не позволяет проследить, как же происходит этот переход от корпускулярной картины к волновой. Им объясняют, что это — чисто статистический процесс, которым управляют законы теории вероятностей. На это они отвечают словами Карла Поппера, который писал, что Гейзенберг пытается «дать причинное объяснение невозможности причинных объяснений», противопоставляют авторитет Лауэ, который отказался принять принцип неопределенности Гейзенберга, ибо «он ставит предел поискам более глубоких причин», и точку зрения Эйнштейна, который всегда настаивал, что вероятность — это наш способ представлять экспериментальные факты, а не внутреннее свойство квантовых систем.
Многочисленные оппоненты до сих пор не могут смириться с тем, что в рамках квантовой механики все вопросы об истинных характеристиках индивидуальных квантовых объектов и ненаблюдаемых явлений строго запрещены. Чтобы преодолеть этот запрет, было сделано множество попыток ввести в теорию так называемые
скрытые параметры, детально описывающие «истинные» свойства объектов, знание о которых мы потом утрачиваем, усредняя по введенным параметрам. (Такую возможность, как и сам термин «скры-
203 тые параметры», обсуждал уже Макс Борн в своей статье 1926 г.). Все эти попытки, однако, до сих пор остались бесплодными и ничем не обогатили квантовую теорию.
Спорам об интерпретации квантовой механики не видно конца: гордость человека и его вера во всемогущество разума нелегко смиряются с открытыми им же пределами знания. Не все относятся к этим спорам одинаково серьезно: «Великая армия в своем движении в неизвестное дискутирует с интересом, а порой забавляясь канителью споров о том, что такое реальность и что такое истина»,— говорил Резерфорд в 1932 г.
Характерно, что никто из оппонентов не отрицает плодотворности и истинности заключений квантовой механики в области ее применимости. Нильс Бор хорошо сознавал этот слабый пункт позиции несогласных и с присущим ему мягким юмором любил рассказывать историю о своем соседе по загородному дому в Тисвилле. У этого соседа на двери была прибита подкова. Однажды кто-то спросил его, неужели он и в самом деле верит, что она приносит в дом счастье. «Нет, конечно,— ответил сосед,— но, говорят, она помогает даже тем, кто В нее не верит».
Но — «не хлебом единым жив человек», и, пока не исчезли бескорыстные сомнения, спор этот нельзя считать законченным. Он, конечно, не изменит основ существующей теории, но, быть может, облегчит поиски новых путей и понимание вновь открываемых явлений.
«Те, кто знает истину, отличаются от тех, кому она нравится, а те, кто предпочитают ее, не всегда находят в ней удовольствие».
Китайская пословица
«Реальность предоставляет нам факты столь романтичные, что воображение бессильно добавить что-либо к ним.»
Жюль Верн
Итоги
ГЛАВА 12
Вельгельм Конрад Рентген. Анри Антуан Беккерель. Пьер и Мария Кюри. Эрнест Резерфорд и Фредерик Содди. Энергия радия.
Вокруг кванта
ГЛАВА 13
Химия радиоэлементов. Изотопы. Радиоактивное семейство урана. Стабильные изотопы. Энергия радиоактивного распада. Энергия связи ядер.
Вокруг кванта
ГЛ А В А 14
В глубь ядра. Нейтрон. Искусственная радиоактивность. Медленные нейтроны. Деление ядер.
Вокруг кванта
ГЛАВА 15
Туннельный эффект. Эффективные сечения реакций. Нейтронные сечения. Деление ядер.
Вокруг кванта
ГЛАВА 16
Цепная реакция. Ядерный реактор.
Вокруг кванта
ГЛАВА 17
Атомная энергия. Плутоний. Атомная бомба. Атомная проблема.
Вокруг кванта
ГЛАВА 18
Свет Солнца. Тигли элементов. Судьба Солнца.
Вокруг кванта
ГЛАВА 12
Василиск
Без огня не было бы человека. Того человека, который расщепил атом, достиг Луны и вычислил путь Земли среди звезд. Но уже в следующем веке огонь, который согревал человека на протяжении тысячелетий, погаснет. Оценки экспертов различаются лишь сроками: одни называют начало, другие — конец XXI века, но все они согласны в главном: запасам органического топлива на Земле приходит конец. Это — очень всерьез и надолго, хотя сегодня большая часть людей еще не успела привыкнуть к такому повороту истории.
Наша надежда и наше обозримое будущее — это атомная или, точнее, ядерная энергия. Не прошло еще и полувека с тех пор, как человек овладел энергией ядра,— по существу, все мы — современники этого события. При общей краткости человеческой жизни для нас это — редкая и неповторимая удача: со времен приручения древнего огня в истории человека не было события более важного, чем открытие «атомного огня». Поэтому овладение атомной энергией — не просто еще один эпизод в длинной череде научных открытий, это решительный перелом в развитии нашей цивилизации. Его значимость до сих пор не осмыслена не только людьми неискушенными, но даже частью интеллектуальной элиты.
Хотим мы этого или боимся — дальнейшая судьба человечества зависит от расщепленного атома: либо мы его обуздаем, либо он уничтожит нас — третьего выхода не остается. Дилемма эта вполне реальна и слишком важна, чтобы оставить ее решение на усмотрение сугубых специалистов — будь то ученые-атомщики, кадровые военные или профессиональные политики. Поэтому
каждый человек должен иметь грамотное и
свое представление о сущности физических процессов, от которых отныне зависит его жизнь»— точно так же, как он представляет себе теперь природу огня и молнии.
ВИЛЬГЕЛЬМ КОНРАД РЕНТГЕН
Как правило, рождение атомной эры связывают с грохотом первого атомного взрыва. Это неправильно: медный гром духового оркестра общепонятен и убедителен, но музыка началась не с него, а с простой мелодии и одной-единст-венной струны.
Сохранилась удивительная фотография: в комнате с большим окном у стены справа — лабораторный стол с приборами; у стены слева — высокий шкаф с препаратами, из окна в комнату льется свет, а за окном — двор и дорожка в старый парк. Это — лаборатория Вильгельма Конрада Рентгена (1845—1923) в Вюрцбургском университете. В канун рождества 1895 г. (электричества в нынешнем понимании еще нет! Радио и автомобилей — тоже нет!) в этой комнате впервые удалось заглянуть в глубь атома (о ядре еще не знают, электрон откроют через два года, понятие «квант» появится только через пять лет).
Глядя на эту фотографию, трудно поверить, что бесстрастная логика исследований всего через пятьдесят лет неумолимо приведет из этого кабинета на полигон в пустыне Аламогордо и на пепелище Хиросимы и Нагасаки. Не мог знать этого и Нобелевский комитет Шведской академии наук, но все же именно Рентгена он избрал в 1901 г. первым лауреатом Нобелевской премии. Будущее подтвердило правильность его выбора: именно с работы Рентгена началась цепь блистательных открытий, которую Резефорд назвал героическим периодом в истории физики, плоды которого мы сейчас пожинаем.
Ко времени открытия Рентгену было 50 лет, он вел размеренную жизнь немецкого профессора, отличался строгостью суждений и независимостью взглядов. Он был учеником Рудольфа Клаузиуса, а также известного немецкого физика-экспериментатора Августа Адольфа Кундта, школу которого прошли также знаменитые русские физики Петр Николаевич Лебедев и Борис Борисович Голицын. К 1895 г. Рентген был автором 50 научных работ, а его экспериментальный талант был общепризнан в среде профессионалов.
Во времена Рентгена знаменитая трубка Гейслера (трубка Плюккера, Гитторфа, Гольдштейна, трубка Крукса) была известна уже более 40 лет, с ней работали самые выдающиеся физики XIX столетия, и все же природа катодных лучей оставалась невыясненной. Трубку Крукса можно было встретить почти в любой лаборатории, и каждый исследователь менял в ней что-то, чтобы проверить очередную догадку или гипотезу. Только что, весной 1895 г., Жан Перрен собрал катодные лучи в «цилиндр Фарадея» и окончательно установил, что они заряжены отрицательно; в том же году Филипп фон Ленард выпустил их из трубки и определил длину их пробега в атмосфере,— казалось, еще немного — и природа катодных лучей будет разгадана. Их загадку обсуждали повсеместно, и Рентген также не остался к ней равнодушен: он

|
|
В Рентген
|
решил повторить
некоторые из опытов Ленарда.
Как и сотни исследователей до него, Рентген в своих опы
тах мог наблюдать красивое желто-зеленое свечение, которое возникало в месте падения катодных лучей на стенку трубки, отклонение этого пятна под действием магнитного поля и т. д. Так продолжалось до того памятного вечера 8 ноября 1895 г., когда Рентген вдруг заметил свечение полоски бумаги, покрытой флуоресцирующей солью бария, которая лежала в стороне от работающей трубки Крукса. Более того, трубка была в это время закрыта непрозрачным картонным футляром.
Рентген не оставил без внимания это случайное наблюдение: он был достаточно зрелым и опытным исследователем, чтобы сразу понять значение своего открытия. Последовало пять недель напряженного труда, в течение которых он велел приносить ему пищу в лабораторию и даже перенес туда свою кровать.
К концу декабря Рентген знал уже все основные свойства открытых им Х-лучей (так он их назвал тогда), включая их значение для медицины. (Позднее, отвечая на вопрос одного из многочисленных репортеров: «Что вы подумали, увидев вспышку флуоресцирующего экрана?» — он в присущей ему грубоватой манере скажет: «Я исследовал, а не думал».) 22 декабря 1895 г. можно считать началом флюорографии: снимок левой руки госпожи Рентген, полученный в этот день, вошел впоследствии во все книги по рентгеновским лучам. 28 декабря Рентген доложил о результатах своих исследований Физическому обществу и отправил статью с описанием свойств Х-лучей в научный журнал (она была напечатана уже 6 января 1896 г.). Кроме того, по обычаю тех лет, он написал письмо во Французскую академию наук.

Открытие Рентгена вызвало беспрецедентный и повсеместный интерес среди ученых и широкой публики: достаточно сказать, что статью Рентгена в течение нескольких недель издали пять раз отдельной брошюрой и перевели на несколько языков. Только в течение 1896 г. было опубликовано свыше 1000 научных работ и около 50 книг, посвященных изучению свойств Х-лучей, а в медицинской практике Х-лучи стали использовать уже через несколько недель. Сразу же были «открыты» Г-лучи, N-лучи, лучи Блондло и т. д.
Газеты немедленно подхватили и разнесли сенсацию, и вскоре некая английская фирма начала рекламировать нижнее белье, защищающее от Х-лучей, в сенат одного из североамериканских штатов внесли законопроект о запрещении использования Х-лучей в театральных биноклях, а самого Рентгена уже в середине января вызвали ко двору кайзера для демонстрации открытых им лучей. Публичные показы нового явления проводились повсеместно, на них ходили, как в театр, при виде человеческих костей на экране в публике случались истерики и обмороки. В мае 1896 г. знаменитый Эдисон построил в Нью-Йорке демонстрационный аппарат, который позволял каждому посетителю увидеть тень от костей своей руки. (Этот опыт окончился трагически: демонстратор Эдисона умер от тяжелых ожогов. Вероятно, и для самого Рентгена работа с Х-лучами не прошла бесследно: четверть века спустя он умрет от рака.)
Вспыхнули и споры о приоритете: на открытие рентгеновских лучей со свойственной ему агрессивностью претендовал Ленард (он умудрился до конца жизни сохранить враждебность к Рентгену), нашли даже фотографию в рентгеновских лучах, полученную в Америке за пять лет до Рентгена, вспомнили и Крукса, который жаловался на потемнение фотопластинок, лежащих вблизи работающей трубки. Но, как всегда в таких спорах, претенденты на открытие забыли, что в свое время они говорили и писали не совсем то и далеко не так, как это стало возможным после открытия Рентгена.
АНРИ АНТУАН БЕККЕРЕЛЬ
Весть об открытии таинственных Х-лучей, которые беспрепятственно проходят сквозь все предметы и даже позволяют заглянуть внутрь человеческого тела, распространилась чрезвычайно быстро. Уже 20 января 1896 г. Анри Пуанкаре зачитал письмо Рентгена на очередном заседании Французской академии, в тот раз чрезвычайно многолюдном. Член Академии Анри Антуан Беккерель (1852—1908) также присутствовал в зале, сидел в первых рядах и внимательно слушал сообщение. После прочтения письма он спросил Пуанкаре, что тот сам думает о природе Х-лучей. Пуанкаре отвечал, что, вероятнее всего, они возникают в ярком флуоресцирующем пятне, которое образуется в месте падения катодных лучей на стеклянную стенку трубки Крукса.
Люминесценция (и ее частный случай — флуоресценция) встречается в природе повсеместно: это и свечение экрана телевизора, и свет гнилушек, и мерцание светлячков южной ночью, и северное сияние в полярной ночи. Естественно, что научный интерес к ней возник по крайней мере за 300 лет до опытов Рентгена.
Для Анри Беккереля всё связанное с флуоресценцией было родным в самом точном значении этого слова: это явление изучали его отец Александр Эдмон Беккерель (1820—1891) и дед Антуан Сезар Беккерель (1788—1878), и Анри не нарушил традиции, посвятив свою жизнь его исследованию. (Впоследствии он продолжит еще одну семейную традицию: в 1908 г., незадолго до смерти, станет президентом Французской академии.)
В Музее естественной истории, профессорами которого последовательно были все Беккерели, хранилась великолепная коллекция флуоресцирующих минералов, собранная на протяжении жизни трех поколений, и уже на следующий день после заседания Академии Анри Беккерель смог приступить к своим исследованиям. (Для этого ему понадобились еще и фотопластинки, приготовление которых в то время требовало немалого искусства. Однако и здесь его выручила семейная традиция: отец много занимался использованием фотографии в астрономических исследованиях, в частности ему принадлежат первые цветные фотографии солнечного спектра.) Ход мыслей Беккереля был прост и логичен: Х-лучи возникают в флуоресцирующем пятне катодной трубки; весьма вероятно, что они каким-то образом связаны с явлением люминесценции; следовательно, надо проверить, не излу-

|
|
А. Беккерель
|
чаются ли Х-лучи минералами, обладающими свойством флуоресценции.
Идея его эксперимента была также предельно проста: надо взять фотопластинку, завернуть ее в черную бумагу, положить на нее минерал, выставить все это на солнечный свет и через некоторое время проявить фотопластинку. Если Х-лучи действительно возникают в процессе флуоресценции минерала, то они засветят фотопластинку — черная бумага для них не преграда.
Из своей богатой коллекции минералов Беккерель для задуманного опыта выбрал почему-то довольно редкую соль урана (возможно потому, что его отец посвятил много лет изучению именно этой соли, а быть может, просто по той причине, что лет 15 назад он эту соль собственноручно приготовил). А дальше все происходило именно так, как он предполагал и ждал: фотопластинку в черной бумаге с лежащей поверх нее солью урана он выставлял на балкон, держал ее там несколько часов под солнцем и после проявления фотопластинки на ней проступали очертания кристаллов соли урана.
24 февраля Беккерель доложил Французской академии о результатах своих первых опытов, которые как будто подтверждали гипотезу Пуанкаре. Доклад вызвал сочувствие и интерес слушателей, и было решено, что на следующем заседании, 2 марта, Беккерель сообщит о своих новых опытах. Как нарочно, 26 февраля испортилась погода и весь конец недели в Париже было пасмурно. Беккерель досадовал, но делать было нечего, и приготовленные для опытов фотопластинки с лежащими на них кристаллами урановой соли три дня пролежали без движения в ящике письменного стола.
В воскресенье, 1 марта 1896 г., Беккерель пришел в лабораторию. Над Парижем по-прежнему висела густая облачность. Назавтра в Академии ему предстоял доклад, а докладывать было решительно нечего. По этой ли или по какой другой причине он решил проявить хотя бы те фотопластинки, которые лежали у него в ящике стола в ожидании солнца. Трудно сомневаться в том, что Беккерель испытал счастливое волнение первооткрывателя, когда увидел на них отчетливые отпечатки кристаллов урановой соли, значительно более резкие, чем те, которые он получал при многочасовых облучениях кристаллов на солнечном свету.
Каждое большое открытие складывается из важных, часто утомительных мелочей, и лишь после того, как ощупью проделана вся подготовительная работа и планомерно изучены детали, счастливая вспышка случая может на мгновение осветить контуры целого. Но только истинный естествоиспытатель в этот краткий миг успевает правильно разгадать замысел природы. Подробности картины, внезапно открывшейся ему, дорисовать обычно несложно: с этим может справиться любой достаточно грамотный исследователь.
Впоследствии дотошные историки науки доподлинно установят, что еще за тридцать лет до Беккереля два исследователя Н. де Сен-Виктор и Л. Арнодон, наблюдали потемнение фотопластинок под действием солей урана. Однако ни они, ни три других современника Беккереля, которые поторопились сообщить о наблюдении рентгеновских лучей, излучаемых флуоресцирующими минералами, так и не стали первооткрывателями нового явления природы. Мотивы, по которым Беккерель решил проявить необлученные фотопластинки, могут быть различными, незначительными, чисто случайными, они могли прийти на ум любому из исследователей. Но не случайно то, что именно Беккерель сделал правильные выводы из неожиданных и непонятных фактов: он сознательно искал свое открытие и — главное — был к нему готов.
2 марта 1896 г. Беккерель сделал в Академии краткое сообщение о своих опытах. Еще через полгода он имел перед собой первую достаточно полную картину нового явления природы. Беккерель выяснил, что:
аналогичное действие на фотопластинку оказывают лишь те минералы из его коллекции, которые содержат уран;
действие это не зависит от вида минерала, а только от количества урана в нем;
эффект никак не связан с явлением люминесценции: чистый металл уран, не обладающий этим свойством, действует на фотопластинку точно так же (и даже сильнее), как и его флуоресцирующая соль.
23 ноября 1896 г. Беккерель доложил о результатах своих исследований Французской академии наук. Из них следовало, что уран испускает не известные ранее лучи (их быстро окрестили «урановыми» или «беккерелевыми»), которые аналогично А-лучам Рентгена действуют на фотопластинку и ионизируют воздух. Так было открыто замечательное явление природы, которое Мария Склодовская-Кюри в 1898 г. назовет
радиоактивностью.
ПЬЕР И МАРИЯ КЮРИ
О жизни Марии Склодовской-Кюри написано много замечательных книг. Еще при жизни ее избрали почетным членом 106 академий и ученых обществ, а недавние опросы показали, что и до сих пор она остается самой почитаемой женщиной мира. Жизнь эта не была богата яркими внешними событиями — она проста и строга, как чистый гармонический тон, и вся она, без остатка, отдана служению науке. Для Марии Кюри наука — не средство и даже не цель, а естественный способ существования. Недаром решение посвятить свою жизнь науке она сравнивала с уходом в монастырь.
Марии Склодовской было 24 года, когда она приехала из Польши в Париж и переступила порог Сорбонны — одно из немногих мест в тогдашнем мире, где женщина могла получить высшее образование. Здесь она встретила Пьера Кюри — человека редкого таланта и благородства, с которым связала свою жизнь и сделала свои главные научные открытия. Она родила и воспитала двух дочерей, одна из которых, Ирэн, впоследствии продолжит и умножит дело жизни своих родителей.
Весной 1896 г. Мария Кюри заканчивала обучение в Сорбонне и тщательно выбирала тему магистерской диссертации. («Выбор темы первого научного исследования — это, как первая любовь,— на всю жизнь»,— говорила она полушутя.) Как раз в это время стали известны первые результаты исследований Беккереля, среди которых ее особенно заинтересовал один: способность «урановых лучей» ионизировать воздух. Интерес этот был не случайным: незадолго до этого ее муж Пьер Кюри вместе со своим братом Жаком изобрели очень удобный и чувствительный электрометр, основанный на явлении пьезоэлектричества (открытого ими же). Работать с электрометром было много проще, чем с фотопластинками, и к тому же он позволял не просто констатировать наличие нового излучения, но и довольно точно измерять его интенсивность. Именно этот количественный подход к явлению радиоактивности позволил Марии Кюри пойти дальше других.
Вначале Мария Кюри хотела найти ответ на простые вопросы: «Только ли уран испускает новые лучи? И если да, то в чем его исключительность?» К тому времени уран был известен уже более ста лет и ничем особым среди других элементов не выделялся: металл как металл, тяжелый, серо-стального цвета, использовали его в то время редко, в основном для окрашивания стекол и керамики в желто-зеленый
214

 П. Кюри М. Кюри
П. Кюри М. Кюри
цвет. С помощью электрометра Мария Кюри терпеливо проверила на радиоактивность практически все известные в то время элементы (более 80) и вскоре обнаружила, что из них только торий также обладает этим свойством — и даже в большей степени, чем уран (одновременно с нею и независимо этот факт установил также немецкий ученый Эрхард Карл Шмидт (1865—1949)). Это был важный результат, поскольку он сразу же устранял вопрос об исключительности урана: если существует два радиоактивных элемента, то почему их не может быть больше?
После небольшого перерыва в исследованиях (она ждет ребенка), уже через два месяца после рождения Ирэн, в декабре 1897 г., Мария Кюри с новой энергией возвращается к работе. Среди многочисленных химических веществ и минералов ее особое внимание привлекла смоляная обманка из рудника близ Иоахимсталя в Чехии, из которой в то время добывали уран. Радиоактивность смоляной обманки оказалась в четыре раза выше, чем урана, в ней содержавшегося. Это было неожиданно, поскольку химические анализы показали, что торий в смоляной обманке отсутствует. Тогда Мария Кюри предположила (это была смелая, хотя и строго логичная гипотеза), что в смоляной обманке присутствует не известный ранее радиоактивный элемент в количествах, недоступных обычному химическому анализу. Если это действительно так, то его активность должна быть в тысячи раз больше, чем активность урана, который составлял около 30 % от общего веса руды.
16 декабря 1897 г. появляется первая запись Марии Кюри в лабораторном журнале. В марте 1898 г. Пьер Кюри
оставил свои работы и присоединился к ней. Уже к 12 мая 1898 г. они были уверены, что открыли новый элемент, который впоследствии получит имя «радий», что означает «луч». В июле они обнаружили в отходах руды еще один радиоактивный элемент, названный ими полонием — в память о родине Марии. Наконец, 26 декабря 1898 г. они доложили о своих результатах Французской академии наук. В то время Мария и Пьер уже могли продемонстрировать слушателям препарат радия, который был в 900 раз активнее, чем равное ему по массе количество урана.
Отныне все мысли Марии Кюри сосредоточились на одном желании: выделить радий в чистом виде. Но как это сделать? Без лаборатории, без помощников, без руды, которая к тому же стоит дорого? Однако ясно осознанное желание, как правило, осуществимо, если оно опирается на сильную волю и готовность к лишениям.
При содействии геофизика Эдуарда Зюсса, тогдашнего президента Австрийской академии наук, австрийское правительство согласилось подарить супругам Кюри тонну урановой смоляной обманки. Удалось найти подходящий сарай, куда свалили эту руду, а также другие десять тонн, которые оплатил миллионер барон Эгмон Ротшильд. Для Марии Кюри начались годы напряженной, однообразной и утомительной работы: изо дня в день, в течение многих лет растворять, выпаривать и снова растворять. Ей пришлось почти вручную переработать 11 т руды и провести только одних кристаллизаций несколько тысяч. Впоследствии Мария Кюри вспоминала: «...открытие радия было сделано в жалких условиях: сарай, в котором произошло это событие, уже овеян легендой. Но эта романтическая подробность не была преимуществом: она поглотила наши силы и замедлила осуществление открытия...»
Это была черная и тяжелая работа, в жару и холод, в старом сарае, без всяких мер предосторожности: счетчик радиоактивного излучения и сейчас продолжает угрожающе щелкать, когда к нему подносят страничку из лабораторного журнала Марии и Пьера Кюри тех лет. «Мы сознавали, что наше здоровье не на высоте, что мы подвергаем его тяжелым испытаниям. Как это случается со всеми, кто знает цену совместной жизни, нас иногда охватывал страх перед непоправимым. Тогда какое-то чувство, быть может просто храбрость, приводило Пьера неизменно к одному и тому же выводу: пусть мы будем казаться бездушными существами, нам все равно надо работать»,— писала Мария Кюри много лет спустя.
216
Оба они безвременно ушли из жизни: Пьер в 1906 г. был сбит на улице Парижа ломовым извозчиком, Мария умерла в 1934 г. от последствий радиоактивного облучения.
К 1902 г. Мария Кюри выделила из тонны руды несколько десятых долей грамма концентрированного препарата радия, еще три года спустя она имела 0,4 г чистого хлорида радия и лишь в 1910 г., через 12 лет после начала работы, исполнилась ее мечта: она увидела, наконец, серебристо-белую капельку чистого металла радия массой 0,0085 г. Но эта капелька излучала в 3 млн. раз активнее, чем такая же капелька урана.
Научный подвиг Пьера и Марии Кюри был признан во всем мире еще при их жизни: в 1903 г. они совместно с Анри Беккерелем удостоены Нобелевской премии по физике. В 1911 г., уже после смерти Пьера Кюри, Шведская академия наук присуждает Марии Кюри вторую Нобелевскую премию (по химии) — этой чести за всю историю Нобелевских премий удостоены только три исследователя.
ЭРНЕСТ РЕЗЕРФОРД И ФРЕДЕРИК СОДДИ
Приведенный ниже рисунок появился впервые в 1903 г. в докторской диссертации Марии Кюри. Теперь он вошел во все учебники мира и каждый школьник бойко объяснит, что радиоактивные вещества испускают три типа лучей, которые (с легкой руки Резерфорда) получили название а-, 0- и у-лучей.
Испускание 0-лучей еще в 1898 г. обнаружил Беккерель, позже было показано, что их свойства совпадают со свойствами катодных лучей, то есть они представляют собой поток быстрых электронов (электрон — очень кстати — был открыт в предыдущем году). Два ученый Поль Вийяр (1860—1934) компонентов «урановых лучей» являются у-лучи, свойства которых оказались подобными Х-лучам Рентгена. В январе 1899 г. Резерфорд обнаружил третий компонент — а-лучи неизвестной дотоле природы. В наше время даже школьники знают, что а-лучи — это «просто» ядра гелия, но, чтобы доказать
года спустя французский установил, что одним из
этот факт, в то время даже таким людям, как Резерфорд, Содди и Рамзай, потребовалось не менее пяти лет работы.
В нем состояла сложность задачи? Прежде всего, такого понятия, как «ядро атома», тогда еще не изобрели: оно появится только через 11 лет. И хотя электрон уже два года как был известен, само существование атомов не было в то время строго доказано: опыты Перрена будут поставлены лишь 9 лет спустя. Отголосок трудностей тех дней мы чувствуем даже сейчас, при попытке последовательно изложить историю открытий радиоактивности. В самом деле, как мы хорошо теперь знаем, все эти явления относятся к области ядерной физики, а нам приходится анализировать их, тщательно избегая употребления слова «ядро».
В год открытия радия Эрнест Резерфорд был докторантом знаменитого Дж. Дж. Томсона в лаборатории Кавендиша. Узнав об открытиях Беккереля и Кюри, он оставляет свои исследования ионизации газов и уже осенью 1898 г. завершает большую работу по изучению радиоактивности урана. Вскоре он переехал в Канаду, возглавил в Монреале кафедру физики университета Мак-Гилла и с присущими ему энергией и размахом занялся всесторонним изучением нового явления. В отличие от Марии Кюри, которая сосредоточилась на химическом выделении радия в чистом виде, Резерфорда больше всего интересовала физическая природа радиоактивности.
В чем суть явления радиоактивности? Каков ее внутренний механизм? И в чем ее истинная причина? Вот что хотел понять Резерфорд прежде всего.
Для начала он решил изучить свойства а-частиц.
Через три года напряженной работы («Шесть дней в неделю сижу в лаборатории допоздна»,— писал он невесте в Новую Зеландию) Резерфорд был уже почти уверен, что а-частицы — это не что иное, как дважды ионизованные атомы гелия. Он опирался при этом на простой и общеизвестный факт: во всех соединениях урана и тория был обнаружен гелий, причем в больших количествах. Например, из 1 г тория можно прокаливанием выделить около 10 см
3 гелия, что примерно в 100 раз превышает объем взятого тория. Гелий, который нашли на Земле за семь лет до этого (кстати, именно в минералах тория), к 1902 г. был уже хорошо изучен, и о нем было известно, что он относится к группе благородных газов и ни в какие химические реакции не вступает. Поэтому объяснить химическими причинами присутствие такого количества гелия в тории не представлялось возможным.
218
Итак, гелий образуется из радиоактивных элементов. Но что при этом происходит с самими элементами?
Вскоре после приезда в Канаду Резерфорд смог объяснить одно наблюдение своего препаратора: оказалось, что соединения тория выделяют какой-то неизвестный радиоактивный газ, который он назвал «эманацией» (дословно — «то, что выделяется»).
Годом позже Пьер и Мария Кюри наблюдали такую же эманацию радия. Дополнительные опыты показали, что это очень тяжелый газ и что он довольно быстро теряет свою радиоактивность: каждые четыре дня она уменьшается вдвое.
Это была новая загадка: к тому времени радиоактивность уже привыкли считать неизменной характеристикой элемента, примерно такой же, как его атомная масса. Что же происходит с радием? И откуда берутся теперь уже два газа — гелий и эманация радия?
Осенью 1900 г. к Резерфорду присоединился молодой и талантливый химик Фредерик Содди (1877—1956). Вскоре они доказали, что эманация радия — это инертный газ, химические свойства которого подобны свойствам всех благородных газов: гелия, неона, аргона, криптона и ксенона. (Совместно с Уильямом Рэлеем их открыл Уильям Рамзай и в 1901 г. догадался, что в таблице Д. И. Менделеева они образуют особую 8-ю группу с нулевой валентностью.)
Через два года вдохновенной работы (оба они были так молоды тогда: одному 29 лет, другому — всего 23!) Резерфорд и Содди пришли к поразительному заключению:
радиоактивность есть не что иное, как распад атома на заряженную частицу (именно ее мы воспринимаем как радиоактивное излучение)
и атом другого элемента, по своим химическим свойствам отличный от исходного. Образовавшийся при распаде атом также может оказаться радиоактивным и испытать дальнейший распад.
Это утверждение, известное теперь как гипотеза радиоактивного распада, в то время казалось неожиданным и очень смелым. Посудите сами: только в конце века начали соглашаться (да и то не все!) с тем, что атомы существуют. Но при этом никто не допускал даже мысли о том, что они могут быть изменены, а тем более распадаться самопроизвольно. Это убеждение продолжало многовековую традицию атомистов — от Демокрита до Ньютона и Максвелла, поэтому допущение о распаде атомов означало крутую ломку основных представлений о структуре
материи. Кроме того, все это очень смахивало на утверждение алхимиков о возможности превращения элементов, а говорить такое в цивилизованный век было уж и вовсе неприлично. Можно понять поэтому опасения физиков Монреаля в том, что опубликование новых идей о превращении элементов нанесет ущерб научному престижу молодого университета.
Тем не менее дело было сделано, а слово — сказано. Гипотеза радиоактивного распада, как и всякая плодотворная гипотеза, имела следствия и допускала их опытную проверку. Первую из них осуществил Содди совместно с Уильямом Рамзаем уже летом 1903 г., вскоре после возвращения из Монреаля в Лондон. Идея их опыта была предельно проста: они собирали эманацию радия, которая выделялась из имеющихся у них 50 мг бромида радия, в тонкую стеклянную трубку и, пропуская через нее электрический разряд, наблюдали характерный, ни на что другое не похожий спектр нового элемента. С течением времени, однако, этот спектр слабел, а на его месте все более отчетливо проступал спектр гелия: эманация радия распадалась на гелий и радий
А, Участники и очевидцы этого эксперимента даже много лет спустя не могли скрыть волнения, рассказывая о нем,— настолько он поразил их воображение: видеть воочию, как один элемент превращается в другой,— это для физика и химика равносильно тому, как если бы зоолог наяву увидел превращение кошки в собаку. Немного позднее «эманация радия» получит от Резерфорда свое настоящее имя — радон (символ Rn), а Рамзай проявит чудеса экспериментального искусства и, имея всего 0,1 мм
3 радона, измерит
его атомную массу: она окажется равной 222. Атомная масса радия (226) была измерена Марией Кюри в 1902 г., а атомная масса гелия (4) была определена в работах Рамзая за три года до этого. Теперь гипотезу радиоактивного распада радия по схеме
Ra--->• Rn Не

|
|
220
|
можно было проверить не только качественно, по наблюдению спектров, но и количественно. Действительно, атомная масса радия 226 = 222 + 4 оказалась в точности равной сумме атомных масс радона и гелия. После такого доказательства гипотезу радиоактивного распада можно смело переводить в ранг научной истины.
Довольно скоро установили, что все радиоактивные элементы распадаются с определенной скоростью, которая является такой же неотъемлемой характеристикой радиоэлемента, как и его атомная масса. По предложению Резерфорда, с 1900 г. эту скорость принято характеризовать периодом полураспада элемента Г1/2, то есть временем, за которое распадается половина исходного количества радиоактивного элемента. Например, период полураспада радона — 3,82 дня, радия — 1600 лет, урана — 4,5 млрд. лет.
Наконец с точки зрения гипотезы радиоактивного распада становилось понятным, почему радий всегда встречается вместе с ураном: по-видимому, он является продуктом его распада. Далее, если радий получается как продукт распада урана, радий порождает радон, последний распадается еще дальше, то должны существовать целые
радиоактивные семейства, у которых есть первый элемент (радиоактивный) и последний (стабильный). Все последующее десятилетие было посвящено поискам этих радиоактивных семейств, распутыванию последовательности распадов в них, измерению скоростей распада и т. д. К 1913 г. эта работа была в основном закончена.
Итоговая статья Резерфорда и Содди имела название «Причина и природа радиоактивности». После нее можно было сказать, что теперь природа радиоактивности надежно установлена. Однако причина, по которой атомы радиоактивных веществ самопроизвольно взрываются, эта причина станет понятной только четверть века спустя, после создания квантовой механики. И только через десять лет станет ясной природа Х-лучей, с открытия которых начались исследования радиоактивности.
ЭНЕРГИЯ РАДИЯ
Вскоре после начала своих исследований Пьер и Мария Кюри заметили, что склянки с концентратами радия светятся в темноте мягким голубоватым светом (этому свечению радий обязан своим названием). «Вот свет будущего!» — говорил Пьер Кюри своим друзьям, не подо-
22/
зревая, насколько он прав. Уже тогда понимали, что наблюдаемое свечение объясняется флуоресценцией, которую вызывает излучение радия в веществе стекла. Но в отличие от обычной флуоресценции, которая быстро затухает после облучения вещества, свечение препаратов радия без видимого ослабления длилось годами. Кроме того, соединения радия были всегда немного теплее, чем окружающие предметы. Все это означало, что радий непрерывно излучает энергию.
В начале 1903 г. Пьер Кюри и Альбер Лаборд измерили количество выделяемой теплоты: оказалось, что 1 г радия за 1 ч выделяет примерно 100 кал (по позднейшим измерениям— 135 кал), то есть теплоту, достаточную для tofo, чтобы вскипятить 1 г воды или расплавить 1 г льда. Резерфорд, измеряя ионизацию газов под действием радиоактивности, пришел к тому же заключению: радий непрерывно излучает энергию. Эта энергия очень велика: легко подсчитать, что за год 1 г радия выделяет свыше 1 млн. кал, то есть энергию, которая освобождается при сгорании 170 г угля, а при полном распаде 1 г радия выделится огромная энергия около 4 млрд, кал, то есть теплота сгорания 0,5 т угля.
Откуда радий черпает такую большую энергию? На этот вопрос ученые тщетно пытались ответить в течение четверти века. Мнения исследователей разделились: Уильям Крукс, Пьер и Мария Кюри и ряд других ученых склонялись к мысли, что атомы радия работают как трансформаторы энергии, то есть они вначале поглощают энергию волн неизвестной природы, которые пронизывают все сущее наподобие эфира, а затем переизлучают эту накопленную энергию. Другие уподобляли выбрасывание а-частиц процессу испарения молекул. Но в этом случае они должны были бы иметь различные энергии, а Уильям Брэгг в 1904 г. определенно доказал, что это не так: все а-частицы, испускаемые радием, имели одну и ту же, строго определенную энергию. Резерфорд решительно настаивал на внутриатомном происхождении энергии радия и, как показало будущее, был совершенно прав.
Споры о происхождении внутриатомной энергии носили острый, эмоциональный характер и переходили иногда принятые границы корректности в научных дискуссиях. По-види-мому, это характерная особенность таких дискуссий — начиная с проблемы «вечного двигателя». Быть может, присущий им эмоциональный накал объясняется важностью проблемы: на добывание энергии человечество всегда тратило около трети своих усилий.
ВОКРУГ КВАНТА
Рентгеновские волны

Дифракция и интерференция рентгеновских лучей были открыты в 1912 г. в Мюнхене — и это не случайно. В то время там директором Института физики был Рентген, кафедрой теоретической физики заведовал Зоммерфельд, а Лауэ работал у него приват-доцентом. Все они интересовались рентгеновскими лучами и верили в их волновую природу, правда, по-разному. Сам Рентген полагал, что он открыл продольные колебания эфира, подобные звуковым. Зоммерфельд считал, что Х-лучи возбуждаются при резком торможении электронов, и на основе этой модели даже оценил их длину волны.
В феврале 1912 г. ассистент Зоммерфельда Петер Пауль Эвальд (1888—1985), решая задачу о рассеянии световых волн на пространственной решетке, обратился за помощью к Лауэ. Ответа Лауэ не знал, но при обсуждении задачи ему пришла в голову мысль пропустить через кристалл рентгеновские лучи — мысль сама по себе не новая, поскольку многие, включая самого Рентгена, уже неоднократно этот опыт ставили. Но Лауэ не просто предлагал, он
предсказывал. Ход его рассуждений был прост и логичен: «Если рентгеновские лучи — это очень короткие волны, а кристаллы — действительно упорядоченные решетки атомов, расстояния между которыми сравнимы с длиной волны рентгеновских лучей, то при пропускании их через кристалл должна происходить их дифракция и интерференция». Однако оба эти предположения отнюдь не были в то время очевидными и казались многим (включая Планка и Зоммерфельда) «остроумной, но все-таки фантастичной комбинацией идей».
Молодые физики, узнавшие о предложении Лауэ в кафе, где они собирались по средам, были настроены менее консервативно. Один из них, ассистент Зоммерфельда Вальтер Фридрих (1883—1968), сразу же решил проверить гипотезу Лауэ. Зоммерфельд вначале не одобрил его энтузиазма (он поручил ему другую работу), но Фридрих продолжал заниматься этим вечерами, а вскоре, в апреле 1912 г., ему на помощь пришел докторант Рентгена Пауль Книппинг (1883—1935). Совместными усилиями они уже 21 апреля обнаружили явление, которое предсказывал Лауэ и которое почти два десятилетия ускользало от
223

внимания исследователей. Через две недели после получения первых фотографий Лауэ завершил теоретическую картину обнаруженного явления и 8 июня 1912 г. доложил о результатах работы Немецкому физическому обществу. В этот день он продемонстрировал те самые знаменитые лауэграммы кристаллов медного купороса, которые до сих пор неизменно воспроизводятся во всех учебниках атомной физики.
Реакция научного сообщества была мгновенной и бурной. Эйнштейн писал: «Это самое удивительное из всего, что
я когда-либо видел», Уильям и Лоуренс Брэгги немедленно
создали свой кристалл-дифракционный спектрометр для определения длин волн Х-лучей (его тут же использовал Генри Мозли в своей знаменитой работе), а Шведская академия наук уже через полтора года присудила Лауэ Нобелевскую премию — случай в ее практике чрезвычайно
редкий.
лась «настолько само собой разумеющейся», что он «ни
Эта реакция современников сейчас может показаться нам неоправданно восторженной (вспомним: Планк получил Нобелевскую премию в 1918 г., а Эйнштейн — лишь в 1921 г.), но это объясняется, по-видимому, тем, что открытие Лауэ слишком быстро перешло в разряд «очевидных». Даже самому Лауэ его идея впоследствии казакогда не мог понять удивления, которое она вызвала в мире специалистов». Не следует, однако, забывать, что эта «очевидность» того же сорта, что и «яйцо Колумба» или астрономические открытия Галилея: сотни людей до него держали в руках подзорную трубу, но никому из них не пришло в голову направить ее на небо. Точно так же в Мюнхенском университете, который в течение многих лет был центром кристаллографических исследований, во многих лабораториях можно было постоянно видеть каркасные модели кристаллов, но именно над привычным задуматься труднее всего — для этого необходим элемент гениальности.
Были и другие причины, обусловившие чрезвычайную популярность открытия Лауэ. Прежде всего, оно появилось необычайно вовремя, чтобы окончательно закрепить победу сторонников идеи реальности атомов: как раз в это время Жан Перрен завершал опыты с эмульсиями, Резерфорд предложил планетарную модель атома, а Чарльз Вильсон построил свою знаменитую камеру, позволявшую увидеть движение атомов.. Именно после этой серии открытий Вильгельм Оствальд напишет в 1913 г.: «Атомы стали видимыми!»
И последнее: Лауэ объяснил, наконец, природу открытых Рентгеном Х-лучей и уже одним этим обеспечил себе достойное место в истории физики. (Макс Планк в 1939 г. на юбилее Лауэ говорил, что 1879 г. для науки — особый: в этот год родились Эйнштейн, Ган, Лауэ и на несколько месяцев раньше их — любознательная девочка Лизе Мейт-нер...)
8 Л. И. Пономарев
ГЛАВА 13
Ба-Чжа
На рубеже двух веков идея прогресса, как представление о неограниченном поступательном движении человечества, достигла, казалось, своего полного воплощения. Именно тогда вошли в обиход людей почти все изобретения, определившие лицо нашего времени: электричество, телефон и радио, граммофон и кинематограф, автомобиль и самолет. Мировые войны, кризисы и революции — все это еще впереди, и мало кто думает об ограниченности и скором истощении богатств Земли.
Именно в то время в широкой публике пробудился всеобщий интерес к точному знанию, и для многих символом достижений науки нового времени стал радий: им восхищались, его боялись, на него возлагали надежды. Явление радиоактивности изучают во всем мире: Пьер и Мария Кюри — во Франции, Резерфорд — в Канаде, Содди, Крукс, Рамзай — в Англии, Брэгг — в Австралии, Фаянс, Ган и Мейтнер — в Германии, Швейдлер — в Австрии, Болтвуд — в Америке, Стрёмгольм и Сведберг — в Швеции, Антонов и Петров — в России... Шумный прогресс мало изменил устоявшуюся тишину научных лабораторий, а сами ученые вряд ли подозревали, что от их работы зависит судьба цивилизации: по традиции они искали истину и не задумывались о том, как она потом обернется — на благо или во зло людям.
ХИМИЯ РАДИОЭЛЕМЕНТОВ
Через 15 лет после открытия радиоактивности и через 10 лет после объяснения ее природы было исследовано уже около 30 радиоактивных элементов. Им наскоро придумали названия: уран уран Х
2, радий
А, В, С,..., вплоть до G, и т. д. — не очень задумываясь вначале, в каком отношении они находятся к обычным химическим элементам. К 1913 г. о них было известно уже довольно много:
все они распадаются за времена от миллионных долей секунды до миллиардов лет, излучая при этом а-частицы (ядра гелия), р-частицы (быстрые электроны) и у-лучи (рентгеновские лучи с очень короткой длиной волны);
при радиоактивном распаде одновременно с излучением а- и р-частиц происходит изменение химических свойств элемента;
энергия радиоактивных излучений в миллионы газ превышает энергию химических реакций;
процесс радиоактивного распада не может быть замедлен или ускорен: тепло и холод, давление и химические реакции, электрические и магнитные поля нисколько на него не влияют.
Предстояло найти ответ на три основных вопроса:
Какова химическая природа радиоэлементов? Откуда они черпают свою энергию? Что является причиной их распада?
На два последних вопроса ответят теория относительности и квантовая механика. На первый вопрос вскоре нашли ответ сами радиохимики.
Главное затруднение химиков заключалось в том, что радиоэлементы, как правило, нельзя было выделить в количествах, достаточных для проведения стандартных химических анализов. Поэтому их присутствие устанавливали по испускаемому ими характерному излучению, а между собой их различали по присущим им периодам полураспада. Постепенно произошла подмена понятий: радиоэлементом стали называть не вещество с набором характерных химических свойств, а элемент с определенным периодом полураспада. В этом проявилось изменение психологии исследователей: совсем недавно они встретили гипотезу радиоактивного распада как отрицание самой идеи неизменных химических элементов, теперь же, чтобы установить присутствие в смеси какого-либо радиоэлемента, они используют именно факт распада его атомов! При всем* остроумии и плодотворности этого метода, окончательное суждение о химической природе радиоэлемента остается за химией. Именно этим правилом руководствовалась Мария Кюри в своем стремлении выделить химически чистый радий, и, достигнув цели, она одновременно доказала, что радиоактивность никак не изменяет химических свойств элемента и, в свою очередь, не зависит от них.
Другая проблема, которая ставила в тупик радиохимиков той поры, состояла в том, что в некоторых случаях радиоэлементы, явно различающиеся между собой и периодом полураспада, и типом излучения, никак не удавалось отделить друг от друга известными химическими методами. Например, радий
D не отделялся от свинца, радий
С — от висмута, а «ионий» — от тория. И, наконец, радиоэлементов стало слишком много: казалось положительно невозможным разместить 30 элементов с различными периодами полураспада в те 12 клеток таблицы Менделеева, которые к тому времени оставались свободными.
В 1913 г. несколько исследователей одновременно подошли к решению этих загадок. В то время об атоме уже знали много больше, чем на пороге века: в 1909 г. сообщил о своих первых опытах Перрен, в том же году Милликен измерил заряд электрона, в 1911 г. Резерфорд доказал существование ядер атомов, годом позже стали известны опыты Лауэ, а в 1913 г. появились сразу: модель атома Бора, работа Мозли и гипотеза Ван ден Брука о равенстве заряда ядра его порядковому номеру в таблице Менделеева. Все это, несомненно, помогло Фредерику Содди сформулировать понятие
изотоп и тем самым завершить многолетний труд радиохимиков.
ИЗОТОПЫ
Представьте, что у вас в руках 30 монет разного достоинства: одна, две, три, пять и т. д. копеек,— рассортировать их по стопкам должным образом не составляет труда. При этом никого не смущает тот очевидный факт, что в каждой из стопок не все монеты полностью одинаковы. Например, кроме цифры 5 на пятикопеечных монетах выбит еще год их выпуска, и, весьма вероятно, у некоторых он различен. Но если мы интересуемся лишь покупательной способностью монет, то эту деталь можно не принимать во внимание.
С радиоактивными элементами нужно было поступить точно так же: разбить их на группы с одинаковыми химическими свойствами и, не обращая внимания на различие

периодов полураспада элементов, попавших в эту группу, поместить их в одну и ту же клетку таблицы Д. И. Менделеева. («Изотоп» в переводе с греческого именно это и означает: «занимающий одно и то же место».)
В наше время эта мысль может показаться попросту тривиальной. В самом деле, общеизвестно, что атом — это система, состоящая из ядра и электронов. Ядро имеет две характеристики: заряд и массу. Заряд ядра равен количеству электронов в атоме и полностью определяет химические свойства элемента. Масса ядра определяет его атомную массу и период полураспада, но никак не влияет на его химические свойства и вовсе не обязана быть одинаковой у всех ядер атомов одного и того же элемента. Поэтому не следует удивляться, если в одной клетке таблицы Д. И. Менделеева окажется несколько атомов с разной атомной массой, но — обязательно — одинаковым зарядом ядра. Такая смесь изотопов совершенно однородна и неразложима никакими химическими способами, хотя, с точки зрения радиохимика, представляет собой совокупность различных радиоэлементов с характерным для каждого из них периодом полураспада.
Обращаясь к нашей аналогии с монетами, химиков можно уподобить обычным людям — они интересуются лишь достоинством монет. Радиохимики же напоминают нумизматов, для которых наибольший интерес представляет как раз год выпуска монеты, а не их достоинство.
Глубокий смысл гипотезы об изотопах окончательно прояснится лишь в 1932 г., после того, как будет открыт нейтрон и утвердится протонно-нейтронная модель ядра. Однако следствия из этой гипотезы можно было извлечь немедленно. Прежде всего, теперь для полного определения элемента необходимо было задавать две характеристики: заряд и массу ядра, которые обычно пишут слева от символа элемента. Например, символ означает изотоп радия с зарядом ядра 88 и массой 226, символ 1Н — тяжелый изотоп водорода — дейтерий, а символ 1Не
2+ — дважды ионизированный атом гелия с массой 4, то есть попросту а-частицу.
Радиоактивный распад радия на радон и гелий можно представить теперь в виде схемы которая очень напоминает уравнения обычных химических реакций. В действительности это и есть настоящая реакция, только реакция
ядерная (наконец-то мы можем пользоваться этим термином!). В реакции а-распада масса исходного ядра уменьшается на 4 единицы, а заряд — на 2, поэтому химические свойства образовавшегося атома полностью отличны от свойств исходного, так как в таблице Менделеева он смещается на 2 клетки влево.
226 -г. ОС
88 Ra
1600 лет
222
86
Rn +*Не,
При p-распаде, согласно тогдашним представлениям, из ядра каким-то образом излучается электрон, в результате чего заряд исходного ядра увеличивается на 1 (в таблице Менделеева исходный элемент смещается на 1 клетку вправо), а его масса остается практически неизменной. Например, именно так образуется из радиоактивного висмута полоний, открытый Марией и Пьером Кюри:
210
83
Bi
Р
5 дней
210
84
Ро + е.
С помощью этих простых правил (так называемых
правил смещения Содди — Фаянса) ухалось, наконец, распутать цепочки радиоактивных превращений и каждому радиоэлементу найти свое место в периодической системе: все они спокойно уместились в семь клеток таблицы Менделеева в промежутке между свинцом и ураном. Оказалось, кроме того, что все известные в то время радиоэлементы группируются в три радиоактивных семейства: урана, тория и актиния, в которых каждый последующий элемент ряда получается из предыдущего путем излучения а- или р-частицы.
РАДИОАКТИВНОЕ СЕМЕЙСТВО УРАНА
На схеме представлено семейство урана. Не торопитесь ее перелистывать! Представьте на минуту, сколько вложено в нее труда, сколько великих судеб и счастливых открытий с нею связано! Чтобы нарисовать ее, потребовались годы изнурительной работы физиков и радиохимиков, тысячи опытов, бесконечные осаждения, экстракции, анализы — все то, о чем практически невозможно рассказать непосвященным.
С появлением этой схемы у всех радиохимиков наступило то мгновенное чувство облегчения, которое возникает на перевале после длительного восхождения. И точно так же сразу

|
| Радий 6 |
стало видно далеко по обе стороны перевала: стали понятны прежние ошибки и ясен дальнейший путь. Прежде всего, теперь исчезли все таинственные элементы — многолетний кошмар химиков (их тогдашние названия приведены снизу истинных символов элементов): уран Хг (открыт Круксом в 1900 г.), уран Х
2 (Фаянс и Геринг, 1913 г.), уран II (Гейгер и Неттол, 1912 г.), ионий (Болтвуд, 1907 г.), радий Л, В, С,
G (Резерфорд, 1904 г.),— многие из них оказались хорошо знакомыми химическими элементами: торием, висмутом, свинцом и т. д.
В цепочке превращений, представленной на схеме, присутствуют два урана, два висмута, три полония и три свинца, причем лишь последний из них
282
6РЬ стабилен. Поражает разнообразие периодов полураспада радиоэлементов: от 4,5 млрд, лет у
2ilU до 1,6«10“
4 с у
2в|Ро. Причина такого разнообразия выяснится только через 15 лет после открытия этой схемы и через 3 года после создания квантовой механики.
Теперь стало ясно также, что в любом минерале урана присутствуют одновременно все продукты его распада, то есть все 15 элементов радиоактивного семейства. Не случайно поэтому, что радий (Ra) и полоний (Ро) супруги Кюри открыли именно в урановой смолке. Более того, легко видеть, что, выделив из урановой смолки фракцию висмута, они наблюдали в ней излучение по крайней мере двух изотопов полония с атомными массами 214 и 210.
Все элементы радиоактивного семейства находятся в состоянии радиоактивного равновесия, то есть каждую секунду числа образовавшихся и распавшихся атомов каждого элемента равны между собой. Интуитивно ясно, что чем короче период полураспада элемента, тем меньше его атомов находится в смеси. Строгий расчет подтверждает это заключение и приводит к выводу, что отношение концентраций любых двух элементов радиоактивного семейства в их стационарной смеси равно отношению их периодов полураспада. Например, концентрация радия по отношению к урану равна
(1,6-10
3 лет)/(4,5-10
9 лет) =0,36-10“
6,
то есть в 1 т урана следует ожидать всего 0,36 г радия — как раз примерно столько, сколько удалось выделить Марии Кюри.
Когда и как образовался уран — об этом мы узнаем немного позднее. Но раз образовавшись, он живет и умирает по законам, которые нам теперь хорошо известны. В каком-то смысле уран даже более удивителен, чем радий. Его период полураспада огромен: 4,5 млрд. лет. Свидетель и современник рождения нашей планеты, он сохраняет в своих недрах и радий, и полоний, и еще десяток других радиоэлементов, которые без него давно бы исчезли на Земле. Ежечасно и ежесекундно он порождает их вновь и вновь — подобно древнему богу неба Урану, исторгавшему из своего чрева титанов и циклопов.
Прежде чем
2I!U превратится в
2в!РЬ, должно произойти 8 а-распадов и 6 0-распадов с разными скоростями и различной энергией излучаемых частиц, причем каждый 0-распад сопровождается также излучением у-кванта. Вот всю эту смесь и наблюдал Беккерель в своем первом опыте! Даже сегодня удивительно, что ее удалось разложить на составные части. Наверное, нечто подобное испытывал Левенгук, глядя на каплю простой воды в микроскоп.
При виде схемы превращений
2э!и трудно удержаться от мыслей об эволюции элементов, и это — не случайная
232
ассоциация. Резерфорд с юношеских лет находился под влиянием идей известного английского астрофизика Нормана Локьера, который последовательно отстаивал мысль о «неорганической эволюции» элементов, то есть о возможности их превращения друг в друга в недрах звезд. Быть может, поэтому именно Резерфорд стал автором гипотезы радиоактивного распада: для него мысль о распаде радиоактивных элементов не выглядела столь абсурдной, как для других. В дальнейшем Резерфорд сознательно будет стремиться осуществить искусственную «трансмутацию элементов» и в 1919 г., через 20 лет после начала своих занятий радиоактивностью, добьется цели.
СТАБИЛЬНЫЕ ИЗОТОПЫ
В приведенной схеме распада
2glU последний элемент ряда — стабильный изотоп свинца
2вВРЬ — обязательно должен иметь атомную массу 206; в противном случае вся эта схема распада — не более чем красивое, но умозрительное построение. Поначалу такой вывод смутил химиков: они-то хорошо знали, что атомная масса природного свинца равна 207,2. Но вскоре после появления идеи об изотопах, в том же 1913 г., американский ученый
Теодор Уильям Ричардс (1868—1928) определил атомную массу свинца, выделенную из минералов урана, и показал, что она действительно равна 206. Год спустя Фредерик Содди установил, что атомная масса свинца, образующегося при распаде тория, равна 208 — в полном согласии с предсказаниями для ториевого радиоактивного семейства. Отсюда следовал однозначный вывод: природный свинец представляет собой смесь стабильных изотопов с целочисленными атомными массами. Более того: наличие изотопов не является, по-видимому, привилегией только лишь радиоактивных элементов, но
все химические элементы представляют собой смесь изотопов с целочисленными атомными массами.
Указания на справедливость этой гипотезы получил Дж. Дж. Томсон все в том же 1913 г. в сотрудничестве с Фрэнсисом Уильямом Астоном (1877—1945). На фотографиях пучков ионов неона, полученных с помощью знаменитого «метода парабол» Томсона, они заметили, кроме изотопа неона-20, также следы изотопа неона-22. Чтобы убедиться в этом, Астон предпринял первую в истории попытку разделить изотопы неона и даже добился на этом

|
|
Ф. Астон
|
пути некоторого успеха. (Тридцать лет спустя метод газовой диффузии, использованный впервые Астоном для разделения изотопов неона, найдет применение для разделения изотопов урана. В нынешней ядерной энергетике это один из самых необходимых процессов.) Но в целом наука в то время еще не была готова к решению такой задачи, и Астон избрал другой путь: он построил
масс-спектрограф, который позволял измерять массы изотопов с точностью 0,1 %, не выделяя их предварительно из естественной смеси изотопов.
Первая мировая война надолго задержала осуществление планов Астона: лишь в 1919 г. он смог завершить свой прибор и приступить к систематическим исследованиям. Уже к концу 1920 г. Астон изучил изотопный состав 19 элементов и у 9 из них нашел изотопы. Примерно в это же время американский ученый Артур Джеффри Демпстер (1886—1950) сконструировал свой масс-спектрограф, и совокупными усилиями он и другие исследователи установили, что большинство элементов в природе (83 из 92, известных к 1940 г.) состоят из смеси 281 изотопа (сейчас известно 287 стабильных изотопов, из которых 210 открыл Астон). В 1931 г. Астон открыл изотоп урана
2g|U, а в 1935 г. Демпстер обнаружил тот самый изотоп урана
292U, с атомной массой 235, которому было суждено великое будущее. У водорода 2 стабильных изотопа, у неона — 3, у железа — 4, у ртути — 7; наибольшее число стабильных изотопов, 10, обнаружено у олова.
После открытия изотопов стали различать «простой элемент» и «смешанный элемент» (несмотря на явную несообразность этих словосочетаний). Простой элемент — это совокупность атомов с одинаковой массой и одинаковым зарядом ядра (таковым, например, является золото, состоящее из единственного стабильного изотопа ^эАи). Смешанный элемент — это естественная смесь простых элементов, однажды возникшая при образовании Солнечной системы.
«Простой» элемент или «смешанный» — для химии безразлично: она не может их различить даже с помощью самых тонких методов анализа. Тем более недоступно это

человеку с его несовершенными органами чувств. Но иногда это неосязаемое отличие становится очевидным и гибельным: оставшиеся в живых жители Хиросимы навсегда запомнят разницу между безобидным изотопом урана
2э1и и изотопом
292U, которым была начинена испепелившая их го род атомная бомба.
ЭНЕРГИЯ РАДИОАКТИВНОГО РАСПАДА
В современной науке прямолинейные попытки решения фундаментальных проблем с помощью одной логики и чистого умозрения редко приводят к успеху. Как правило, для этого необходимо всесторонне, а главное,
количественно исследовать открытое явление и установить его связь с другими явлениями природы. Так было и с проблемой происхождения энергии радиоактивного распада: ее решили лишь тогда, когда научились очень точно измерять массы изотопов и, кроме того, вспомнили формулу Эйнштейна
Е — тс2.
В первых масс-спектрографах точность измерений масс изотопов была не очень высока (погрешность около 0,1 %), хотя и достаточна, чтобы надежно установить целочисленность атомных масс изотопов — без всяких исключений. Астон не медля принялся строить новый прибор, в десять раз лучше прежнего, который бы позволял измерять массы изотопов с погрешностью 0,01 %. (В 1937 г. он снизит погрешность измерений до 0,001 %.) В 1925 г. он сообщил результаты своих новых измерений. Оказалось, что массы всех изотопов действительно очень близки к целым числам, однако все-таки немного отличаются от них.
Возросшая точность измерений привела к необходимости различать
атомную массу А, то есть массу атома в выбранных единицах, и
массовое число N, которое равно ближайшему целому от атомной массы. Прежде за единицу атомной массы традиционно принимали массу атома водорода (по-видимому, не без влияния гипотезы Праута). Теперь это стало неудобно, поскольку при таком выборе атомная масса и массовое число почти для всех элементов сильно различаются между собой (конечно, сильно — с новой точки зрения).
Вначале было решено принять за единицу атомной массы 1/16 часть массы изотопа кислорода
16О. Этим эталоном пользовались долго, вплоть до 1961 г., когда решили перейти к эталону
12С, то есть условились считать, что атомная масса изотопа
12С равна в точности его массовому . числу: А (
12С) =М(
12С) = 12,00000. Эта
атомная единица массы (сокращенно а. е. м.) принята сейчас во всем мире, а ее числовое значение известно теперь с большой точностью:
1 а. е. м. = (1г/моль)/?У
А= 1,66054 • 10
-24 г, где А^
а —6,022136• 10
23 моль
-1 — хорошо известное значение постоянной Авогадро. Со времен Астона технику измерений улучшили по крайней мере в сто раз, и сейчас мы знаем массы изотопов с относительной погрешностью 10
-7, или 0,00001 %. Например, атомная масса атома водорода 1Н (в единицах
12С) равна 1,0078250, масса тяжелого изотопа водорода — дейтерия
2Н равна 2,0141018, а масса гелия гНе равна 4,0026033. Масса электрона в этих единицах равна 0,00054858, и ее тоже надо принимать во внимание, поскольку при таких точностях измерений масса ядра и масса атома уже заметно различаются между собой.
Максимальное отклонение атомной массы
А от массового числа
N для всех изотопов не превышает нескольких тысячных долей массы изотопа. Однако эти ничтожные на первый взгляд отличия очень существенны. Достаточно сказать, что атомная электростанция работает именно благодаря им, а также потому, что знаменитая формула Эйнштейна
Е = пгс2
оказалась истинной.
И в начале века, и много позже эта формула вызывала затяжные и жестокие споры. Если не вникать в гносеологические тонкости, то ее суть можно пояснить следующим образом: в каждом теле с массой
пг запасена энергия
Е = пгс\ где
с — 3* 10
10 см/с — скорость света. Энергия эта огромна: в 1 г вещества содержится
Е=1 г* (3* 1О
1осм/с)
2 = 9» 10
20эрг = 9* 10
13 Дж,
то есть столько же, сколько в 3000 т первосортного угля (железнодорожный состав в километр длиной!). Если же масса тела уменьшится всего лишь на три десятитысячные доли грамма (маковое зернышко), выделится энергия такая же, как при сжигании 1 т угля. 0,3 мг вещества и 1 т топлива — в три миллиарда раз больше — вот масштабы ядерной энергии, к которым нам надо теперь привыкать.
Чтобы дальнейшее выглядело более понятным, проделаем несколько простых вычислений. Эти вычисления не сложнее, чем ежемесячные расчеты за электроэнергию по показаниям счетчика, и тем не менее они позволяют прикоснуться к одной из самых глубоких тайн материи.
В ядерной физике энергию принято измерять в особых единицах — в мегаэлектронвольтах (МэВ). Один мегаэлектронвольт — это один миллион электронвольт. Один электронвольт — это энергия, которую приобретает электрон, проходя разность потенциалов один вольт. Эта единица энергии связана с привычными нам единицами энергии: эргом, джоулем и калорией — с помощью соотношений
1 МэВ = 1,602 • 10“
6эрг = 1,602 • 10-
13Дж =
= 3,829-10~
14 кал. По формуле Эйнштейна
Е = тс2 теперь легко вычислить, что в одной атомной единице массы заключена энергия 931,5 МэВ, поскольку
1 а. е. м. = 1,66054-10~
24 г, £=( 1,66054-10~
24 г) • (2,9979-1О
10 см/с)
2 =
= 1,4924- 1О
-Зэрг = 931,5 МэВ.
(При вычислении этой величины лучше использовать точное значение скорости света
с = 2,99792458• 10
10 см/с.)
Сравним эту энергию с энергией, выделяемой при сгорании одного атома углерода. Как известно, в одном моле любого вещества содержится одинаковое число атомов, а именно = 10
23 моль
-1. Поскольку атомная масса
углерода по определению точно равна
А (
12С) = 12,00000, то в 1 г угля содержится
NA 04
—г.— = 0,5 • 10
23 атомов.
Л(
12С)
При полном сгорании 1 г угля выделяется 7800 кал теплоты, или 33 000 Дж, то есть на один атом приходится
энергия

|
Дж=4,2эВ. |
По сравнению с энергией, заключенной в ядре углерода (12-931,5 МэВ = 1,1 • Ю
10 эВ, то есть более 10 млрд, электронвольт), энергия сгорания угля ничтожна. Поэтому, если мы сумеем использовать хотя бы тысячную долю энергии, запасенной в ядре, мы и тогда получим ее почти в 3 миллиона раз больше, чем при сжигании угля.
Энергия атомов при комнатной температуре равна 0,04 эВ, а их скорость около 1 км/с. Энергия а-частиц, испускаемых при распаде радия, равна 4,8 МэВ, то есть в 100 миллион раз больше, а их скорость 15 000 км/с всего в 20 раз меньше скорости света. Эту огромную энергию а-частица черпает из ядра радия, и теперь, зная точные атомные массы элементов, можно легко ее вычислить.
В самом деле, атомные массы радия (Ra), радона (Rn) и гелия (Не) соответственно равны
Л
Ка =226,02544,
A Rn =222,01761,
А не =4,0026033.
Поэтому при радиоактивном распаде
2|б
Ка —
2Щ?п+^Не
масса системы уменьшается на
Д/п=Л^
а (Л
Кп 4~Лне) =0,00523 а. е. м.,
что приведет к выделению энергии
Е = 0,00523 а.е.м.-931,5 МэВ =4,88 МэВ.
Часть ее (примерно 2 %) уносит ядро радона, а остальные 4,8 МэВ — а-частица, что совпадает с экспериментом. 1 г радия за 1 с испускает 3,7-10
10 а-частиц, то есть за 1 ч распадается (3,7-Ю
10)-3600 = 1,33-10
14 атомов и при этом выделится энергия
Е= 1,3-10
14-4,8 МэВ = 6,4-10
14 МэВ = 24 кал.
Это число примерно в 4 раза меньше, чем значение, полученное впервые Кюри и Лабордом, и в 6 раз меньше, чем измеренное впоследствии значение 135 кал. Причина отличия становится понятной при взгляде на схему распада урана. Дело в том, что радий в чистом виде получить практически невозможно: в нем всегда присутствуют продукты его распада. Уже через несколько дней в препарате радия устанавливается радиоактивное равновесие всех продуктов распада
2itRa вплоть до
28°РЬ (который живет в среднем 19,4 года). В состоянии равновесия числа образующихся и распадающихся ядер каждого сорта равны между собой, поэтому каждый распад
228Ra. влечет за собой распад всех остальных членов радиоактивного семейства. Суммарная энергия, выделяющаяся при этом, равна 28 МэВ, то есть в 5,8 раза больше, чем энергия одиночного распада радия. Таким образом, через несколько дней после приготовления 1 г радия должен излучать в час 24-5,8 = 140 кал теплоты — в хорошем согласии с величиной, измеренной в эксперименте.
Мы намеренно так подробно остановились на этих простых вычислениях. После них ни у кого не должно остаться сомнений в том, что источник энергии радиоактивного распада» который тщетно искали в начале века, после работ Астона перестал быть загадкой.
Эйнштейн получил свою формулу в 1905 г. как простое следствие теории относительности. Оно было столь необычным, что физики вначале не приняли эту формулу всерьез, и в течение почти десяти лет она служила, в основном, поводом для раздумий философов да мишенью для остроумия эстрадных комиков.
Причину такого отношения к формуле
Е = тс2 легко понять: казалось, ее невозможно будет никогда проверить. В самом деле, при сжигании 1 г угля выделяется в среднем энергии Q = 7000 кал, то есть 3-10
11 эрг. Это означает, что при этом масса угля уменьшается всего лишь на
Ат
3-10
11 эрг (3-10
10 см/с)
2
3-10-
10 г.
А наилучшие аналитические весы позволяют взвешивать лишь с погрешностью 10~
8 г... (Таким образом, закон сохранения массы реагирующих веществ теперь уже нельзя считать точным, хотя вряд ли кому придет в голову упрекать Ломоносова и Лавуазье за категоричность их первоначальной формулировки.)
Когда Эйнштейн предлагал свою формулу, он понимал, что проверить ее будет непросто, и уже тогда указывал на радиоактивные превращения как на один из способов ее проверки. Однако об этом его предложении вспомнили лишь в 1913 г. Поль Ланжевен (1872—1946) во Франции и Дж. Дж. Томсон в Англии. А вспомнив однажды формулу
Е = тс2, в дальнейшем уже не составляет труда получить из нее все логические следствия.
6 августа 1945 г. в формулу Эйнштейна поверят все. В 8 ч 16 мин утра понедельника атомная бомба массой 20 кг за миллионную долю секунды уменьшится всего на 0,7 г. Энергии, заключенной в них, оказалось достаточно, чтобы уничтожить город Хиросиму и унести 70 тысяч жизней.
ЭНЕРГИЯ СВЯЗИ ЯДЕР
Как только стали известны результаты первых измерений Фрэнсиса Астона и его заключение о целочисленности атомных масс всех изотопов, тотчас же возродилась гипотеза
Праута, согласно которой все элементы е природе построены путем последовательной конденсации из атомов водорода. Правда, принять эту гипотезу окончательно мешало то обстоятельство, что заряд ядра и его массовое число не равны между собой. Но сразу же во многих местах — Резерфорд в Англии, Харкинс в США, Мэссон в Австралии — предположили, что все ядра атомов построены из протонов и некоторых других, нейтральных, частиц, которые представляют собой очень компактные системы, состоящие из протона
и электрона. Такую систему Резерфорд тогда
же, несколько поспешно, назвал «нейтроном» (настоящий нейтрон будет открыт 12 лет спустя). Оставался, однако, нерешенным один важный вопрос: какие силы удерживают протоны внутри ядра? В то время уже знали, что размеры ядер во всяком сЛучае меньше, чем 10“
12 см, а силы электрического отталкивания на таких расстояниях огромны.
Чтобы дать представление об этих силах, предположим, что нам удалось разделить электроны и протоны из 1 г водорода и разнести их на расстояние 1 км друг от друга. Даже в этом случае они будут притягиваться с неправдоподобной силой: 6-Ю
5 т, то есть полмиллиона тонн. Электрон и протон в атоме водорода удалены друг от друга в среднем на расстояние 0,5-10~
8 см, поэтому силы притяжения между ними поистине огромны. Если заменить электрон протоном, то возникнут точно такие же силы отталкивания. А если учесть, что для образования сложного ядра протоны нужно сблизить до расстояния 10
-12 см, то сразу становится ясно, что для этого нужны специальные
ядерные силы.
В 1915 г., еще до точных измерений Астона, американский физик Уильям Дрэпер Харкинс (1873—1951) предположил, что источником таких сил может служить как раз энергия, запасенная в ядре. Он предсказал, что атом гелия должен быть легче тех четырех атомов водорода, из которых он, согласно гипотезе Праута, образован. Он утверждал далее, что именно эта разница масс А/п = 4А
н —А
Не, которую он назвал «дефектом массы», обеспечивает устойчивость ядра гелия, а энергия АЕ = Ат-с
2, ей соответствующая, удерживает протоны в ядре, несмотря на силы электрического отталкивания между ними. Энергию электрического отталкивания можно оценить по известному закону Кулона:

Учитывая, что заряд протона е = 4,8-10
10 ед. СГСЭ, а среднее расстояние между протонами в ядре гелия
240
а«2-10
13 см, найдем
г (4,8.10-’° ед. СГСЭ)
2_,
t 1Л_
6
эрг = 0,7
МэВ.
~FTo^'cm ’
Это очень много, но все же меньше, чем энергия ядерного притяжения. Теперь хорошо известно, что ядро любого атома построено из
нуклонов, то есть из протонов и нейтронов, массы которых немного различаются между собой:
Шр= 1,007276 а.е.м.,
нгп = 1,008665 а.е.м.
При объединении двух протонов с двумя нейтронами возникает ядро гелия (а-частица) с массой т
а=4,001506 а. е.м., то есть дефект массы ядра гелия
Am = 2m
p + 2m
n — т
а=0,030377 а.е.м.,
а его энергия связи
Е = Ат-с
2 = 0,030377* 931,5 МэВ = 28,3 МэВ
в 40 раз больше, чем энергия электрического отталкивания протонов в ядре.
Можно ввести, наконец, некоторую среднюю характеристику прочности ядра, которую называют энергией связи
нуклона в ядре
Ei и которая равна полной энергии связи, деленной на число нуклонов в ядре. Например, для гелия Ei=28,3 МэВ/4 = 7,1 МэВ. Для более тяжелых ядер энергия связи нуклона вначале возрастает (то есть ядра становятся прочнее), достигает максимума Ei=8,5 МэВ примерно в середине таблицы Менделеева для элементов, расположенных вблизи олова, и затем вновь монотонно уменьшается до значения
Ei==7fi МэВ для ядра урана. (Для сравнения напомним, что энергия химической связи между двумя атомами водорода в молекуле равна 4,5 эВ, то есть более чем в миллион раз меньше, а для испарения молекулы воды, то есть для преодоления притяжения между молекулами, достаточно затратить всего около 0,1 эВ.)
При чтении этой главы могло сложиться впечатление, что ядерная физика — очень простая наука. В самом деле, для выяснения источников энергии радиоактивного распада и понимания причины стабильности большинства ядер достаточно знать формулу Эйнштейна
Е = тс2, значения масс изотопов и четыре правила арифметики. Однако эти простые вычисления не помогают ответить на вопрос:
почему распадаются ядра радиоактивных элементов? Ведь для того чтобы вырвать из ядра урана хотя бы один нуклон, надо затратить энергию АЕ|=7,6 МэВ, а а-частица состоит из четырех нуклонов! Так что же заставляет а-частицы покидать ядра урана, радия и других радиоэлементов, и притом с энергией в несколько мегаэлектронвольт?
Ответ на этот вопрос будет получен только в 1928 г.— через 3 года после создания квантовой механики и через 32 года после открытия радиоактивности.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
Уран
В 1789 г., в год Великой французской революции, немецкий химик и натурфилософ Мартин Генрих Клапрот (1743—1817) впервые выделил окись урана UO2. Лишь полстолетия спустя, в 1841 г., французский ученый Эжен Пе-лиго (1811 —1890) выделил уран в чистом виде. Оказалось, что это — тяжелый металл серо-стального цвета с плотностью 19,04 г/см
3 и точкой плавления 1132 °C. По виду он похож на серебро, по тяжести — на платину, по химическим свойствам — на вольфрам. Вначале ему приписывали атомную массу 120, но в 1874 г. Д. И. Менделеев исправил ее на 240. Сейчас хорошо известно, что природный уран состоит из смеси двух изотопов: на 99,28
% из урана-238 и на 0,72 % — из урана-235.
Урана в земле довольно много: в среднем в каждом грамме земной породы содержится 3«10“
6 г урана, то есть больше, чем свинца, серебра и ртути. В граните его еще больше: 25 г на каждую тонну гранита. Известно около 200 соединений и минералов урана, среди которых особое место занимает UF6 — бесцветные кристаллы, которые уже при 56,5 °C превращаются в ядовитый газ. Это — единственное известное газообразное соединение урана, и не будь его, разделить изотопы урана было бы намного сложнее.
Периоды полураспада ядер урана чрезвычайно велики: 7,1 «10
3 лет для
292U и 4,5* 10
9 лет для
292U. Кроме этих двух изотопов известны еще 12 изотопов урана, самый короткоживущий из которых
29гП имеет период полураспада 1,3 мин.
Земля и радий
Было давно известно, что при спуске в шахту температура Земли повышается примерно на 3° на каждые 100 м. Этот факт объясняли вполне естественно: когда-то Земля была раскаленным шаром, с тех пор постепенно остывает и поэтому внутри она горячее, чем снаружи. Однако, когда Уильям Кельвин в середине прошлого века вычислил время остывания, оно оказалось необычайно малым: меньше 100 млн. лет.
Этот результат немало обескуражил Чарлза Дарвина, поскольку для эволюции видов нужны громадные промежутки времени, и притом уже на остывшей Земле. (Он даже сделал соответствующие оговорки во втором издании своего знаменитого труда «Происхождение видов».) Геологи также решительно воспротивились: для объяснения наблюдаемых фактов им необходимо было по крайней мере в десять раз большее время существования остывшей Земли. Спор этот между физиками — с одной стороны, и биологами и геологами — с другой, длился довольно долго и прекратился по молчаливому обоюдному согласию ввиду его очевидной бесплодности.
Открытие радиоактивности позволило возвратиться к этой проблеме на новой основе. Было сразу же замечено, что если в каждом грамме вещества земного шара содержится хотя бы 10“
13 г радия, то этого количества вполне достаточно, чтобы поддерживать внутреннюю температуру Земли на постоянном уровне за счет тепла радиоактивного распада. Как показали дальнейшие анализы, в каждом грамме земных недр содержится 10~
6 г урана и, следовательно, 3« 10“
13 г радия, то есть даже больше, чем это необходимо. В связи с этим геологи склонны сейчас считать, что Земля вовсе не остывает, а, наоборот, разогревается изнутри благодаря энергии распада радиоактивных веществ. (Одним из первых в 1910 г. к этой мысли пришел русский ученый Алексей Петрович Соколов (1854—1928).) Общий поток теплоты от распада радиоактивных элементов на поверхности Земли равен 3*10
13 Вт, то есть примерно в три раза превышает мощность всей энергетики мира.
Что же касается действительного возраста Земли, то его можно сразу оценить, определив относительную концентрацию свинца в урановой руде. В самых древних урановых рудах примерно пятая часть урана распалась до свинца, то есть возраст этих пород никак не меньше 1 млрд. лет.
Рыцари пятого знака
«Часы, весы и масштаб — символы прогресса»,— писал Джемс Клерк Максвелл более ста лет назад. На протяжении всей книги мы неоднократно отмечали значение точных измерений в физике и ту роль, которую они играют в установлении новых законов природы. Такая работа выглядит буднично и не поражает, как правило, воображение юношества, но это — хлеб физики, без которого точные науки немыслимы^ «В наше время,— любил повторять Майкельсон,— новые законы природы можно открыть только в пятом знаке после запятой». Сам он был подлинным энтузиастом точных измерений: достаточно вспомнить измерение диаметра звезды Бетельгейзе, создание оптического эталона метра и знаменитый опыт Майкельсона — Морли, доказавший отсутствие эфирного ветра (Нобелевская премия 1907 г.).
Открытие благородных газов началось с отличия двух чисел всего в третьем знаке после запятой: в 1892 г. Джон Уильям Рэлей (1842—1919) обнаружил, что вес 1 л азота, выделенного из воздуха, равен 1,2521 г, а литр азота, выделенного из химического соединения, весит 1,2505 г. Впоследствии совместно с Уильямом Рамзаем (1852—1916) они объяснили это различие и выделили из воздуха почти все благородные газы, открыв тем самым 8-ю группу элементов таблицы Менделеева (Нобелевская премия 1904 г.).
Без точных спектроскопических измерений Ангстрема не было бы ни формулы Бальмера, ни атома Бора. Прецизионные измерения длин волн спектральных линий привели Уиллиса Юджина Лэмба (р. 1913 г.) к открытию поляризации вакуума (Нобелевская премия 1955 г.).
Именно к таким, по определению Рэлея, «рыцарям пятого знака» принадлежал и Фрэнсис Уильям Астон (Нобелевская премия 1922 г.). Четверть века посвятил он непрерывному усовершенствованию своего масс-спектрографа. Его тщательные измерения масс изотопов стали основой многих открытий: они указали на первоисточники энергии радиоактивного распада, излучения Солнца и звезд, объяснили причину стабильности ядер и позволили сразу же после открытия Гана и Штрассмана вычислить энергию деления ядер урана.
глава 14

Первая мировая война для многих ученых явилась неожиданным и тяжелым испытанием. От повсеместных успехов позитивных наук и возвышенных идей о вездесущем прогрессе Европа внезапно опустилась до уровня худших образцов средневекового варварства. В эти годы научная жизнь в лабораториях едва теплилась: Мария Кюри вместе с дочерью Ирэн налаживала рентгеновские установки в госпиталях, Луи де Бройль служил связистом, Макс Борн и Макс Лауэ воевали по другую сторону фронта, Фрэнсис Астон и Джордж Томсон работали на авиационном заводе, а Генри Мозли — погиб. Ученые впервые поняли тогда, что наука — не всегда благо и что добытое ими знание можно обернуть против людей: они могли видеть, как от изобретенных химиками ядовитых газов задыхались в окопах солдаты.
В то время многим стало ясно, что наука больше не защищена «башней из слоновой кости» и отныне ей придется жить у всех на виду, под пристальным вниманием репортеров и бизнесменов, генералов и политиков. Ученые с обостренным чувством нравственных ценностей уже тогда пытались отделить инстинкт познания от страха перед его неконтролируемыми последствиями. Тридцать лет спустя эта дилемма обернется для ученых трагедией, и многие из них вслед за Отто Ганом захотят сказать после Хиросимы и Нагасаки: «Я не имею к этому никакого отношения!»
В ГЛУБЬ ЯДРА
По окончании войны ученые стали возвращаться к прерванным исследованиям. 1919 г. навсегда войдет в историю науки: в этом году Эрнест Резерфорд впервые на Земле осуществил искусственное превращение элементов. Сама возможность таких превращений в то время уже не казалась удивительной: многочисленные примеры «трансмутации
элементов» можно было наблюдать в явлениях радиоактивности. Но именно наблюдать: тепло и холод, электрические и магнитные поля, давление и химические реакции ни на йоту не изменяли процесс радиоактивного распада. Было нечто величественное в том равнодушии, с которым природа отвергала все попытки человека нарушить ход ее естественных процессов. Можно понять поэтому тот интерес и возбуждение, с которым ученое сообщество встретило опыты Резерфорда.
В 1919 г. Эрнесту Резерфорду исполнилось 48 лет, он был лауреатом Нобелевской премии, директором знаменитой лаборатории Кавендиша, членом почти всех академий мира, признанным авторитетом в атомной и ядерной физике; королева Англии за научные заслуги пожаловала ему титул лорда, вокруг него выросла могучая школа учеников, многие из которых впоследствии сами станут нобелевскими лауреатами. Но как и двадцать лет назад, во времена своей молодости, он по-прежнему любил сидеть за микроскопом и экспериментировать с а-частицами.
В этот раз, продолжая довоенные измерения своего ассистента Марсдена, он обнаружил, что при прохождении а-частиц через обыкновенный воздух возникают какие-то новые частицы, пробеги которых значительно больше пробегов исходных а-частиц. Довольно скоро Резерфорд выяснил, что вторичные частицы — это протоны, и возникают они при столкновениях а-частиц с ядрами азота. Но как? Резерфорд допускал две возможности: либо, сталкиваясь с ядром азота, а-частица выбивает из него протон, в результате чего оно превращается в ядро углерода:
а+ ’|N--> а + ’iC + p,
либо же а-частица застревает в ядре азота и превращает его в ядро кислорода:
a + ’|N--->’
78О + р.
Шесть лет спустя сотрудник Резерфорда Патрик Мейнард Стюарт Блэккет (1897—1974) наблюдал эту
ядерную реакцию в камере Вильсона и доказал, что верна вторая схема. Это означало, что человек впервые своими руками изменил то, что, по словам Ньютона, «Бог создал" сам в первый день творения». Сбылись мечты алхимиков и юношеские надежды самого Резерфорда. «Современная алхимия» — так он назовет впоследствии свою книгу о превращениях ядер и до конца жизни сохранит удивление перед открывшимся ему миром.
246
В последующие четыре года Резерфорд совместно с Джеймсом Чэдвиком (1891 —1974) установил, что при обстреле а-частицами по крайней мере еще десяток элементов — вплоть до калия — вступают в ядерные реакции. Но на этом возможности а-частиц были исчерпаны: заряд калия равен 19, заряд а-частицы — 2, и ее энергии уже не хватало, чтобы преодолеть отталкивание ядер с зарядами, большими 20. Заряд протона вдвое меньше, поэтому в качестве снаряда для обстрела ядер он предпочтительнее а-частиц. Но где взять протоны больших энергий? Радиоактивных элементов, испускающих протоны, в природе не существует.
Тогда-то впервые и возникла идея
ускорителя протонов, которая воплотилась в металле почти десять лет спустя: в 1931 г. почти одновременно Роберт Ван де Грааф (1901 — 1967) предложил свой электростатический генератор, Эрнест Орландо Лоуренс (1901 —1958) изобрел циклотрон, а Джон Дуглас Кокрофт (1897—1967) и Эрнест Томас Синтон Уолтон (р. 1903 г.) построили каскадный генератор для ускорения протонов.
Кокрофт и Уолтон уже в 1932 г. осуществили в лаборатории Резерфорда первую ядерную реакцию, вызванную ускоренными протонами. Обстреливая мишень из лития протонами, ускоренными до энергии 0,2 МэВ, они обнаружили, что примерно один протон из миллиарда расщеплял ядро лития на две а-частицы, которые с огромной энергией по 8,5 МэВ каждая разлетались в противоположные стороны: р + Ю --> гНе + гНе.
Эта ядерная реакция стала столь же знаменитой, как и первая реакция Резерфорда по превращению азота в кислород. Сравнивая энергии в начале и в конце этой реакции (0,2 и 17 МэВ), в пору усомниться в законе сохранения энергии, если, конечно, не принимать во внимание формулу Эйнштейна
Е = пгс2. В действительности же справедливость формулы Эйнштейна была окончательно доказана именно в этой реакции. Чтобы убедиться в этом, достаточно сравнить массы частиц до и после реакции:
до реакции после реакции
гпр= 1,007276 а.е.м. т
Не= 4,001506 а.е.м.
ти =7,014359 а.е.м. т
Не =4,001506 а.е.м.
сумма: 8,021635 а.е.м. сумма: 8,003012 а.е.м.
Дефект массы Дт=0,018623 а.е.м. Выделившаяся энергия
Е=Д/п«931,5 МэВ =17,3 МэВ.
Согласитесь, что стоило проделать этот простой расчет, чтобы убедиться в справедливости одного из самых фундаментальных законов природы.
НЕЙТРОН
Нейтрон — это ключ, открывший доступ к запасам внутриядерной энергии. Теперь мы знаем о нем много: он лишен заряда, его масса
тп — 1,008665 а.е.м. незначительно — примерно на две электронных массы — превышает массу протона, его спин равен спину протона, а все ядра представляют собой плотную упаковку из смеси протонов и нейтронов. Гипотеза о протонно-нейтронной структуре ядра была выдвинута сразу же после открытия нейтрона несколькими учеными почти одновременно: советским физиком Дмитрием Дмитриевич Иваненко (р. 1904 г.), Вернером Гейзенбергом, талантливым, рано умершим итальянским ученым Этторе Майорана (1906—1938) —и с тех пор ни разу не подвергалась сомнению. И сразу же был открыт тяжелый изотоп водорода дейтерий (Гарольд Юри, 1932 г.), ядра которого представляют собой связанное состояние протона и нейтрона.
В свободном состоянии нейтрон довольно быстро, с периодом полураспада 10,7 мин, распадается на протон, электрон и электронное антинейтрино по схеме
п--> p+e + v.
В ядре нейтрон связан прочными ядерными силами и, как правило, стабилен, но иногда испытывает распад по обычной схеме, причем протон остается в ядре, а электрон и антинейтрино излучаются. Именно эти электроны мы воспринимаем как р-лучи радиоактивных элементов. Ядерные силы существенно меняют свойства нейтронов и в зависимости от типа ядра период его p-распада может быть самым разным: от сотых долей секунды до нескольких миллиардов лет.
Положительно непонятно, почему нейтрон обнаружили так поздно: Резерфорд и Харкинс предсказали его еще в 1920 г., для его открытия не нужно было* ничего, кроме привычных а-частиц, и тем не менее лишь десять лет спустя ученые напали на его след.
В 1930 г. ученик Планка Вальтер Боте (1897—1957) совместно с Г. Беккером, продолжая традицию исследований ядерных реакций, начатую в 1919 г. Резерфордом, облучали а-частицами бериллий. Однако наблюдали они при этом не протоны, а какое-то другое излучение, которое проходило
248
даже через слой свинца толщиной в 2,5 см. Они решили, что это жесткое у-излучение возбужденного ядра бериллия, и на этом успокоились.
Два года спустя Ирэн и Фредерик Жолио-Кюри продолжили исследования природы нового излучения. Направив его на мишень из парафина, они сразу же обнаружили протоны, которые с большой энергией вылетали из мишени, и на этом основании они решили, что открыли «новый способ взаимодействия излучения с материей», посредством которого «у-кванты» Боте и Беккера весьма эффективно выбивают не только протоны из атомов водорода, входящих в состав парафина, но даже ядра углерода.
Джеймс Чэдвик долгое время работал в лаборатории Резерфорда, который осенью 1920 г. пригласил его продолжить с ним эксперименты по искусственному превращению элементов. Подсчитывать сцинтилляции приходилось в темноте, и во время этих длинных и утомительных сеансов Резерфорд подробно развивал перед Чэдвиком свои представления о нейтроне и его возможной роли в структуре ядра. Впоследствии Чэдвик даже предпринял несколько попыток обнаружить нейтрон. Они оказались неудачными, но не напрасными и, в сущности, подготовили его к открытию: узнав об опытах Жолио-Кюри, он уже через месяц понял, что Боте и Беккер наблюдали ядерную реакцию превращения бериллия в углерод с испусканием нейтрона:
а4-4Ве--->-
1бС + п,
а супруги Жолио-Кюри — просто отдачу протонов при столкновении с нейтронами, подобную той, которую каждый многократно наблюдал при соударении бильярдных шаров.
До изумления просто, не так ли? Настолько просто, что это открытие Чэдвика три года спустя, в 1935 г., будет отмечено Нобелевской премией. Но почему все-таки ни Жолио-Кюри, ни Боте не додумались до столь простой мысли?
При анализе подобных ситуаций, которые в истории науки встречаются не так уж редко, следует проявлять известную осторожность. Дело в том, что отчетливая формулировка кардинального открытия, противоречащего общепринятым взглядам, причем такая, которая не оставляет места для отступления в случае ошибки, сопряжена для любого ученого со своеобразным профессиональным риском. И чем именитее ученый, тем опаснее для него ошибка такого рода. Быть может, это одна из причин, по которой часто именно молодые совершают истинно революционные открытия, хотя постановку проблем и пути их решения готовит для них, как правило, предыдущее поколение. (Энрико Ферми любил повторять, что проблемы решаются аспирантами, задача руководителей — сформулировать их.) Таких примеров в истории физики — множество: достаточно вспомнить теорию относительности, атом Бора, матричную механику, спин электрона и многое другое. Как и всякий эмпирический факт, это правило не следует абсолютизировать: Рентген, Планк, Резерфорд, Шрёдингер, Борн и сам Чэдвик сделали свои главные открытия в зрелые годы.
ИСКУССТВЕННАЯ РАДИОАКТИВНОСТЬ
Можно понять огорчение Ирэн и Фредерика Жолио-Кюри, когда они узнали об открытии Чэдвика. Но они были истинные ученые: радость научного поиска, а не уколы самолюбия направляли их действия, и они с новым энтузиазмом продолжили свои исследования. Их усилия вскоре увенчались успехом: они открыли
искусственную радиоактивность.
В начале 1934 г. они облучали а-частицами алюминий и, как прежде, наблюдали излучение с большой проникающей способностью. Теперь им уже было ясно, что происходит ядер-ная реакция
а + НА1 >?
5°Р + п,
то есть при захвате а-частицы ядром алюминия излучается нейтрон и образуется ядро одного из изотопов фосфора. Но дальше опять начиналось непонятное: облученный алюминий испускал не только нейтроны, но и
позитроны, частицы с массой электрона, но заряженные положительно. Их существование предсказал Поль Дирак в 1928 г., но в это мало кто верил, пока Карл Дэвид Андерсон (р. 1905 г.) не открыл их в 1932 г. в космических лучах, почти одновременно с доказательством реальности нейтрона.
Факт излучения позитронов можно было понять, допустив, например, существование 0-распада протона на нейтрон, позитрон и нейтрино:
Р --»-n+e
+ + v,
который вполне аналогичен реакции 0-распада нейтрона, но протекает в обратном направлении. Такое допущение может показаться неправдоподобным: хорошо известно, что ядра атомов водорода стабильны, иначе водород уже давно бы исчез на Земле. Однако устойчив лишь свободный протон,

|
|
И. Жолио-Кюри
|

|
|
Ф, Жолио-Кюри
|
а останется ли он стабильным при включении его в состав любого ядра — за это нельзя поручиться заранее: мы ведь знаем, что скорость распада нейтрона в ядре отличается от скорости распада свободного нейтрона, он может при этом стать даже стабильным.
Одним словом, сам факт излучения позитронов был хотя и непривычным, но его удавалось как-то истолковать. Непонятно было другое: когда убирали источник а-частиц, поток нейтронов прекращался сразу же, а излучение позитронов продолжалось, причем оно подчинялось хорошо известным законам радиоактивного распада с периодом полураспада 2,5 мин. Почему? Откуда? При взгляде на схему ядерной реакции выбора не остается: позитроны должны излучаться ядрами образовавшегося изотопа фосфора:
зор --30Si + e++v
В результате этого радиактивного распада образуется редкий изотоп кремния, содержание которого в природном кремнии составляет примерно 3 %. Но фосфор, из которого он образуется, в природе отсутствует. Этот новый, искусственно полученный изотоп супруги Жолио-Кюри назовут впоследствии
радиофосфором — после того, как докажут, что по химическим свойствам он идентичен элементу фосфору.
Какими бы убедительными ни были аргументы физиков, какие бы схемы ядерных реакций они ни писали, химик все равно им не поверит, пока ему не дадут
химического доказательства образования новых элементов при ядерных превращениях. Но как это сделать? Для обычного химического анализа необходимо иметь хотя бы микрокрупинку вещества, по крайней мере не меньше чем 10~
8 г, то есть примерно 10
14 атомов. А при облучении алюминия а-частицами за разумное время может образоваться в лучшем случае несколько миллионов, то есть 10
6 атомов. Однако если атомы фосфора — не простые, а радиоактивные, то химические доказательства его образования получить все-таки можно, используя так называемую «реакцию с носителем». Ее идея проста и остроумна: вначале к раствору, где химики подозревают наличие радиофосфора, приближают счетчик Гейгера — Мюллера, который сразу же начинает трещать, отзываясь даже на ничтожные примеси атомов радиофосфора. Затем в этот раствор добавляют большое количество обычного фосфора и после осаждают его с помощью подходящего реактива. Вместе с добавленным фосфором в осадок выпадает и подозреваемый радиофосфор. Дальнейшее просто: к осадку и к оставшемуся раствору поочередно приближают счетчик Гейгера, и если вблизи осадка он щелкает, а в растворе — молчит, значит, действительно в исходном растворе был радиофосфор, который затем полностью перешел в осадок. Вот так примерно и было получено первое химическое доказательство искусственного превращения элементов в процессе ядерных реакций.
Радиофосфор 15Р — первый радиоактивный изотоп, несуществующий в природе и все же полученный человеком. Потом их получат множество — свыше тысячи. Пройдет всего 11 лет, и в пустыне Аламогордо взорвется первая атомная бомба, начиненная несколькими килограммами изотопа плутония
294Ри, которого еще за 5 лет до этого в природе не существовало.
Открытие Ирэн и Фредерика Жолио-Кюри немедленно удостоили Нобелевской премии за 1935 г.— настолько всем очевидна была его важность. Мария Кюри не дожила до этого дня: она умерла осенью 1934 г. Но перед смертью она все же успела прикоснуться обожженными радием пальцами к пробирке с радиофосфором и услышать щелканье счетчика Гейгера — Мюллера. Ирэн и Фредерика постигнет та же участь: оба они умрут от последствий радиоактивного облучения. Но прежде им еще предстоит пережить фашистское нашествие и построить первый атомный реактор во Франции.
МЕДЛЕННЫЕ НЕЙТРОНЫ
Великому итальянскому физику Энрико Ферми в истории атомной энергии принадлежит исключительная роль. Принято считать его теоретиком, однако Нобелевскую премию он получил за работу по экспериментальной физике, а Нацио-
нальная академия в Риме присудила ему почетную медаль за работы по химии... Любая из научных специализаций была для него узка, он был
естествоиспытателем в самом точном и широком смысле этого слова. Такая универсальность — качество в XX веке чрезвычайно редкое — оказалась совершенно необходимой при решении проблемы атомной энергии, где каждый шаг был — в неизвестность.

Ферми был одним из первых, кто сразу же понял, что нейтрон — это идеальное средство для исследования
ядерных реакций и простейший способ получения новых радиоизотопов. Главное отличие и преимущество нейтрона — его электронейтральность, которая позволяет ему беспрепятственно проникать в ядра любых, даже самых тяжелых элементов.
Летом 1934 г. группа молодых итальянских физиков, из которых самому младшему — Бруно Понтекорво — было 20, а самому старшему — Ферми — всего 33, увлеченно экспериментировала. Их приборы были просты: радон-бериллиевый источник нейтронов и счетчики Гейгера — Мюллера. Постановка задачи предельно ясная: облучить различные элементы нейтронами и посмотреть, что при этом происходит. Поле деятельности обширное — вся периодическая система элементов, а сил и энтузиазма — не занимать: впоследствии понадобилось написать более десяти статей, чтобы описать свойства нескольких десятков новых радиоизотопов, которые они при этом получили.
Когда нейтрон поглощается каким-либо ядром /X с зарядом Z и массовым числом N, оно превращается в изотоп
N + zX, который в свою очередь стремится избавиться от лишнего нейтрона. Самый простой путь — превратить нейтрон в протон, испустив при этом электрон и антинейтрино. При таком
^-распаде ядра образуется ядро нового элемента Y с зарядом ядра Z + 1 и массовым числом N+ 1, то есть происходит последовательность ядерных реакций:
n + N
X —. n+i
x _Д n + >Y
+e
+ v-.
Несмотря на внешнее сходство, этот процесс получения искусственных изотопов сильно отличается от схемы Жолио-Кюри, которую можно представить в следующем
253
виде:



В обоих случаях из элемента с зарядом ядра Z образуется элемент Y с зарядом ядра Z+1, но изотопы при этом получаются разные: в опытах Ферми — с массовым числом N-j-1, а в опытах Жолио-Кюри — с N+3. И, конечно, если у Жолио-Кюри облученная а-частицами мишень испускала позитроны, то у Ферми та же мишень, облученная нейтронами, испускала электроны.
Например, при облучении алюминия у Жолио-Кюри получалось:

а у Ферми:


(Земная кора на 28 % состоит из смеси изотопов кремния; из них uSi составляет 92,2 %, ilSi — 4,7 % и i2Si — 3,1 %.)
Достаточно очевидно, что способ Ферми получения новых изотопов предпочтительнее: он проще и универсальнее. В короткое время «мальчики» Ферми облучили 68 элементов и в 47 из них наблюдали искусственную радиоактивность, то есть синтезировали сразу полсотни новых изотопов.

Но главное их открытие состояло не в этом: 22 октября 1934 г. они вдруг с удивлением обнаружили, что нейтроны в сотни раз эффективнее захватываются ядрами атомов, если между мишенью и источником нейтронов поместить кусок парафина либо же опустить мишень под воду (благо, во дворе института в Риме был бассейн с золотыми рыбками). Их удивление длилось целых два часа — до тех пор, пока Ферми с присущим ему изяществом не набросал контуры нового физического явления. Суть его объяснения проста. Молекулы воды НгО состоят из кислорода и водорода, а масса нейтрона практически равна массе протона. Поэто-
му при столкновениях нейтрона с ядрами водорода он быстро замедляется — в десятки раз быстрее, чем при столкновении с тяжелыми ядрами,— а после этого легко вступает в ядер-ные реакции.
Удивление обычно является следствием столкновения неожиданных фактов с инерцией мышления. За много лет физики привыкли к мысли, что ядро — это хоть и неосязаемое, но весьма прочное нечто, и чтобы его изменить, необходимо как можно сильнее разогнать снаряд — будь то а-частица или протон. Для этой цели изобрели даже ускорители. А для нейтрона все оказалось строго наоборот: чем медленнее он двигался, тем охотнее поглощался ядрами. Причин тому две: во-первых, он не отталкивается, а притягивается ядрами, и, во-вторых, он подчиняется законам квантовой механики.
Открытие ядерных реакций, вызванных замедленными нейтронами, не выглядит столь эффектно, как открытие самого нейтрона или искусственной радиоактивности, однако именно ему суждено было великое будущее: без него нельзя ни запустить ядерный реактор, ни понять принцип его работы.
Участники этого исторического эксперимента безошибочно почувствовали его значительность: в тот же вечер 22 октября 1934 г. они-собрались на квартире Ферми и глубокой ночью закончили статью под названием «Влияние водородосодержащих веществ на радиоактивность, наведенную нейтронами». В 1938 г. «за открытие искусственной радиоактивности, вызванной бомбардировкой медленными нейтронами», Энрико Ферми был удостоен Нобелевской премии.
ДЕЛЕНИЕ ЯДЕР
Среди множества элементов, которые «папа Ферми» (такой же непогрешимый в науке, как папа римский в вопросах веры) со своими «мальчиками» облучил медленными нейтронами в то памятное лето 1934 г., был и уран. Подобно большинству других элементов, после облучения нейтронами он становился p-активным, то есть испускал электроны. Это-то и было особенно интересным: ведь уран в то время занимал последнее место в таблице Д. И. Менделеева. Заряд его ядра равен 92, поэтому если ядро урана захватит нейтрон и затем испустит электрон, то его заряд увеличится на единицу, а уран превратится в следующий за ураном «трансурановый элемент» согласно схеме реакции
n+
292U ---►
292U --->
293X-f-e4-V.
Из опытов Ферми такой вывод следовал настолько естественно, что даже без детальной его проверки он сразу же стал научной сенсацией и достоянием газет. В этом согласном хоре раздавались, однако, и критические голоса, о которых вспомнили лишь несколько лет спустя: немецкие радиохимики супруги Ида и Вальтер Ноддак, открывшие элемент рений, уже в 1934 г. допускали, что Ферми видел не образование трансурановых элементов, а осколки ядра урана. Но большинство радиохимиков еще не были готовы к таким радикальным заключениям и принялись искать «трансурановые» элементы.
Немецкий радиохимик Отто Ган (1879—1968), ученик Рамзая и Резерфорда, в течение многих лет терпеливо и тщательно распутывал цепочки радиоактивных превращений, открыл элемент протактиний и изомерию ядер. В 1937 г. совместно с Лизе Мейтнер (1878—1968) и Фрицем Штрассма-ном (1902—1980) он решил повторить опыты Ферми по облучению урана нейтронами. Он наблюдал при этом обычную p-активность с периодом полураспада 23 мин, и, поскольку эту активность никак не удавалось отделить от урана, они согласились с Ферми, что это действительно p-распад
292U с превращением его в новый неизвестный элемент
2эзХ. Но в отличие от Ферми они были профессиональными химиками и, прежде чем объявить о своем открытии, хотели найти химические доказательства образования нового элемента. Последовала новая серия экспериментов, которая летом 1938 г. была прервана: Лизе Мейтнер, спасаясь от преследований нацистов, эмигрировала в Швецию.
Осенью 1938 г. Ган и Штрассман возобновили опыты, используя при этом все тот же метод «реакций с носителем». Облучив уран нейтронами, они его растворяли, добавляли в раствор соли бария и затем осаждали барий. Оказалось, что вместе с барием в осадок выпадает и p-активное вещество. Ган и Штрассман решили, что это радий-231, который мог бы образоваться из
29гП путем двух последовательных а-распа-дов и который по своим химическим свойствам весьма похож на барий. Но что-то мешало им немедленно сообщить об этом заключении, да к тому же в аналогичных опытах Ирэн Кюри и Павле Савича происходило тоже нечто непонятное: они как будто наблюдали лантан. В конце концов, после бесконечных проверок, Ган и Штрассман убедились, что их p-активность от радия отделить можно, но отделить ее от бария никакими силами не удается. За этот результат Отто Ган, радиохимик с тридцатилетним стажем, мог поручиться. И все же сомнения оставались, и в своей статье Ган и Штрасс-
ман честно в них признавались: «Как химики мы должны заменить символы Ra, Ас и Th в нашей прежней схеме на Ba, La и Се. Как «химики-ядерщики», в определенном смысле близкие физике, мы еще не можем решиться на этот шаг, противоречащий всем прежним представлениям ядерной физики».
Нам трудно понять сейчас их недоумение: уже в школе мы знаем, что ядро урана делится, и не находим в этом ничего странного. Попытаемся, однако, взглянуть на это явление глазами первооткрывателей и если не понять, то хотя бы почувствовать корень их сомнений. Прежде всего, они — химики, и химический элемент для них — некая чрезвычайно устойчивая индивидуальность, которая остается невредимой, пройдя через жар и холод, бесконечные растворения, кристаллизации и бурные химические реакции. Лишь недавно они с большим трудом привыкли к тому, что иногда, в процессе радиоактивного распада ядер, один элемент может превратиться в другой. Но самое большее, чего можно было в этом случае добиться,— это передвинуть элемент в таблице Менделеева на одну, максимум на две клетки. Но ведь порядковый номер бария равен 56 — почти вдвое меньше порядкового номера урана! И если поверить в то, что барий действительно образуется из урана, придется допустить, что элементы по таблице Менделеева можно перемещать, как вздумается,— ни один химик с этим смириться не может.
22 декабря 1938 г. Ган и Штрассман направили в печать статью с описанием своих опытов. Накануне Отто Ган написал письмо Лизе Мейтнер, в котором поделился своими сомнениями,— с ней его связывали 30 лет дружбы, работы и совместных открытий. Она получила письмо незадолго до рождественских каникул, которые намеревалась провести в отеле небольшого городка Кунгалв близ Гётеборга. Там навестил ее племянник Отто Роберт Фриш (1904—1979), тоже физик, эмигрировавший в Копенгаген и работавший в то время в институте Нильса Бора. Сообща они довольно быстро поняли, что Ган и Штрассман наблюдали развал ядра урана при захвате им нейтрона (чуть позже они по предложению биолога Уильяма Арнольда ввели общепринятый теперь термин
деление ядра — по аналогии с делением клетки, точно так же, как за четверть века до них Резерфорд ввел понятие «ядро атома» по аналогии с ядром клетки). Но— самое главное — они тут же поняли, что при таком делении должна выделяться огромная энергия. После работ Астона было известно, что энергия связи на один нуклон в ядре урана равна 7,6 МэВ, а для ядер элементов, расположенных
9 Л. И. Пономарев
257 в середине таблицы Менделеева,— значительно больше — 8,5 МэВ. Чем больше энергия связи ядра, тем оно прочнее и тем больше его дефект массы, то есть разность между массой ядра и массой составляющих его нуклонов, и тем большая энергия выделяется при образовании ядра. Поэтому при делении ядра урана с атомным весом 235 должна освобождаться энергия
Д£=(8,5 —7,6) МэВ-235^200 МэВ,
то есть почти в пять раз больше, чем во всей цепочке радиоактивного распада — от урана до свинца. Теперь мы уже знаем, что это действительно огромная энергия, и можем понять волнение Фриша и Мейтнер, когда они впервые на клочке бумаги проделали этот простенький подсчет: из него следовало, что при делении ядер, заключенных в 1 г урана, выделяется энергия, равная 8-1O
10 Дж, то есть теплота, запасенная в 3 т угля.
По возвращении в Копенгаген Фриш успел рассказать все эти новости Нильсу Бору чуть ли не на пристани у трапа парохода, увозившего Бора на несколько месяцев в Америку, а сам немедленно принялся готовить эксперимент по проверке гипотезы о делении ядер урана. Во второй половине дня
13 января Фриш начал свой эксперимент, к 6 часам утра
14 января убедился в том, что гипотеза о делении ядер урана правильна, а 16 января он уже отослал в редакцию журнала «Nature» статью с изложением результатов экспериментов.
С этого момента события вошли в стремительный и крутой поворот, и счет времени идет не на годы и месяцы, а на недели и дни. Но это уже другая история, и, чтобы в полной мере понять смысл составляющих ее событий, нам необходимо предварительно усвоить несколько простых следствий основных принципов квантовой механики.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
Письма о делении
Поздно вечером в понедельник 19 декабря 1938 г., за два дня до отправки статьи в печать, Отто Ган пишет Лизе Мейтнер: «Весь день я и неутомимый Штрассман, при поддержке Либер и Бонне, работали с продуктами урана. Сейчас как раз 11 часов вечера; в четверть двенадцатого хотел вернуться Штрассман, так что я могу собираться домой. Что-то все-таки есть в этих «изотопах радия», причем такое редкое,
258

что мы пока сообщаем только тебе... Они отделяются от
всех элементов, кроме бария... Хотя еще нельзя исключить случайного стечения обстоятельств, мы все же все более приходим к ужасному заключению: наши изотопы радия ведут себя не как радий, а как барий... Я договорился со Штрассманом, что мы пока скажем это только тебе. Может быть, ты сможешь предложить какое-нибудь фантастическое объяснение. Мы, конечно, знаем, что не может произойти распад в барий, но хотим еще проверить, не имеет ли возникающий из «радия» изотоп актиния свойств лантана, а не актиния... Не верится, чтобы мы так долго заблуждались...»
21 декабря 1938 г., Мейтнер — Гану: «Ваши результаты с радием ошеломляют. Процесс, обусловленный медленными нейтронами и приводящий к барию!.. Признать такой необычный распад, мне кажется, пока очень трудно, но мы пережили в ядерной физике столько неожиданностей, что уже ни о чем нельзя сказать прямо: это невозможно...»
21 декабря 1938 г., Ган — Мейтнер: «Со вчерашнего дня мы суммируем наши доказательства о барии — радии... На их основе, как «химики», мы должны сделать заключение, что три хорошо изученных нами изотопа являются не радием, но, с точки зрения химика, барием... Актиний, возникающий из изотопов, вовсе не актиний, но, скорее всего, излучающий лантан!!»
22 декабря 1938 г. статья Гана и Штрассмана поступила в редакцию журнала. В ней они писали: «Кроме того, мы должны сказать о некоторых новых исследованиях, результаты которых из-за их странности мы сообщаем лишь с колебанием... Мы приходим к заключению: наши «изотопы радия» имеют свойства бария. Как химики, мы, собственно, должны сказать, что новое вещество — не радий, а барий; о других элементах не может быть и речи».
28 декабря 1938 г., Ган — Мейтнер: «Я хочу поскорее сообщить тебе еще кое-что о моих бариевых догадках: может, Отто-Роберт сейчас у тебя в Кунгалве и вы сможете обсудить это... Вот моя новая догадка: если бы было возможно урану-239 расщепиться на барий и мазурий, 138 + 101 дали бы 239!.. Возможно ли это энергетически? Я этого не знаю; я знаю только, что наш радий обладает свсйствами бария...»

29 декабря 1938 г., Мейтнер — Гану: «Ваши результаты с радием — барием очень интересны. Отто-Роберт и я уже сломали себе головы».
1 января 1939 г., Мейтнер — Гану, после прочтения рукописи статьи Гана и Штрассмана: «Может быть, это энергетически и возможно расщепиться тяжелому ядру».
3 января 1939 г., Мейтнер — Гану: «Теперь я почти убеждена, открыли распад в барий, и считаю это действительно прекрасным результатом, с которым сердечно поздравляю тебя и Штрассмана...»
5 января 1939 г., Ган — Мейтнер: «Сегодня я больше не уверен, даже снова боюсь за барий; не радий ли это все-таки? Никак не могу поверить в это».
6 января 1939 г. вышел номер журнала «Naturwissen-schaften» со статьей Гана и Штрассмана «О доказательстве существования и свойствах щелочноземельных металлов, возникающих при облучении урана нейтронами».
10 января 1939 г., Фриш — Гану: «Я накопил уже столько аргументов против трансуранов, что мне трудно согласиться с их оживлением».
16 января 1939 г. в редакцию журнала «Nature» направлены две статьи: «Физическое доказательство деления тяжелых ядер при бомбардировке их нейтронами» Отто Фриша и «Расщепление урана нейтронами: новый тип ядер-ной реакции» Мейтнер и Фриша.
22 января 1939 г., Ган — Мейтнер (после получения рукописей статей Фриша и Мейтнер): «...выходит, все наши трудоемкие опыты после убедительного опыта Отто-Роберта не нужны...»
25 января 1939 г., Мейтнер — Гану: «Вовсе не «нужны», без вашего прекрасного результата о барии вместо радия мы никогда бы не пришли к этому...»
26 января 1939 г., Мейтнер — Гану: «Все сделанное вами в последнее время мне представляется фантастическим. Добрая половина периодической системы встречается среди этих осколков урана...»
Упорное нежелание Гана признать неоспоримые факты, полученные им самим же, кроме объективной сложности явления деления, имело еще и психологические основания.
260
Прежде всего, было нелегко признаться самому себе, что трехлетний напряженный труд по поиску трансурановых элементов (круглосуточное — в три
смены — дежурство у счетчиков) оказался напрасным. Кроме того, признавая это публично, он невольно ставил в ложное положение Лизе Мейтнер, поскольку опровергал результаты их совместных работ, но уже без нее. И, наконец, непросто было признать и частичную правоту Ирэн Жолио-Кюри с ее «лантаноподобным веществом», которое в Берлине называли не иначе, как «кюрьозий». И все же научная честность и профессиональная добросовестность победили...
ГЛАВА 15
|
Таурт
|

|
Книга, написанная иероглифами, вызывает у большинства людей лишь поверхностный интерес или легкое недоумение: неужели без них нельзя обойтись? И почему японцы (или китайцы) до сих пор не перешли на буквенное письмо? Однако для специалиста-востоковеда, а тем более для жителей Японии и Китая иероглифы — это не просто средство передачи информации, они хранители истории и культуры народа. В них непостижимым образом уместились не только понятия, им соответствующие, но также история их возникновения и даже отношение к ним людей: бывают «плохие» и «счастливые» иероглифы, и существуют целые картины, состоящие из одного-единственного иероглифа. Понятно, что словами содержание такой картины можно пересказать лишь приблизительно.
Природу «атомного огня» удается объяснить только на языке квантовых понятий. Чтобы однозначно закрепить их смысл, изобретена система символов, которые чем-то сродни иероглифам. Несколько таких иероглифов мы уже знаем. Например, при виде символа волновой функции ф у нас в сознании возникает целая совокупность образов и ассоциаций: от бесформенной волны-частицы до строгих рядов формул, ее представляющих. Теперь нам предстоит усвоить еще по крайней мере три «квантовых иероглифа»:
туннельный эффект, сечение реакции, квантовый резонанс. Без них дальнейшее изложение если и не лишено интереса, то в значительной мере бесполезно.
ТУННЕЛЬНЫЙ ЭФФЕКТ
Явление радиоактивности открыл Анри Беккерель в 1896 г. Шесть лет спустя, в 1902 г., Резерфорд и Содди объяснили его суть: самопроизвольный распад ядер, при котором выделяется огромная энергия. Об истинном источнике этой энергии стали догадываться в 1913 г., но лишь десять лет спустя, после работ Астона, гипотеза о внутриядерном происхождении энергии вылетающих а-частиц была надежно доказана.
К этому времени Резерфорд осуществил искусственную трансмутацию элементов, и все постепенно привыкли к мысли, что ядро, так же как и атом, имеет сложное строение.
И хотя о внутренней структуре ядра знали по-прежнему мало, никто не сомневался в том, что а-частицы вылетают
из ядер. Однако это знание, или, точнее, убеждение, мало что проясняло. По-прежнему оставалось непонятным:
Почему а-частицы вылетают из ядра? (Ведь они там так прочно связаны!)
Чем объяснить моноэнергетичность вылетающих а-частиц?
От чего зависят периоды полураспада ядер и почему они столь различны?
Чем определяется время и место распада ядер?
В 1928 г., через 3 года после создания квантовой механики и через 32 года после открытия явления радиоактивности, на эти вопросы ответили почти одновременно русский физик Георгий Антонович Гамов (1904—1968) и американские ученые Рональд Уилфрид Герни (1899—1953) и Эдвард Кондон (1902—1974). Их идея отличалась простотой и смелостью: они предположили, что движение а-частицы в ядре, подобно движению электронов в атоме, подчиняется уравнению Шрёдингера
Многое в этом уравнении нам уже знакомо:
И — это постоянная Планка, деленная на 2л,
т — масса а-частицы,
Е — ее энергия, ф = ф(х) —волновая функция, описывающая движение а-частицы в потенциальном поле
V (х) на расстоянии
х от центра ядра. Надо честно признаться, что и сегодня, несмотря на все успехи ядерной физики, истинная природа ядерных сил, а потому и точная форма потенциала V(x) неизвестна. Мы знаем только, что ядерные силы — притягивающие, короткодействующие и очень мощные: они в десятки раз превышают силы кулоновского отталкивания между а-частицей и ядром, однако простираются лишь на расстояния 10~
13—10“
12 см, то есть в десятки и сотни тысяч раз меньшие, чем размеры атомов.
Общий вид потенциала Г(х) изображен на рисунке. Вне ядра а-частица отталкивается кулоновским полем
V(х) = = 2Ze
2/x ядра
Z. На границе ядра, при х = го, отталкивание

циал
V(х): не правда ли, это
сменяется притяжением, а-частицы движутся в узкой и глубокой
потенциальной яме и от внешнего мира отделены
потенциальным барьером. Оказалось, что даже этих знаний о потенциале У(х) достаточно, чтобы понять основные закономерности а-распада ядер.
Взгляните еще раз на рисунок, изображающий потен-<оже на вулкан в разрезе? Да и само явление радиоактивности чем-то сродни извержению вулкана: а-частицы внутри ядра можно уподобить магме, которая кипит в жерле вулкана и выплескивается из него наружу в моменты извержений. Однако в отличие от магмы а-частицы подчиняются квантовым законам, и потому их энергия
Е «квантована», то есть может принимать лишь дискретный набор значений
Е\, Еъ, ..., Еп. Поэтому в жерле «квантового вулкана» они могут находиться лишь на определенной высоте. Если а-частица движется ниже линии горизонта (Е
л<0), то самопроизвольное испускание а-частиц невозможно, ядро стабильно, вулкан потух. Если же
EnZ> О, то есть энергия а-частицы превышает энергию ядра, из которого удалена а-частица, то а-распад энергетически выгоден и, как мы сейчас увидим, неизбежен.
Глубоко в жерле вулкана магма кипит постоянно, однако настоящее извержение начинается лишь тогда, когда магма поднимается до кратера вулкана и начинает переливаться через край. В отличие от магмы (и в согласии с законами квантовой механики!) а-частица может «просочиться» из «ядерной ямы» через «потенциальный барьер» наружу даже в том случае, если ее энергия недостаточна, чтобы его преодолеть. Это типично квантовое явление получило название
туннельного эффекта, и понятно почему: представьте, что в боковой стенке вулкана пробит туннель — ясно, что в этом случае магма начнет изливаться через него задолго до начала извержения вулкана.
Просочившись сквозь потенциальный барьер, а-частица с огромной силой отталкивается кулоновским полем ядра и, скатываясь по «склону вулкана», приобретает у его «подножия» как раз ту кинетическую энергию
Еп, которой она обладала в скрытом виде до а-распада. Тогда мы наблюдаем ее как след в камере Вильсона или как вспышку в спинтарископе Крукса. Конечно, эти вспышки не столь эффектны и зрелищны, как дымящийся Везувий, однако мы вскоре убедимся, что а-частицы — лишь тихие вестники ядерных катастроф, а «извержение ядра» — намного более страшная картина, чем вид раскаленной лавы.
В квантовой механике нет, вероятно, ни одного явления, которое бы пытались объяснить «для пешеходов» чаще, чем туннельный эффект. Для пущей наглядности просили представить себе автомобиль, который исчезает из запертого гаража, человека, который проходит сквозь стену тюрьмы, и т. д. и т. п. Такой способ объяснения, однако, не проясняет специфику явления и, кроме того, неверен по существу: попытка рассказать о самой сути квантовых явлений без использования основных понятий квантовой физики не может быть успешной — даже при условии искренности побуждений и серьезности намерений.
Туннельный эффект — это прежде всего следствие корпускулярно-волнового дуализма квантовых объектов. Конечно, аналогии для него в классической физике найти можно, но искать их надо не в явлениях движения частиц (и автомобилей), а в явлениях распространения и дифракции волн. Свойство любого излучения огибать препятствие, то есть проникать в область геометрической тени, хорошо известно. Особенно отчетливо оно проявляется в том случае, если длина волны излучения сравнима с размерами препятствия. Например, сантиметровые волны, которые используют для передачи телевизионных изображений, не могут обогнуть гору, поэтому приходится строить ретрансляционные станции. Таких проблем не возникает с радиоволнами, длина которых может достигать нескольких сот метров: они свободно огибают все неровности земной поверхности.
Еще пример. Всем хорошо знакомо явление полного внутреннего отражения: если луч света, распространяясь, скажем, в стекле, падает на границу раздела с воздухом под углом, большим некоего критического угла 0
кр, то он полностью от нее отражается. Если к этому куску стекла плотно прижать снизу другой такой же кусок стекла, то луч света распространяется прямолинейно, не замечая условной границы раздела. А что произойдет, если эти куски стекла немного раздвинуть?
Прежде всего, что значит «немного»? Например, на толщину волоса — это много или мало? С точки зрения геометрической оптики этот вопрос не имеет смысла, он некорректно поставлен: «немного» — по сравнению с чем? В волновой оптике он вполне осмыслен, поскольку в этом случае

существует естественный масштаб — длина волны. Например, для видимого света (длина волны Х«500 нм=5‘10~
5 см) толщина волоса (примерно 10“
2 см) —это много, а для тепловых лучей (Х«0,1 см) — мало. Когда ширина зазора
d сравнима с длиной волны X излучения, часть этого излучения все-таки проникает через воздушный зазор из первого куска стекла во второй, и тем ус-
d. Явление это хорошо изучено, явление — наиболее близкий аналог туннельного эффекта в квантовой физике.
пешнее, чем меньше зазор
его можно довольно легко наблюдать. Именно это оптическое
Корпускулярные свойства а-частиц (импульс, масса, заряд) особенно хорошо заметны вне ядра, например при движении их в камере Вильсона. Внутри ядра преобладают (то есть более заметны) волновые свойства а-частиц: частота и длина волны. Ясно, что длина волны а-частиц в ядре не может превышать размеров ядра: см, а их скорости движения примерно в сто раз меньше скорости света, поэтому частота их колебаний внутри ядра
v — v/K достигает значений v«4-10
20 с~
1. Наталкиваясь на стенки потенциального барьера, волны а-частиц, как правило, испытывают «полное внутреннее отражение», но иногда, с ничтожной вероятностью, все же проникают сквозь барьер — точно так же, как проникает свет через воздушный зазор, разделяющий два куска стекла. Чем больше энергия а-частиц в ядре, тем меньше ширина потенциального барьера, который ей необходимо преодолеть, и тем с большей вероятностью мы можем обнаружить ее вне ядра.
Вероятность проникновения а-частицы через потенциальный барьер равна
су = |-ф(Г1)1
2л;ехр V2m[V(x) — £]
dx^ .
Л)
Тем, кто далек от математики, это выражение, вероятно, покажется слишком сложным. В действительности же оно немедленно следует из уравнения Шрёдингера. А если учесть, что с его помощью удается понять практически все особенности а-распада, то следует признать его даже слишком простым. Эта вероятность чрезвычайно мала: цапример, для ядра радия она составляет лишь w«3,3* 10~
32, но она все же не равна нулю, и это принципиально отличает квантовые объекты (а-частицы) от классических (магма). Каждую секунду а-частица подходит к стенке барьера v«4-10
2° раз и каждый раз с вероятностью w«3,3-10~
32 может покинуть ядро, то есть каждое ядро радия каждую секунду может распасться с вероятностью
A =v • w= 1,4* 10~
п с
-1.
Следовательно, среднее время жизни ядра радия т=1/Л = = 7,4-10
1° с «2300 лет, а период полураспада радия 7
1/2==0,7т = 1600 лет. В одном грамме радия содержится
Na=A =6-1О
23/226=2,7-1О
21 ядер радия, и каждую секунду из них распадается
(2,7-10
21) - (1,4-10-
11) =3,7- Ю
10 ядер.
Именно это число радиоактивных распадов в секунду условились принять за единицу радиоактивности и назвали ее
кюри — в память о выдающемся вкладе семьи Кюри в науку о радиоактивности.
Теперь, наконец, мы можем ответить на все вопросы о природе, причине и законах радиоактивности, которые мы задали в начале этой главы.
Почему а-частицы вылетают из ядра? Потому, что радиоактивные ядра нестабильны по своей природе, они, как и люди, уже в момент своего рождения обречены на смерть.
Чем объясняется моноэнергетичностъ вылетающих а-частиц? а-частица в ядре имеет строго определенную квантованную энергию, с которой она и движется, покинув ядро.
От чего зависит период полураспада ядер? Он определяется, в основном, энергией а-частиц: чем больше эта энергия, тем уже барьер, который ей необходимо преодолеть, тем больше вероятность просочиться сквозь него и тем меньше время жизни радиоактивного ядра. Зависимость эта очень сильная: при изменении энергии а-частиц всего в полтора раза их период полурапада изменяется в миллиарды раз (для урана-238 £
л=4,2 МэВ, 7\/2=4,5*10
9 лет, для радия-226 £
я=4,8 МэВ, Т
1/2 = 1,в*1О
3 лет, для радона-222 (эманация радия) £«=5,5 МэВ, 7
1/2 = 3,8 дня, для полония-218
Еп— =6,0 МэВ, 71/2=3 мин, а для полония-214 £
й=7,7 МэВ, 71/2 = 1,6-10"
4 с). Зависимость между периодом полураспада ядер и энергией испускаемых а-частиц, известная как закон Гейгера — Нэттола, была обнаружена еще в 1909 г., но лишь 20 лет спустя получила удовлетворительное объяснение.
Чем определяется время и место распада радиоактивных ядер? Законами случая. Ядро — это микрообъёкт, подчиняющийся законам квантовой механики, поэтому при его описании понятие вероятности является основным. Можно достоверно предсказать среднее время жизни ядра и сколько в среднем ядер из большого их числа распадется в секунду. Но момент распада каждого отдельного ядра предсказать нельзя. Это — некорректно поставленный вопрос. Среднее время жизни ядра радия-226 т = 2300 лет, но это совсем не означает, что ядро радия, которое только что образовалось при распаде тория-230, проживет именно столько: с равной вероятностью оно может распасться и в следующую секунду, и через миллион лет. Радиоактивные ядра можно уподобить людям, больным неизлечимой болезнью: рано или поздно они умирают. Однако в отличие от людей, смертность которых с возрастом увеличивается, радиоактивные ядра не стареют: вероятность их распада не зависит от времени, которое они «прожили» к моменту распада.
На эту особенность радиоактивных явлений обратил внимание еще в 1905 г. австрийский физик Эгон Швейдлер (1873—1948). По существу, это было первое свидетельство о квантовом характере внутриядерных процессов, хотя глубокий смысл наблюдения Швейдлера стал ясным только четверть века спустя.
Оглядываясь назад, трудно удержаться от мысли, что а-распад — значительно более простое явление, чем извержение вулкана, и лишь предрассудок о заведомой трудности и непонятности квантовой механики мешает признать это сразу. В самом деле, никому еще не удалось предвидеть, когда проснется вулкан и сколько камней он при этом выбросит. А свойства а-распада мы можем предсказать вполне надежно.
Объяснение радиоактивности, столь просто и естественно следующее из основных представлений квантовой механики, произвело на современников исключительное впечатление. Снежный ком противоречивых гипотез и безнадежных вопросов, скопившихся за 30 лет вокруг явления радиоактивности, неожиданно распался. Резерфорд и Мария Кюри дожили до этого времени и могли видеть, как новое знание осветило путь, впервые пройденный ими ощупью, и объяснило смысл их гиганской работы, проделанной много лет назад со страстью и энтузиазмом юности.
С работы Гамова, Гёрни и Кондона берет начало современная ядерная физика. Именно они заставили поверить, что квантовая механика — это не узкоспециальная наука о строе-
268
нии атомов и молекул (вначале ее так и называли: атомная механика), а наука о всех явлениях атомной и ядерной физики. (По прихоти судьбы Эдвард Кондон родился в том самом году, когда Резерфорд и Содди впервые поняли природу радиоактивности, в местечке Аламогордо на краю той самой пустыни, где 43 года спустя взметнется пламя первого атомного взрыва.)
ЭФФЕКТИВНЫЕ СЕЧЕНИЯ РЕАКЦИИ
Мы хорошо представляем теперь, как а-частицы вылетают
из радиоактивного ядра., Сталкиваясь с ядрами других элементов, они могут вызвать ядерную реакцию, то есть проникнуть
внутрь ядра. Квантовая механика позволяет вычислить вероятность и таких процессов. Например, она может объяснить, почему только одна а-частица из 300 000 вызывает знаменитую реакцию Резерфорда
a + "N —>•
17О + р.
Чтобы привыкнуть к терминам, которые при этом используются, полезно на время освободиться от гипноза слова «квантовый» и рассмотреть более простой процесс. Представьте себе увеличенную модель кристалла, подобную изображенной на рисунке (в каждой школе такая наверняка найдется). Пусть в каждом кубическом сантиметре такого «кристалла» содержится
по «ядер» с радиусом го, длина «кристалла» равна /, площадь его торца — S, и мы в этот торец стреляем из дробовика, причем скорость дробинок равна
v. Площадь поперечного сечения одного «ядра» оо = лго, а площадь сечения всех «ядер» в объеме «кристалла» равна
gqHoSI, то есть произведению оо на общее число ядер
rioSl в объеме кристалла
SL Пролетая через кристалл, дробинка попадет в любое из ядер с вероятностью
ЛГо*
ItoSl .
------=аоМо/,
которая равна отношению суммарной площади
gqHqSI геометрического сечения всех «ядер» в объеме «кристалла» к площади 3 его торца. Вероятность попадания в единицу времени после этого легко вычислить, поделив полученную величину на время
t = l/v пролета дробинок через кристалл, то есть
вероятность попадания в единицу времени
^w^o0uno.
269

Таким образом: если каждую секунду со скоростью и (см/с) через площадь в 1 см
2 пролетает одна дробинка, то е вероятностью
w== —воспо она попадет в одно из «ядер».
Эта очень важная формула справедлива и в квантовой механике, только под оо там надо понимать не геометрическое сечение ядра о
0 = лго, а некоторое другое, «эффективное сечение», которое может быть как меньше, так и больше геометрического,— в зависимости от вида реакции, которую мы изучаем. Нанример, если мы интересуемся только теми столкновениями дробинок с «ядрами», при которых последние раскалываются, то ясно, что число таких столкновений всегда меньше, чем число простых попадании.
Это уменьшение можно учесть е помощью некоторого коэффициента
w?, после чего прежняя формула примет вид
W = W fGQVrio — Gvn^.
Величину
Q = WfOo называют
эффективным сечением реакции. При желании его можно представить себе наглядно, как некую «работающую» часть геометрического сечения ядер. Полезнее, однако, помнить его истинный физический смысл: эффективное сечение или просто сечение — это мера вероятности ядерной реакции, которую оно характеризует.
В ядерной физике сечения принято измерять в специальных единицах
барнах-.
1 барн = 1 б==10“
24 см
2
Барн — это английское слово «Ьагп», то есть «амбар». Очевидная несообразность этого термина объясняется историей его происхождения. Во время войны все работы по делению урана в Америке были строго засекречены. Поэтому даже в секретных отчетах писали не
2э1и или
29?Ри, а элемент-25 и элемент-49 — по последним цифрам атомного номера и массового числа элементов. Точно так же значения сечений ядерных процессов сообщали в засекреченных единицах площади — «барнах». «Потому что,— объясняли физики, предложившие этот термин,— в ядерной физике сечение 10“
24 см
2 — такая же большая величина, как амбар в обычной жизни». Но, несмотря на грустную анекдотичность своего происхождения, термин этот прижился. За единицу измерения сечений барн выбран, конечно, не столь случайно, как
170
слово для его обозначения. Радиусы ядер меняются от го = = 0,13» 10“
12 см (для водорода) до го=О,8»1О“
12 см (для урана), и, следовательно, их геометрические сечения о
0= = лг
2 заключены в пределах от 0,05 до 2,1 барн, то есть соизмеримы с выбранной единицей сечения.
До сих пор мы молчаливо предполагали, что эффективные сечения реакций не зависят от энергии налетающих частиц. Можно подозревать, что это — очень грубое допущение, и опыт подтверждает наше сомнение. В действительности эффективные сечения очень прихотливо зависят от энергии столкновений, а для разных реакций могут различаться в десятки, тысячи и миллионы раз. Одна из заслуг квантовой механики состоит как раз в том, что она дает способ вычислить эти сечения и тем самым определить относительную вероятность различных ядерных реакций. Из формул квантовой механики следует также, что эффективное сечение упругого рассеяния ядер не равно их геометрическому сечению. Это — важное утверждение, и мы к нему еще вернемся.
НЕЙТРОННЫЕ СЕЧЕНИЯ
Судьбу атомной энергии решили эффективные сечения взаимодействия нейтронов с ядрами, или, коротко,
нейтронные сечения. В этом утверждении нет преувеличения ради эффекта: действительно, от ошибки в их определении зависели иногда судьбы целых народов. В 1939 г. Германия приняла решение о производстве атомной бомбы. Для осуществления этой цели, как мы вскоре узнаем, необходимо было знать сечение поглощения нейтронов ядрами углерода. Его измерение поручили нобелевскому лауреату Вальтеру Боте, чьи эксперименты в свое время немало способствовали открытию нейтрона.
И он ошибся. В десять раз (и вряд ли намеренно, как хотелось бы думать впоследствии многим). В результате было принято решение строить атомный котел на тяжелой воде, которую приходилось ввозить из Норвегии, где завод, ее производивший, вскоре взорвали патриоты... Судьба германского уранового проекта была тем самым предрешена.
В отличие от а-частиц нейтрон лишен электрического заряда и всегда притягивается короткодействующими ядер-ными силами. Поэтому с точки зрения нейтрона ядро — это не вулкан, а воронка, которую он может с ходу проскочить, а может и застрять в ней. В рамках этой аналогии легко поверить, что быстрому нейтрону «ядерную воронку» проскочить легче, чем медленному. Это и в самом деле верно: для
271
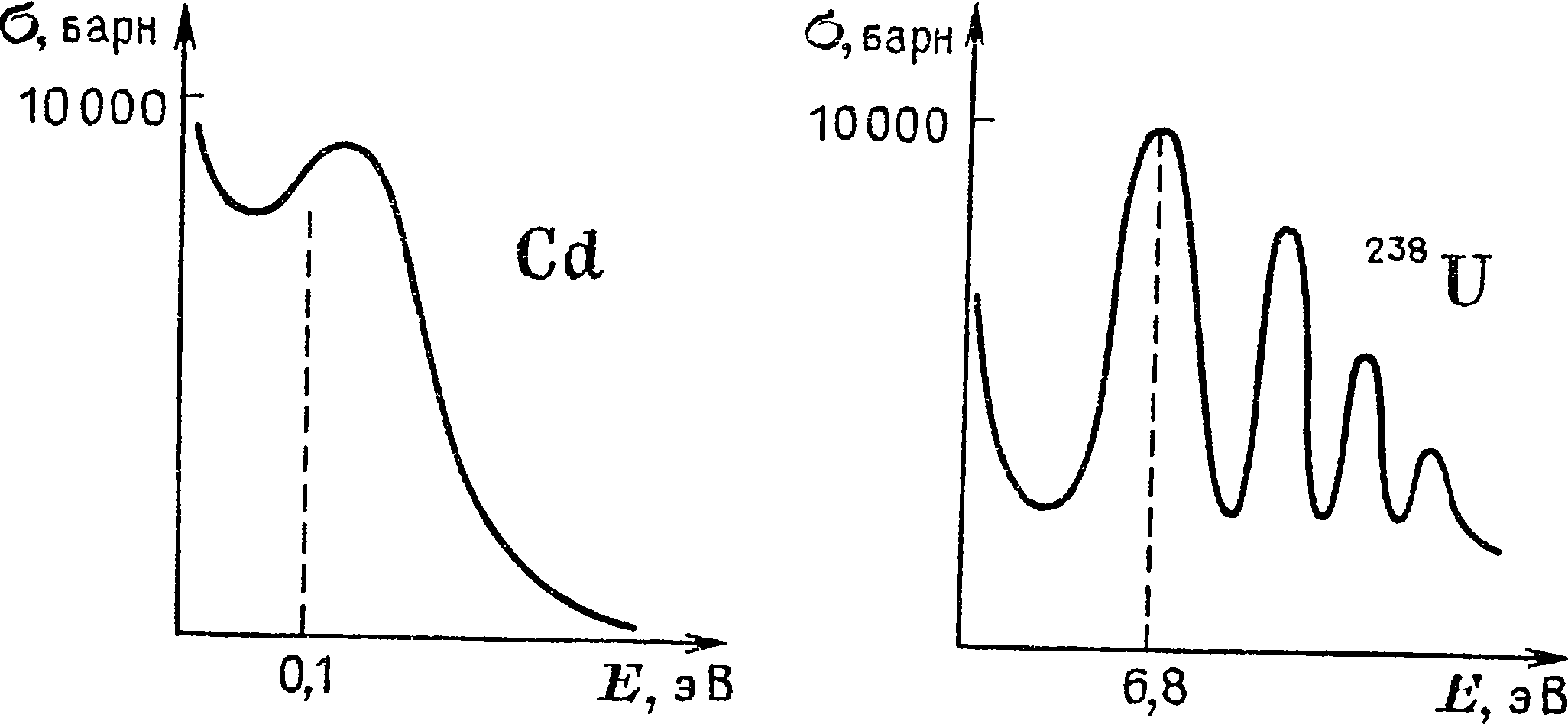
нейтронов с энергией 1 МэВ или больше сечения ядерных реакций примерно совпадают с геометрическими сечениями ядер; однако при меньших энергиях столкновения эффективные сечения ведут себя весьма причудливо.
На рисунке приведены сечения поглощения нейтронов ядрами кадмия и урана. При малых энергиях
(Е< 100 эВ) они очень велики: 10 000 барн и более. Такие всплески называют
резонансами в сечениях реакций. Кроме того, глядя на графики, можно заметить, что при очень малых энергиях нейтронов
E<z\ эВ (их называют тепловыми, поскольку средняя энергия движения атомов при комнатной температуре 7° = 20°С равна примерно 0,04 эВ) сечения начинают резко и монотонно возрастать. Чтобы понять все эти особенности нейтронных сечений, необходимо вновь вспомнить о квантовой природе ядерных реакций и, в частности, о волновых свойствах нейтрона.
Уже в 1936 г., через четыре года после открытия нейтрона, Вальтер Эльзассер (еще до создания квантовой механики он указал на волны де Бройля как на причину аномалий в опытах Джермера) предсказал, что нейтрону, как и электрону, должны быть присущи волновые свойства. В том же году .Петер Прейсверк (1907—1972) и Ханс Халбан (1908—1964) в Институте радия в Париже подтвердили экспериментально его предсказание. Масса нейтрона /и
п = 1,67-Ю
-24 г, при энергии 1 эВ его скорость
v = 1,4 • 10
6 см/с, а соответствующую длину волны легко вычислить по формуле де Бройля:

|
|
ти
|
6,67 • 10
27 эрг - с
= 2,8-10-
9 см.
(1,67-10
-24 г) - (1,4-10
6 см/с)
Если, как обычно, за «радиус» квантовой частицы принять величину го“А,/2л, то при энергии 1 эВ «радиус нейтрона» '*о~4-10“
10 см, то есть в 500 раз превышает радиус ядра урана.
До сих пор мы явно и неявно предполагали, что нейтрон меньше ядра. Мы уподобляли его, например, дробинке, которая налетает на бильярдный шар. Это казалось нам настолько естественным, что мы принимали такую картину без
обсуждений и, как теперь понятно, без всяких к тому оснований. Если «снаряд» больше «мишени», то естественно их поменять местами и считать, что ядро налетает на нейтрон, «геометрическое сечение» которого о
0 = лго при энергии 1 эВ равно 1,5-10
5 барн, то есть 150 000 барн. Как правило, нейтронные сечения о меньше <т
0, но иногда, а именно при
резонансных энергиях, эффективные сечения реакций нейтронов достигают своего верхнего предела о
0, а на графиках сечений при этих энергиях видны характерные максимумы —
резонансы.
Причину появления резонансов в сечениях поглощения нейтронов ядрами довольно легко понять. Предположим, что нейтрон сталкивается с ядром
29®и и захватывается им. При этом выделяется энергия связи нейтрона в ядре, равная приближенно 7,6 МэВ, и образуется новый изотоп урана
292U. Ядро, как и атом,— сложная квантовая система, энергия которой принимает разные, но всегда определенные
квантованные значения. Поэтому она может перейти из одного состояния в другое, только поглотив вполне определенную порцию (квант) энергии.
Вспомните знаменитый опыт Франка и Герца: они облучали атомы ртути электронами, но атомы не поглощали эту энергию до тех пор, пока она была недостаточной, чтобы возбудить атом. Но когда энергия электронов достигала значения 4,9 эВ, вероятность возбуждения атомов резко возрастала, или, как мы говорим теперь, в сечении возбуждения атомов ртути электронным ударом при энергии 4,9 эВ наблюдался резонанс.
Точно так же при облучении урана нейтронами реакция
n+TsU-► W,
в результате которой образуется ядро нового изотопа урана в возбужденном состоянии, происходит с большой вероятностью (имеет большое сечение) только при некоторых,
резонансных энергиях. Таких резонансов в сечении может быть довольно много, например в сечении поглощения нейтронов ядрами урана-238 наблюдается восемь резонансов в интервале энергий нейтронов от 5 до 200 эВ.
Образовавшийся изотоп урана немедленно переходит в основное состояние, испуская у-квант, то есть в действительности реакция протекает по схеме
п + T
2U--->
2i
92U*--->
2f
2U + у.
Это— наиболее частая реакция, так называемая (п, у)-реакция, которая впоследствии, при постройке атомного котла, доставит много хлопот.
При энергиях
Ес 1 эВ резонансы в нейтронных сечениях исчезают, но сами сечения с уменьшением энергии нейтронов продолжают расти, как это и можно было ожидать, глядя на формулу
2
( h \2
Оо = лго = л(---) .
\ mv /
В действительности, как показывает строгий квантовомеханический расчет, обычно сечения растут не так быстро, а именно согласно знаменитому «закону 1/v», то есть
<т = С/у,
где
v — скорость нейтрона,
а С — некоторая постоянная величина. Теперь мы, наконец, можем понять эффект, который наблюдал Ферми в тот солнечный день октября 1934 г., поместив источник нейтронов в бассейн с золотыми рыбками: сталкиваясь с ядрами водорода, нейтроны из радон-бериллиевого источника замедлялись и поэтому с большой вероятностью поглощались ядрами элементов.
Просто, не правда ли? Особенно если вспомнить, что речь идет о процессах внутри ядер атомов, то есть микрообъектов с размерами 10“
12 см, структуру и свойства которых мы, по существу, сами воссоздали силой своего воображения. Конечно, созданная нами картина не произвольна — она опирается на данные опытов, но от этого удивление силой человеческого воображения не становится меньше.
ДЕЛЕНИЕ ЯДЕР
В 1936 г., за два года до открытия деления урана, Нильс Бор развивал «капельную модель ядра». Эта умозрительная попытка проникнуть в существо внутриядерных процессов требовала от автора известной научной смелости. В самом деле, к тому времени все уже успели убедиться, что ядро — это хоть и непонятное, но очень прочное нечто, а Бор предлагал его мыслить в виде жидкой капли, состоящей из

протонов и нейтронов. Основой его концепции было представление о
составном ядре, которое возникает при захвате нейтрона, протона, а-частицы обычным ядром. При этом, утверждал Бор, новые частицы теряют свою индивидуальность, «растворяются» в ядре, а энергия, которую они с собой принесли, распределяется между всеми нуклонами ядра. Ядро возбуждается и, чтобы освободиться от избыточной энергии, может поступить по-разному: испустить у-квант, выбросить электрон и антинейтрино или же а-частицу. Развивая эти представления, Бор смог связать воедино разрозненные факты из физики ядерных реакций и даже вывести формулу для энергии связи ядер, которая довольно хорошо совпала с опытом.
Узнав об открытии деления урана, Бор £разу же понял, что оно наиболее естественно объясняется в рамках капельной модели ядра. В самом деле, возбужденное ядро деформируется, иногда настолько сильно, что ему проще разделиться на две части, чтобы избавиться от энергии возбуждения, чем испустить несколько частиц. Совместно со своим учеником Джоном Арчибальдом Уилером (р. 1911 г.) Нильс Бор развил теорию деления ядер. (Ту же задачу независимо решил советский физик Яков Ильич Френкель (1894—1952).)
Сейчас о процессе деления урана известно очень много. Точно измерено сечение деления
2giU тепловыми нейтронами — оно оказалось довольно большим, 582 барн. Известно, что ядро урана делится не одним, а примерно 50 различными способами, причем вероятности их сильно различаются, но не превышают 8 % каждый. Например, барий, который впервые обнаружили Ган и Штрассман в осколках деления урана, образуется при следующих способах деления (их вероятности около 6 %):

Р
г
1,7 с

Р
г
25 с

Р
г
18 мин

Р
?
3,7 ч

..Л.
33 дня
59
140Р „ 140 ~
И
е wT-
Cs
Р -
ИОР -~ Р -
14°Т Р . 140хч.
66 с ” 12,8дая
5,ь 40,2 ч
235П
92 U
236,,* о «
92 и —► 2 или 3 нейтрона
93 Q Р
93 v
38 7,Эмин
39 10,3 ч
“Nb.
В одном из каналов деления образуется также
15?Ьа с периодом полураспада 3,7 ч, который впервые наблюдали Ирэн Кюри и Павле Савич. Любопытно, что ядро урана почти никогда не делится на две равные части: вероятность такого способа деления меньше 0,01 %. (Как правило, массы осколков распределены в отношении 3:2.) В осколках деления содержится свыше сотни различных радиоактивных изотопов, с разными химическими свойствами и периодами полураспада. Эти изотопы выделяют, сортируют и затем используют как «меченые атомы» в разнообразных исследованиях.
При делении ядра урана кроме осколков вылетают еще 2 или 3 нейтрона — в зависимости от способа деления. Если усреднить их число по всем способам деления, то на каждое деление приходится v/ = 2,42 нейтрона с энергией около 1,3 МэВ. И если бы это число
Vf оказалось всего на 10 % меньше, то ядерный реактор на естественном уране был бы невозможен.

ВОКРУГ КВАНТА
Меченые атомы
Уже в своей итоговой работе 1903 г. Резерфорд и Содди в явлении радиоактивности увидели не только объект, но и средство исследования: «...радиоактивность может быть использована для наблюдения за химическими превращениями, происходящими в веществе»,— писали они и сравнивали такой метод исследования со спектральным анализом.
Восемь лет спустя Резерфорд встретил в пивном баре Манчестера Дьёрдя Хевеши (1885—1966), молодого химика из Венгрии, проходившего у него стажировку, и предложил ему отделить радий
D от свинца. Теперь-то ясно, что задача эта неразрешима химическими методами, поскольку радий
D — это попросту радиоактивный изотоп свинца
210 РЬ. Но в то время лишь после безуспешных попыток решить ее Хевеши совместно с австрийским радиохимиком Фришем Адольфом Панетом (1887—1958) догадались обратить задачу, а именно: принимая факт неразделим ости свинца и радия D, использовать последний для изучения химических реакций свинца.
Этот метод, который впоследствии назвали «методом радиоактивных индикаторов» или «меченых атомов» (Нобелевская премия 1943 г.), оказался чрезвычайно эффективным при исследовании химических реакций и структуры вещества. Сейчас он используется повсеместно: в физике и биологии, в медицине и металлургии, в археологии и криминалистике.
Открытие искусственной радиоактивности позволило получить десятки новых радиоактивных изотопов, а из осколков деления урана в современных ядерных реакторах выделяют свыше сотни разнообразных радиоизотопов. С их помощью человек узнал удивительные факты даже о себе самом: объем крови, циркулирующей по всему телу, механизм функционирования внутренних органов, скорость миграции веществ в организме и многое другое. Например, если выпить глоток соленой воды, в которую добавлен радиоактивный изотоп натрия
24Na, то уже через 2 минуты с помощью счетчика Гейгера — Мюллера его можно обнаружить в пальце руки, через час он распределится по всему телу, а еще спустя 3 часа начнет выводиться из организма. Оказалось, что полный круг кровообращения занимает всего 23 секунды, что атомы человеческого тела непрерывно заменяются новыми, поступающими в организм с пищей, и что весь цикл такой замены атомов занимает около года, то есть каждый год человек почти полностью обновляется, сохраняя при этом свою индивидуальность и целостность.
Теперь, почти столетие спустя после открытия радиоактивности, кажется странным, почему ее не замечали раньше: ведь она повсюду вокруг и даже внутри нас самих. В теле человека каждую секунду происходит свыше 20 000 распадов калия-40, около 300 распадов углерода-14 и 4 распада радия-226, с таким трудом открытого Марией и Пьером Кюри. Впрочем, в истории науки таких фактов множество:
радиоволны пронизывают все пространство вокруг нас, но об этом даже не подозревали до работ Генриха Герца, и лишь после Луи Пастера узнали, что в каждом кубическом сантиметре вдыхаемого нами воздуха содержатся миллионы разнообразных бактерий.
Радиоуглеродный метод датировки
В пространствах Вселенной каждую секунду происходят космические катастрофы: вспыхивают новые и взрываются старые звезды, выбрасывая в межзвездные пространства ядра водорода, гелия и других элементов. В галактических магнитных полях эти ядра разгоняются до громадных энергий — в сотни и тысячи раз больших, чем достигнутые сегодня на ускорителях. Эти
космические лучи, как их назвал Роберт Милликен, встретив на своем пути Землю, пронизывают атмосферу и, сталкиваясь с ядрами ее атомов, вызывают разнообразные ядерные реакции: разбивают ядра на осколки, выбивают из них вторичные протоны и нейтроны. Эти вторичные частицы вступают в новые ядерные реакции, одна из которых в 1946 г. привлекла особое внимание американского физика Уилларда Фрэнка Либби (1908—1980).
Он заметил, что выбитые нейтроны, сталкиваясь с ядрами атомов азота, из которого на 79 % состоит атмосфера Земли, могут выбить из них протон и превратить их в ядра углерода:
n +
l4N--->
14С + р.
В отличие от обычного изотопа углерода
12С, редкий изотоп
14С радиоактивен: он распадается по схеме
14С --->-
14N + e + v
e
с периодом полураспада 71/2 = 5730 лет. Каждую секунду на площадку в 1 м
2 падает примерно 4000 космических протонов, которые после каскада ядерных превращений приводят к образованию примерно 2 ядер
14С в каждом кубическом сантиметре верхних слоев атмосферы. Эти изотопы углерода вскоре соединяются с кислородом и в виде углекислого газа усваиваются растениями, а затем животными и человеком. В результате такого круговорота в органическом веществе всех растений и животных устанавливается равновесная концентрация изотопа
14С, который можно обнаружить с помощью обычного счетчика Гейгера — Мюллера. Оказалось, что в 1 г углерода органического происхождения — будь то древесина, трава, кости животного или бактерии —
278 содержится примерно 70 млрд, атомов углерода 14С, причем каждую минуту 15 из них распадаются.
Однако это заключение справедливо лишь для живой материи: как только растение, животное или человек умирает, прекращается обмен веществ, составляющий суть жизни, а вместе с этим в останках нарушается и равновесная концентрация атомов
l4C. С момента гибели живого организма число атомов
14С в нем непрерывно уменьшается по строго определенному закону: через 5730 лет их станет вдвое меньше, еще через 5730 лет — вчетверо меньше и т. д. А это означает, что 1 г углерода только что срубленного дерева через 5730 лет будет излучать вместо 15 импульсов в минуту только 8, а еще 5730 лет спустя — 4 импульса в минуту и т. д.
Теперь ясно, как определить возраст любой археологической находки — будь то угли первобытного костра, мумия из египетской пирамиды или обломки корабля аргонавтов. Для этого достаточно сосчитать число распадов, которые зарегистрирует счетчик Гейгера — Мюллера за 1 мин в 1 г углерода, взятого из исследуемого образца (для удобства его обычно сжигают и исследуют на радиоактивность образовавшийся углекислый газ).
Идея этого метода определения времени довольно древняя: по этому принципу, например, устроены песочные и водяные часы, но поистине удивительно, как в радиоуглеродном методе датировки причудливо переплелись новейшие достижения ядерной физики и седая древность, лучи из мировых глубин и филигранная работа живых клеток, усваивающих углерод в процессе фотосинтеза.
В 1960 г. физик Либби за это открытие удостоен Нобелевской премии по химии, хотя значение его выходит далеко за рамки обеих наук.
ГЛАВА 16
|
Мергатсегер
|

|
Титан Прометей — внук Урана, сын Фемиды и брат Атланта больше других помог Зевсу в его битве с Кроносом: именно он склонил великую богиню Гею стать на сторону Зевса и посоветовал ему низвергнуть побежденных титанов в мрачный Тартар. После победы Зевс решил уничтожить прежний род людской и вместо него создать новый, лучший. Для начала он лишил людей огня в наказание за хитрость Прометея в их пользу при разделе жертвенного быка. В ответ Прометей похитил огонь из кузницы Гефеста и передал его людям, а также научил их искусствам и знаниям, земледелию и скотоводству, чтению и письму. Разгневанный громовержец приковал Прометея к скале над морем в далекой Скифии, куда каждый день в течение долгих лет прилетал орел клевать его печень. Кроме того, он повелел Гефесту создать из глины и воды Пандору — первую земную женщину нового поколения — и отдать ее в жены Эпиметею, брату Прометея. Афродита украсила Пандору прелестями, Гермес внушил ей хитрость, а Зевс подарил запечатанный сосуд с людскими бедами. Искушаемая любопытством, Пандора вскрыла сосуд, и все земные несчастья разлетелись по свету; на дне сосуда осталась лишь надежда, которая с тех пор заменяет людям счастье.
Эта древняя легенда не поблекла даже теперь, после многих лет неумеренного употребления ее фрагментов в бесчисленных повествованиях об открытии атомной энергии. Чаще всего вспоминают незадачливую Пандору с ее сосудом как прообраз атомной бомбы, часто — Прометея, добывшего атомный огонь ценой страданий и внутреннего разлада между долгом и нравственностью. И совсем редко упоминают конец легенды: Геракл убивает орла и разбивает цепи, Зевс прощает Прометея, а мудрый кентавр Хирон умирает вместо него, даруя Прометею свое бессмертие.
Борьба человека за атомный огонь даже для нас, современников начала атомной эры, уже покрыта легендами.
Драматическая история овладения атомной энергией неотделима от трагических поворотов судьбы всего человечества во времена самой бесчеловечной из его войн. Каждая подробность этой истории важна и значительна, но, чтобы в должной мере оценить их смысл, надо вначале представить себе суть физических процессов, составляющих основу происходивших событий.
ЦЕПНАЯ РЕАКЦИЯ
Поздно вечером 21 декабря 1938 г. Отто Ган и Фриц Штрассман закончили статью, в которой вынуждены были признать, что при облучении урана медленными нейтронами возникают элементы барий, лантан и церий. В тот вечер Отто Ган вряд ли в полной мере предвидел все последствия своего открытия, хотя и чувствовал безошибочно их важность. Он позвонил своему другу Паулю Розбауду, издателю еженедельника «Naturwissenschaften», и попросил опубликовать их сообщение как можно быстрее. Розбауд вставил статью в готовый номер, и она была напечатана уже через две недели, 6 января 1939 г. Эта статья оказалась тем последним камнем, который увлекает за собой лавину: только в течение 1939 г. было
опубликовано свыше ста работ по проблеме деления урана. (Шесть лет спустя эта работа Гана будет отмечена Нобелевской премией 1944 г.; он узнает об этом в состоянии глубокой депрессии после сообщений о Хиросиме и Нагасаки, сидя под арестом в английском замке.)
В то время, когда Пауль Розбауд знакомился со статьей Гана и Штрассмана, Энрико Ферми поднимался по трапу парохода, чтобы навсегда покинуть фашистскую Италию. 2 января 1939 г. он сошел на берег в гавани Нью-Йорка: «Итальянский мореплаватель прибыл в Новый Свет» (четыре года спустя такими словами Артур Комптон сообщит руководству американского уранового проекта об успешном запуске первого атомного реактора под руководством Ферми). 7 января, на следующий день после выхода статьи Гана и Штрассмана, в Соединенные Штаты отплывал Нильс Бор. 16 января он сошел с корабля в Нью-Йоркском порту, еще не зная, что именно в этот день Отто Фриш отправил в редакцию «Nature» сразу две статьи: в одной из них «Разрушение урана нейтронами: новый тип ядерной реакции» (напечатана 18 февраля) Отто Фриш и Лизе Мейтнер объяснили суть открытия Гана и Штрассмана и впервые ввели термин «деление ядер», в другой Отто Фриш сообщал, что накануне
(13 января} он наблюдал осколки деления урана с помощью простейшей ионизационной камеры. (На многие годы в кругу друзей «деление» станет прозвищем Отто Фриша.)
Нильс Бор и Энрико Ферми встретились 26 января в Вашингтоне на конференции по теоретической физике, где Нильс Бор рассказал об открытиях последних недель. Реакция физиков была бурной и единодушной и очень напоминала реакцию самого Бора на рассказ Фриша: «Как мы могли не замечать этого так долго!» — сказал он тогда, хлопнув себя по лбу. В течение ближайших двух-трех дней открытие деления ядра было подтверждено по крайней мере в пяти лабораториях США, 26 января в этом убедился Жолио-Кюри в Париже (его заметка в Докладах Французской академии была напечатана уже 30 января), а к тому времени, когда вышла статья Фриша и Мейтнер, деление ядер уже наблюдали десятки исследователей в Копенгагене и Нью-Йорке, Вашингтоне и Париже, Ленинграде и Варшаве.
Выступая вслед за Бором, Энрико Ферми обратил внимание на то, что при делении ядер урана, кроме двух ядер-осколков, должно испускаться несколько нейтронов, которые в свою очередь могут вызвать последующие деления, то есть в уране возможна
цепная реакция деления с выделением огромной энергии. Заключение Ферми было очень естественным (хотя в то время и не вполне очевидным: сами Фриш и Мейтнер, например, не заметили этого следствия своей гипотезы), однако противоречило наблюдаемым фактам: никто никогда не видел, чтобы кусок урана взрывался при облучении его нейтронами.
Размышляя над этим противоречием, Нильс Бор вспомнил, что четыре года назад Артур Демпстер с помощью своего


усовершенствованного масс-спектрометра обнаружил редкий изотоп урана
292U, причем оказалось, что природный уран на 99,28 % состоит из изотопа и лишь на 0,72 % — из изотопа
292U. Бор предположил, что медленными нейтронами делится уран-235, а быстрые нейтроны, которые при этом делении испускаются, сразу же поглощаются ядрами урана-238, поэтому нейтронная вспышка гаснет, как спичка, брошенная в поленницу сырых дров. Альфред Нир (р. 1911 г.) и Джон Даннинг (1907—1975) подтвердят эту гипотезу Бора только через год, 1 марта 1940 г., но поверили в нее сразу и во всех дальнейших исследованиях принимали ее во внимание.
Сразу же встало три новых вопроса:
Сколько нейтронов и с какой энергией вылетает из ядра изотопа урана-235 при каждом делении? Что происходит с ядрами изотопа урана-238 после захвата нейтрона? При каких условиях возможно осуществить незатухающую цепную ядерную реакцию в уране?
Ответ на первый вопрос уже в середине марта получили сразу четыре группы исследователей: Фредерик Жолио-Кюри, Хальбан и Коварски во Франции, Флеров и Русинов в России, Ферми, Андерсон и Ханштейн, а также Сцилард и Зинн в США. Оказалось, что при каждом делении ядра урана-235 испускается примерно два-три вторичных нейтрона со средней энергией 1,3 МэВ. (Точное число нейтронов деления v=2,42, измеренное впоследствии, оставалось государственной тайной вплоть до 1950 г.)
При попытке ответить на второй вопрос вспомнили сразу одну из работ Мейтнер, Гана и Штрассмана. Еще в 1937 г., повторяя эксперименты группы Ферми, они заметили, что ядра урана особенно эффективно поглощают нейтроны с энергией 25 эВ (так тогда думали, в действительности — 6,8 эВ). Такое
резонансное поглощение нейтронов всегда сопровождается 0-активностью с периодом полураспада 23 мин, в отличие от случая поглощения медленных «тепловых» нейтронов с энергией 0,04 эВ, когда наблюдается сложная смесь различных периодов полураспада. Теперь причина такого различия прояснилась: уран-235 наиболее эффективно делится медленными нейтронами (его сечение деления велико), и образующиеся в этом случае продукты деления имеют различные периоды полураспада. Напротив, при энергии нейтронов в несколько электрон-вольт сечение резонансного поглощения ураном-238 значительно превышает сечение деления урана-235, поэтому основным процессом является превращение урана-238 в нептуний-238 путем 0-распада.
|
Таким образом, чтобы цепная реакция стала возможной, необходим замедлитель нейтронов, который дол |
|
жен, во-первых, уменьшить их энергию в 10 миллионов раз — от 1 МэВ, с которой они вылетают при делении ядра урана-235, до энергии 0,1 эВ — и, во-вторых, осуществить это так |
| / |
быстро, чтобы нейтроны успели замедлиться до того, как они столкнутся с ядром урана-238. Наконец, сам замедлитель не должен поглощать нейт |
|
Я. Б. Зельдович
|
роны, то есть сечение захвата им нейтронов должно быть очень малым. |
| Наиболее эффективно замедляет нейтроны водород (это хорошо помнили после опытов Ферми 1934 г.), но, к несчастью, оказалось, что он сильно их поглощает: сечение реакции |
d + Y,
в которой при столкновении нейтрона с протоном образуется тяжелый изотоп водорода дейтерий и испускается у-квант, равно о = 0,33 барн. Это значительно меньше, чем сечение резонансного захвата в уране-238, равное «10 000 барн, но все-таки слишком много.
Летом 1939 г. советские теоретики Яков Борисович Зельдович и Юлий Борисович Харитон проделали первый расчет кинетики цепной реакции деления в растворе урана с водой. Их выводы были неутешительными: такой
гомогенный ядерный реактор будет работать только в том случае, если концентрацию изотопа урана-235 повысить до 2,5 % вместо тех 0,72 %, которые присутствуют в любом образце природного урана.
Так возникла первая большая проблема атомной энергетики:
разделение изотопов урана. Вначале ее считали настолько неприступной, что в течение двух лет о ней практически не думали. В самом деле, казалось невероятным, что когда-нибудь удастся разделить химически совершенно идентичные атомы изотопов урана, массы ядер которых различаются всего на полтора процента. Но война меняет представления о границах возможного: уже в 1944 г. были построены и работали заводы по разделению изотопов урана — огромные четырехэтажные корпуса шириной в полкилометра и в километр длиной, потреблявшие энергию электростанции, равной по мощности Днепрогэсу. Технологические детали этого процесса до сих пор хранятся в секрете, но его идея — метод газовой диффузии — хорошо известна.

Если смесь двух газов пропустить сквозь пористую перегородку с отверстиями, которые чуть больше самих атомов, то за перегородкой легкого газа в смеси станет немного больше, чем до перегородки, и, повторяя этот процесс многократно, смесь газов можно в принципе разделить полностью. По удивительной прихоти природы среди примерно 200 соединений урана есть только одно газообразное — шестифтористый уран UF6 — ядовитый газ, который уже при 56° конденсируется в виде игольчатых кристаллов. Если этот газ пропустить через специальную пористую перегородку, то за ней урана-235 станет на 0,14 % больше, чем до нее, а поставив несколько тысяч таких перегородок, можно в конце концов отделить уран-235 от урана-238. Все это станет возможным, однако, только пять лет спустя, а летом 1939 г. ученые были озабочены другим: как осуществить незатухающую ядерную реакцию в природном уране?
Прежде всего, вместо воды следовало выбрать другой замедлитель. Выбор оказался небогатым: либо углерод (сечение захвата им нейтронов о = 0,0034 барн), либо тяжелая вода D2O, то есть вода, в которой водород замещен дейтерием (сечение захвата о = 0,0012 барн). Легко видеть, что тяжелая вода предпочтительнее. Однако ее очень трудно добывать: в литре обычной воды содержится всего 0,15 г тяжелой. К тому же в 1939 г. это умели делать только в одном месте в мире — в Норвегии, на небольшом заводе в Веморке. Из двух возможностей Жолио-Кюри и Гейзенберг независимо друг от друга выбрали тяжелую воду, в то время как Ферми, Сцилард и Курчатов решили попытать счастья с графитом.
. Условие, при котором цепная ядерная реакция возможна, принято записывать с помощью простой и знаменитой «формулы четырех сомножителей»:
^оо = т^ефО.
Коэффициент размножения — это число вторичных нейтронов, возникающих в реакторе бесконечных размеров на каждый первичный нейтрон деления. Ясно, что
расходящаяся цепная реакция возможна лишь в том случае, если
kOQ> 1, то есть в каждом последующем «поколении» нейтронов будет больше, чем в предыдущем.
Коэффициент ц — это число вторичных тепловых нейтронов в естественном уране, которое отличается от среднего числа нейтронов деления в чистом уране-235. Дело в том, что при захвате медленного нейтрона ядрами урана-235 они делятся только в 84 % случаев, а в остальных 16 % испускают у-квант и превращаются в ядра изотопа урана-236. Кроме того, даже тепловые нейтроны захватываются изотопом урана-238, хотя и много слабее, чем резонансные. Но в естественной смеси изотопов урана-238 в 149 раз больше, чем урана-235, поэтому для такой смеси коэффициент т) = 1,34 — много меньше исходного коэффициента размножения v = 2,42, хотя все еще и превышает единицу.
Коэффициент е учитывает то обстоятельство, что быстрые нейтроны деления, пока их энергия больше чем 1,5 МэВ, способны также делить и ядра урана-238, то есть реально увеличивают число вторичных нейтронов. Для уран-графитовых реакторов е=1,03.
Много хлопот доставил коэффициент ф — вероятность избежать резонансного захвата нейтронов в уране-238 в процессе их замедления. Если бы все нейтроны деления достигали тепловых энергий без потерь в уране-238, то коэффициент ф был бы равен единице. Как всякий идеал, значение ф=1 недостижимо, но можно пытаться к нему приблизиться. Способ увеличить коэффициент ф придумали почти сразу же, летом 1939 г.: во Франции, США и Германии независимо возникла идея
гетерогенного реактора. Суть идеи проста и состоит в следующем: вместо того чтобы перемешивать равномерно уран и замедлитель, нужно разместить блоки урана в пространстве на некотором расстоянии друг от друга, наподобие атомов в кристаллической решетке, а затем уже заполнить этот объем замедлителем. В этом случае нейтроны деления, вылетая из блоков урана с энергией около 2 МэВ, большую часть пути будут проходить в замедлителе и к тому времени, когда они достигнут другого блока урана, уже минуют опасную резонансную область энергий. К тому же нейтроны деления, образовавшиеся в блоках урана с большой начальной энергией 2 МэВ, проходят его толщу, не успевая замедлиться до резонансных энергий, что еще более повышает эффективность такого гетерогенного реактора. (В работе Исая Исидоровича Гуревича и Исаака Яковлевича Померанчука, которая стала важным элементом советской урановой программы, это явление названо «блок-эффектом».) Должным образом подбирая расстояния между блоками урана, на этом пути достигли значения ф = 0,93 (для гомогенного реактора ф=0,65).
286

|
|
И. Я. Померанчук
|
нию с захватом в углероде, для которого о
захв =0,0034 барн.) Таким образом, для уран-графитового гетерогенного реак
Коэффициент ft в «формуле четырех сомножителей» — это вероятность избежать захвата нейтрона в замедлителе и всевозможных примесях. Для чистого графита удалось повысить этот коэффициент до значения ft=0,84. Очень важно, чтобы графит был чистым: малейшая примесь, например, бора — всего 3—4 атома на миллион атомов углерода — делает его непригодным для замедлителя. (Сечение захвата нейтронов ядрами бора огромно: <т
захв = 755 барн, поэтому только при концентрации примеси примерно 10~
6 захватом нейтронов в боре можно пренебречь по сравне-тора на естественном уране произведение четерех сомножителей
= necpft = 1,34 • 1,03 • 0,93 * 0,84 = 1,07,
то есть цепная ядерная реакция в бесконечно большом реакторе возможна.
В реальном реакторе конечных размеров часть нейтронов теряется, уходя из объема реактора наружу через его поверхность, поэтому действительный коэффициент размножения нейтронов
k меньше и
& = р,
где коэффициент р зависит от размеров и формы реактора, но


всегда меньше единицы. Очевидно, существуют какие-то
критические размеры реактора, при которых произведение
k = kco р=1. Оставалось выяснить, насколько велики эти размеры.
В декабре 1940 г. Ганс Халбан и Лео Коварски в Англии, куда они после оккупации Франции эмигрировали со всем запасом урана и тяжелой воды, установили, что для осуществления незатухающей ядерной реакции достаточно взять около 5 т тяжелой воды и разместить в ней должным образом примерно столько же тонн урана. К аналогичному выводу пришел и Гейзенберг в Германии. Однако такого количества тяжелой воды не было тогда во всем мире, и трудно было ожидать, что она появится в ближайшее время. Поэтому Ферми пытался определить критические размеры уран-гр афитового реактора и в течение последующих двух лет достиг цели.
Итак, ядерный реактор построить можно. Но можно ли им управлять? Не взорвется ли он, как только значение коэффициента размножения нейтронов
k превысит единицу? Оказалось, что природа и здесь пошла навстречу человеку.
В лавине работ, которые появились сразу вслед за открытием деления урана, была одна, которую вначале не оценили должным образом. В марте 1939 г. Робертс, Мейер и Вонг из Колумбийского университета обнаружили, что примерно 1 % нейтронов вылетает при делении урана не вместе с осколками, а чуть позже — через 0,2, 0,9 и даже через 56 с. Физика этого явления вскоре стала понятной:
запаздывающие нейтроны, в отличие от
мгновенных, вылетают не из ядра урана, а из его осколков.
Осколки эти — свыше сотни изотопов около сорока различных элементов из середины таблицы Менделеева — отягощены избытком нейтронов и стремятся от них избавиться. Большая часть изотопов освобождается от нейтронов путем Р-распада, то есть превращая их в протоны,— точно так же, как это происходило в опытах Ферми по поглощению нейтронов ядрами. Однако небольшая часть образовавшихся изотопов, после некоторых колебаний, выбрасывает лишний нейтрон целиком, не расщепляя его на протон и электрон. Именно эти запаздывающие нейтроны, которые составляют всего 0,64 % от общего их числа, позволяют управлять работой ядерного реактора. В самом деле, если по какой-то причине число нейтронов в реакторе внезапно увеличится, то благодаря запаздывающим нейтронам они станут размножаться лавинообразно не сразу, а только через несколько
288
секунд. Этого времени вполне достаточно, чтобы погасить «атомный огонь» вручную, без всякой автоматики, погружая в толщу реактора стержни из бора или кадмия (сечения захвата нейтронов для них огромны: для кадмия, например, 0захв = 245О барн).
ЯДЕРНЫЙ РЕАКТОР
Названия «атомная энергия», «атомный реактор», «атомная бомба» — дань исторической традиции. В действительности при этом речь всегда идет о
ядерной энергии, ядерном реакторе и
ядерной бомбе. И хотя инерцию общепринятого словоупотребления преодолеть теперь, по-видимому, уже нельзя, помнить об этом следует.
В среду, 2 декабря 1942 г., в 15 ч 25 мин по местному времени на теннисном корте под трибунами стадиона в Чикаго Энрико Ферми впервые в истории человечества осуществил управляемую ядерную реакцию в «атомном котле». Первый ядерный реактор представлял собой сплющенный эллипсоид диаметром 8 м и высотой 6 м, сложенный из 385 т графитовых брикетов, между которыми на расстоянии 21 см друг от друга было размещено 46 т урановых блоков весом 2 кг каждый, то есть в целом реактор был похож на кристалл с кубической решеткой. Мощность этого реактора — 40 Вт — была меньше мощности горящей спички, и после 28 мин работы ядерная реакция в нем была остановлена с помощью кадмиевых полос. Криков восторга не было, лишь Вигнер откупорил припасенную им бутылку кьянти — любимого вина Ферми. 43 участника и свидетеля этого события понимали его значительность: отныне пути назад, в доатомную эру, больше не было.
В среду 25 декабря 1946 г., в 19 часов в Москве под руководством Игоря Васильевича Курчатова запущен первый советский ядерный реактор.
15 декабря 1948 г. неподалеку от Парижа под руководством Ирэн и Фредерика Жолио-Кюри запущен французский ядерный реактор.
27 июня 1954 г. вступила в строй первая в мире атомная электростанция в г. Обнинске под Москвой мощностью 5 МВт.
С тех под прошло не так много лет, но уже сейчас свыше 400 ядерных реакторов в 26 странах мира вырабатывают более 300 ГВт электроэнергии — около 16% всей электроэнергии на Земле, то есть больше, чем все гидростан-
10 Л. И. Пономарев 259

ции мира. Во Франции АЭС вырабатыва ют 70 % электроэнергии, а к концу ве-ка эта доля возрастет до 85 % (во всем мире — до 30 %).
История овладения атомной энергией уникальна во многих отношениях: по значимости проблемы, обстоятельствам, сопутствовавшим ее решению, и последствиям, которые еще далеко не всеми осознаны. В науке и раньше так случалось, что два исследователя независимо друг от друга открывали одно и то же явление. Само по себе это не очень удиви-верим в объективность законов природы.
Но впервые случилось так, что сотни и тысячи людей, разделенные океанами, пожаром войны и стеной секретности, последовательно, шаг за шагом приходили к одинаковым заключениям, ставили и решали одни и те же научные, технологические и инженерные задачи и примерно в той же последовательности. Только в 1955 г., после 15 лет практически полной изоляции, ученые из СССР и США, Франции и Англии, Канады и Японии — всего 79 стран — собрались в Женеве на Первую международную конференцию по мирному использованию атомной энергии и смогли убедиться, что их независимые измерения и формулы совпали с большой точностью. Мало того, часто совпадали даже обозначения в формулах, полученных в разное время и разными людьми. Как будто Книга Природы открылась всем им одновременно, а они лишь записали ее письмена.
Оглядываясь назад, трудно удержаться от удивления, насколько узкой оказалась тропа и сколь хрупким мостик из века пара и электричества в эпоху атома и ядра. Ведь любой из четырех сомножителей в формуле для коэффициента размножения нейтронов мог оказаться на 5—10 % меньше — и реактор на природном уране был бы невозможен. А если бы не запаздывающие нейтроны, то управление реактором стало бы специальной и трудной проблемой.
Все физические процессы, происходящие внутри ядерного реактора, мы знаем теперь во всех деталях. Для начала цепной реакции в принципе достаточно даже одного нейтрона. В толще урана они всегда есть: каждую секунду в 1 кг урана спонтанно делятся 7 ядер, и вылетающие при этом нейтроны могут служить «спичкой», поджигающей «урановый костер». Вылетевшие нейтроны, прежде чем дать
290
начало новому поколению нейтронов, живут в реакторе меньше тысячной доли секунды. За это время они успевают испытать с ядрами углерода 114 соударений, пройти путь 54 см, замедлиться до тепловых скоростей и вызвать новое деление ядра урана. Число нейтронов в реакторе нарастает лавинообразно и через несколько секунд достигает уровня, который заранее задан расположением регулирующих стержней поглотителей. В каждом кубическОхМ сантиметре объема мощного реактора содержится примерно пол миллиарда нейтронов, которые всегда «находятся в пути» от одного ядра урана к другому. В целом же внутри корпуса реактора устанавливается некоторое стационарное распределение нейтронов, так называемое
нейтронное поле довольно сложной конфигурации, которое отчасти можно уподобить распределению электрического поля в электролитических ваннах. Им можно управлять, иногда оно испытывает колебания и всегда является предметом пристального внимания физиков и повседневных забот инженеров.
В целом, несмотря на сложность физических процессов, происходящих в «атомном котле», его принципиальная схема оказалась проста до чрезвычайности. «Урановый реактор олицетворяет собой самое гениальное и замечательное достижение разума за всю историю человечества»,— писал Фредерик Содди в конце жизни, через 50 лет после начала своих опытов с ураном и торием.
Спонтанное деление урана
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
В феврале 1939 г. статьи Гана и Штрассмана, Мейтнер и Фриша почти одновременно дошли до Ленинграда. Как и повсюду, в лаборатории И. В. Курчатова немедленно начались эксперименты. Вскоре там тоже наблюдали осколки ядер урана, и уже в апреле Георгий Николаевич Флеров и Лев Ильич Русинов измерили число вторичных нейтронов деления v = 3±l, а в мае 1940 г. Флеров и Константин Антонович Петржак натолкнулись на новое, неожиданное явление природы — спонтанное деление ядер урана. Оказалось, что даже в отсутствие нейтронов, без внешнего воздействия, ядра урана самопроизвольно взрываются. Это происходит очень редко: период полураспада по каналу деления равен 10
16 лет, то есть в миллион раз больше, чем время существования Вселенной, и в два миллиарда раз больше, чем период сс-распада урана. В среднем за час из 3-10
21 ядер, содержащихся в 1 г урана, распадается всего 23 ядра. Это очень мало, но именно такие сигналы природы свидетельствуют о самых важных деталях ее устройства.
Естественный ядерный реактор Окло
7 июня 1972 г. при стандартном масс-спектрометрическом анализе урана, поступившего на обогатительный завод во Франции, было обнаружено, что содержание урана-235 в исходном сырье составляет 0,717 % вместо 0,720 %, обычного для всех земных пород, образцов лунного грунта и метеоритов. Поиски источника аномалии привели на рудник вблизи селения Окло в Габоне (Западная Африка). Концентрация двуокиси урана UO2 в месторождении Окло в среднем не превышала 0,5 % (что довольно обычно), но иногда в нем встречались линзы толщиной около метра и протяженностью 10—20 м с концетрацией UO2 до 20—40 %. Именно в этих линзах содержание изотопа урана-235 оказалось значительно меньше обычного (0,72 %) и достигало значения 0,62 %, а иногда 0,44 %.
Некоторое время ученые пребывали в замешательстве: до сих пор не было известно случая, чтобы изотопный состав какого-либо элемента зависел от взятого для анализа образца. Тщательное изучение геологии месторождения показало,
292 что оно расположено в дельте древней реки, в толще осадочных пород, образовавшихся около 1,8 млрд, лет назад, в раннюю протерозойскую эру. В то время сутки были в полтора раза короче нынешних, Европа покоилась на дне океана, вместо Азии было несколько материков, а жизнь только-только зарождалась: в морях уже обитали сине-зеленые бактерии, но пройдет еще около миллиарда лет, прежде чем они освоят процесс фотосинтеза.
Но самое существенное для феномена Окло заключалось в том, что концентрация урана-235 в естественной смеси изотопов урана составляла в то время около 3 %, то есть примерно столько же, сколько в современных водо-водяных ядерных реакторах (напомним, что период полураспада урана-238 равен 4,5 млрд, лет, в то время как урана-235 — только 0,7 млрд. лет). Поэтому каждый раз, когда в линзу урановой руды (размеры которой также сравнимы с объемом активной зоны современных реакторов) попадала вода, в ней начиналась ядерная реакция деления, которая продолжалась до тех пор, пока выделившееся тепло не испаряло воду, и естественный ядерный реактор, лишенный замедлителя, прекращал работу; после остывания линзы и заполнения ее водой реакция начиналась снова. По оценкам реактор Окло работал в таком режиме более полумиллиона лет, хотя средняя мощность его при этом не превышала 25 кВт.
Феномен Окло — замечательный пример явления природы, которое, будучи у всех на виду, тем не менее, подобно электромагнитным волнам, может веками оставаться незамеченным до тех пор, пока не будут изобретены теоретические понятия, необходимые для его адекватного объяснения. Вряд ли имеет смысл подробно пояснять, что без таких понятий, как «атом», «ядро», «нейтрон», «изотопы», «радиоактивность», «период полураспада», «деление», «сечение реакций» и т. д., глубокий смысл отличия двух чисел 0,717 и 0,720 % всего лишь в третьем знаке после запятой попросту никому бы не был понятен, не говоря уж о том, что без современного масс-спектрографа такое различие в содержании изотопа урана-235 вообще нельзя обнаружить.
Кроме того, существование естественного ядерного реактора в далеком прошлом самым убедительным образом доказывает возможность безопасной эксплуатации всех ядерных реакторов настоящего. И, наконец, больная проблема ядерной энергетики — проблема захоронения радиоактивных отходов — выглядит теперь не столь безнадежно: оказалось, что вся «ядерная зола» осталась на том же месте, где она и возникла около 2 млрд, лет назад при горении «ядерного огня».
ГЛАВА 17
Лошадь Нептуна
Идея прогресса, как символ веры в неограниченное нравственнее и умственное совершенствование природы человека, оформилась в V веке, в трудах блаженного Августина. Эта столь привычная теперь идея в корне отличается от античных представлений о смене веков — от золотого до железного— и еще более древних учений о круговороте периодов расцвета и упадка человечества. В XVII веке идея прогресса обрела философское и научное основание, а в следующем веке, дополненная верой в поступательное социальное развитие, получила всеобщее признание.
Движущей идеей прогресса стала наука. «Scientia est ро-tentia» — «Знание — сила» — эти крылатые слова Фрэнсиса Бэкона повторяют уже четыре столетия, хотя теперь уже и без былой гордости: в наше время они приобрели устрашающую наглядность. Та же наука, которая в продолжение трех веков питала и утверждала идею прогресса, теперь довольно точно определяет его пределы. Она бесстрастно свидетельствует, что через 50—100 лет на Земле иссякнут запасы нефти и газа, а еще через 300—500 лет — запасы угля; что при нынешних темпах загрязнения наша планета уже в будущем столетии станет непригодной для жизни; что на Земле сейчас освоено 55 % годных к обработке почв и 15 % пресных вод и что она способна* прокормить и согреть лишь в три раза больше людей, чем теперь.
Человек впервые сталкивается с проблемами такого глобального, по существу космического, масштаба, и никто не может предсказать, как он с ними справится. Одно несомненно: прежде всего ему предстоит решить проблему энергии, поскольку во все времена — от первого костра до атомной электростанции — на ее добывание человек затрачивал примерно треть усилий. Уже сегодня ясно, что без ядерной энергии эту проблему hq решить. И если бы наука нуждалась в оправданиях, одного этого открытия с нее было бы довольно.
АТОМНАЯ ЭНЕРГИЯ
Современная атомная электростанция (сокращенно АЭС) — довольно сложное инженерное сооружение высотой в десятиэтажный дом. Она состоит из двух частей: ядерного реактора, в котором выделяется энергия деления ядер, и парогенератора, который превращает эту тепловую энергию в электрическую. Сердце АЭС — ядерный реактор. Разработаны десятки их разновидностей: уран-графитовые, водо-водяные, на тяжелой воде, на тепловых, промежуточных и быстрых нейтронах и т. д. Все они жгут одно и то же топливо — уран (естественный или обогащенный изотопом
235U), а их различия обусловлены выбором замедлителя нейтронов, теплоносителя парогенератора, степенью обогащения ядерного топлива и т. д.
Уран-графитовые реакторы ничем принципиально не отличаются от первых реакторов Ферми и Курчатова. Например, реактор мощностью в тысячу мегаватт (или один гигаватт) — это графитовый цилиндр весом 600 т, высотой 7 м и диаметром 12 м, в котором просверлено около 2 тысяч вертикальных каналов диаметром 15 см. Около 100 каналов занято управляющими стальными стержнями с добавкой бора, а в остальные каналы помещено примерно 200 т урана, расфасованного в длинные стержни — тепловыделяющие элементы — ТВЭЛы, собранные из таблеток окиси урана UO
2, обогащенного до 1,8 % изотопом урана-235. (Цель обогащения понятна: чем больше сухих дров добавлено в костер из сырых поленьев, тем устойчивее он горит.) Кроме того, по трубам, проведенным сквозь толщу реактора, прогоняется вода при температуре 300 °C и давлении 150 атмосфер, которая отводит тепло в парогенератор и обеспечивает работу мощных паровых турбин — электрогенераторов. Температура графита в работающем реакторе — около 700 °C, температура ТВЭЛов — около 2000 °C.
Еще проще идея водо-водяных реакторов (ВВР): по существу, это просто большой бак с водой, в которую погружены ТВЭЛы и регулирующие стержни. В таком реакторе вода является одновременно и замедлителем и теплоносителем. Для работы такого реактора его ТВЭЛы должны быть изготовлены из обогащенного урана с добавкой около 3 % урана-235. Поразительна концентрация энергии в таком реакторе: в баке с водой размером с обычную железнодорожную цистерну в секунду вырабатывается энергия, которая в 100 раз превышает среднюю мощность вулкана и равна половине мощности Братской ГЭС.
Конструктивное воплощение этой идеи, конечно, не так просто: надо предотвратить заражение окружающей местности радиоактивными осколками деления (для этого нужна сложная система фильтров), надо защитить работающих на станции от радиоактивных излучений (для этого вокруг реактора воздвигают бетонную защиту толщиной в три и более метра), наконец, надо обогащать уран и изготавливать ТВЭЛы. Тем не менее уже сейчас стоимость электроэнергии, вырабатываемой на АЭС, ниже стоимости электричества тепловых станций, а в дальнейшем это различие станет еще более ощутимым: органическое топливо на Земле быстро истощается.
Не менее важное преимущество АЭС — их минимальное воздействие на биосферу. АЭС мощностью в 1 ГВт (1 ГВТ = = 10
9 Вт) «сжигает» всего около 1 кг урана-235 в день. Даже с учетом того обстоятельства, что вес расходуемого урана составляет 2—3 % от общего веса урана, это все-таки много меньше, чем эшелон нефти или угля в день, необходимый для работы тепловой станции равной мощности. Ясно, что при этом во столько же раз снижается объем горных выработок и транспортные расходы.
Много написано об экологической безопасности атомных станций, и это действительно так. Риск погибнуть от радиации в окрестностях АЭС меньше, чем опасность быть убитым молнией или крупным метеоритом. Тепловые станции в этом

отношении много вреднее: в каждой тонне угля содержится примерно 80 г урана, поэтому радиоактивность шлейфов дыма мощных ТЭЦ в сотни раз превышает выбросы АЭС, не говоря уж о том, что сернистый газ этого дыма со временем уничтожает в округе все леса и живность.
И все же люди инстинктивно сопротивляются строительству АЭС, по этому поводу устраиваются референдумы и демонстрации, уходят в отставку правительства. Причина этого явления — не только в неосведомленности большей части людей относительно природы атомной энергии: как правило, они отождествляют ее с атомной бомбой. По-видимому, эмоциональное неприятие атомной энергии сродни тем многочисленным психологическим феноменам человеческого сознания, которые часто побуждают нас к поступкам, явно противоречащим нашим же целям. К примеру, многие горожане мечтают жить в тишине, но мало кто из них пожелает поселиться в заброшенном замке — даже если он не верит в привидения и вампиров. Но независимо от капризов психологии логика жизни побеждает: на пепелище Хиросимы вновь выросли дома и рождаются дети. И даже трагедия Чернобыля не может надолго изменить логику развития атомной энергетики: у человечества нет пока другой длительной перспективы выжить. Атомную энергию невозможно теперь «закрыть». Точно так же нельзя упразднить автомобили, корабли и самолеты несмотря на то, что каждый год десятки и сотни тысяч людей, к сожалению, тонут в кораблекрушениях, гибнут в авто- и авиакатастрофах.
Грядущие проблемы энергетики без атомной энергии решить невозможно — с этим теперь согласны почти все. Но как надолго хватит «уранового топлива»? В каждом грамме земной породы содержится в среднем 3,5 -10~
6 г урана, то есть 3« 10“
8 г урана-235. В пересчете на энергию деления это составляет 600 кал, то есть всего лишь в 10 раз меньше, чем химическая энергия, заключенная в грамме угля. Кстати, в 1 г угля урана больше, а именно 0,8-10~
4 г, и при сгорании он большей частью остается в золе, которая составляет 20 % от веса исходного угля. Легко сосчитать, что в каждом грамме золы запасено около 60 ккал энергии деления урана-235, то есть примерно в 10 раз больше, чем энергия сгорания самого угля. Таким образом, земля под ногами — это сплошное месторождение ядерного топлива, и нужно только научиться его оттуда извлекать.
Во всем мире считаются рентабельными месторождения с содержанием урана больше чем 10“
3 г/г, то есть 1 г на 1 кг породы. В таких месторождениях — около 5 млн. тонн урана или 50 тыс. тонн урана-235, из которых сейчас на планете добывается около 300 тонн в год. Современный уровень потребления электроэнергии соответствует сжиганию около 500 тонн урана-235 в год, то есть при нынешних темпах развития энергетики запасов урана-235 хватит ненадолго — не более чем на 100 лет. Отсюда ясно, что для решения энергетической проблемы будущего нужно найти способ использовать уран-238. Такой способ нашли довольно быстро: Ферми предложил идею «реактора-размножителя», при работе которого ядерного топлива образуется больше, чем сгорает.
ПЛУТОНИЙ
Атомный реактор можно уподобить костру, в котором около 1 % сухих дров (уран-235), а все остальное — сырые поленья (уран-238). Спору нет, такой костер все равно греет, но все же обидно и неэкономно после того, как он прогорит, разбрасывать кучу тлеющих головешек. А нет ли способа их как-либо использовать? Один из них издревле применяют углежоги: они сооружают поленницу из сырых дров, укрывают ее, зажигают внутри костер, и через некоторое время сырые поленья превращаются в первосортный древесный уголь. Нечто похожее можно осуществить и в атомном реакторе, превращая «негорючий» уран-238 в «горючий» плутоний-239.
Чистый плутоний — это серебристо-серый тяжелый металл с плотностью 19,82 г/см
3 и температурой плавления 640 °C. Принято говорить, что его химические свойства изучены сейчас лучше, чем химия железа. В природе плутония практически нет: в урановых рудах его в 400 000 раз меньше, чем радия, но зато сотни тонн плутония хранятся в арсеналах разных стран.
Сейчас известно 15 изотопов плутония — от плутония-232 до плутония-246, все они радиоактивны с периодами полураспада от 20 мин до 76 млн. лет. Самый важный из них — плутоний-239. Его период полураспада Ti
/2 = 24 360 лет, то есть в масштабе человеческой жизни его можно считать стабильным. Подобно радию, он испускает а-частицы с энергией 5,1 МэВ и превращается при этом в уран-235:
1 строенный циклотрон, который мог ускорять дейтроны до энергии 16 МэВ. Направляя их на мишень из бериллия, он вызывал ядерную реакцию
d+9
Be^to
B + n
с мощным потоком нейтронов: чтобы получить такой же поток с помощью стандартного радон-бериллиевого источника, нужно несколько килограммов радия, то есть больше его мировых запасов. Облучая этими нейтронами тонкую урановую мишень, Макмиллан, как и многие до него, наблюдал множество осколков деления, которые вылетали из урановой мишени с большой энергией. Сама мишень тоже становилась радиоактивной и испускала электроны с периодом полураспада 23 мин, то есть как раз с тем периодом, который наблюдали еще в 1937 г. Ган, Мейтнер и Штрассман.
К этому времени уже не было особых сомнений в том, что это распадается изотоп урана-239, который образовался при захвате нейтрона ядром урана-238, по схеме
Р
238 тт 239 у-у 239
п+ -Np-
Трансурановый элемент с атомным номером 93, образующийся при p-распаде урана-238, в 1946 г. назовут нептунием, но, чтобы доказать его реальность, предстояло еще выделить его в чистом виде.
В мае 1940 г. Филипп Абельсон, геохимик из Вашингтонского университета, приехал ненадолго в Беркли, чтобы на уникальном в то время циклотроне продолжить исследования с ураном, начатые Макмилланом. Вдвоем им хватило недели, чтобы отделить новый элемент от урана. При этом оказалось, что он тоже испускает электроны, но с периодом полураспада 2,3 дня. Логично было предположить, что нептуний-239 превращается при этом в новый элемент 94, который впоследствии назовут плутонием:
299
99
Np
—---^ Pu
2,3 дня 1 Ги‘
Тогда это была только недоказанная гипотеза, но многие сразу в нее поверили.
Через год, в марте 1941 г., четверо американских исследователей — Джозеф Кеннеди, Гленн Сиборг, Эмилио Сегре и Артур Валь — доказали, что из нептуния-239 действительно образуется плутоний-239, который в свою очередь испускает а-частицы и с периодом полураспада 24 360 лет превращается
в хорошо знакомый уран-235. Два месяца спустя они убедились, что плутоний-239 под действием медленных нейтронов делится, подобно урану-235, в согласии с предсказаниями теории деления Бора — Уилера — Френкеля. Еще через год, 18 августа 1942 г., Баррис Каннингем и Луис Вернер в Беркли выделили первые 0,1 мг плутония. (Девять лет спустя за открытие плутония Эдвин Маттисон Макмиллан (1907— 1989) и Гленн Теодор Сиборг (р. 1912 г.) будут удостоены Нобелевской премии, 1951 г.).
Только через семь лет после опытов Ферми по облучению урана нейтронами стал вполне понятен их смысл: он наблюдал одновременно свыше сотни осколков деления урана-235 и, кроме того, всю цепочку превращений урана-238:
„ . 238тт 239тт *_______ 239тт
П+ 92^
92U iq-17
с 92 U
+ У
 239
239 XT . ~
ЗЗмин -
NP
+ е + v

2,3дня “
Рп + е+*
 235 у?
235 у?
24 360 лет
92 а'
По существу он был прав тогда, говоря о наблюдении трансурановых элементов, хотя и не представлял всей сложности наблюдаемого явления.
Возвращаясь к событиям тех не очень далеких, но уже исторических дней, трудно удержаться от мысли, что решение Ферми прекратить исследования реакций нейтронов с ураном (которое он никогда не мог себе простить) обернулось для человечества неожиданным благом. Страшно подумать, как бы повернулась история, если бы деление урана было открыто не в 1938 г., а в 1934 г. — вскоре после прихода нацистов к власти. Трудно сомневаться в том, что идущий к войне фашизм сумел бы использовать весь научный потенциал Германии, чтобы создать и применить ядерное оружие.
Открытие плутония изменило сам подход к решению урановой проблемы. Прежде всего, стало ясно, что поглощение нейтронов в уране-238 — полезный процесс, поскольку при этом образуется «ядерное топливо» — столь же и даже более эффективное, чем уран-235. Кроме того, плутоний можно отделять от урана, из которого он образуется, химическими методами, а это несравнимо проще, чем разделять изотопы урана. Однако вся эта красивая схема могла стать реаль-
300
ностью лишь при условии, что цепная ядерная реакция в природном уране действительно осуществима. (Сырые поленья можно просушить только в том случае, если костер пусть плохо, но все же горит.) Пуск первого ядерного реактора в декабре 1942 г. разрешил это последнее сомнение. Отныне на пути к ядерной энергии оставались лишь инженерные и технологические трудности. Их тоже немало, и преодолеть их было не просто: достаточно вспомнить, что для выделения 1 г плутония надо переработать примерно 1 кг облученного урана, пропустив его через 30 химических реакций и более сотни операций. Но уже в августе 1944 г. в Хэнфорде были запущены огромные «урановые котлы», а весной 1945 г. они давали почти по килограмму плутония в день.
В истории атомной энергии поражает контраст между простотой конечного результата (урановые стержни в баке с водой) и изощренностью физических идей, необходимых для понимания процессов, происходящих в этом баке. Для решения проблемы ядерной энергии были использованы все главные достижения науки XX века: теория относительности и квантовая механика, атомная и ядерная физика, учение о радиоактивности и техника ускорителей. Пожалуй, никогда прежде повседневная жизнь
людей не зависела так явно от успехов самого абстрактного знания.
АТОМНАЯ БОМБА
Сочетание слов «атомная бомба» впервые появилось в научно-фантастическом романе Герберта Уэллса «Освобожденный мир» в 1913 г. (Любопытно, что в этом же романе Уэллс предсказал открытие искусственной радиоактивности в '1933 г. и пуск первой атомной электростанции в 1953 г. и в обоих случаях ошибся всего на год.) Постепенно к этим словам привыкли.
«Мир — рвался в опытах Кюри Атомной, лопнувшею бомбой На электронные струи...»
— напишет Андрей Белый в 1921 г.
В 1933 г. венгерский ученый Лео Сцилард, спасаясь от фашизма, приехал в Англию и там впервые прочел роман Уэллса. Впечатление от романа, недавнее открытие нейтрона, предчувствие надвигавшейся войны и ненависть к нацизму — вся эта сложная смесь эмоций и новых знаний привела к тому,
что весной 1934 г. (вскоре после открытия искусственной радиоактивности) Сцилард взял патент на первую атомную бомбу, действие которой он мыслил себе как взрыв в результате цепной реакции размножения нейтронов в бериллии: п +
9Ве-^
8Ве + 2п.
По-видимому, это была первая попытка осуществить не-затухающую цепную ядерную реакцию, обреченная, однако, на неудачу, поскольку в предложенной схеме энергия не выделяется, а, напротив, поглощается. Поэтому, когда Сцилард пришел со своей идеей к Резерфорду, тот попросту отказался ее обсуждать.
Тем не менее мысль о том, что атомную бомбу в принципе можно сделать и, что еще хуже, она может попасть в преступные руки нацистов, не давала Сциларду покоя, и, когда в январе 1939 г. он узнал от своего соотечественника Юджина Вигнера об открытии Гана и Штрассмана, он немедленно начал действовать: одолжил деньги у знакомых на аренду радия, необходимого для экспериментов, написал Жолио-Кюри и убедил Виктора Вайскопфа дать тому телеграмму с просьбой о прекращении дальнейших научных публикаций по проблеме урана, а также призвал к добровольной самоцен-зуре своих коллег. Наконец, после того как Жолио-Кюри все-таки опубликовал свои результаты, из которых следовало, что в принципе цепная реакция в уране осуществима, Сцилард написал знаменитое письмо о грозящей цивилизованному миру опасности, которое 2 августа 1939 г. за подписью Эйнштейна было послано президенту США Рузвельту. (В мае 1945 г., после разгрома фашизма, Сцилард станет писать другие письма: с призывом запретить использование атомного оружия — поистине ему суждено было стать Кассандрой атомной проблемы.)
В течение всего 1939 г. об атомной бомбе говорили и писали повсеместно, вплоть до вечерних газет, вероятно, потому, что сами физики все-таки не очень верили в ее реальность — особенно после того, как Нильс Бор объяснил, что для этого надо сначала разделить изотопы урана, о чем тогда и помыслить еще не решались. (Сам Нильс Бор готов был сформулировать «пятнадцать веских аргументов, доказывающих, что это невозможно», а Отто Ган с надеждой повторял: «Несомненно, это было бы противно воле божьей».) Не случайно поэтому, что первый разговор Ферми об атомной бомбе с чинами из военно-морского ведомства США, который состоялся уже в марте 1939 г., окончился вежливым взаимным недоверием.
302
Начало второй мировой войны в сентябре 1939 г., вторжение немецких дивизий в Бельгию весной 1940 г., падение Парижа в июне 1940 г., нападение Германии на СССР в июне 1941 г. и атака Японии на Пёрл-Харбор в декабре 1941 г. заставили государственных чиновников прислушаться, наконец, к предостережениям физиков. К тому же стало известно, что все ведущие немецкие физики собраны в «Урановое общество», что 1200 т уранового концентрата из Бельгийского Конго (половина мирового запаса) конфискованы Германией у побежденной Бельгии и что единственный в мире завод по производству тяжелой воды в Норвегии находится под особой охраной частей СС.
Нависшую опасность острее всего чувствовали ученые-эмигранты: Лео Сцилард и Юджин Вигнер из Венгрии, Альберт Эйнштейн, Виктор Вайскопф, Ганс Бете, Франц Симон и Рудольф Пайерлс из Германии, Энрико Ферми из Италии, Отто Фриш из Австрии, Фрэнсис Перрен, Ганс Халбан и Лео Коварски из Франции, Иосиф Ротблат из Польши, — они и стали инициаторами военной атомной программы. И все же до лета 1940 г. очевидные трудности разделения изотопов урана оставляли мало надежд на то, что атомную бомбу можно будет сделать в обозримом будущем.
Положение сильно изменилось после 15 июня 1940 г., когда Филипп Абельсон и Эдвин Макмиллан сообщили, что при облучении урана-238, по-видимому, образуется делящийся изотоп нового трансуранового элемента, названный впоследствии плутонием-239. Поскольку плутоний можно отделить от урана химическими методами, то проблема разделения изотопов тем самым устраняется. Джеймсу Чэдвику следствия этой работы казались настолько очевидными, что он послал в США официальный протест против публикации такого рода исследований в открытой печати. Его беспокойство имело основания: в июле 1940 г. Карл фон Вейцзеккер в Германии уже понимал, что уран-235 в атомной бомбе можно заменить плутонием-239, а вскоре к тому же выводу пришел и Фриц Хоутерманс. Несколько раньше, 27 мая 1940 г., в США на значение
239Ри обратил внимание Луис Тёрнер в представленном секретном тогда докладе. (Именно в это время все публикации по проблеме урана в США были запрещены.)
Раньше других реальную возможность сделать атомную бомбу осознали в Англии, и там же (Фриш, Пайерлс, Перрен и Чэдвик) в 1939—1940 гг. были сделаны первые оценки ее критической массы. Именно эти работы в значительной мере повлияли на решение правительства США от 6 декабря
1941 г. начать работы по созданию атомной бомбы. 16 июля 1945 г. в 5 ч 30 мин утра была взорвана первая из них. К концу этого года их было уже около двухсот.
Атомная бомба — это просто-напросто кусок урана-235 или плутония-239, а весь ее секрет — в трудности выделения этих делящихся изотопов. Минимальная масса атомной бомбы определяется критическими размерами куска урана или плутония, то есть такими размерами куска, в котором уже возможна цепная реакция, несмотря на то, что часть нейтронов уходит через его поверхность. Поскольку, в отличие от атомного реактора, в бомбе нет урана-238, поглощающего нейтроны, то надобность в замедлителе отпадает и поэтому объем ее не превышает одного литра. Критическая масса шарообразного куска урана-235 равна 47,8 кг, плутония-239 — всего 9,65 кг. Массу этих шаров можно значительно уменьшить, если предварительно сжать их с помощью обычной взрывчатки.
Для взрыва атомной бомбы достаточно соединить вместе ее части, размеры каждой из которых меньше критических. Мощность атомных бомб, сброшенных на Хиросиму (около 20 кг урана-235) и Нагасаки (около 5 кг плутония-239), эквивалентна взрыву 13 и 21 тыс. тонн тринитротолуола соответственно. В первом случае «сгорело» 0,7 кг урана, во втором — 1,2 кг плутония, масса бомб уменьшилась на 0,7 г и 1,2 г соответственно, температура при взрыве превысила температуру в центре Солнца, а грибообразное облако радиоактивного праха поднялось до высоты 15 км.
В современных ядерных бомбах, кроме энергии деления, используют энергию синтеза ядер дейтерия и трития по схеме
d + t-^
4He + n + 17,6 МэВ.
Идею такой «водородной бомбы» еще в феврале 1942 г. обсуждали Ферми и Теллер, а в 1952 г. она уже была взорвана.
В водородной бомбе обычная плутониевая бомба служит запалом: при ее взрыве температура достигает 100 млн. градусов — в семь раз больше, чем в центре Солнца. При такой температуре два ядра изотопов водорода уже могут преодолеть кулоновский барьер отталкивания и слиться в ядро гелия, выделив при этом огромную энергию: при «горении» смеси дейтерия и трития освобождается энергии в три раза больше, чем при «сгорании» урана-235 равной массы.
В реальных конструкциях водородного (или
термоядерного) оружия вместо смеси дейтерия и трития используют
304
дейтерид лития-6
6LiD. Тритий в такой бомбе готовится в момент взрыва атомной бомбы, в потоке нейтронов деления, в результате ядерной реакции n+
6Li --->
4He + t.
Критической массы для термоядерной бомбы не существует, а самая большая из взорванных до сих пор — в 5 тысяч раз мощнее бомбы, сброшенной на Хиросиму.
Всего в арсеналах разных стран накоплено сейчас более 50 тысяч водородных бомб, каждая из которых примерно в 20 раз мощнее первой атомной бомбы. Шесть стран владеют технологией изготовления ядерного оружия, и, по оценкам, еще восемь близки к его
АТОМНАЯ ПРОБЛЕМА


производству. Одним словом, сделать атомную бомбу сейчас — не проблема, значительно труднее понять, как теперь жить на Земле, если на каждого обитателя планеты, вклю
чая стариков и грудных младенцев, уже сейчас накоплено по 5 т ядерной взрывчатки.
Со времени открытия радиоактивности, выяснения ее природы и запасов энергии, с ней связанных, ученые всегда опасались, что, влекомые инстинктом познания, они невольно уподобятся злополучной Пандоре.
В 1903 г. Резерфорд как-то заметил: «Может статься, что какой-нибудь идиот в лаборатории взорвет ненароком весь мир».
В том же году Пьер Кюри с беспокойством говорил в своей нобелевской речи: «Можно думать, что в преступных руках радий станет очень опасным, и здесь уместно задать вопрос, заинтересовано ли человечество в дальнейшем раскрытии секретов природы, достаточно ли оно созрело для того, чтобы с пользой применить полученные знания, не могут ли они повлиять отрицательно на будущее человечества?»

|
|
Р. Оппенгеймер
|
В 1936 г., незадолго до открытия деления урана, Фрэнсис Астон возвращается к той же мысли: «...доступные источники внутриатомной энергии, безусловно, имеются повсюду вокруг нас, и настанет день, когда человек высвободит и поставит под контроль ее почти бесконечную силу. Мы не сможем помешать ему сделать это и лишь надеемся, что он не будет использовать ее исключительно для того, чтобы взорвать своего ближайшего соседа».
Ощущение этой изначальной антиномии между логикой познания и нравственным императивом не покидало ученых даже в моменты их наивысшего торжества: «Все мы теперь сукины дети»,— сказал Кеннет Бейнбридж Роберту Оппенгеймеру, глядя на зловещий атомный гриб в пустыне Аламогордо. (Он мог воочию удостовериться в справедливости формулы Эйнштейна
Е — тс\ которую он сам же подтвердил количественно в 1933 г.) «Мы делали дело дьявола»,— скажет Роберт Оппенгеймер десять лет спустя.
При виде атомного зарева ученые не только испытали гордость за мощь человеческого разума, но сразу же почувствовали и свое бессилие воспрепятствовать преступным применениям открытых ими сил. Осознание этого бессилия стало источником многих личных трагедий. «Страшно подумать,— писал Фредерик Содди в 1949 г.,— в какие неподготовленные руки наука столь преждевременно вложила силы, немногим более четырех лет назад казавшиеся недоступными...» А мягкий, кроткий и доброжелательный Отто Ган после Хиросимы и Нагасаки был близок к самоубийству.
Не все ученые восприняли новую ситуацию столь трагично. «Быть может, жизнь станет теперь менее счастливой, но она не прекратится. У нас нет пока такой силы, которая могла бы уничтожить нашу планету»,— писал Ферми после испытания водородной бомбы. Эйнштейн соглашался с ним: «Открытие деления урана угрожает цивилизации и людям не более, чем изобретение спички. Дальнейшее развитие человечества зависит от его моральных устоев, а не от уровня технических достижений». А Роберт Оппенгеймер в конце жизни сравнивал страх перед атомной бомбой с ужасом древнего человека перед молнией и бушующим океаном. Современному человеку эти стихии также неподвластны, но он изобрел громоотвод и построил корабли, под защитой которых чувствует себя в
306
безопасности. Точно так же трудно поверить в то, что когда-либо удастся укротить стихию человеческих страстей, но можно надеяться, что со временем человек найдет способ защиты от их гибельных последствий. Как это ни парадоксально, но именно после изобретения атомной бомбы Европа вот уже сорок лет не знает войн — такое за всю ее историю случилось только однажды. С 1945 г. на Земле прошло свыше ста больших и малых войн, но ни одна из них не коснулась территории ядерных держав.
Человек впервые узнал огонь благодаря лесным пожарам. В отличие от животных, он сумел преодолеть ужас перед ним и научился им управлять. Точно так же страх перед атомной бомбой не должен заслонять нам пути в будущее, парализовать волю к жизни и веру в нашу способность предотвратить самоуничтожение. Храм Артемиды и сейчас беззащитен против геростратов, но отсюда еще не следует, что строить его не стоило. И, наконец, «человек мудрый ни о чем так мало не думает, как о смерти».
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
Хронология атомной эры
Сейчас, когда стали известны факты, хранимые во время войны в глубоком секрете, поучительно проследить, что и когда предпринимали разные страны, разделенные фронтами и океанами, для создания атомного оружия.
1939 г.
6 января —напечатана статья Гана и Штрассма-
на об открытии деления урана;
17 марта — встреча Энрико Ферми с представи
телем военно-морских сил США;
30 апреля — в министерстве науки Германии со
стоялось первое совещание по проблеме урана;
май — Генри Тизард пытается приобрести для
Англии монопольное право на покупку урана у бельгийской компании «Юнион Миньер» — единственного в то время производителя уранового концентрата;
2 августа — письмо Эйнштейна к Рузвельту;
I сентября — нападение Германии на Польшу, нача
лась вторая мировая война;
26 сентября
21 октября
16 декабря
7 марта
16 марта
8 апреля
10 апреля
май
14 июня
июль
30 июля
сентябрь
15 октября
— по инициативе министерства вооружений в Германии создано Урановое общество с участием В. Боте, Г. Гейгера, В. Гейзенберга, К. Вейцзеккера и др.;
— первое заседание Консультативного комитета по урану, созданного по распоряжению Рузвельта;
— первое обсуждение проблемы плутония в составе: Э. Ферми, Э. Сегре, Э. Лоуренс, Дж. Пэгрем.
1940 г.
— второе письмо Эйнштейна к Рузвельту;
— капитан Жак Аллье доставил Жолио-Кюри 185 л тяжелой воды из Норвегии;
— вторжение Германии в Данию. К®н-фискация запасов урана в Бельгии. Установление контроля над заводами тяжелой воды в Норвегии:
— под руководством Дж. П. Томсона в Лондоне проведено совещание по проблеме атомной бомбы. Впервые обсуждалась реакция деления на быстрых нейтронах;
— Ф. Абельсон и Э. Макмиллан в Беркли установили, что при облучении урана-238 нейтронами должен образовываться плутоний-239;
— падение Парижа;
— письмо В. И. Вернадского, А. Е. Ферсмана и В. Г. Хлопина заместителю председателя Совнаркома Н. И. Булганину. Беседа В. И. Вернадского с В. М. Молотовым. Под руководством А. Е. Ферсмана создана комиссия для поисков месторождений урана;
— на заседании президиума АН СССР создана Урановая комиссия под руководством В. Г. Хлопина;
— вторая половина мирового запаса уранового концентрата (около 1200 т) переправлена из Катанги в Нью-Йорк;
— президиум АН СССР утвердил первую программу исследований по урановой проблеме;
декабрь
май
22 июня
30 июня
11 июля
15 июля
3 октября
11 октября
18 октября
6 декабря
6 декабря
7 декабря
январь
26 февраля
— Дж. Чэдвик правильно оценил критические размеры атомной бомбы.
1941 г.
— в Беркли доказано, что плутоний-239 может заменить уран-235 в качестве ядерного топлива и взрывчатки;
— нападение Германии на СССР;
— доклад Э. Ферми Урановому комитету США о перспективах атомной энергии;
— доклад Э. Лоуренса правительству США о возможности создания плутониевой бомбы;
— доклад Дж. П. Томсона правительству Великобритании о возможности создания атомной бомбы *из урана-235 еще до конца войны;
— Дж. П. Томсон и М. Олифант знакомят американских коллег с результатами британских исследований по проблеме атомной бомбы;
— послание Рузвельта Черчиллю с предложением объединить усилия в деле создания ядерного оружия;
— создана британская промышленная компания «Тьюб эллойз» для технической реализации атомного проекта;
— решение правительства США о начале работ по проблеме атомной бомбы;
— начало контрнаступления Красной Армии под Москвой;
— нападение Японии на Пёрл-Харбор; вступление США в войну.
1942 г.
— в Англии начато строительство опытного завода по разделению изотопов урана методом газовой диффузии (теорию процесса разработали Ф. Симон, Р. Пайерлс и П. Дирак);
— теоретическая конференция в Берлине по проблемам урановой бомбы с участием В. Гейзенберга, О. Гана, В. Боте и др.;
7 апреля
4 июня
20 июня
23 июня
8 июля
13 августа
18 августа
2 декабря
2 февраля
11 февраля
21 февраля
март
— письмо Г. Н. Флёрова И. В. Сталину о необходимости возобновить работы по проблеме урана;
— обсуждение проблемы атомной бомбы с участием германского министра вооружений, генералов и адмиралов третьего рейха;
— встреча Рузвельта и Черчилля; решение объединить усилия Англии и США в деле создания атомной бомбы;
— доклад министра вооружений Шпеера Гитлеру о перспективах создания атомного оружия. Работа в этом направлении практически прекращена;
— совещание в штабе японского флота по проблеме атомного оружия с участием физиков Иосио Нишины и Рио-киты Сагане;
— для выполнения военной атомной программы в США создан «Манхэттенский округ»;
— в Беркли (США) выделен первый образец плутония массой 0,1 мг;
— под руководством Энрико Ферми в США осуществлена первая самопод-держивающаяся ядерная реакция. Открыт путь для промышленного получения плутония.
1943 г.
— разгром фашистских войск под Сталинградом;
— Игорь Васильевич Курчатов назначен руководителем советской урановой программы;
— норвежские патриоты взорвали завод по производству тяжелой воды в Ве-морке (Норвегия) и тем самым лишили германский урановый проект замедлителя;
— в Лос-Аламосе под руководством Роберта Оппенгеймера организована специальная лаборатория для создания атомной бомбы;
5 мая
август 1944 г.
16 июля
6 августа
9 августа
— доклад Нишины штабу ВМС Японии о технической возможности создания атомной бомбы. Утверждена программа исследований по этой проблеме;
— в Хэнфорде (США) начато промышленное производство плутония.
1945 г.
— первое испытание плутониевой атомной бомбы в пустыне Аламогордо, Нью-Мексико (США);
— город Хиросима в Японии уничтожен атомной бомбой из урана-235;
— город Нагасаки уничтожен атомной бомбой из плутония-239;
25 декабря 1946 г.— в Москве под руководством И. В. Курчатова осуществлена незатухающая ядерная реакция;
10 июня 1948 г. —в СССР запущен промышленный ядерный реактор по производству плутония;
29 августа 1949 г.— испытана первая советская атомная
бомба из плутония-239;
30 октября 1952 г.— на западном побережье Австралии
взорвана первая британская атомная бомба;
1 ноября 1952 г. — на атолле Эниветок взорвано термоядерное устройство (США);
12 августа 1953 г.— в СССР взорвана первая термоядер
ная бомба из дейтерида лития;
13 февраля 1960 г.— на юго-западе Сахары испытана пер
вая атомная бомба Франции;
16 октября 1964 г.— испытана атомная бомба в Китае; май 1974 г. — взорвано атомное устройство в Индии.
Всего в мире за прошедшие 40 лет взорвано около 2000 атомных бомб и накоплено сотни тонн плутония.
Содди об атомной энергии
Фредерик Содди был не только выдающимся ученым, но также человеком разносторонней культуры, глубоким и оригинальным мыслителем. Эти грани его личности отчетливо проявились на страницах написанных им научно-популярных книг, которые в начале нашего века пользовались заслужен-

ным успехом и широкой известностью. (Фредерик Жолио-Кюри, по его собственному признанию, выбрал жизненный путь под влиянием книги Содди «Радий и его разгадка».) В этих книгах он настойчиво внушал, какие необратимые изменения в жизнь людей принесла с собой новая наука о радиоактивности. Мало кто в его время с такой определенностью и беспокойством говорил о будущем атомной энергии, об экологии и энергетическом кризисе — обо всем том, что лишь сейчас, три четверти века спустя, стало очевидным для многих. Уже в своей лекции 23 февраля 1904 г. собравшимся, что «искусственная трансму-
Содди
тация
блемы
Представленные здесь отрывки из многочисленных книг
объяснял
элементов навсегда освободит человечество от проэнергии».
Содди интересны во многих отношениях: и как документы эпохи, и как отпечаток его личности, и как редкая возможность взглянуть глазами современника на первые шаги атомной эры, зная уже, к чему они впоследствии привели.
В 1907 г. в своей знаменитой книге «Радий и его разгадка» Содди писал: «Через несколько лет основы радиоактивности будут преподаваться во всех школах, ибо они принадлежат к основным принципам физики».
«В последнее столетие культурное человечество стало, так сказать, совершеннолетним и вступило в обладание наследством, которое солнце в течение долгих времен запасло в каменном угле. Человечество стремится как можно скорее растратить это наследство. С юношеской беззаботностью оно не думает о будущем и живет надеждою, что неисчерпаемы те запасы энергии, от которых наша культура зависит во всех отношениях...»
«Мы действительно переживаем замечательный момент. Первым шагом на длинном пути от варварства к цивилизации, пройденным человеком, было, по-видимому, искусство добывать огонь... Нетрудно себе представить, как он впервые, благодаря естественным пожарам, познал огонь и его свойства. Открытый нами недавно внутренний запас энергии в атомах ставит нас в то же положение, в котором первобытный человек находился по отношению к стихийной силе огня: мы знаем о существовании этого внутреннего запаса только благодаря естественным проявлениям радиоактивности».
«Не надо особого полета фантазии, чтобы в энергии видеть источник физической жизни вселенной, а ключ к первоисточникам энергии, как мы в настоящее время знаем, дает превращение элементов».
«Жизнь зависит, конечно, столько же от постоянного притока вещества, как и от постоянного притока энергии... Одно и то же вещество, одни и те же химические элементы служат неизменно для бесчисленных циклов жизни, но для них необходим непрерывный приток свежего запаса энергии... Одно и то же количество энергии в одних и тех же условиях работает только один раз. Борьба за существование в основе своей и есть непрерывная борьба за свежий запас физической энергии».
«Дикий человек, который не знал земледелия и не умел добывать огня, погибал от голода и холода, если он не уподоблялся хищному зверю и не пожирал других зверей. Хотя запасы тепла и пищи существовали везде вокруг него и в силу естественных процессов должны были быть ему известны, тем не менее он не умел воспользоваться ими для своих целей. Теперь — нечто подобное. Вся наша цивилизованная раса и теперь еще живет в борьбе за ограниченный запас энергии, тогда как кругом находятся неистощимые запасы, способные поддержать нашу жизнь...»
«Благодаря завоеваниям экспериментальной науки в области радиоактивности, наследство человека увеличилось, его стремления возвысились, и судьба его в некоторых отношениях настолько облагородилась, что мы в настоящее время не можем даже этого вполне оценить. Истинное благополучие мира лежит в его энергии, и, благодаря открытию радиоактивности, в первый раз стало ясно, что тяжелая борьба за существование и за остатки энергии, за счет которой развился род человеческий, не есть уже больше единственно возможный и неизбежный его удел.
Законно стало стремление человека верить в то, что настанет некогда день, когда он получит возможность овладеть для своих целей первоисточниками энергии, которые природа так ревниво охраняет для будущего. До осуществления этой надежды, без сомнения, очень далеко, но самая возможность ее изменяет отношение человека к окружающему и придает высший смысл существованию».
Четыре года спустя в своей книге «Материя и энергия» он продолжал:
«Страх израсходовать запас пищи врожден нам; страх израсходовать запас топлива человек еще должен развить в себе... Прежние эпохи получили название от некоего
мате-
риала: был век каменный, бронзовый, железный. Но ни один из них не состоялся бы, если бы человек не знал
огня. Истинное богатство мира — его энергия. Именно признание энергии особой сущностью отличает нынешний век от веков минувших...»
«Век, в который мы живем, век каменного угля, черпает свою жизненную влагу из мелеющей лужи, оставшейся между приливом и отливом великой космической волны... Шумный прогресс последнего полустолетия, открывающего повсюду девственные территории и совершенно не думающего о сохранении естественных источников, сменяется периодом раздумья; цивилизацщ! приходится подумать о грядущем расчете со своим кредитором.
Цивилизация, как она сейчас существует, даже с физической точки Зрения не представляет собой непрерывного само-поддерживающегося движения... Она становится возможной лишь после многовекового накопления энергии. Аппетит ее увеличивается тем, чем она питается. Она пожинает то, чего не сеяла, и до сих пор тратит, не возобновляя. Ее сырой материал — энергия, а ее продукт — знание...»
«Пока все победы науки над природой смахивают на успехи школьника. Но этот период уже проходит... Экономия и бережливость неизбежно сменят идею развития и прогресса... Покуда же наука для нас — попутный ветер. Существует ошибочное представление, будто наука создает богатство, рост которого сопутствует применению знаний. Современная наука и ее синоним, современная цивилизация, не создает ничего, кроме знания... Мы склонны думать, таким образом, что потомки наши будут свидетелями интересного состязания между прогрессом науки, с одной стороны, и истощением естественных ресурсов — с другой...»
«Рано или поздно — но, разумеется, не в бесконечно отдаленном будущем — на Земле для пополнения естественного расходования энергии не останется ничего, кроме первоначальных запасов атомной энергии...»
В 1920 г., пережив смерть Мозли и варварство первой мировой войны, он добавлял: «Будем надеяться, что достижение в области источников физических сил, подвластных человечеству, не разделит судьбу тех, которые в прошлом превращали заслуженное наукой благословение в проклятие. Как неожиданно и внезапно было сделано само открытие радиоактивности, так в любой момент какой-нибудь счастливец из небольшой группы исследователей, погруженных в эту область науки, может найти ключ и использовать его. Таким образом, первоисточник природной энергии был бы открыт
314
для человеческого знания и был бы использован у самого истока,— на благо или во вред человеку, смотря по тому, правильно ли усвоены длинные и горькие уроки тяжелого прошлого и настоящего».
Среди открывателей и первых исследователей радиоактивности Содди — почти единственный, кто дожил до кошмара Хиросимы и дождался пуска первой атомной электростанции. На склоне лет он написал еще одну книгу — «История атомной энергии», в которой подвел итоги полувековой и поистине фантастической истории приручения человеком атомного огня.
ГЛАВА 18
Сирин
Созерцание звездного неба во все времена возбуждало смутное беспокойство в душе человека. Успехи новейшего знания здесь мадо что изменили: тайна неба не исчезла, она лишь отодвинулась.
О небе мы знаем теперь много. Наше единственное Солнце — рядовая звезда среди ста миллиардов других звезд, населяющих нашу Галактику, а она — лишь одна из многих миллиардов таких же галактик, разбросанных в видимой части Вселенной. Наша Земля со скоростью 30 км/с вращается вокруг Солнца, которое со скоростью 200 км/с движется вокруг центра Галактики, а она, в свою очередь, со скоростью 600 км/с мчится неведомо куда. Космические расстояния чудовищно огромны и подавляют воображение своей непредставимостью: от ближайшей звезды Проксима Центавра свет идет к нам 4,3 года, от центра Галактики — 30 тыс. лет, от туманности Андромеды — ближайшей к нам большой галактики — 2 млн. лет, а от видимых границ Метагалактики — свыше 10 млрд. лет. Мы знаем теперь размеры, массу, температуру и состав звезд, почему они светятся, сколько живут и отчего взрываются,— мы действительно много знаем.
Но, может быть, именно поэтому в час полуночи, когда бесшумно распахивается окно в звездную бездну, человеком вдруг овладевает пронзительное чувство покинутости на крохотном островке в океане Вселенной. Он вдруг отчетливо сознает всю хрупкость феномена жизни, чудом прикрепившейся к тонкой застывшей корке раскаленной изнутри планеты, летящей вокруг Солнца в двадцать раз быстрее артиллерийского снаряда. Отчаяние таких минут человеку помогают преодолеть лишь древнее тепло очага, глаза детей и рука друга.
В былые времена спасение от страха перед небом искали и находили в религии. В наш просвещенный век концы логических умозаключений и очевидных следствий точного знания не принято топить в бездонном колодце веры. Нам дают силы сознание своей принадлежности к роду человеческому и вера в его еще не ясное предназначение, восхищение мощью его разума и смирение перед лицом познанных им законов.
СВЕТ СОЛНЦА
Странно, что вопрос об источниках энергии Солнца, по-видимому, мало занимал не только древних философов, но даже таких ученых нового времени, как Лаплас и Гершель. Сейчас хорошо известно, что за пределами атмосферы каждую секунду на квадратный сантиметр поверхности Земли лучи Солнца приносят энергию 0,135 Дж, то есть 0,135 Вт/см
2. Расстояние до Солнца
R = 150 млн. км, или 1,5-10
13 см, то есть полная мощность излучения Солнца равна
4л/?
2-0,135 = 4л(1,5« 10
13)
2 - 0,135 = 3,8 -10
26 Вт.
Это огромная энергия: чтобы получить ее, нужно каждую секунду сжигать 1,3-10
16 т угля — в тысячу раз больше, чем все его известные запасы на Земле. Поэтому если бы Солнце светило за счет горения угля, то при массе 2 • 10
33 г его хватило бы только на
(2-10
33)/(1,3-10
22) =1,5.10
,1’*с = 5«10
3 лет
— всего на 5 тыс. лет. Несуразица очевидная, но только в 1845 г. на нее обратил внимание открыватель закона сохранения энергии Роберт Майер (1814—1878). Сам Майер в 1848 г. полагал, что энергия Солнца объясняется его столкновениями с метеорами. Предлагались и другие объяснения: Герман Гельмгольц в 1854 г. видел источник энергии Солнца в его постепенном сжатии, а Джеймс Джинс объяснил ее слиянием протонов и электронов.
Открытие радиоактивности изменило направление мыслей ученых, и, хотя спектроскоп бесстрастно свидетельствовал об отсутствии на Солнце радия, мысль о «субатомном» источнике его энергии в начале века стала общепринятой. Тот же спектроскоп сообщил, что Солнце состоит в основном из водорода и гелия, поэтому, как только стали известны точные измерения Астона для масс атомов, английский астрофизик Артур Стэнли Эддингтон (1882—1944) сразу же сказал, что излучение Солнца — это энергия слияния четырех ядер водорода в ядро гелия.
В 1920 г. у этой гипотезы было много противников, цключая и Резерфорда. В лаборатории Кавендиша ему только что удалось осуществить первую ядерную реакцию, и он лучше других знал, насколько это трудно. «Звезды недостаточно горячи для этого»,— возражал Резерфорд. «Найдите местечко Погорячее»,— советовал ему Эддингтон (намекая на жар в аду) и добавлял: «То, что доступно лаборатории имени Кавендиша, не может быть слишком трудным для Солнца». Однако до создания квантовой механики эмоции мало могли помочь в разрешении этого спора.
В 1929 г., вскоре после объяснения Гамовым квантовой природы явления а-распада, выпускники Гёттингенского университета Рудольф Аткинсон и Фриц Хоутерманс указали, что при температурах около 20 млн. градусов протоны за счет туннельного эффекта могут преодолеть кулоновский барьер отталкиванид^легких ядер и войти в состав нового ядра, выделив при этом довольно большую энергию связи, которая вполне может обеспечить длительную светимость Солнца. Но и эта догадка была несколько преждевременной: пройдет еще 10 лет, прежде чем Ганс Альбрехт Бете (р. 1906 г.) построит последовательную теорию ядерного горения в звездах.
За это время было сделано несколько фундаментальных открытий, без которых его теория была бы невозможной:
1931 г. —Вольфганг Паули высказал гипотезу о сущест
вовании нейтрино—нейтральной безмассовой частицы v.
1932 г. — Гарольд Клейтон Юри открыл тяжелый изотоп
водорода дейтерий d (Нобелевская премия 1934 г.).
— Джеймс Чэдвик открыл нейтрон п (Нобелевская премия 1935 г.).
— Карл Дэйвид Андерсон открыл позитрон е
+ (Нобелевская премия 1936 г.).
— Дмитрий Дмитриевич Иваненко выдвинул гипотезу о протонно-нейтронной структуре ядра.
1933 г. — Энрико Ферми создал теорию p-распада ядер
и ввел в физику новый тип взаимодействий — слабое.
1934 г. — Ирэн и Фредерик Жолио-Кюри открыли искус
ственную радиоактивность и p-распад протонов в ядрах на нейтрон, позитрон и нейтрино (Нобелевская премия 1935 г.).
Кроме того, за 10 лет квантовая механика стала необходимым и привычным инструментом исследования в атомной и ядерной физике, в физике кристаллов и теоретической химии, а понятия «сечение ядерной реакции» и «резонанс» вошли в повседневный научный обиход.
Опираясь на эти достижения, Георгий Гамов и Эдвард Теллер смогли в 1938 г. осмысленно повторить оценки Аткинсона и Хоутерманса и отнестись к ним серьезно. В апреле 1938 г. Гамов собрал в Вашингтоне небольшую конференцию с участием астрофизиков и ядерных физиков, на которой присутствовали Карл Вейцзеккер и Ганс Бете. Вскоре после этого появились их знаменитые статьи об источниках энергии звезд, которые в 1939 г. завершились обстоятельной работой Бете (Нобелевская премия 1967 г.). Теория Бете проверялась и уточнялась вплоть до середины 50-х годов, и в настоящее время ее суть можно изложить довольно просто. («Нет ничего проще звезды»,— любил повторять Эддингтон.)
В недрах Солнца, где давление достигает 100 млрд, атмосфер, плотность свыше 100 г/см
3, а температура — 13—14 млн. градусов, происходит последовательность реакций, известная теперь как протон-протонный или водородный цикл ядерных реакций в звездах:
р + р -^d + е
+ + V + 1,442 МэВ (1,3 • 10
юлет)
d + р —»-
3Не + у + 5,494 МэВ (6с)
3Не +
3Не -^
4Не + 2р +12,86МэВ (10
6лет)
4р -*
4Не + 2е
+ + 2v + 2 у +• 26,73 МэВ
Самая длительная стадия — первая: пройдет 13 млрд, лет, прежде чем протон найдет себе пару и образует с ним ядро дейтерия — слабосвязанное состояние протона и нейтрона. Это и неудивительно: для этого он должен предварительно превратиться в нейтрон, а скорость такой ядерной реакции p->n + e
+ + v весьма мала, поскольку она определяется слабыми взаимодействиями.
Образовавшийся дейтрон уже через 6 с вступает в реакцию с протоном и образует ядро легкого изотопа гелия
3Не, которое потом блуждает примерно миллион лет, прежде чем встретит другое такое же ядро и при слиянии с ним образует а-частицу (ядро
4Не), вновь освобождая 2 протона. Но пройдет еще несколько миллионов лет, прежде чем энергия, выделившаяся в центре Солнца, достигнет его поверхности и оттуда излучится в мировое пространство. Еще через 8 мин лучи Солнца достигнут Земли.
В действительности процесс «горения» ядер водорода происходи немного сложнее: кроме основного цикла идут побочные, благодаря которым энерговыделение в протон-протонном цикле снижается до 26,172 МэВ. Кроме того, наряду с основным циклом (его вклад составляет 86 %) синтез водорода в гелий происходит по так называемому углерод-азотному циклу, где энерговыделение равно 24,97 МэВ. Поэтому в среднем при слиянии 4 протонов в ядро гелия выделяется энергия
(26,17.0,86 + 24,97.0,14) МэВ = 26,00 МэВ,
то есть по 6,5 МэВ на каждое сгоревшее ядро водорода. Это означает, что его масса т
н= 1,007825 а. е. м. уменьшается при этом на
Ат = 6,5 МэВ/931,5 МэВ = 0,006978 а. е. м.,
то есть на 0,69 % — в семь раз больше, чем при делении ядра урана.
В 1 г водорода содержится 6,02-10
23 ядер, а при их ядер-ном горении выделится энергия
(6,02-10
23).6,5 МэВ = 3,91 • 10
24 МэВ = 6,27-10
18 эрг =
= 6,27- 10
й Дж.
Поэтому, чтобы обеспечить мощность излучения 3,8-10
26 Вт, в недрах Солнца каждую секунду должно «сгорать»
(3,8 - 10
26 Вт) - 1
6,27.10” Дж/г
с- = 0,607 •
10
|5г=607
млн.
водорода, масса Солнца уменьшится при этом на
607 млн. т-0,0069 а. е. м./1 а. е. м. = 4,2 млн. т
и в виде фотонов рассеется в мировом пространстве. (Часть энергии (около 5 %) уносится нейтрино и не включена в этот баланс, поэтому в действительности водорода сгорает чуть больше, а именно 630 млн. т., или 0,63* 10
15 г/с.)
При таком темпе горения массы Солнца (2-10
33 г), из которых 75 % составляет водород, хватило бы на
2- 10
33 г-0,75
0,6- 10
15 г/с
= 2,5.10
,8с
0,8- 10
11
лет,
то есть на 80 млрд. лет. В действительности при устойчивом горении допустима потеря массы не более 10 %, то есть Солнце будет так же неизменно светить на небосклоне еще 5—7 млрд. лет. Несмотря на огромность излучаемой энергии, Солнце горит очень экономно: при массе 2 -10
33 г оно излучает 3,8-10
26 Дж/с, то есть его удельная мощность равна всего (3,8-10
26 Вт)/(2-10
33 г) = 1,9-10“
7 Вт/г — в 10 тыс. раз уступает удельной мощности человека (2-10
-3 Вт/г) и в 50 млрд, раз меньше удельной мощности горящей спички (примерно 10 000 Вт/г).
ТИГЛИ ЭЛЕМЕНТОВ
В недрах Солнца каждую секунду 630 млн. тонн водорода превращается в гелий. Но как возникли все остальные элементы, из которых состоит земля, растения и мы с вами? Квантовая физика и основанная на ней ядерная астрофизика могут теперь ответить и на этот вопрос.
Когда в ядре Солнца выгорит весь водород, сразу же уменьшится поток и давление излучения, которое препятствует сжатию Солнца под действием сил тяготения, его ядро начнет уменьшаться в объеме, и в процессе такого
гравитационного сжатия плотность в центре Солнца достигнет 10
5 г/см
3, а температура превысит 100 млн. градусов,— как раз в этот момент начнет «гореть» гелий. Ядерная реакция горения гелия — тройной альфа-процесс (За- процесс) — замечательна во многих отношениях и заслуживает более подробного рассмотрения.
Прежде всего, простая реакция слияния двух ядер гелия в ядро бериллия
4Не +
4Не->
8Ве
невозможна, поскольку такой изотоп бериллия в природе отсутствует. К счастью, в сечении этой реакции при энергии около 0,1 МэВ наблюдается резонанс, который можно мыслить себе как очень нестабильное ядро
8Ве*. Это «ядро» живет всего 10
-16 с, однако по ядерным масштабам это не так мало: при столкновении а-частиц они, прежде чем разлететься вновь, успевают совершить около миллиона колебаний в составе
8Ве*. За это время к ним может приблизиться третья а-частица и образовать с ними ядро углерода
,2С.
Эта возможность, однако, осталась бы нереализованной, если бы не вторая удача, сопутствующая успеху За-процесса. Дело в том, что масса трех а-частиц на 7,28 МэВ превышает массу ядра
,2С и прямой процесс образования ядер углерода из трех а-частиц крайне маловероятен. Но у ядра
12С есть возбужденное состояние
,2С* с энергией возбуждения 7,66 МэВ, то есть масса ядра
,2С*, в отличие от массы
t2C, не меньше массы трех а-частиц, а, наоборот, на 7,66 МэВ — 7,28 МэВ =0,38 МэВ превышает ее. А это означает, что при достаточно высоких энергиях столкновения а-частиц возможна резонансная реакция
8Ве* +
4Не-^
,2С*.
Возбужденное ядро
,2С* живет недолго — всего 10
-12 с и,
испуская у-кванты или электронно-позитронную пару, переходит в основное состояние.
Но этого времени оказывается достаточно, чтобы успело произойти необратимое объединение трех а-частиц.
При температурах Г^Ю
8 К кинетическая энергия а-частиц (0,02 МэВ) в гелиевой звезде значительно меньше энергии 0,38 МэВ, при которой выполняется условие резонанса для реакции
8Ве* +
4Не->
,2С*. Однако в недрах такой звезды всегда существует незначительная примесь очень быстрых частиц (10
-9, примерно одна частица на миллиард), для которых это условие выполнено, и этого оказывается достаточно, чтобы осуществить последовательность реакций За-процесса
4Не +
4Не->
8Ве*,
8Be* +
4He->
I2C*->
I2C + У
со скоростью в тысячу раз большей, чем горение водорода.
За-процесс был предсказан в 1952 г. американским теоретиком Эдвином Эрнестом Солпитером (р. 1924 г.) и лишь впоследствии подтвержден всей совокупностью наблюдаемых данных. Теперь он исследован во всех деталях, но не стал от
этого менее удивительным: ведь если бы массы ядер гелия и углерода отличались от действительных всего на 0,1 %, то редкое сочетание сразу двух резонансов в За-процессе было бы разрушено и условия нуклеосинтеза в звездах были бы иными.
Углерод — основа всех живых организмов и одно из самых привычных и необходимых веществ на Земле. Но только теперь становится ясным, от каких тонких особенностей структуры ядер и случайностей их сочетания зависит в конечном итоге и сама жизнь, и ее разумная разновидность, способная понять и оценить их смысл.
После образования углерода в гелиевом ядре звезды происходит образование других элементов: кислорода, неона и магния:
|2С +
4Не-ЛО + ?,
,6O +
4He->
20Ne + ?.
20Ne +
4He^
24Mg + Y-
К моменту образования магния весь гелий в звезде истощается, и, чтобы стали возможными дальнейшие ядерные реакции, необходимо новое сжатие звезды и повышение ее температуры. Это, однако, возможно не для всех звезд, а лишь для достаточно больших, масса которых превышает так называе-
322
мый чандрасекаровский предел
М = 1,2 М
о, то есть для звезд с массой, по крайней мере на 20 % превышающей массу Солнца
MQ. (Существование такого предела установил еще в 30-х годах индийский ученый Субраманьян Чандрасекар (р,. 1910 г.).)
Звезды с массами 1,2Л4
0заканчивают свою эволюцию на стадии образования магния и превращаются в белые карлики — звезды с массой около 0,6М
о, размером с нашу Землю и плотностью около тонны в кубическом сантиметре. В белых карликах электроны отделены от ядер, так что вся звезда представляет собой единый кристалл, свойства которого можно описать только с помощью уравнений квантовой механики, используя, в частности, и знаменитый принцип Паули, запрещающий двум электронам иметь одинаковые квантовые числа. Теорию белых карликов построил уже в 1926 г. Ральф Говард Фаулер (1889—1944).
В более массивных звездах при температурах 5-Ю
8 — 10
9 градусов происходит синтез кремния в реакциях:
24Mg +
4He ->
28Si + у,
i6O + i6O_>28Si + a
После очередного этапа гравитационного сжатия температура повышается до 2 млрд, градусов и средняя энергия излучаемых гамма-квантов достигает 0,2 МэВ, при которой они способны разрушать ядра кремния на а-частицы:
28Si+Y->7
4He.
Эти a-частицы затем последовательно вдавливаются в ядра кремния, образуя более тяжелые элементы — вплоть до железа. На этом источники ядерной энергии внутри звезды истощаются, поскольку образование более тяжелых элементов идет не с выделением, а с затратой энергии: эволюция звездного вещества вступает в новую фазу.
Теперь ядерные реакции идут на поверхности железной сердцевины звезды, где еще сохранились несгоревшие ядра
4Не,
12С,
20Ne, а также небольшое количество водорода. В некоторых из этих реакций возникают свободные нейтроны, которые поглощаются ядрами железа, и — точно так же, как в опытах Ферми,— после 0-распада нейтрона образуется новое ядро со следующим порядковым номером, то есть ядро кобальта:
58Fe + n->
59Fe*->
59Co + е + v.
Таким же образом из кобальта образуется никель, из никеля — медь и т. д., вплоть до изотопа висмута
209Вь
На этом возможности
s-процесса (slow — медленный) образования химических элементов исчерпываются, и все элементы тяжелее висмута образуются в
r-процессе (rapid — быстрый), при взрывах звезд.
Такой взрыв становится возможным, если масса звезды достаточно велика для того, чтобы силы тяготения смогли сжать и нагреть ее железную сердцевину до 4 млрд, градусов и выше. В этих условиях каждое ядро железа
56Бе распадается на 13 а-частиц и 4 нейтрона, поглощая при этом 124 МэВ энергии. Сердцевина звезды охлаждается и начинает катастрофически сжиматься под действием сил тяготения, которые теперь уже не сдерживаются давлением излучения. Происходит
имплозия, взрыв внутрь, коллапс звезды. При этом вначале а-частицы разваливаются на протоны и нейтроны, а затем электроны вдавливаются в протоны, образуя нейтроны и испуская нейтрино:
р + е n +v.
Сложное взаимодействие процессов в ядре звезды и ее оболочке (еще до конца не понятое) приводит к тому, что вся звезда взрывается, сбрасывая оболочку. (Ее остатки мы потом наблюдаем в виде космических лучей.) На небе в этот момент загорается очень яркая
сверхновая звезда, или просто сверхновая. Это (не вполне удачное) название предложили в 1934 г. замечательные астрономы Вальтер Бааде (1893— 1960) и Фриц Цвикки (1898—1974), и они же предположили, что при взрыве сверхновых в их центре образуется маленькая
нейтронная звезда: ее масса равна примерно массе Солнца, а радиус — всего 10—13 км, то есть плотность ее достигает миллиарда тонн на кубический сантиметр.
На возможность существования нейтронных звезд впервые указал Лев Давидович Ландау (1908—1968) в 1932 г., сразу же после открытия нейтрона, но долгое время на них смотрели как на выдумку теоретиков. Прошло 35 лет, и в августе 1967 г. Жаклин Белл, аспирантка кембриджского профессора Мартина Райла, обнаружила на небе периодический источник радиоизлучения с периодом 1,3 с. Когда прошел первый испуг, вызванный мыслью о встрече с инопланетными цивилизациями, все согласились, что этот
пульсар не что иное, как быстро вращающаяся нейтронная звезда. Сейчас их известно уже более двухсот. (За эти работы Мартин Райл совместно с Энтони Хьюишем удостоен Нобелевской премии 1974 г.)
Потоки нейтронов, возникающие при взрывах сверхновых, столь велики, что одно и то же ядро успевает захватить десят-
324
ки нейтронов прежде, чем произойдет 0-распад хотя бы одного из них. Именно так в свое время возникли все радиоактивные элементы, в том числе уран и торий, причем в момент начала их образования (около 10 млрд, лет назад) изотопа урана-235 было в полтора раза больше, чем урана-238.
Синтез химических элементов в звездах продолжается и сейчас. Наглядное доказательство этому нашли в 1952 г., когда обнаружили в спектре одной из звезд линии технеция: это означает, что он там непрерывно образуется, поскольку все изотопы технеция живут менее 3 млн. лет и за время существования Солнечной системы (около 5 млрд, лет) он полностью распался. (Его синтезировал только в 1937 г. один из «мальчиков» Ферми — Эмилио Сегре.)
Утверждение о том, что звезды — это тигли, в которых происходит превращение элементов, еще в конце прошлого века настойчиво повторял знаменитый английский астроном Джозеф Норман Локьер (1834—1920), открывший на Солнце гелий и давший ему имя. Его идеи и книга «Неорганическая эволюция» решительно повлияли на склад мыслей молодого Резерфорда и направление его позднейших исследований. Но в то время это была только смелая догадка, подобно гипотезе Праута о происхождении всех элементов из водорода. В конечном итоге и Праут, и Локьер оказались правы, хотя реальность много богаче их умозрительных построений.
Истинную последовательность рождения и превращения элементов удалось понять только с помощью идей и методов квантовой физики и совсем недавно — лишь в конце 50-х — начале 60-х годов — трудами Уильяма Фаулера, Фреда Хойла, Джефри и Элинор Бербидж и многих других. (Уильяму Фаулеру в 1983 г. совместно с Чандрасекаром присуждена Нобелевская премия за работы по астрофизике.) Не все детали этой грандиозной картины установлены пока одинаково надежно, но ее основа и общие контуры не вызывают сомнений. Во всяком случае уже сейчас мы можем достаточно уверенно рассчитать относительную распространенность химических элементов в космосе и убедиться, что она совпадает с наблюдаемой. (Печально знаменитое предсказание Огюста Конта о невозможности узнать состав звезд, сделанное им всего за три года до открытия спектрального анализа, выглядит на этом фоне особенно удивительным.)
Но мы можем теперь даже больше: нарисовать общую картину рождения и угасания звезд.
Для звезд с массой в 1,5—3 раза больше солнечной возможен и другой финал: после того, как в их недрах выгорит все ядерное топливо, они не взрываются, а начинают неудержимо сжиматься, происходит
гравитационный коллапс звезды, и она превращается в
черную дыру. Размер черной дыры определяется размером ее гравитационного радиуса, который, например, для Солнца не превышает 3 км. Гравитационное притяжение черной дыры настолько мощное, что никакой сигнал не может его преодолеть и сообщить о ее существовании. Поэтому наблюдать образование черной дыры можно только по ее воздействию на другие космические тела. И все же даже эти могильники звезд продолжают жить: со временем они «испаряются», излучая в космическое пространство энергию, причем спектр их излучения совпадает со спектром абсолютно черного тела — тем самым, с которого началась наука о квантах. К этому выводу пришел в 1974 г. английский ученый Стивен Уильям Хокинг (р. 1924 г.) — человек трудной судьбы и победившего ее большого таланта.
СУДЬБА СОЛНЦА
Современная Книга Бытия, написанная астрофизиками, начинается так: «Вначале был «Big-Bang» — «Большой взрыв»...
Через одну сотую секунды после него Вселенная представляла собой
нечто с плотностью в 4 млрд. (4-Ю
9) раз большей, чем плотность воды, и температурой 100 млрд. (10
11) градусов. Это «нечто» расширялось почти со скоростью света и состояло в основном из фотонов и нейтрино, а также из электронов и позитронов, которые непрерывно рождались из света и снова аннигилировали в излучение: свет и вещество представляли собой некую неделимую сущность. Примесь протонов и нейтронов в этот момент была ничтожной: один нуклон на миллиард легких частиц.
Через одну десятую секунды температура уменьшилась в три раза, через секунду — в десять раз, а еще через четырнадцать секунд — в тридцать раз, то есть упала до

3 млрд. (ЗИО
9) градусов и началась необратимая аннигиляция электронов и позитронов в фотоны.
В конце третьей минуты температура первичного вещества уменьшилась до 1 млрд, градусов, плотность упала до плотности воды и началось образование ядер гелия из протонов и нейтронов.
Еще через час температура снизилась до 300 млн. градусов и образовалась та смесь водорода и гелия, которую мы до сих пор наблюдаем повсеместно во Вселенной.
Прошло еще около миллиона лет, прежде чем температура понизилась до 3000 градусов и электроны объединились с ядрами водорода и гелия: отныне фотоны не могли их разрушить, излучение отделилось от вещества.
Теперь Вселенная представляла собой однородную смесь, состоящую на 3/4 из водорода и на 1/4 из гелия. Плотность ее по космическим масштабам была довольно большой: несколько тысяч атомов в кубическом сантиметре (в наше время — всего один-два атома на кубический метр), а примеси других атомов (в основном дейтерия и лития) не превышали 0,0001 %. Как раз в это время, подчиняясь закону всемирного тяготения, первичная смесь водорода и гелия начала собираться в сгустки, из которых впоследствии образовались галактики и звезды.
Уже Ньютон знал, что однородная большая масса вещества неустойчива, но только два столетия спустя, в 1902 г., мысли Ньютона о гравитационной неустойчивости распределенных масс вещества получили развитие в работах Джеймса Хопвуда Джинса (1877—1946) (нам он уже известен как один из авторов распределения Рэлея — Джинса в теории теплового излучения).
Уплотнение водородно-гелиевых сгущений происходило довольно быстро: уже через миллион лет плотность и температура внутри таких сгустков достигает значений, при которых начинается ядерное горение водорода. В этот момент сжатие прекращается противодавлением излучения и образовавшаяся звезда стабилизируется до тех пор, пока не исчерпает запасов ядерной энергии. Время жизни звезд зависит от их массы: чем меньше звезда, тем дольше она живет. Звезды с массой Л4<Л4
О живут десятки миллиардов лет, а с массой М>5М
О — в тысячу раз меньше.
На ранних стадиях расширения Вселенной чаще образовывались массивные звезды, которые быстро сжигали запасы ядерного топлива и взрывались как сверхновые. Взрыв сверхновой — это грандиозное событие даже по космическим масштабам. По существу, это взрыв термоядерной бомбы величиной с наше Солнце. Энергия, которая при этом выделяется, в сотни миллиардов раз превышает излучение Солнца, и сверхновая некоторое время светит, как целая галактика. Масса сброшенной при взрыве оболочки сверхновой сравнима с массой Солнца, а ее вещество обогащено тяжелыми элементами, которые образовались в мощном потоке нейтронов термоядерного взрыва.
Именно эти взрывы изменили первоначальный химический состав вещества Вселенной: теперь, кроме водорода и гелия, оно содержит также от 1 до 3 % примесей тяжелых элементов. Это — как соль в космическом супе, но именно из этой соли построена Земля. Соотношение элементов в Земле с большой точностью повторяет распределение, тяжелых элементов на Солнце (гелий и свободный водород улетучились уже в раннюю геологическую эпоху Земли). Состав тканей человека не отличается существенно от состава морской воды и распространенности элементов в Земле, так что в итоге все мы — остатки взорвавшейся некогда звезды.
Сейчас взрывы сверхновых в нашей Галактике происходят очень редко: одно-два в столетие. За последнюю тысячу лет в летописях зафиксировано только четыре из них: в 1006, 1054, 1572 гг. (звезда Тихо Браге) и в 1604 г. (звезда Кеплера). Они светили ярче Венеры и были видны днем. (Две последние вспышки поколебали средневековый догмат о неизменности неба и немало содействовали изобретению телескопа в 1608 г.) Однако в первый миллиард лет существования Вселенной именно такие взрывы определили современный ее облик.
Наше Солнце — звезда третьего поколения. Оно образовалось из космической пыли, уже дважды прошедшей через космические тигли, около 5 млрд, лет назад. Через 5—7 млрд, лет оно истощит запасы водорода и перейдет в стадию гелиевого горения — с этого момента дни его сочтены. Внешняя оболочка Солнца, окружающая гелиевую сердцевину, начнет быстро расширяться, достигнет орбиты Земли и превратит ее в раскаленную пустыню: Солнце перейдет в стадию красного гиганта, подобного Альдебарану или Бетельгейзе. Это продлится недолго: всего через 10 тыс. лет оболочка Солнца рассеется, а само оно превратится в белый карлик, похожий на звезду Сириус В — спутник Сириуса А, самой яркой звезды нашего неба (которая сама к этому времени, вероятнее всего, взорвется). Но вряд ли кому-либо из людей придется наблюдать эту картину апокалипсиса.
Вселенная продолжает расширяться и охлаждаться до сих пор. Этот вывод следует из уравнений общей теории относительности Эйнштейна. Но когда советский физик Александр Александрович Фридман (1888—1925) в 1922 г. нашел такие решения этих уравнений, из которых следовало, что Вселенная расширяется, Эйнштейн возражал против такого заключения и лишь впоследствии признал свою неправоту. Семь лет спустя, в 1929 г., американский астроном Эдвин Пауэлл Хаббл (1889—1953) обнаружил «разбегание галактик» и даже измерил его скорость. Оказалось, что далекие галактики удаляются тем быстрее, чем дальше они отстоят от

нас — в полном согласии со следствиями гипотезы «боль
шого взрыва». На границе видимой Вселенной (10—15 млрд, световых лет) галактики удаляются от нас со скоростью близкой к скорости света.
Свидетелем эпохи «большого взрыва», происшедшего около 15 млрд, лет назад, осталось
реликтовое излучение, открытое Арно Пензиасом и Робертом Уилсоном в 1965 г. (Нобелевская премия 1978 г.): это то излучение, которое через 0,01 с после «большого взрыва» имело температуру 10
11 градусов, а миллион лет спустя охладилось до 3000 градусов. Сейчас реликтовое излучение равномерно заполняет всю Вселенную (около 500 квантов в кубическом сантиметре), его средняя температура равна 2,82 К, а спектр подчиняется той самой знаменитой формуле Планка для равновесного излучения абсолютно черного тела, с которой началось развитие квантовой физики и с рассказа о которой мы начали эту книгу.
Круг замкнулся. Как говорили в древнем Китае: «Человек восходит корнями к предкам, но корни всего сущего находятся на небе».
Гипотезу «большого взрыва» выдвинул Георгий Гамов в 1948 г. — через двадцать лет после объяснения им явления а-распада. Основанием для такого предположения послужила космологическая теория Фридмана и подтверждение ее Хабблом. Сейчас гипотезу Гамова называют «теорией горячей Вселенной», а еще чаще — «стандартной моделью» ранней Вселенной. Эти нарочито прозаические слова не соответствуют величию и грандиозности предмета обсуждения: ведь речь идет о начале мира, и при всем желании сохранить научную строгость и объективность умозаключений трудно отрешиться от сопутствующего им чувства нереальности.

Человеческая жизнь (менее 100 лет), вся история науки (300—400 лет), история цивилизаций (10 тыс. лет), появление человека (миллион лет) и даже возникновение Солнечной системы (около 5 млрд, лет),— все это лишь незначительные фрагменты летописи Вселенной.
Но почему мы должны верить во всю эту поистине библейскую картину рождения мира? Ответ прост, хотя, быть может, и не вполне убедителен: по той же самой причине, по которой мы верим в созданную нашим воображением картину атома: до сих пор все наблюдаемые следствия «стандартной модели» согласуются с предсказаниями теории «большого взрыва».
«Истина удивительнее всякой фантазии», и, по словам Фарадея, «ничто не может быть настолько прекрасным, чтобы заменить истину». Правда о звездах и Вселенной оказалась еще более захватывающей, чем все поэтические вымыслы о них. Эта правда, возвышая дух, подавляет воображение. Мы знаем теперь, что свет звезд, который на протяжении столетий был символом покоя и безмятежности, хранит в себе память о гибели и возрождении атомов, о магнитных бурях и космических взрывах. И это знание не проходит для нас бесследно.
Азарт научного поиска и неизбежные мелочи, сопутствующие ему, заслоняют часто величие открываемых явлений. И все же, оставаясь наедине со звездной бездной, трудно отрешиться от первобытного страха, так похожего на чувства человека, стоящего на краю пропасти.
«Астрономия — счастливая наука, ойа не нуждается в украшениях»,— сказал однажды Франсуа Араго. Это — древнейшая из наук, однако истинные законы неба узнали совсем недавно, после создания квантовой физики: устройство Вселенной нельзя понять прежде, чем изучены строение атома и структура ядра.
Мы живем в удивительное время: прошло всего полвека с тех пор, как стал известен наш адрес на окраине Галактики. На наших глазах происходит самая большая революция в астрономии со времен Коперника и Галилея, и постепенно пришедшая ей на смену астрофизика может изменить самосознание человека даже больше, чем открытие атомной энергии.
Солнце, жизнь и хлорофилл
«Солнце, жизнь и хлорофилл» — так назвал свою книгу Климент Аркадьевич Тимирязев (1843—1920), однажды восхищенный чудом фотосинтеза и отдавший его изучению более полувека. «Едва ли какой процесс, совершающийся на поверхности Земли, заслуживает в такой степени всеобщего внимания, как тот далеко еще не разгаданный процесс, который происходит в зеленом листе, когда на него падает луч Солнца...» — писал он в одной из своих статей.
Чем питаются растения? Зачем дереву листья? И почему они зеленые? — эти и подобные им «детские вопросы» задавали уже в древности. Ответить на них смогли только в прошлом веке, когда трудами фламандского врача Яна Баптиста Гельмонта (1579—1644), английского ботаника Стивена Гейлса (1677—1761), английского химика Джозефа Пристли-(1733—1804), голландского врача Яна Ингенхауза (1730— 1799), швейцарских естествоиспытателей Жана Сенебье (1742—1809) и Никола Теодора Соссюра (1767—1845) было установлено, что под лучами Солнца в зеленых листьях растений происходит превращение углекислого газа и воды в сахар, крахмал и древесину, которое сопровождается выделением кислорода.
Человек и весь животный мир планеты во всех отношениях зависит от этого процесса: мы дышим кислородом воздуха, едим хлеб, испеченный из злаков, пьем молоко, принесенное с пастбищ. Но точно так же, как мы не замечаем воздуха, которым дышим, мы редко задумываемся о космической роли растений: это единственные организмы на Земле, способные улавливать энергию солнечного излучения и превращать ее в химическую энергию органических соединений, необходимых для поддержания жизни животных и человека.
В прошлые века этому удивлялись больше: «Я вижу, как моя кровь образуется в хлебном колосе... а древесина отдает зимою теплоту, огонь и свет, похищенные ею у Солнца»,— писал Сенебье в 1791 г. А Юлиус Роберт Майер (1814— 1878) в 1845 г. продолжал: «Природа поставила себе задачей перехватить на лету притекающий на Землю свет и превратить эту подвижнейшую из сил в твердую форму».
В 1817 г. парижские аптекари Пьер Жозеф Пельтье (1788—1842) и Жозеф Бьенеме Каванту (1795—1877) выде-
лили из листьев некое вещество, «зеленую кровь растений», и назвали его
хлорофиллом. Впервые зеленые пузырьки этого вещества наблюдал изобретатель микроскопа Антони ван Левенгук (1632—1723) еще в конце XVII века, но лишь в середине XIX века стало понятно, что именно хлорофилл — основное звено в сложной цепи превращений воды и углекислого газа в крахмал.
В 1906 г. изобретатель хроматографии русский ботаник Михаил Семенович Цвет (1872—1919) обнаружил, что существует не один хлорофилл, а по крайней мере два. В 1913 г. немецкий биохимик Рихард Вильштеттер (1872— 1942) установил их химический состав: голубовато-зеленый хлорофилл
а состоит из 137 атомов (С55 H
72N
4O5Mg), а желтовато-зеленый хлорофилл
b — из 136 атомов (CssHyoN^Mg)
Но только в 1940 г. Хансу Фишеру (1881 —1945) удалось установить структуру хлорофилла, то есть последовательность, в которой его атомы соединены между собой. Оказалось, что эта структура очень близка к структуре гема — основной части гемоглобина крови всех животных. Только вместо атома железа, из-за которого гемоглобин окрашен в красный цвет, в центре молекулы хлорофилла помещен атом магния, сообщающий ему зеленый цвет. (Таким образом, метафора «зеленая кровь растений» неожиданно оказалась строгим научным утверждением. Не случайно также, что именно Ханс Фишер в 1929 г. расшифровал структуру гема и был удостоен за это Нобелевской премии 1930 г.)
Прошло еще 20 лет, и в 1960 г. американский биохимик Роберт Вудворд (р. 1917 г.) синтезировал хлорофилл. (Он же в 1962 г. синтезировал тетрациклин, Нобелевская премия 1965 г.) Но даже после этих успехов не все детали фотосинтеза поняты до конца, хотя общие контуры этого сложного явления установлены теперь довольно надежно — и наука о квантах немало этому содействовала.
Химическая суть процесса фотосинтеза предельно проста: молекула воды (Н2О) соединяется с молекулой углекислого газа (СОг), освобождая при этом молекулу кислорода (Ог) и образуя «строительный блок» СН2О многих органических соединений (например, глюкоза СбН|
2Об или (СНгО)б составлена из 6 таких блоков), то есть
СО2 + Н2О —> СН2О + О2.
Такая перестройка атомов требует энергии: на возбуждение молекул Н
2О и СОг, на разрыв связей между водородом и кислородом в молекуле воды, на отрыв атома килорода от молекулы СОг, который затем объединяется в молекулу О
2
с атомом кислорода из молекулы НгО. Эту энергию зеленый лист черпает из потока квантов солнечного света.
Каждая химическая связь образуется парой электронов, поэтому при разрыве двух связей водород — кислород и образовании двух новых связей водород — углерод необходимо переместить 4 электрона. Опыт показывает, что для этого необходимо самое меньшее 8 квантов красного цвета, то есть по 2 кванта на каждый электрон. Поэтому истинное уравнение фотосинтеза имеет вид
СО2 4“ Н2О -Г 8/zv—>СНгО -Г О2.
Энергия красного кванта с длиной волны около 700 нм равна 1,8 эВ, а суммарная энергия 8 квантов 14,4 эВ. Одна треть этой энергии (около 5 эВ) запасается в виде энергии химических связей в молекулах глюкозы.
Когда мы пьем чай, то молекулы кислорода, захваченные гемоглобином, в присутствии ферментов соединяются с молекулами глюкозы в обратном процессе
СН
2О+О2->Н
2О + СО2, освобождая при этом энергию солнечного луча, запасенную хлорофиллом, которая, в конечном итоге, и сохраняет нашу жизнь. (Как говорил Герман Гельмгольц, зная это, каждый из нас «вправе наравне с самим китайским императором величать себя сыном Солнца».)
Простота уравнения фотосинтеза не должна нас обманывать: это не просто реакция, а сложный биохимический процесс, включающий в себя несколько стадий и десятки разнообразных реакций.
В листьях молекулы хлорофилла (их размер 10 А = = 10“
7 см) упакованы в специальные структуры —
хлоропласты, представляющие собой чешуйки диаметром 10
_3 см и толщиной 10
-4 см. Эти структуры покрыты оболочкой, а внутри устроены довольно сложно: достаточно сказать, что в их состав входит до 10 различных разновидностей хлорофилла и более 200 других соединений.
В хлоропластах молекулы хлорофилла объединены в ячейки (примерно по 300 молекул в каждой) вместе с другими пигментами, назначение которых — собирать свет и передавать его энергию на реакционный центр ячейки. Структура этого центра пока точно не установлена, но предполагают, что он представляет собой пару молекул хлорофилла а, специальным образом сцепленную с молекулами пигмента, которая поглощает красный свет с длиной волны около 700 нм. Энергия этих квантов (1,8 эВ) достаточна, чтобы оторвать
333 электрон от хлорофилла
а и передать его по цепочке промежуточных соединений к месту объединения углерода молекулы СОг с протонами разрушенной молекулы Н2О. За секунду реакционный центр (его называют центром Р
7оо) может «переработать» до 50 квантов света, то есть обеспечить синтез 1 молекулы глюкозы и выделение 6 молекул кислорода.
В действительности существует два типа реакционных центров: фотосистема I и фотосистема II. В фотосистеме I (реакционный центр Р
7оо) при отщеплении электрона от хлорофилла
а происходит синтез промежуточных нестойких соединений, в которых запасается поглощенная хлорофиллом
а энергия квантов. (Среди этих соединений особо следует отметить довольно сложное соединение аденозинтрифосфат (АТР) с формулой C10H16O13N5P3, которое является универсальным аккумулятором энергии во всех живых организмах.)
Фотосистема II включает в себя реакционный центр Рб8о, который поглощает красные лучи с длиной волны Л = 680 нм и использует их энергию для отрыва электронов от некоторой системы S, которая предположительно является белковым комплексом, содержащим атом марганца (Мп). Отдавая последовательно 4 электрона, он становится катализатором, в присутствии которого молекулы воды расщепляются на водород и кислород.
Обе стадии фотосинтеза — образование АТР и расщепление НгО—очень быстрые (10
-9 с) и происходят только на свету. После них следует довольно длительная (0,05 с) стадия, не требующая света. Она включает около 20 реакций (так называемый цикл Кальвина), в которых протоны, используя энергию, накопленную в АТР, через цепочку промежуточных комплексов присоединяются к углероду углекислого газа и образуют с ним структурную единицу СН2О любой древесины. Эту стадию удалось изучить довольно подробно сравнительно недавно, в 1946—1951 гг., с помощью изотопа
,4С в лаборатории Мелвина Кальвина (Нобелевская премия 1961 г.). А двустадийность процесса фотосинтеза доказана только в 1D58 г.
Изучение фотосинтеза продолжается: усложняются решаемые задачи, изощреннее становится методика исследований и быстро растет объем накопленных фактов. Но как и тысячелетия назад, с восходом солнца растения продолжают свою молчаливую каждодневную работу: улавливают солнечный свет и консервируют его впрок. Так было не всегда: фотосинтез возник на Земле в процессе эволюции растений сравнительно недавно — около миллиарда лет
334
назад, когда кислорода в атмосфере было менее процента и почти вся она состояла из азота и углекислого газа. Это был решающий поворот эволюции, изменивший лицо Земли: простейшие сине-зеленые водоросли начали перерабатывать углекислоту в кислород, над планетой образовался озоновый слой, который и сейчас охраняет всё живое от губительного воздействия ультрафиолетовых лучей, жизнь под его защитой вышла из океанов на сушу, возникли животные и человек, которые теперь возвращают растениям свой долг, снабжая их углекислотой.
За час 1 м
2 листьев усваивает 6—8 г (3—4 л) СОг из воздуха и выделяет такой же объем кислорода. Человек потребляет около 500 л кислорода в сутки (продукция трех взрослых деревьев) и такой же объем углекислого газа возвращает растениям. Весь углекислый газ атмосферы проходит через растения за 300 лет, а весь кислород через животных — за 2000 лет.
Красный свет, используемый в процессе фотосинтеза, составляет всего 2 % от общего потока излучения Солнца и только 30 % из этой части, то есть около 0,5 % общего потока,

усваивается растениями. (Это число впервые измерил в 1860 г. отец Анри Беккереля Эгмон Беккерель.) Это немного, но эта узкая тропа — единственный путь, связывающий царство неживой материи с миром живых существ, по которому энергия термоядерных топок Солнца, непрерывно дробясь, достигает нервных клеток мозга человека, способного понять и оценить весь этот непостижимый замысел Природы и его постигаемое воплощение.
Жизнь под Солнцем
Поклонение Солнцу — самая древняя из религий и, если позволительно так говорить о вере, самая понятная из них. «Солнце... является неисчерпаемым источником физической силы... та непрестанно заводящаяся пружина, которая поддерживает в состоянии движения механизм всех происходящих на Земле деятельностей»,— писал Роберт Майер в 1845 г.
Радиус Земли /?
3 =6350 км, поэтому с Солнца, на расстоянии 150 млн. км, она видна как копеечная монета с расстояния в сотню метров. Из 4,2 млн. т фотонов, излучаемых Солнцем каждую секунду, на нее попадает только 0,45*10
-9 часть, то есть половина миллиардной доли излучаемой энергии Солнца, а именно
(4,2* 10
6 т) *(0,45* 10
-9)= 1,85* 10
_3 т=1,85 кг.
В холодной пустыне космоса именно эти два без малого килограмма фотонов в секунду сохраняют оазис нашей планеты теплым и зеленым. Благодаря им текут реки, дуют ветры, шумят леса и жив человек.
2 кг фотонов — не так уж мало: по формуле Эйнштейна
Е—тс2 в них заключена энергия
Е= (1,85* 10
3 г) * (3* 10
1° см/с)
2 = 1,7* 10
24 эрг= 1,7* 10
17 Дж, то есть мощность солнечного излучения, падающего на Землю, равна 1,7* 10
17 Вт — почти в 20 тысяч раз больше, чем мощность всей энергетики мира (10
13 Вт). Примерно половина этой мощности (0,8 *10
17 Вт) достигает земной поверхности, площадь которой равна 4л/?
2~5*10
14 м
2, то есть средняя интенсивность излучения Солнца на уровне Земли равна 160 Вт/м
2.
Подавляющая часть этой мощности (99,9 %) поглощается почвой, расходуется на испарение воды, на ветры, грозы и все то, что мы называем погодой. И только 0,1 % лучистой энергии Солнца (10
14 Вт) накопляется растениями в процессе фо-
336 тосинтеза органических веществ из углекислого газа и воды. Именно этой долей энергии питается все живое на Земле: от бактерий до животных и человека, поскольку сущность жизни в своей первооснове — это обратный фотосинтезу процесс разложения органических веществ на углекислый газ и воду.
Первичная мощность фотосинтеза 10
14 Вт, или 10
й т сухого органического вещества в год,— это все, на что может рассчитывать человек в своих долгосрочных планах и прогнозах. Эта мощность не может быть существенно увеличена, поскольку для процесса фотосинтеза нужна пресная вода, а уже сейчас 60 % ее мировых запасов вовлечено в круговорот органических веществ.
Из всей энергии фотосинтеза около 10 %, или 10
13 Вт, приходится на пашни, луга и пастбища и примерно половину ее (5*10
12 Вт) потребляет на свои нужды человек.
Эту мощность можно вычислить и по-другому, вспомнив, что для нормальной жизни человек должен каждые сутки усваивать с пищей около 3000 ккал, то есть примерно 1,26-10
7 Дж энергии. В сутках 8,6* 10
4 с, поэтому средняя мощность жизненных процессов в организме человека равна
(1,26-10
7 Дж)/(8,6-10
4 с) «140 Вт
— меньше мощности горящей спички (200 Вт). На Земле сейчас живет 5 млрд, человек и только для питания им всем необходима энергия
140 Вт* (5* 10
9) =0,7* 10
12 Вт.
С учетом эффективности использования продукции пашни (13 %) эта энергия возрастет как раз до 5* 10
12 Вт.
Это — заметная доля (5%) от всей продукции фотосинтеза. Еще примерно столько же человек потребляет в виде древесины, т. е. всего 10
13 Вт, или 10 % первичной продукции. А с учетом того, что луга и пашни в три раза менее продуктивны, чем леса, вырубленные на их месте, доля потребляемой человеком продукции фотосинтеза возрастает до 17 %. Еще примерно столько же (10
13 Вт) человечество черпает из запасов ископаемого топлива, сжигая уголь, нефть и газ. Таким образом, человечество, общая биологическая масса которого не превышает 2-10
8 т (5*10
-14 от массы Земли), потребляет в год около 2*1О
10 т органических веществ — в сто раз больше своего веса. Это — очень много и означает, что человек — лишь один из многих миллионов биологических видов — в последнее столетие превратился в решающий фактор дальнейшей эволюции жизни на Земле. «Человек — властелин природы»,— сказано давно, но при
12 Л. И. Пономарев 337
этом, похоже, забыли, что власть предполагает ответственность.
Практически вся продукция фотосинтеза (10
11 т сухого органического вещества в год) вновь разлагается живыми организмами на углекислый газ и воду. Лишь ничтожная часть (около 10
-4 или 10
7 т/год) остается ими не использованной и запасается впрок. Это означает, что за предыдущие 300 млн. лет — с тех пор, как на Земле появилась обильная растительность,— в ее недрах запасено примерно 10
15 т угля, нефти и газа. Доступные запасы много меньше: 10
13 т угля, 3-10
12 т нефти и столько же газа, причем около 5% этих запасов мы уже сожгли с тех пор, как американец Эдвин Дрейк пробурил в 1859 г. первую нефтяную скважину. За год в топках сжигается ЗЛО
9 т угля, 4*10
9 т нефти и ЗЛО
9 т газа, т. е. 10
1° т органического вещества — примерно 0,1 % их разведанных запасов, 10% от годовой продукции растений и в тысячу раз быстрее, чем запасается ими впрок.
Каждый день население Земли увеличивается на 200 тыс. человек (2 человека в секунду) и в течение последних 300 лет каждые 35 лет число людей удваивается. Несложный подсчет показывает, что при таком темпе размножения всего через полторы тысячи лет общая масса людей должна превысить массу самой Земли. Абсурдность этого вывода очевидна, и это означает, что в ближайшие годы должны произойти качественные изменения в образе жизни людей: при любом подсчете ресурсов Земли она не может прокормить более 10—12 млрд, человек — втрое больше, чем сейчас. Но и в этом случае ископаемого органического топлива хватит еще на 300—500 лет — и не более. Это — по самым оптимистическим оценкам, и, похоже, человечество еще не готово сделать из них правильные выводы. Одно ясно: без ядерной энергии — будь то энергия деления урана или энергия синтеза изотопов водорода — у человечества нет длительных перспектив сохранить нынешний уровень своего развития. И наш долг перед будущими поколениями не в том, чтобы сберечь для них в неприкосновенности запасы угля и нефти, а в том, чтобы передать им более высокую культуру, которая со временем поможет найти новые пути и новые источники энергии. В противном случае, как бы бережно мы ни расходовали природные запасы, рано или поздно мы будем вынуждены возвратиться в доиндустриальную эпоху, сократив при этом свою численность в 10—20 раз.
В последние годы со страниц научно-фантастических повестей как-то сами собой исчезли звездолеты, астронавты и космические одиссеи. Малость Земли и абсолютная ограниченность ее ресурсов не позволят человеку покинуть свою голубую планету. Перед лицом этой земной правды тускнеют космические грезы: сейчас у человека нет задачи важнее, чем сохранить себя как биологический вид.
Солнце на Земле
«Если действительно внутриатомная энергия в звездах поддерживает огонь в их гигантских топках, то мы, по-видимому, оказываемся намного ближе к осуществлению нашей мечты об овладении этой скрытой мощью для процветания человеческого рода или для его самоубийства»,— писал Артур Эддингтон в 1920 г. Всего через 32 года его предсказание сбылось: взорвав водородную бомбу, человек впервые зажег солнце на Земле.
К сожалению, предвидение Эддингтона сбылось лишь наполовину: пока что мы можем использовать энергию синтеза ядер только как орудие самоубийства. Нам остается надеяться, что со временем мы сумеем укротить термоядерный взрыв и обратим его на благо человечества.
О проблеме управляемого термоядерного синтеза, о магнитном удержании плазмы в термоядерных реакторах и о грандиозных перспективах термоядерной энергетики написано много и подробно. Прошло около 40 лет с того дня, когда впервые появилась надежда «поймать солнце в магнитную бутылку». Эта цель до сих пор не достигнута, но тысячи исследователей во всем мире не оставляют надежды достигнуть однажды сказочной долины Эльдорадо с ее неисчерпаемыми запасами термоядерной энергии.
Кванты вокруг нас
С развитием цивилизации труд становится эффективнее, досуг — изощреннее, а знания — обширнее. В современной системе знаний квантовая механика занимает особое место: ни одна физическая теория до сих пор не объясняла такого широкого и разнородного круга явлений и не добивалась столь блестящего согласия с экспериментом. Это неудивительно: всё вокруг нас и мы сами построены из атомов.
Сидя у телевизора, мы не задумываемся над тем, что его трубка работает лишь благодаря туннельному эффекту, а мы видим изображение на ней только потому, что в нашем глазу родопсин — особое вещество, подобное хлорофиллу, улавливает кванты света и трансформирует их в энергию импульсов зрительного нерва. Привычно щелкая затвором фотоаппарата, мы не вспоминаем об удивительной последовательности фотохимических реакций, позволяющих «остановить мгновенье». И в утренней спешке, мельком взглянув на электронные часы, не все догадываются, что всё их устройство основано на квантовых эффектах. (Вспомним: всего 400 лет назад Галилей открыл законы качания маятников, отсчитывая удары собственного пульса.)
Любые свойства вещества: его цвет, твердость, температуру плавления, магнитные и электрические характеристики, нельзя понять и предсказать без квантовой теории. Квантовая химия без всяких дополнительных гипотез позволила понять природу химической связи атомов в молекулах, квантовая теория конденсированных сред объяснила сверхпроводимость и свойства полупроводников, без которых не было бы ни современного телевидения, ни авиалайнеров, ни космических полетов. И всегда, когда мы хотим понять истинно глубокое явление природы — будь то работа атомного котла или деление клетки,— мы неизбежно переходим на язык квантовых иероглифов. Быть может, это и есть родной язык Природы, знание которого современному человеку необходимо так же, как его далеким предкам — понимание языка диких животных.
«Ученье без размышления — потеря времени» размышление без обучения опасно.»
Конфуций
«Печальна жизнь того, кто лишь мудр.»
Вольтер
«Я не знаю откуда я, куда иду и даже кто я.»
Эрвин Шрёдингер
Размышления
ГЛАВА 19
Возникновение научного метода. Сущность и развитие научного метода. Истинность и полнота научной картины мира. Наука и человечество. Границы научного метода. Наука и искусство. Будущее науки.
ГЛАВА 19
Пан
«Человечество околдовано неудержимым движением науки, и только искусство способно вернуть его к реальности»,— сказал однажды Бернард Шоу с присущим ему блеском.
Могущество современной науки поражает даже искушенный ум: она расщепила атомное ядро, достигла Луны, открыла законы наследственности... Но в обстановке всеобщего восхищения не всегда понимают, в чем суть научного метода, истоки его силы, и, тем более, не представляют его границ.
Недавно один физик в пылу спора заявил: «В принципе, для описания даже такой сложной системы, как человек, достаточно знать закон Кулона и уравнения квантовой механики». Такие утверждения в науке — не новость. Чтобы поднять Землю, Архимеду было достаточно рычага, а Лаплас брался предсказать будущее мира, если ему дадут начальные координаты и импульсы всех частиц во Вселенной. И хотя такая вера в законченность и всемогущество науки всегда привлекательна, полезно все-таки помнить предостережение Роджера Бэкона (1214—1294), которое сегодня так же верно, как и семьсот лет назад: «Если бы человек жил в смертной юдоли даже тысячи веков, он и тогда бы не достиг совершенства в знании; он не понимает теперь природы мухи, а некоторые самонадеянные доктора думают, что развитие философии закончено!»
Ослепление успехами точного знания, повсеместное еще четверть века назад, на наших глазах сменяется отрезвлением и спокойным анализом результатов науки. Квантовая физика — редкое умение человека, особо почитаемое в XX веке. Следует, однако, помнить, что это лишь небольшая, хотя и очень важная, часть общечеловеческой культуры и только в этом контексте можно понять ее истинное место и
роль в развитии нынешней цивилизации.
ВОЗНИКНОВЕНИЕ НАУЧНОГО МЕТОДА
Мы утратили знания древнейших времен, до нас дошли только их осколки. Но они бессистемны, чужды нам по духу и кажутся наивными. У истоков нынешней науки стоят древние греки. Они наши предшественники не только по времени, но — что самое главное — по духу. Греки изобрели
доказательство. Ни в Египте, ни в Месопотамии, ни в Китае такая идея не возникла, быть может, потому, что все эти цивилизации были основаны на тирании и безусловном подчинении авторитетам. В таких условиях даже сама мысль о возможности разумных доказательств кажется крамольной.
В Афинах впервые за всю мировую историю возникла республика. Не надо ее особенно идеализировать: она расцвела на труде рабов. Тем не менее в Древней Греции сложились условия, при которых стал возможен свободный обмен мнениями, и это привело к небывалому расцвету наук.
В средние века потребность рационального познания природы совершенно угасла рядом с попытками осмыслить предназначение человека в рамках различных религиозных вероучений. В продолжение почти десяти веков религия давала исчерпывающие ответы на все вопросы бытия, которые не подлежали ни критике, ни даже обсуждению.
Сочинения Эвклида были переведены на латинский язык и стали известны в Европе в XII веке. Однако в то время их воспринимали просто как совокупность

остроумных правил, которые надлежало заучить наизусть — настолько они были чужды духу средневековой Европы, привыкшей верить, а не искать корней истины. Но объем знаний стремительно рос, и их уже не удавалось согласовать с направлением мыслей средневековых умов.
Конец средневековья обычно связывают с открытием Америки в 1492 г. Некоторые указывают даже более точную дату: 13 декабря 1250 г.— день, когда в замке Флорентино близ Лючеры умер король Фридрих II Гогенштауфен. Конечно, не следует относиться к этим датам всерьез, но несколько таких дат, взятых вместе, создают несомненное ощущение достоверности перелома, который произошел в сознании людей на рубеже XIII и XIV веков. В истории этот период назвали Возрождением. Подчиняясь внутренним законам развития и без видимых на то причин, Европа всего за два века возродила зачатки древних знаний, до того более десяти веков находившихся в небрежении и получивших впоследствии название научных.
В период Возрождения в умах людей произошел поворот от стремления осознать свое место в мире к попыткам понять его рациональное устройство без ссылок на чудеса и божественное откровение. Вначале переворот носил аристократический характер, но изобретение книгопечатания распространило его на все слои общества. Суть перелома — освобождение от давления авторитетов и переход от средневековой веры к знанию нового времени. Церковь всячески противилась новым веяниям, она строго судила философов, которые признавали, что есть вещи истинные с точки зрения философии, но ложные с точки зрения веры, «как будто в противовес истине, заключенной в священном писании, может находиться истина в книгах язычников».
Если отвлечься от политических страстей времени, в которое жил Галилей, становится ясно, что судили его не только за сочувствие системе Коперника: такие же мысли столетием раньше отстаивал кардинал Николай Кузанский (1401 — 1464) и остался безнаказанным. Но в то время как ученый кардинал
утверждал их, ссылаясь на авторитеты — как то и подобает верующему, Галилей —
доказывал, как того требует наука, то есть предлагал проверить каждому, опираясь лишь на опыт и здравый смысл. Именно этого не могли простить ему служители церкви. Но рухнувшую плотину веры починить было уже нельзя, и освобожденный дух стал искать новые пути для своего развития.
Принципы научного знания и
метод, позволяющий их осуществить, начали искать задолго до возникновения современной науки. Уже в XIII веке Роджер Бэкон в своем знаменитом трактате писал: «Существует естественный и несовершенный опыт, который не сознает своего могущества и не отдает себе отчета в своих приемах: им пользуются ремесленники, а не ученые... Выше всех умозрительных знаний и искусств стоит умение производить опыты, и эта наука есть царица наук...
Философы должны знать, что их наука бессильна, если они не применяют к ней могущественную математику... Невозможно отличить софизм от доказательства, не проверив заключение путем опыта и применения».
В 1440 г. Николай Кузанский написал книгу «Об ученом невежестве», в которой настаивал, что все познания о природе необходимо записывать в цифрах, а все опыты над нею производить с весами в руках.
Утверждение новых взглядов происходило медленно. Например, арабские цифры уже в X веке вошли во всеобщее употребление, но даже в XVI веке вычисления повсеместно производили не на бумаге, а с помощью особых жетонов, которые были еще менее совершенны, чем наши конторские счеты.
Настоящую историю научного метода принято начинать
с Галилея и Ньютона. Согласно той же традиции Галилео Галилей (1564—1642) считается родоначальником экспериментальной физики, а Исаак Ньютон (1643—1727) — основателем теоретической физики. Конечно, в их время не было такого разделения единой науки физики на две части, не было даже самой физики — она называлась натуральной философией. Но такое разделение имеет глубокий смысл: оно помогает понять особенности научного метода и, по существу, эквивалентно делению науки на опыт и математику, которое сформулировал еще Роджер Бэкон.
СУЩНОСТЬ И РАЗВИТИЕ НАУЧНОГО МЕТОДА
Человеку дана способность познания явлений, то есть умение находить связи между ними и устанавливать последовательность причин и следствий. На каждом этапе истории он реализовал эту способность по-разному — в зависимости от того, что считала главным эпоха и каких ответов требовала она от своих лучших представителей. Нынешний век — век науки. Мы настолько привыкли отождествлять понятия «знание» и «наука», что не мыслим себе иного знания, кроме научного. В чем его сущность и особенности?
Сущность научного метода можно сформулировать довольно просто: он позволяет добыть такие знания о явлениях, которые можно проверить, сохранить и передать другому. Отсюда сразу следует, что наука изучает не вообще всякие явления, а только те из них, которые повторяются. Ее главная задача — отыскать
законы, согласно которым эти явления протекают. В разное время наука достигала этой цели по-разному.
Древние греки внимательно
наблюдали явления и затем с помощью умозрения пытались проникнуть в гармонию природы силой интеллекта, опираясь только на данные
чувств, накопленные в памяти. В период Возрождения стало очевидно, что поставленная цель не может быть достигнута только с помощью пяти чувств — необходимы приборы, которые есть не что иное, как их продолжение и обострение. При этом сразу же возникли два вопроса: насколько можно доверять показанием приборов и как сохранить информацию, полученную с их помощью?
Вторая задача была вскоре решена изобретением книгопечатания и последовательным применением математики в естественных науках. Значительно труднее оказалось разрешить первый вопрос — о достоверности знаний, полученных с помощью приборов. По существу, окончательно он не исчерпан до сих пор, и вся история научного метода — это история постоянного углубления и видоизменения этого вопроса.
Довольно скоро поняли, что показаниям приборов, как правило, можно доверять, то есть они отражают что-то реальное в природе, существующее независимо от них. (В конце концов убедились, например, в том, что пятна на Солнце — это пятна именно на Солнце, а не дефекты зрительной трубы, с помощью которой они были открыты.) В этот период расцвета экспериментальной физики были накоплены все те знания, на основе которых в конце прошлого века произошел мощный скачок техники.
Однако объем знаний стремительно рос, и в какой-то момент люди перестали понимать, как соотносить числа, полученные с помощью приборов, с реальными явлениями в природе. Этот период в истории естествознания на рубеже веков известен как кризис в физике.
Причин кризиса было две. С одной стороны, приборы слишком далеко ушли от непосредственных ощущений человека и поэтому интуиция, лишенная образной основы наблюдаемых фактов, не давала простой картины изучаемых явлений. Тем самым были исчерпаны возможности наглядной интерпретации данных опыта. С другой стороны, не существовало логической схемы, которая помогла бы упорядочить научные факты и без ссылок на интуицию привести к таким наблюдаемым следствиям, против которых не мог бы возразить даже здравый смысл.
Кризис преодолели на втором пути: по-прежнему доверяя показаниям приборов, изобрели новые понятия и новые логические схемы, которые научили по-новому относиться к этим показаниям. (Именно в этот момент важное значение приобрела теоретическая физика.) Решающую роль в ломке устоявшихся понятий сыграла квантовая механика. Она не
347 только дала нам власть над совершенно новым миром квантовых явлений, но и убедила в том, что показания приборов — не простая фотография явлений природы: они лишь отражают и закрепляют числами их разные грани и только вместе с нашими представлениями о ней получают смысл и значение. Эти знания с течением времени совершенствуются и позволяют нам правильно предсказывать всё более тонкие явления природы. С этим согласны теперь почти все физики. Однако, как и все люди, они хотят понять больше: насколько полна картина мира, нарисованная физикой? Вопрос этот не физический, а, скорее, философский. Он возникал во все времена, но впервые четко был сформулирован в диалогах Платона.
Платон уподобил ученых узникам, прикованным в пещере спиной ко входу так, что они не видят освещенных предметов, находящихся у них за спиной, а только тени, движущиеся на стене перед ними. Он признавал, что даже в этих условиях, внимательно наблюдая движение теней, можно научиться предугадывать поведение тех тел, чьи тени видны на стене. Но знание, приобретенное таким способом, бесконечно далеко от того, которое получает освобожденный узник, выйдя из пещеры.
«Не думаешь ли ты, что, вспоминая о своей первой жизни, о той мудрости и о тех узниках, он сочтет свою перемену счастливой, а о других (оставшихся в пещере) будет жалеть?.. Вспоминая также о почестях и похвалах, которые возданы были друг другу, и о наградах тому, кто с проницательностью смотрел на происходящее и лучше других замечал, что бывает сначала, что потом и что идет вместе и, исходя из этого, обладал особой способностью угадывать, что должно быть,— как ты думаешь, будет ли он желать того же и станет ли он завидовать людям, которые у них считаются почетными и влиятельными?» — спрашивает один из героев Платона.
Платону нечего возразить. Окружающий мир и в самом деле богаче того, который мы в состоянии себе представить только на основе данных физики. Слепой от рождения может в совершенстве изучить оптику, но при этом он не будет иметь ни малейшего представления о том, что такое свет и как выглядит богатство весенних красок. Когда мы вступаем в мир квантовых явлений, все мы становимся похожими на слепых от рождения. Мы начисто лишены «квантового зрения» и вынуждены двигаться в непривычном мире ощупью.

|
|
348
|
Число подобных аналогий легко умножить, и каждая из них учит физиков быть скромнее. Теперь мы понимаем, что вопросы о полноте физических знаний и о сущности явлений лежат вне физики и не могут быть разрешены ее средствами. Физика изучает только законы, по которым эти явления происходят. И в этом смысле она в точности следует «теории теней».
Но даже такое, ограниченное знание о природе, насколько оно истинно?
ИСТИННОСТЬ И ПОЛНОТА
научной картины мира
Вопрос этот не может быть разрешен логически: мы
верим в науку, поскольку она позволяет нам правильно предсказывать явления природы и не зависит рт произвола познающей личности. Мы можем сомневаться в структуре ее образов — они зависят от способа общения. Но мы теперь с достоверностью знаем, что все земные и небесные тела построены из одних и тех же элементов и примерно в тех же пропорциях. Мы уверены даже, что законы природы одинаковы во всей Вселенной, и, следовательно, атом натрия всегда излучает одну и ту же D-линию, находится ли он на Земле, на Сириусе или в другой галактике. Это теперь признают почти все, и никто не сомневается в истинности
этих знаний. Сомнения возникают тогда, когда мы на основании твердо установленных, но частных фактов пытаемся создать целостную и непротиворечивую картину мира, согласную со всей совокупностью данных опыта и общей природой человеческого сознания. Наиболее часто возникает вопрос: насколько однозначна
форма физических законов, в которую мы облекаем наше знание?
Категорического ответа на этот вопрос не существует. Те, кто знаком с историей науки, знают, что в некоторые периоды ее развития действительно бок о бок существовали две физические теории, каждая из которых считала себя истинной, и обе одинаково хорошо объясняли известные в то время явления. Однако та же история свидетельствует, что с тече-
349 нием времени новые опыты выбирали из двух теорий только одну, либо же на новом этапе обе они сливались воедино на основе новых, более высоких принципов,— как это случилось с корпускулярной и волновой теориями света после открытия квантовой механики.
Факты и понятия науки могут показаться случайными хотя бы потому, что установлены в случайное время случайными людьми и часто при случайных обстоятельствах. Но, взятые вместе, они образуют единую закономерную систему, в которой число перекрестных связей настолько велико, что в ней нельзя заменить ни одного звена, не затронув при этом всех остальных. Под давлением новых фактов система эта непрерывно изменяется и уточняется, но никогда не теряет цельности и своеобразной законченности. Нынешняя система научных понятий — продукт длительной эволюции: в течение многих лет старые звенья в ней заменялись новыми, более совершенными, и даже истинно революционные открытия всегда возникали с учетом и на основе прежних знаний. Одним словом, наука — это не застывшая мертвая схема, а живой развивающийся организм. И хотя все понятия науки — творения человеческого разума, они произвольны настолько же, насколько случайна сама разумная жизнь в природе.
В одном из фантастических рассказов Рэя Брэдбери герой на машине времени отправился в далекое прошлое и во время короткого визита туда нечаянно раздавил там маленькую бабочку. Когда он вернулся обратно, то не узнал мира, который оставил уезжая: оказалось, что его невольное
и на первый взгляд незначительное вторжение в ход биологической эволюции полностью изменило все ее конечные результаты. Очевидно, пример этот — не более чем эффектная крайность, извинительная для фантаста. Нет слов — все
в природе взаимосвязано. Однако не такой жесткой причинностью, граничащей с детерминизмом, а более изобретательно и гибко — на манер статистических закономерностей квантовой механики.
Эволюция системы научных понятий — такой же бесконтрольный, но закономерный процесс, как и эволюция животного мира. Можно мыслить его другим в частностях, можно удивляться его странным особенностям, но нельзя представить его целиком иным. Неизвестно, как возникло первое понятие и первый организм и что случилось бы, если бы они были другими. Но мы знаем, что каждый новый шаг эволюции зависел от всех предыдущих. Поэтому можно легко вообразить лошадь с лапами тигра или атом в виде бублика, но
350
представить иными весь животный мир и всю систему научных понятий нам не под силу: и биологическая эволюция, и формирование научных знаний подчиняются своим внутренним законам, изменить которые мы не в состоянии и познать которые еще никому не удалось.
Мы рождаемся в мире сформировавшихся видов и установившихся понятий. Можно вывести новую породу лошадей или заменить одно понятие другим, которое больше соответствует научной истине. Однако вопрос об истинности или ложности
всей системы человеческих знаний лежит вне сферы сознания и не может быть разрешен его силами. Более того, вопрос этот лишен смысла. Наука создана человеком и для человека, и вся система ее понятий придумана так» что она соответствует природе человеческого сознания. Конечная же цель понятий — объяснять и предсказывать явления, воздействующие на наши органы чувств или на их продолжение — приборы.
Быть может, где-то во Вселенной существуют разумные существа с иными органами чувств и другой структурой сознания. Почти наверное их система понятий отлична от нашей. Но даже если мы будем в состоянии понять ее настолько, чтобы сравнить с нашей собственной, мы не сможем заключить из этого сравнения, что она ложна. Наоборот, она всегда истинна, если дает своим органам чувств правильные предсказания. Наши научные знания о мире — это реальные тени реальных явлений природы. Тени, которые они отбрасывают, освещенные светом нашего сознания. И как один и тот же предмет отбрасывает различные тени в зависимости от угла, под которым он освещен,— точно так же система научных знаний, созданная разумной жизнью другой планеты, может отличаться от нашей. Быть может, когда-нибудь мы сможем сравнить между собой эти «сознательные тени» и, как узник Платона, вырвавшийся из пещеры, восстановить по ним истину во всей полноте и блеске. (Так по нескольким плоским чертежным проекциям детали опытный мастер изготавливает ее целиком.) Но пока этого не случилось, мы должны развивать нашу теперешнюю науку: при всем своем несовершенстве, это пока единственный способ проникнуть в глубь наблюдаемых явлений.
Мир существует независимо от нашего сознания. Ему нет никакого дела до того, как мы, часть этого мира, представляем себе внутренние механизмы его внешних проявлений. Это важно только для нас самих. Все дело в другом: как далеко мы можем продвинуться на этом пути? И до каких пор сможем уточнять наши представления о причинах наблю-
ЗЫ
даемых явлений? Вместо вопроса о физической реальности мы должны решить вопрос о границах научного метода, который после изобретения квантовой механики стал особенно актуален.
НАУКА И ЧЕЛОВЕЧЕСТВО
В нынешнем понимании этого слова наука существует не более 300—400 лет, а слово «ученый» в современном значении появилось впервые лишь в 1840 г. в сочинениях Уильяма Уэвелла. За такой ничтожный срок человек открыл и освоил Землю, покорил океан, научился летать, видеть собеседника на другой стороне Земли, ступил обеими ногами на Луну и, запрокинув голову, посмотрел оттуда на Землю.
Наука полностью изменила образ жизни цивилизованных народов, их отношение к миру, способ мышления и даже моральные категории. Главная черта новой философии жизни — ощущение непрерывных движений в мире и, как результат этого ощущения — стремление узнать и понять окружающий мир, чтобы должным образом ответить на его изменения. Современный человек скептически относится к раз навсегда установленным принципам, он не верит в окончательность любого знания и каждую минуту находится в состоянии поиска оптимальных решений. Жажда знаний, пробудившаяся впервые в эпоху Возрождения, не угасла до сих пор.
Научный метод преобразовал мир, в котором мы живем: он населил его машинами, впервые накормил людей и защитил их от болезней. На основе успехов научного метода возникла и укрепилась новая вера — вера в науку. Поворот в умах, вызванный открытием научного метода, можно сравнить только с великими религиозными переворотами: буддизмом, христианством, исламом. Наука и формально и по существу пришла на смену религии: от нее ждут ответов на все вопросы жизни, ее приговоры считают окончательными, среди ее служителей ищут образцы для подражания, а число ее адептов растет быстрее, чем армия буддийских монахов на Востоке в старые времена. Страны Запада, воспринявшие эту новую веру, далеко обогнали прежде цветущие страны Востока. Все это оказалось возможным благодаря простому открытию: суть многих явлений природы можно записать в виде чисел и уравнений, устанавливающих связи между этими числами. Как и всякий последовательный метод, научный метод имеет свои преимущества, область действия и границы применимости.
Сидеть на берегу моря и смотреть, как солнце совершает свой круг по небу, в древности считалось занятием, достойным мужа. С тех пор многое изменилось. Индуктивные науки пришли на смену чистому умозрению и принялись «поверять алгеброй гармонию». Наука стала на прочное основание опыта, но утратила черты спокойной мудрости и неторопливого созерцания. На это можно сетовать, но изменить этого уже нельзя.
В пору ее становления наукой занимались на свой страх и риск преданные ей одиночки. Долгое время ее результаты не считали обязательными для всех: даже в середине прошлого века Фарадей ратовал за признание науки элементом всеобщего образования. В наши дни наука стала массовой, а научная работа — самым обычным и часто прозаическим занятием. Из инструмента познания наука превратилась в материальную силу, но вместе с этим прикоснулась к человеческим страстям совсем не того высокого склада, которым она обязана своим возникновением.
Все это верно, все это так, но в век науки немыслимо отказаться от ее результатов только из этических соображений: в стремлении к чистоте не следует преступать границ стерильности. Наука пока что исправно несет свою службу: строит машины, кормит человечество, снабжает его энергией, защищает от болезней. Конечно, это не снимает моральной ответственности с ученых за их — иногда смертоносные — открытия.
Как известно, в процессе биологической эволюции всегда возникают мутации, часть из которых быстро закрепляется и вытесняет менее приспособленные. Но другая их часть

консервируется впрок и проявляется лишь тогда, когда изменившиеся внешние условия грозят уничтожить биологический вид. Эволюция не прекратилась и теперь — она лишь изменила свои формы: на протяжении тысячелетий тело человека осталось практически без изменений, зато его сознание изменилось неузнаваемо и необратимо. Быть может, наука — это именно тот источник новых идей, которые спасут человечество в грядущих катастрофах.
Наука — это соглашение между людьми, достаточно плодотворное, чтобы стать всеобщим. На основе этого соглашения вырос и развивается своего рода коллективный разум — если и не бессмертный, то сравнительно долговечный. Как долго он проживет и где границы научного метода — пока неясно, однако то, что они существуют,— несомненно.
ГРАНИЦЫ НАУЧНОГО МЕТОДА
Человека всегда занимали «вечные вопросы»: о жизни и смерти, о добре и зле, о боге и вечности, о конечной цели бытия и нашем месте во Вселенной. Религия не смогла на них ответить, она лишь на время успокоила стремление их разрешить, дав краткое утешение в забвении проблем земного бытия.
Наука тоже не приспособлена для ответов на вопросы о смысле жизни — у нее более скромные задачи. В ослеплении успехами точных наук об этом часто забывают и упускают из виду ту простую возможность, что будущим поколениям людей наш рационализм и вера в науку будут столь же смешны и непонятны, как для нас обряды египетских жрецов: безгранично лишь само познание, а не его исторические формы.
Наука в состоянии познать только те явления, свойства которых можно оценить числом. Работу гипнотизера нельзя описать математическими формулами, и тем не менее результаты ее несомненны и воспроизводимы. Достижения индийских йогов — экспериментальный факт, многократно проверенный. Однако эти феномены не могут стать объектами точной науки, поскольку они не поддаются количественному описанию с помощью чисел и формул.
Далеко не все в мире можно разложить на элементы и представить в виде формул и чисел, но не стоит огорчаться по этому поводу: ведь это означает просто, что мир богаче и сложнее, чем его образ, даваемый наукой. С точки зрения точных наук гений и убийца — неразличимы, ибо можно строго научно доказать, что они состоят из совершенно одинаковых атомов. И никакая наука не в силах объяснить нашу радость при виде улыбки ребенка. Это всегда полезно помнить, чтобы не погрязнуть в «ученом невежестве».
На фоне этих рассуждений квантовая механика должна показаться совсем простой наукой. В самом деле, об атоме водорода мы знаем так много, что можем предсказать все его наблюдаемые свойства. Значительно труднее, но все-таки можно рассчитать свойства молекулы водорода. Но уже свойства молекул белка мы предсказать не в состоянии. Белков не так уж много, однако из них построен каждый человек во всей его неповторимости.
Одним словом, наука — это полезно и даже необходимо, но нельзя обращать нужду в добродетель и подчинять ей все только на том основании, что сегодня без науки представить себе жизнь невозможно.
НАУКА И ИСКУССТВО
Нигде так отчетливо не видна ограниченность науки, как при попытках ее методами понять секрет искусства. Наука «все знает» о рояле: число, качество и длину струн, породу дерева, состав клея и мельчайшие особенности строения. И тем не менее она не в состоянии объяснить, что происходит с этим полированным ящиком, когда к нему подходит большой артист. Быть может, это и не нужно: человеку, который плачет над книгой, по большей части все равно, какими средствами добился этого автор. Конечно, он может прочесть затем критический труд вдвое толще книги, его поразившей, но все это напоминает препарирование трупов в анатомичке: специалистам оно необходимо, а большинству людей неприятно. «Чтобы презирать пение и танцы, достаточно разложить их на составные элементы»,— писал Марк Аврелий. Но искусство мудро: оно всегда охраняло непосредственную истину чувственных восприятий от настойчивых вторжений испытующей науки. Во все времена его ценили именно за способность «напоминать нам о гармониях, недоступных для систематического анализа».
Каждый при желании может понять, как устроен атомный котел, даже не увидав его. Но никакими силами нельзя объяснить человеку, что такое обаяние, если он сам ни разу не испытал на себе его воздействия.
Причина могущества науки — в ее всеобщности: ее законы свободны от произвола отдельных людей, она отражает лишь коллективный их опыт, независимый от возраста, национальности и темперамента исследователей. Секрет искусства — в его неповторимости: мощь его воздействия зависит от всего прошлого опыта человека, от богатства его ассоциаций, от неуловимых переходов настроения, от случайного взгляда, слова или прикосновения — от всего того, что составляет силу индивидуальности, красоту преходящего и власть неповторимого.
Высшее достижение ученого — если результаты его работы подтвердятся, то есть кто-то другой повторит их в дальнейшем. В искусстве повторение равносильно смерти, и настоящий артист умирает на сцене каждый раз по-новому.
Известны случаи, когда симфонии сочиняли без знания музыкальной грамоты. Они могли быть непривычными, но имели право на существование, коль скоро хоть кому-то нравились. В науке такое положение немыслимо: в ней существует критерий истины и слово «нравится» исключено из ее лексикона.
Истины в науке доказываются, а явления — объясняются. В искусстве они истолковываются: ему чужды логические рассуждения, а строгие доказательства оно заменяет непосредственной убедительностью образов.
Наука всегда может объяснить, почему хороша эта формула или плоха та теория. Искусство позволяет лишь почувствовать очарование мелодии и блеск сонета — и никогда ничего не объясняет до конца.
Наука началась тогда, когда в хаосе случайных фактов научились выделять простые закономерности. Но лишь там, где при сложении простых и понятных вещей внезапно возникает ощущение чуда, начинается искусство.
Наука основательна и нетороплива: она годами решает свои задачи, которые иногда переходят из поколения в поколение. Она может позволить себе эту роскошь: в ней изобретен однозначный способ записи и хранения добытых фактов. В искусстве интуитивно точный мир образов живет мгновение. («Герои одного мгновения»—так часто говорят о великих актерах.) Однако оно будит в сердцах людей отзвук, который не угасает годами, а иногда круто меняет всю их дальнейшую жизнь. «Остановись, мгновенье, ты прекрасно!» — это желание Фауста может выполнить только магия искусства: благодаря ему даже через много лет память человека с пугающей ясностью восстановит невыразимые словами оттенки давних мыслей и настроений.
Несмотря на кажущуюся хрупкость и неоднозначность образов искусства, оно долговечнее и древнее науки. Эпос о Гильгамеше и поэмы Гомера волнуют нас до сих пор. Потому что они о чем-то главном в человеке, что не изменилось в нем на протяжении тысячелетий. Наука же едва успевает закреплять только что открытые возможности исследования. Читать научные книги прошлого века сейчас почти невозможно: настолько они устарели и так сильно изменился с тех пор весь стиль научного мышления. Поэтому значение научных трудов определяется не их долговечностью, а их плодотворностью: если в свое время они помогли развитию науки — с них довольно.
Можно и дальше искать и находить бесчисленные оттенки различий между искусством и наукой — предмет этот неисчерпаем. Однако польза такого занятия сомнительна: на поверку они различаются между собой не по существу, а лишь по методам познания окружающего мира и человеческой природы. В Древней Греции их не различали и называли одним словом: те%те — что означает «умелость», «опытность», «изощренность» (отсюда же «техника»). Первые законы физики, установленные Пифагором из Самоса, были законами гармонии, а древние научные трактаты часто писались в стихах.
Уже давно поэты мечтают не просто о поэзии, а о «поэзии мысли». Ученые, со своей стороны, берутся объяснить желающим «поэзию в науке». И те и другие вышли, наконец, из своих укрытий, дабы разрушить искусственные границы кланов и забыть давние распри о древности рода: нет смысла спорить, какая рука важнее — левая или правая, хотя развиваются и работают они по-разному.
Актер понимает, что ему не достигнуть вершин мастерства, если предварительно он не овладеет наукой дикции, мимики и жеста. И лишь потом (если он талантлив!) он сможет из этих простых и понятных элементов неведомым ему самому способом создать нечто неповторимое и удивительное.
Точно так же ученый, даже овладевший ремеслом физика,— еще не физик, если он доверяет только формулам и логике. Все глубокие истины науки парадоксальны при своем рождении, и нельзя достигнуть их, опираясь лишь на логику и опыт.
Одним словом, настоящее искусство невозможно без самой строгой науки. Точно так же метод открытия глубоких научных истин лишь отчасти принадлежит науке и в значительной мере лежит в сфере искусства. Но при этом всегда существуют границы научного анализа искусства и предел, который не позволяет постигнуть науку единым порывом вдохновения.

ниях случая» находит единственные и неповторимые, а из «бесконечной вереницы явлений» безошибочно выби
Существует очевидная дополнительность методов науки и искусства в процессе познания окружающего мира. Рабочий, повседневный метод науки — это
анализ фактов и выяснение их причин, стремление «найти вечный закон в чудесных превращениях случая», попытки «отыскать неподвижный полюс в бесконечной веренице явлений». В искусстве преобладает бессознательный
синтез, который в тех же «превращерает лишь те, которые позволяют почувствовать гармонию целого.
Мир человеческих восприятий бесконечно разнообразен, но хаотичен и окрашен личными переживаниями. Человек стремится упорядочить свои впечатления и согласовать их с впечатлениями других. Для этого он изобрел науку и создал искусство. Именно это стремление стало общей побудительной причиной их возникновения. Их объединяет чувство удивления, которое они после себя оставляют:
как возникла эта формула, эта поэма, эта теория и эта мелодия. («Начало знания — удивление»,— говорили в древности.)
Природа творчества едина во всех искусствах и науках. Она определяется интуитивной способностью группировать факты и впечатления окружающего мира таким образом, чтобы удовлетворить нашу эмоциональную потребность в чувстве гармонии, которое человек испытывает, выделив из хаоса внешних впечатлений нечто цельное и законченное: статую из мрамора, поэму из слов, формулу из чисел. Это эмоциональное удовлетворение одновременно и первый критерий истинности созданного, которая, конечно, в дальнейшем проверяется: в науке — опытом, в искусстве — временем.
«Ученый изучает природу не потому, что это полезно: он изучает ее потому, что это доставляет ему удовольствие, потому, что она — прекрасна. Если бы природа не была прекрасной, она не стоила бы того труда, который тратится на ее познание, и жизнь не стоила бы того труда, который нужен, чтобы ее прожить».
Эти слова принадлежат Анри Пуанкаре. Эстетическое восприятие логической красоты науки в той или иной форме присуще каждому настоящему физику. Но, пожалуй, никто не сказал об этом лучше Пуанкаре. «Он любил науку не только ради науки. Она доставляла ему духовную радость и наслаждение художника, постигшего искусство облекать красоту в реальные формы»,— писал о нем русский переводчик его знаменитых книг: «Наука и метод», «Наука и гипотеза», «Ценность науки», «Последние мысли», которые определили выбор жизненного пути Луи де Бройля, Фредерика Жолио-Кюри и еще многих других.
БУДУЩЕЕ НАУКИ
Когда думают о будущем науки, как правило, представляют себе мир машин, кнопок, прозрачных куполов — одним словом, мир
вещей, которыми повелевает человек в чистом комбинезоне. При этом впадают в ту же ошибку, которую допускает большинство людей после беглого знакомства с квантовой физикой. Как правило, их поражают в ней конкретные «грубые и зримые» факты: атомная бомба, атомный ледокол, атомная электростанция. Лишь очень немногие догадываются, что все эти достижения — довольно простые следствия квантовой физики. И удивляться надо не им, а изумительно простой и гармоничной системе научных
идей квантовой механики, благодаря которым стали возможны и ледокол, и электростанция, и, к сожалению, бомба.
Никто не может говорить о будущем науки без риска впасть в наивность или преувеличение. Можно легко доказать ограниченность научного метода в той области, где он неприменим, но нельзя предсказать всех его возможностей. Несомненно, что научный способ мышления — лишь одна из способностей человеческого сознания, которая, однако, до сих пор себя не исчерпала. Вполне вероятно, что в дальнейшем человек откроет новые способы познания окружающего мира и на этой основе лучше поймет свое место в нем. Но это новое, более совершенное знание почти наверное будет включать в себя как составную часть все главные достижения науки.
Остается только гадать, каким будет это новое знание: человек всегда может больше, чем умеет. Быть может, со временем в человеке с новой силой разовьется способность синтетического познания, отличавшая античных мудрецов, которая теперь почти угасла на фоне успехов научного анализа. Быть может, в дальнейшем интуиция из инструмента научного предвидения станет орудием научного доказательства. В этом нет ничего невероятного: ведь мы же доверяем глазу сортировщика алмазов, а он отличается от обычного только особой остротой в результате длительной тренировки. Может быть, точно так же со временем научатся воспитывать интуицию и добьются ее воспроизводимости у разных людей. Если это действительно удастся, то сами собой отпадут вопросы о неоднозначности научных понятий и вообще весь громоздкий аппарат логики. Последствия такой революции в мышлении предсказать невозможно.
В гипотезах о будущем науки недостатка нет: существует их полный спектр — от безудержного энтузиазма до самого мрачного пессимизма. Одни предрекают скорую гибель всей нашей цивилизации от неумелого пользования ею же вызванными силами. Другие верят, что человечество останется жить даже тогда, когда угаснет наше Солнце.
Но как бы ни развивалось человечество, оно всегда с удивлением будет обращаться мыслью в наш бурный и стремительный век науки, точно так же как мы теперь вспоминаем эпоху Возрождения и времена античных мудрецов.
«Всему присуща своя красота, но не каждому она видна.»
Конфуций
«Именно лучшую часть прекрасного нельзя передать на картине.»
Френсис Бэкон
ПОСЛЕСЛОВИЕ
С помощью колдовства герои старой сказки научились понимать язык птиц и зверей. Они сразу стали могущественнее, но вместе с тем и уязвимее: теперь они были в ответе за многое из того, чем ранее могли пренебречь по незнанию.
Когда дикие кочевники клеймили табуны раскаленным железом, они не знали, что спектр его излучения подчиняется формуле Планка. Купая лошадей, они не представляли себе молекул воды в виде уголка в 109°30
/. И, выходя йз реки, не подозревали, что загаром своих тел они обязаны фотонам.
Сейчас, тысячелетия спустя, в природе все осталось по-прежнему: солнце каждый день всходит на востоке, вода в реках замерзает при нуле градусов Цельсия, а раскаленный металл остывает по вечным законам термодинамики.
Только теперь мы обо всем этом знаем. Быть может, наше знание не сделало нас счастливее (ибо сказано: «во многой мудрости много печали»), но знание это необратимо, оно — элемент
культуры, которая единственно отличает нас от первобытных пастухов. Поразительно и необъяснимо, каким образом чтение хороших книг — процесс нематериальный — неузнаваемо меняет весь облик человека: его речь, улыбку, выражение лица и глаз, даже походку и жесты. Совокупность знаний, которую мы называем культурой, настолько изменила образ жизни и систему ценностей цивилизованных народов, что многие даже склонны относить их к другому биологическому виду, чем те дикие прародители, от которых все мы произошли.
Сейчас вся эта огромная масса знаний грозит раздавить человечество, вызвавшее ее к жизни. Часто можно услышать сентенции о том, что наука зашла в тупик, погрязла в мелочах и растеряла свои великие идеалы. И слишком многие повторяют эффектные слова Элиота: «Мы забыли мудрость ради знания, мы утратили знания в потоке информации».
Подобные рассуждения очень импонируют людям усталым или разочарованным. Но вопреки безнадежности в хаосе фактов и мнений вдруг вспыхивает искра таланта, осветив на мгновение что-то очень простое и главное. Тогда все забывают свои сетования, споры по мелочам и молча разделяют восхищение перед новой истиной: как всякая совершенная красота, она редка, удивительна и обезоруживает своей недоказуемой силой.
Я хотел бы, чтобы все, кто дочитал эту книгу до конца, разделили со мной ту радость и то удивление, которые я сам когда-то испытал, узнавая впервые странный мир квантовой физики. И еще, я надеюсь, книга поможет: одним — избавиться от страхов новейшего знания и найти в нем опору среди многоликих смут нынешней цивилизации; другим — почувствовать хрупкость и неповторимость самого феномена жизни и принять свою долю ответственности за его сохранение на нашей единственной планете; а кому-то — понять свое место и предназначение «в этом прекрасном и яростном мире».

ОГЛАВЛЕНИЕ
Причинность и случайность, вероятность и достоверность 178
Научно-художественное издание
ПОНОМАРЕВ Леонид Иванович
ПОД ЗНАКОМ КВАНТА
Оформление художника
В. Я. Батищева Иллюстрации
О. О. Левенок
Заведующий редакцией
Л. И. Гладнева Редакторы
Е. К. Козлова,
В. А. Григорова
Младший редактор
В. А. Кузнецова Художественный редактор
Т. Н. Кольченко Технические редакторы
И. Ш. Аксельрод, А. П. Колесникова
Корректоры
Е. Ю. Рычагова, М. Л. Медведская
ИБ.№ 32804
Сдано в набор 25.11.88. Подписано к печати 25.10.89. Формат 84X108/32. Бумага тип. № 1. Гарнитура литературная. Печать высокая. Усл. печ. л. 19,32. Усл. кр.-отт. 19,74. Уч.-изд. л. 20,47. Тираж 75 000 экз. Заказ № 1269. Цена 1 р. 70 к.
Ордена Трудового Красного Знамени Издательство «Наука»
Главная редакция физико-математической литературы 117071 Москва В-71, Ленинский проспект, 15
Ленинградская типография № 2 головное предприятие ордена Трудового Красного Знамени Ленинградского объединения «Техническая книга» им. Евгении Соколовой Государственного комитета СССР по печати. 198052, г. Ленинград, Л-52, Измайловский проспект, 29.
NAUKA PUBLISHERS
Main Editorial Board for Literature on Physics and Mathematics
Leninski prospect, 15, Moscow 117071, USSR
UNDER THE SIGN OF QUANTUM
Leonid I. PONOMAREV,
Prof. (Phys. & Math.)
I. V. Kurchatov Atomic Energy Institute, Moscow, USSR
READERSHIP: The book will appeal to any reader with a scientific bent who is intrigued by the triumphs of modern science, before which pale the fantasies of science fiction.
CONTENTS: Origins: Atom. Waves. Quanta. Spectra. Ions. Radiant Matter. Atoms, Electron, Waves. The Planetary Atom. Spectral Series. Photons. Pre-Bohr Times. The Bohr Atom. Post-Bohr Time. Teachings of the Ancients. Elements and Atoms. The Periodic Law.
Ideas: Phenomenon, Image, Concept, Formula. Heisenberg’s Matrix Mechanics. Louis de Broglie. Matter Waves. Optical Mechanical Analogy. Schrodinger Equation. The Image of the Atom. Quantum Truth. Wave-Particle Duality. Uncertainty Relation. Complementarity Principle. Probability Waves. The Atom and the Probability. Causality and Chance. What is an Atom? Physical Reality.
Results: Rontgen. Becquerel. Pierre and Marie Curie. Rutherford and Soddy.
Isotopes. Uranium Family. Nuclear Binding Energy. The Neutron. Artificial Radioaktivity. Nuclear Fission. Tunnel Effect. Effective Cross-Sections. Fission. Chain Reaction. Nuclear Reactor. Atomic Energy. The Atomic Bomb. The Atomic Problem. Solar Light. Crucibles of Elements. The Fate of the Sun.
Reflections: Inception of the Scientific Method. Essence of the, Scientific Method and its Development. Truth and Completeness of the Scientific Picture of the World. Science and Humanity. Science and Art. Future of Science.
THE AUTHOR: Leonid I. Ponomarev, professor of physics, the head of the theoretical department in I. V. Kurchatov Atomic Energy Institute, Moscow, USSR.


1
24 360 лет 92 *
Плутоний-239, подобно урану-235, обладает редкой способностью делиться под действием медленных нейтронов. Его сечение деления о
дед=742 барн и средняя множественность нейтронов на деление v=2,92 даже больше, чем для урана-235 (ст
дел = 582 барн и v = 2,42 соответственно), поэтому плутоний-239 — лучшее ядерное топливо и ядерная взрывчатка. Это поняли довольно быстро — всего через два года после открытия деления.
В то лето 1939 г., когда на восточном побережье США Ферми искал способ уменьшить поглощение нейтронов в уране-238, чтобы осуществить цепную реакцию, на западном побережье, в Калифорнии, Эдвин Макмиллан решил подробно изучить, что же происходит с ураном-238 после того, как он поглотит нейтрон. В его распоряжении был только что по-
(обратно)
Оглавление
Л. И. Пономарев
ГЛАВА 1
АТОМЫ
волны
КВАНТЫ
До и после Демокрита
Тит Лукреций Кар
Ньютон об атомах
Глава 2
СПЕКТРЫ
ионы
ЛУЧИСТАЯ МАТЕРИЯ
АТОМЫ, ЭЛЕКТРОНЫ, ВОЛНЫ
Открытие спектрального анализа
У истоков телевидения
Уильям Крукс
Кинетическая теория газов
Михаил Васильевич Ломоносов
ГЛАВА 3
ПЛАНЕТАРНЫЙ АТОМ
СПЕКТРАЛЬНЫЕ СЕРИИ
ФОТОНЫ
ПОБЕДА АТОМИСТИКИ
Неразрезаемый атом
Дифракционная решетка
Что сделал Резерфорд?
Световое давление
ГЛАВА 4
ДО БОРА
АТОМ БОРА
ПОСЛЕ БОРА
ФОРМАЛЬНАЯ МОДЕЛЬ АТОМА
ВОКРУГ КВАНТА
Нильс Хенрик Дэвид Бор
Опытное доказательство постулатов Бора
ГЛАВА 5
УЧЕНИЯ ДРЕВНИХ
ПЕРВЫЕ ПОПЫТКИ
ЭЛЕМЕНТЫ И АТОМЫ
ТАБЛИЦА ЭЛЕМЕНТОВ
ПЕРИОДИЧЕСКИЙ ЗАКОН
ВОКРУГ КВАНТА
Атомы и люди
ГЛАВА 6
ТЕОРИЯ БОРА
ГЛАЗАМИ СОВРЕМЕННИКОВ
ЯВЛЕНИЕ, ОБРАЗ, ПОНЯТИЕ, ФОРМУЛА
МАТРИЧНАЯ
МЕХАНИКА ГЕЙЗЕНБЕРГА
ВОКРУГ КВАНТА
Фундамент физики
ГЛАВА 7
ЛУИ ДЕ БРОЙЛЬ
ВОЛНЫ МАТЕРИИ
ОПТИКО-МЕХАНИЧЕСКАЯ АНАЛОГИЯ
ВОЛНОВАЯ МЕХАНИКА ШРЕДИНГЕРА
Жизнь...
...и атом Бошковича
Пауль Эренфест (1880—1933)
ГЛАВА 8
УРАВНЕНИЕ ШРЕДИНГЕРА
СМЫСЛ -ФУНКЦИИ
ОБРАЗ АТОМА
КВАНТОВАЯ ИСТИНА
Опыт Комптона
Дифракция электронов
ГЛАВА 9
КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ
СООТНОШЕНИЕ НЕОПРЕДЕЛЕННОСТЕЙ
ПРИНЦИП . ДОПОЛНИТЕЛЬНОСТИ
Дуализм и неопределенность
Поэты и принцип дополнительности
ГЛАВА 10
ИГРА В «ОРЕЛ — РЕШКУ» И СТРЕЛЬБА В ТИРЕ
ДИФРАКЦИЯ ЭЛЕКТРОНОВ
ВОЛНЫ ВЕРОЯТНОСТИ
ЭЛЕКТРОННЫЕ ВОЛНЫ
АТОМ И ВЕРОЯТНОСТЬ
ВЕРОЯТНОСТЬ И СПЕКТРЫ АТОМОВ
ВОКРУГ КВАНТА
Люди, события, кванты
ГЛАВА 11
ЧТО ТАКОЕ АТОМ?
ЧТО ТАКОЕ КВАНТОВАЯ МЕХАНИКА?
ФИЗИЧЕСКАЯ РЕАЛЬНОСТЬ
В поисках последних понятий
ГЛАВА 12
ВИЛЬГЕЛЬМ КОНРАД РЕНТГЕН
АНРИ АНТУАН БЕККЕРЕЛЬ
ПЬЕР И МАРИЯ КЮРИ
ЭРНЕСТ РЕЗЕРФОРД И ФРЕДЕРИК СОДДИ
ЭНЕРГИЯ РАДИЯ
ВОКРУГ КВАНТА
Рентгеновские волны
ГЛАВА 13
ХИМИЯ РАДИОЭЛЕМЕНТОВ
ИЗОТОПЫ
РАДИОАКТИВНОЕ СЕМЕЙСТВО УРАНА
СТАБИЛЬНЫЕ ИЗОТОПЫ
ЭНЕРГИЯ РАДИОАКТИВНОГО РАСПАДА
ЭНЕРГИЯ СВЯЗИ ЯДЕР
Уран
Земля и радий
Рыцари пятого знака
В ГЛУБЬ ЯДРА
НЕЙТРОН
ИСКУССТВЕННАЯ РАДИОАКТИВНОСТЬ
МЕДЛЕННЫЕ НЕЙТРОНЫ
ДЕЛЕНИЕ ЯДЕР
Письма о делении
ТУННЕЛЬНЫЙ ЭФФЕКТ
ЭФФЕКТИВНЫЕ СЕЧЕНИЯ РЕАКЦИИ
НЕЙТРОННЫЕ СЕЧЕНИЯ
ДЕЛЕНИЕ ЯДЕР
ВОКРУГ КВАНТА
Меченые атомы
Радиоуглеродный метод датировки
278 содержится примерно 70 млрд, атомов углерода 14С, причем каждую минуту 15 из них распадаются.
ЦЕПНАЯ РЕАКЦИЯ
ЯДЕРНЫЙ РЕАКТОР
Спонтанное деление урана
Естественный ядерный реактор Окло
ГЛАВА 17
АТОМНАЯ ЭНЕРГИЯ
ПЛУТОНИЙ
АТОМНАЯ БОМБА
АТОМНАЯ ПРОБЛЕМА
Хронология атомной эры
Содди об атомной энергии
ГЛАВА 18
СВЕТ СОЛНЦА
ТИГЛИ ЭЛЕМЕНТОВ
СУДЬБА СОЛНЦА
Солнце, жизнь и хлорофилл
Жизнь под Солнцем
Солнце на Земле
Кванты вокруг нас
ГЛАВА 19
ВОЗНИКНОВЕНИЕ НАУЧНОГО МЕТОДА
СУЩНОСТЬ И РАЗВИТИЕ НАУЧНОГО МЕТОДА
ИСТИННОСТЬ И ПОЛНОТА
НАУКА И ЧЕЛОВЕЧЕСТВО
ГРАНИЦЫ НАУЧНОГО МЕТОДА
НАУКА И ИСКУССТВО
БУДУЩЕЕ НАУКИ
*** Примечания ***



 МОСКВА «НАУКА»
ГЛАВНАЯ РЕДАКЦИЯ
ФИЗИКО-МАТЕМАТИЧЕСКОЙ ЛИТЕРАТУРЫ
ББК 22.314
П56
УДК 530.145(023)
Рецензент
член-корреспондент АН СССР И. И. Гуревич
Пономарев Л. И.
П56 Под знаком кванта.—2-е изд., испр. и доп.— М.: Наука. Гл. ред. физ.-мат. лит., 1989.— 368 с.: ил.
ISBN 5-02-014049-Х
Квантовая физика — самое выдающееся открытие XX века. Практически ни одно глубокое явление природы невозможно понять и объяснить без квантовых идей. Цель книги — познакомить читателя-неспециалиста с основными фактами квантовой физики и историей их открытия. Ярко и образно, достаточно строго, но вполне доступно автор рассказывает об эволюции идей и понятий современной физики. Предыдущее издание (М.: Сов. Россия, 1984) удостоено Диплома первой степени на Всесоюзном конкурсе общества «Знание».
Для старшеклассников; учителей, студентов и всех, кого интересуют основы науки.
1604030000-131
053(02)-89
93-89
ББК 22.314
© Издательство «Советская Россия»,
1984
© Издательство «Наука».
ISBN 5-02-014049-Х
Главная редакция физико-математической литературы, 1989, с изменениями
— Этот мир странно устроен...
— По сравнению с чем?
ОТ АВТОРА
«Настоящее колдовское исчисление»,— писал о квантовой механике Альберт Эйнштейн своему другу Мишелю Бессо в декабре 1925 г.: в то время даже для него новая механика казалась слишком сложной. Сейчас хороший студент-физик знает о квантах больше, чем все великие ученые начала века: квантовая физика стала привычной. Но она йе стала от этого менее удивительной, и каждое новое поколение исследователей отдает ей свою дань восхищения.
Квантовая физика родилась в короткий период между двумя мировыми войнами. С тех пор она изменила жизнь цивилизованных народов больше, чем любое из прежних открытий, но даже образованные люди знают о ней незаслуженно мало. Типичные представления о квантовой физике напоминают отчасти донаучное отношение человека к молнии и грому: он не понимал их природы и потому — боялся. Для многих наука об атомах и квантах навсегда присыпана пеплом атомного взрыва, а «физик-атомщик» — чем-то сродни злому волшебнику. Все это несправедливо и достойно сожаления, ибо такое предвзятое отношение мешает понять главное: квантовая физика — не просто еще одна из бесчисленных ныне наук. Это именно та наука, которая стала основой технотронной эры, привела к пересмотру философии знания, повлияла на политику целых государств. По праву науку о квантах можно сравнить лишь с такими взлетами мысли, как система Коперника, законы Ньютона, учение об электричестве. Все они стали теперь достоянием общечеловеческой культуры, и каждому современнику необходимо иметь о них хотя бы простейшие представления.
Но дело даже не в пользе или необходимости: квантовая физика — это интересно. Интересно — в самом точном смысле этого слова,— и столь же увлекательно. Именно внутренняя логика и красота учения о квантах стали побудительной причиной появления этой книги. Ее основное содержание — эволюция идей и понятий квантовой физики. Я буду считать свою работу не напрасной, если читатель поймет необходимость этого странного мира, почувствует неизбежность его квантовых химер и, наконец, примет их и признает естественными.
МОСКВА «НАУКА»
ГЛАВНАЯ РЕДАКЦИЯ
ФИЗИКО-МАТЕМАТИЧЕСКОЙ ЛИТЕРАТУРЫ
ББК 22.314
П56
УДК 530.145(023)
Рецензент
член-корреспондент АН СССР И. И. Гуревич
Пономарев Л. И.
П56 Под знаком кванта.—2-е изд., испр. и доп.— М.: Наука. Гл. ред. физ.-мат. лит., 1989.— 368 с.: ил.
ISBN 5-02-014049-Х
Квантовая физика — самое выдающееся открытие XX века. Практически ни одно глубокое явление природы невозможно понять и объяснить без квантовых идей. Цель книги — познакомить читателя-неспециалиста с основными фактами квантовой физики и историей их открытия. Ярко и образно, достаточно строго, но вполне доступно автор рассказывает об эволюции идей и понятий современной физики. Предыдущее издание (М.: Сов. Россия, 1984) удостоено Диплома первой степени на Всесоюзном конкурсе общества «Знание».
Для старшеклассников; учителей, студентов и всех, кого интересуют основы науки.
1604030000-131
053(02)-89
93-89
ББК 22.314
© Издательство «Советская Россия»,
1984
© Издательство «Наука».
ISBN 5-02-014049-Х
Главная редакция физико-математической литературы, 1989, с изменениями
— Этот мир странно устроен...
— По сравнению с чем?
ОТ АВТОРА
«Настоящее колдовское исчисление»,— писал о квантовой механике Альберт Эйнштейн своему другу Мишелю Бессо в декабре 1925 г.: в то время даже для него новая механика казалась слишком сложной. Сейчас хороший студент-физик знает о квантах больше, чем все великие ученые начала века: квантовая физика стала привычной. Но она йе стала от этого менее удивительной, и каждое новое поколение исследователей отдает ей свою дань восхищения.
Квантовая физика родилась в короткий период между двумя мировыми войнами. С тех пор она изменила жизнь цивилизованных народов больше, чем любое из прежних открытий, но даже образованные люди знают о ней незаслуженно мало. Типичные представления о квантовой физике напоминают отчасти донаучное отношение человека к молнии и грому: он не понимал их природы и потому — боялся. Для многих наука об атомах и квантах навсегда присыпана пеплом атомного взрыва, а «физик-атомщик» — чем-то сродни злому волшебнику. Все это несправедливо и достойно сожаления, ибо такое предвзятое отношение мешает понять главное: квантовая физика — не просто еще одна из бесчисленных ныне наук. Это именно та наука, которая стала основой технотронной эры, привела к пересмотру философии знания, повлияла на политику целых государств. По праву науку о квантах можно сравнить лишь с такими взлетами мысли, как система Коперника, законы Ньютона, учение об электричестве. Все они стали теперь достоянием общечеловеческой культуры, и каждому современнику необходимо иметь о них хотя бы простейшие представления.
Но дело даже не в пользе или необходимости: квантовая физика — это интересно. Интересно — в самом точном смысле этого слова,— и столь же увлекательно. Именно внутренняя логика и красота учения о квантах стали побудительной причиной появления этой книги. Ее основное содержание — эволюция идей и понятий квантовой физики. Я буду считать свою работу не напрасной, если читатель поймет необходимость этого странного мира, почувствует неизбежность его квантовых химер и, наконец, примет их и признает естественными.
 «Каждый школьник знаком теперь с истинами, за которые Архимед отдал бы жизнь.»
Эрнест Ренан
«Ощущение тайны — наиболее прекрасное из доступных нам переживаний. Именно это чувство стоит у колыбели истинного искусства и настоящей науки.»
Альберт Эйнштейн
Истоки
ГЛАВА 1
Атомы. Волны. Кванты. Вокруг кванта
ГЛАВА 2
Спектры. Ионы. Лучистая материя. Атомы, электроны, волны.
Вокруг кванта
ГЛ АВ а з
Планетарный атом. Спектральные серии. Фотоны. Победа атомистики. Вокруг кванта
ГЛАВА 4
До Бора. Атом Бора. После Бора. Формальная модель атома. Вокруг кванта
ГЛАВА 5
Учения древних. Первые попытки. Элементы и атомы. Таблица элементов. Периодический закон. Вокруг кванта
«Каждый школьник знаком теперь с истинами, за которые Архимед отдал бы жизнь.»
Эрнест Ренан
«Ощущение тайны — наиболее прекрасное из доступных нам переживаний. Именно это чувство стоит у колыбели истинного искусства и настоящей науки.»
Альберт Эйнштейн
Истоки
ГЛАВА 1
Атомы. Волны. Кванты. Вокруг кванта
ГЛАВА 2
Спектры. Ионы. Лучистая материя. Атомы, электроны, волны.
Вокруг кванта
ГЛ АВ а з
Планетарный атом. Спектральные серии. Фотоны. Победа атомистики. Вокруг кванта
ГЛАВА 4
До Бора. Атом Бора. После Бора. Формальная модель атома. Вокруг кванта
ГЛАВА 5
Учения древних. Первые попытки. Элементы и атомы. Таблица элементов. Периодический закон. Вокруг кванта


 изыскан, а уважение к нему переходило часто все разумные границы. Для этого были основания: он владел всеми знаниями той эпохи. Аристотель учил обратному: процесс деления яблока можно продолжить бесконечно, по крайней мере в принципе. (Справедливости ради следует признать, что идея бесконечной делимости вещества для неискушенного ума выглядит более естественно, чем
Аристотель мысль о существовании принципиального
предела делимости материи.) Учение Аристотеля стало господствующим, Демокрита забыли на многие века, а его сочинения уничтожались с тщанием, достойным лучшего применения. Поэтому учение Демокрита сохранилось только во фрагментах и свидетельствах современников, а Европа узнала о нем из поэмы древнеримского поэта Тита Лукреция Кара (99—55 гг. до н. э.) «О природе вещей».
Бессмысленно винить древних за такой выбор — для них обе системы были равно разумны и приемлемы: цель своей науки они видели не в практических применениях (они их стыдились), а в том, чтобы с помощью умозрения достигнуть того чувства гармонии мира, которое сообщает человеку всякая законченная философия.
Чтобы освободиться от заблуждений великого авторитета, потребовались две тысячи лет. В XVII веке впервые возникла наука физика, которая вскоре вытеснила древнюю натуральную философию.
Наука опиралась не на чистое умозрение, а на опыт и математику. Окружающую природу стали не просто наблюдать, а изучать, то есть ставить сознательные опыты для проверки гипотез и записывать результаты этой проверки в виде чисел. Идея Аристотеля не выдержала такого испытания, а гипотеза Демокрита окрепла и дала начало атомной теории.
После двадцати веков забвения идею об атомах возродил к жизни французский философ и просветитель Пьер Гассенди (1592—1655): в 1647 г. появилась его книга с изложением идей атомизма. В то время это было сопряжено с известным риском: традиции средневековья преследовали не только гипотезы, но и строгие факты науки, если они противоречили общепризнанным догматам. (В Париже, например, в 1626 г. учение об атомах запретили под страхом смертной казни.) Тем не менее атомную гипотезу приняли все передовые
ученые того времени. Даже Ньютон с его знаменитым девизом «Hypothesis non fingo» («гипотез не строю») поверил в нее и изложил по-своему в конце третьего тома «Оптики».
Однако до тех пор, пока гипотезу об атомах не подтвердили опытом, она оставалась, несмотря на всю свою привлекательность, только гипотезой.
В правоте Демокрита впервые наглядно мог убедиться шотландский ботаник Роберт Броун (1773—1858). В 1827 г. это был уже немолодой директор ботанического отдела Британского музея. В юности он провел четыре года в экспедициях по Австралии и привез оттуда около 4 тысяч видов растений. Двадцать лет спустя он все еще продолжал изучать коллекции экспедиции. Летом 1827 г. Броун обратил внимание на то, что мельчайшая пыльца растений произвольно двигается в воде под действием неизвестной силы. Он тут же опубликовал статью, заглавие которой очень характерно для той неторопливой эпохи: «Краткий отчет о микроскопических наблюдениях, проделанных в июне, июле и августе 1827 г. над частицами, содержащимися в пыльце растений; и о существовании активных молекул в органических и неорганических телах».
Сначала его опыт вызвал недоумение. Это недоумение усугубил сам же Броун, пытаясь объяснить обнаруженное явление некой «живой силой», которая якобы присуща органическим молекулам. Естественно, такое прямолинейное объяснение «броуновского движения» не удовлетворило ученых, и они предприняли новые попытки изучения его особенностей. Среди них особенно много сделали голландец Карбонэль (1880 г.) и француз Гуи (1888 г.). Они поставили тщательные опыты и выяснили, что броуновское движение не зависит от внешних воздействий: времени года и суток, добавления солей, вида пыльцы и «...наблюдается одинаково хорошо ночью в деревне и днем вблизи многолюдной улицы, где проезжают тяжелые экипажи». Оно не зависит даже от вида частичек, а только от их размеров и массы и, что самое главное, никогда не прекращается. (Почти за двадцать веков до Броуна свойства этого движения мысленно представил себе и подробно описал в своей поэме Лукреций Кар.)
Надо сказать, что первое время странное движение не обратило на себя должного внимания. Большинство физиков о нем вообще не знали, а те, кто знал, считали его неинтересным, полагая, что это явление аналогично движению пылинок в солнечном луче. Лишь сорок лет спустя впервые оформилась мысль о том, что видимые в микроскоп беспорядочные движения пыльцы растений вызваны случайными толчками
И
маленьких невидимых частиц жидкости. После работ Гуи в это поверили почти все, и гипотеза об атомах приобрела множество последователей.
Конечно, и до Броуна немало людей были убеждены, что все тела построены из атомов. Для них некоторые свойства атомов были очевидны уже без дальнейших исследований. В самом деле, все тела в природе, несмотря на огромные различия между собой, имеют массу и размеры. Очевидно, у атомов этих тел также должны быть и масса, и размеры. Именно эти их свойства положил в основу своих рассуждений Джон Дальтон (1766—1844) —скромный учитель математики и натуральной философии в городе Манчестере и великий ученый, определивший развитие химии примерно на сто лет вперед* В 1804 г., тщательно анализируя известные в то время данные о химических соединениях, Джон Дальтон сформулировал понятие о химическом элементе', вещество, которое состоит из атомов одного типа.
При этом сразу же возникал вопрос: не означает ли многообразие веществ такого же многообразия атомов, как это утверждал Демокрит? Оказалось, что нет. Вскоре выяснилось, что элементов в природе не так уж много: в то время их знали около 40 (сейчас 105). Все остальные вещества построены из молекул — разнообразных сочетаний этих атомов. Сами атомы разных элементов также различаются между собой, и прежде всего массой. Самые легкие из них — атомы водорода, атомы кислорода тяжелее их в 16 раз, железа — в 56, и т. д. Так в науку об атоме впервые проникли числа.
Однако по-прежнему об абсолютных размерах и массах атомов ничего не было известно.
Первой удавшейся научной попыткой оценить размер и массу атомов следует считать работу преподавателя физики Венского университета Йозефа Лошмидта (1821 —1895). В 1865 г. он нашел, что размеры всех атомов примерно одинаковы и равны 10-8 см, то есть 0,00000001 см, а масса атома водорода составляет всего 10-24 г.
Впервые мы встречаемся здесь с такими малыми величинами, и у нас просто нет необходимых навыков, чтобы их осмыслить. Самое большее, на что мы способны, это сказать: тонкий, как паутина, или — легкий, как пух. Но толщина паутины (10-3 см) в сто тысяч раз больше самого большого атома, а пуховая подушка — это уже нечто весомое и вполне реальное. Чтобы хоть как-то заполнить провал между здравым смыслом и малостью этих чисел, обычно все же прибегают к сравнениям, хотя они, как правило, мало помогают и еще меньше объясняют, поскольку для столь малых объектов само понятие о размере как о величине, измеряемой прикладыванием масштаба, теряет свой первичный смысл. Поэтому лучше с самого начала оставить попытки представить себе эти числа наглядно. Важно только понимать, что, несмотря на свою чрезвычайную малость, эти числа не произвольны: именно та
изыскан, а уважение к нему переходило часто все разумные границы. Для этого были основания: он владел всеми знаниями той эпохи. Аристотель учил обратному: процесс деления яблока можно продолжить бесконечно, по крайней мере в принципе. (Справедливости ради следует признать, что идея бесконечной делимости вещества для неискушенного ума выглядит более естественно, чем
Аристотель мысль о существовании принципиального
предела делимости материи.) Учение Аристотеля стало господствующим, Демокрита забыли на многие века, а его сочинения уничтожались с тщанием, достойным лучшего применения. Поэтому учение Демокрита сохранилось только во фрагментах и свидетельствах современников, а Европа узнала о нем из поэмы древнеримского поэта Тита Лукреция Кара (99—55 гг. до н. э.) «О природе вещей».
Бессмысленно винить древних за такой выбор — для них обе системы были равно разумны и приемлемы: цель своей науки они видели не в практических применениях (они их стыдились), а в том, чтобы с помощью умозрения достигнуть того чувства гармонии мира, которое сообщает человеку всякая законченная философия.
Чтобы освободиться от заблуждений великого авторитета, потребовались две тысячи лет. В XVII веке впервые возникла наука физика, которая вскоре вытеснила древнюю натуральную философию.
Наука опиралась не на чистое умозрение, а на опыт и математику. Окружающую природу стали не просто наблюдать, а изучать, то есть ставить сознательные опыты для проверки гипотез и записывать результаты этой проверки в виде чисел. Идея Аристотеля не выдержала такого испытания, а гипотеза Демокрита окрепла и дала начало атомной теории.
После двадцати веков забвения идею об атомах возродил к жизни французский философ и просветитель Пьер Гассенди (1592—1655): в 1647 г. появилась его книга с изложением идей атомизма. В то время это было сопряжено с известным риском: традиции средневековья преследовали не только гипотезы, но и строгие факты науки, если они противоречили общепризнанным догматам. (В Париже, например, в 1626 г. учение об атомах запретили под страхом смертной казни.) Тем не менее атомную гипотезу приняли все передовые
ученые того времени. Даже Ньютон с его знаменитым девизом «Hypothesis non fingo» («гипотез не строю») поверил в нее и изложил по-своему в конце третьего тома «Оптики».
Однако до тех пор, пока гипотезу об атомах не подтвердили опытом, она оставалась, несмотря на всю свою привлекательность, только гипотезой.
В правоте Демокрита впервые наглядно мог убедиться шотландский ботаник Роберт Броун (1773—1858). В 1827 г. это был уже немолодой директор ботанического отдела Британского музея. В юности он провел четыре года в экспедициях по Австралии и привез оттуда около 4 тысяч видов растений. Двадцать лет спустя он все еще продолжал изучать коллекции экспедиции. Летом 1827 г. Броун обратил внимание на то, что мельчайшая пыльца растений произвольно двигается в воде под действием неизвестной силы. Он тут же опубликовал статью, заглавие которой очень характерно для той неторопливой эпохи: «Краткий отчет о микроскопических наблюдениях, проделанных в июне, июле и августе 1827 г. над частицами, содержащимися в пыльце растений; и о существовании активных молекул в органических и неорганических телах».
Сначала его опыт вызвал недоумение. Это недоумение усугубил сам же Броун, пытаясь объяснить обнаруженное явление некой «живой силой», которая якобы присуща органическим молекулам. Естественно, такое прямолинейное объяснение «броуновского движения» не удовлетворило ученых, и они предприняли новые попытки изучения его особенностей. Среди них особенно много сделали голландец Карбонэль (1880 г.) и француз Гуи (1888 г.). Они поставили тщательные опыты и выяснили, что броуновское движение не зависит от внешних воздействий: времени года и суток, добавления солей, вида пыльцы и «...наблюдается одинаково хорошо ночью в деревне и днем вблизи многолюдной улицы, где проезжают тяжелые экипажи». Оно не зависит даже от вида частичек, а только от их размеров и массы и, что самое главное, никогда не прекращается. (Почти за двадцать веков до Броуна свойства этого движения мысленно представил себе и подробно описал в своей поэме Лукреций Кар.)
Надо сказать, что первое время странное движение не обратило на себя должного внимания. Большинство физиков о нем вообще не знали, а те, кто знал, считали его неинтересным, полагая, что это явление аналогично движению пылинок в солнечном луче. Лишь сорок лет спустя впервые оформилась мысль о том, что видимые в микроскоп беспорядочные движения пыльцы растений вызваны случайными толчками
И
маленьких невидимых частиц жидкости. После работ Гуи в это поверили почти все, и гипотеза об атомах приобрела множество последователей.
Конечно, и до Броуна немало людей были убеждены, что все тела построены из атомов. Для них некоторые свойства атомов были очевидны уже без дальнейших исследований. В самом деле, все тела в природе, несмотря на огромные различия между собой, имеют массу и размеры. Очевидно, у атомов этих тел также должны быть и масса, и размеры. Именно эти их свойства положил в основу своих рассуждений Джон Дальтон (1766—1844) —скромный учитель математики и натуральной философии в городе Манчестере и великий ученый, определивший развитие химии примерно на сто лет вперед* В 1804 г., тщательно анализируя известные в то время данные о химических соединениях, Джон Дальтон сформулировал понятие о химическом элементе', вещество, которое состоит из атомов одного типа.
При этом сразу же возникал вопрос: не означает ли многообразие веществ такого же многообразия атомов, как это утверждал Демокрит? Оказалось, что нет. Вскоре выяснилось, что элементов в природе не так уж много: в то время их знали около 40 (сейчас 105). Все остальные вещества построены из молекул — разнообразных сочетаний этих атомов. Сами атомы разных элементов также различаются между собой, и прежде всего массой. Самые легкие из них — атомы водорода, атомы кислорода тяжелее их в 16 раз, железа — в 56, и т. д. Так в науку об атоме впервые проникли числа.
Однако по-прежнему об абсолютных размерах и массах атомов ничего не было известно.
Первой удавшейся научной попыткой оценить размер и массу атомов следует считать работу преподавателя физики Венского университета Йозефа Лошмидта (1821 —1895). В 1865 г. он нашел, что размеры всех атомов примерно одинаковы и равны 10-8 см, то есть 0,00000001 см, а масса атома водорода составляет всего 10-24 г.
Впервые мы встречаемся здесь с такими малыми величинами, и у нас просто нет необходимых навыков, чтобы их осмыслить. Самое большее, на что мы способны, это сказать: тонкий, как паутина, или — легкий, как пух. Но толщина паутины (10-3 см) в сто тысяч раз больше самого большого атома, а пуховая подушка — это уже нечто весомое и вполне реальное. Чтобы хоть как-то заполнить провал между здравым смыслом и малостью этих чисел, обычно все же прибегают к сравнениям, хотя они, как правило, мало помогают и еще меньше объясняют, поскольку для столь малых объектов само понятие о размере как о величине, измеряемой прикладыванием масштаба, теряет свой первичный смысл. Поэтому лучше с самого начала оставить попытки представить себе эти числа наглядно. Важно только понимать, что, несмотря на свою чрезвычайную малость, эти числа не произвольны: именно та
 кие малые диаметры и массы нужно приписать атомам, чтобы свойства веществ, которые из них состоят, оказались такими, какими мы их наблюдаем в природе.
Число молекул газа в объеме 1 см3 при нормальном давлении и температуре таяния льда
£ = 2,68676-1019 см“3
сейчас известно с большой точностью и называется постоянной Лошмидта. Она примерно в десять раз превышает значение, найденное им впервые.
кие малые диаметры и массы нужно приписать атомам, чтобы свойства веществ, которые из них состоят, оказались такими, какими мы их наблюдаем в природе.
Число молекул газа в объеме 1 см3 при нормальном давлении и температуре таяния льда
£ = 2,68676-1019 см“3
сейчас известно с большой точностью и называется постоянной Лошмидта. Она примерно в десять раз превышает значение, найденное им впервые.
 Однако мы все-таки их различаем не только качественно и субъективно, но и количественно. По какому признаку? У электромагнитного излучения их много, но нам особенно важен сейчас один из них — волновая природа излучения.
Явление распространения волн настолько привычно каждому из нас, что пояснять его вновь кажется излишним. Тем не менее мы все-таки напомним здесь основные свойства волнового движения, по той же самой причине, по которой даже в солидные академические словари иностранных слов помещают вполне понятные обиходные слова.
«Волна» — одно из самых необходимых слов физики. Каждый представляет себе ее по-разному: один сразу же видит волны от брошенного в пруд камня, другой — синусоиду. Поскольку синусоиду рисовать проще — воспользуемся ею. У этой схематической волны четыре свойства: амплитуда А, длина волны X, частота v и скорость распространения v. Амплитуда волны — это наибольшая ее высота. Что такое длина волны — понятно из рисунка. Скорость ее распространения, по-видимому, особых пояснений не требует.
Чтобы выяснить, что такое частота, проследим за движением волны в течение секунды. При скорости и (см/с) она за это время пройдет расстояние v (см). Подсчитав, сколько длин волн уместилось на этом отрезке, мы найдем частоту излучения: v = u/X (с-1).
Важнейшее свойство волн — их способность интерферировать,то есть способность волн уничтожать или усиливать друг друга, например, при отражении, и это именно то свойство, по которому волну всегда можно безошибочно отличить от потока частиц.
Еще одно свойство волны, которое отличает ее от частиц,— дифракция — состоит в ее способности огибать препятствия, если его размеры соизмеримы с длиной волны. Если препятствие невелико, то благодаря дифракции волна может разделиться, обойти его и, складываясь снова, усилить или погасить себя точно так же, как при сложении прямой и отраженной волн.
Именно таким способом, обнаружив интерференцию и дифракцию у рентгеновского и других видов излучения, установили, что все они — волны, только разной длины. Длина волны излучения и есть тот основной признак, по которому мы количественно различаем разные виды электромагнитного излучения. Наибольшая длина у радиоволн: от нескольких километров до нескольких сантиметров. У тепловых лучей она короче — от 1 до 10-2 см. Еще короче волны видимого света, примерно 4-10-5—8-Ю-5 см. Наконец, у рентгеновских лучей длина волны составляет лишь 10~7 — 10“8 см. Все виды излучения распространяются с одной и той же скоростью — со скоростью света с = 3-1О10 см/с. Отсюда по формуле v=c/X очень просто вычислить частоту каждого вида излучения. Очевидно, для рентгеновского излучения она будет наибольшей, а для радиоволн — наименьшей.
Очень важно отдавать себе отчет в том, что, конечно, любое излучение — это не синусоида, изображенная на рисунке, а физический процесс, основные характеристики которого (например, периодичность), по счастью, можно выразить на языке таких простых моделей. У каждого вида излучения свои особенности. Сосредоточимся пока на том его виде, который для нас наиболее важен и привычен,— на солнечном излучении.
Когда вы греетесь на солнце, вы, наверное, не задумываетесь о сложном составе солнечного излучения, хотя иногда солнечные ожоги и напоминают вам об этом. Исаак Ньютон (1643—1727) жил в Англии, где солнце светит не так уж ярко, тем не менее он захотел узнать, из чего состоит солнечный свет. Чтобы выяснить это, Ньютон поставил в 1666 г. опыт, знакомый теперь каждому школьнику: пропуская луч солнца сквозь призму, он обнаружил позади нее на стене радугу — спектр солнечного света. Впоследствии его соотечественник Томас Юнг (1773—1829) выяснил, что каждому цвету радуги-спектра соответствует своя длина волны солнечного излучения: самые длинные волны у красного цвета — 650 нм; у зеленого короче — 520 нм; еще короче у фиолетового— 400 нм (1 нм = 10-7 см).
Однако мы все-таки их различаем не только качественно и субъективно, но и количественно. По какому признаку? У электромагнитного излучения их много, но нам особенно важен сейчас один из них — волновая природа излучения.
Явление распространения волн настолько привычно каждому из нас, что пояснять его вновь кажется излишним. Тем не менее мы все-таки напомним здесь основные свойства волнового движения, по той же самой причине, по которой даже в солидные академические словари иностранных слов помещают вполне понятные обиходные слова.
«Волна» — одно из самых необходимых слов физики. Каждый представляет себе ее по-разному: один сразу же видит волны от брошенного в пруд камня, другой — синусоиду. Поскольку синусоиду рисовать проще — воспользуемся ею. У этой схематической волны четыре свойства: амплитуда А, длина волны X, частота v и скорость распространения v. Амплитуда волны — это наибольшая ее высота. Что такое длина волны — понятно из рисунка. Скорость ее распространения, по-видимому, особых пояснений не требует.
Чтобы выяснить, что такое частота, проследим за движением волны в течение секунды. При скорости и (см/с) она за это время пройдет расстояние v (см). Подсчитав, сколько длин волн уместилось на этом отрезке, мы найдем частоту излучения: v = u/X (с-1).
Важнейшее свойство волн — их способность интерферировать,то есть способность волн уничтожать или усиливать друг друга, например, при отражении, и это именно то свойство, по которому волну всегда можно безошибочно отличить от потока частиц.
Еще одно свойство волны, которое отличает ее от частиц,— дифракция — состоит в ее способности огибать препятствия, если его размеры соизмеримы с длиной волны. Если препятствие невелико, то благодаря дифракции волна может разделиться, обойти его и, складываясь снова, усилить или погасить себя точно так же, как при сложении прямой и отраженной волн.
Именно таким способом, обнаружив интерференцию и дифракцию у рентгеновского и других видов излучения, установили, что все они — волны, только разной длины. Длина волны излучения и есть тот основной признак, по которому мы количественно различаем разные виды электромагнитного излучения. Наибольшая длина у радиоволн: от нескольких километров до нескольких сантиметров. У тепловых лучей она короче — от 1 до 10-2 см. Еще короче волны видимого света, примерно 4-10-5—8-Ю-5 см. Наконец, у рентгеновских лучей длина волны составляет лишь 10~7 — 10“8 см. Все виды излучения распространяются с одной и той же скоростью — со скоростью света с = 3-1О10 см/с. Отсюда по формуле v=c/X очень просто вычислить частоту каждого вида излучения. Очевидно, для рентгеновского излучения она будет наибольшей, а для радиоволн — наименьшей.
Очень важно отдавать себе отчет в том, что, конечно, любое излучение — это не синусоида, изображенная на рисунке, а физический процесс, основные характеристики которого (например, периодичность), по счастью, можно выразить на языке таких простых моделей. У каждого вида излучения свои особенности. Сосредоточимся пока на том его виде, который для нас наиболее важен и привычен,— на солнечном излучении.
Когда вы греетесь на солнце, вы, наверное, не задумываетесь о сложном составе солнечного излучения, хотя иногда солнечные ожоги и напоминают вам об этом. Исаак Ньютон (1643—1727) жил в Англии, где солнце светит не так уж ярко, тем не менее он захотел узнать, из чего состоит солнечный свет. Чтобы выяснить это, Ньютон поставил в 1666 г. опыт, знакомый теперь каждому школьнику: пропуская луч солнца сквозь призму, он обнаружил позади нее на стене радугу — спектр солнечного света. Впоследствии его соотечественник Томас Юнг (1773—1829) выяснил, что каждому цвету радуги-спектра соответствует своя длина волны солнечного излучения: самые длинные волны у красного цвета — 650 нм; у зеленого короче — 520 нм; еще короче у фиолетового— 400 нм (1 нм = 10-7 см).
 Спектр излучения любого тела — будь то Солнце или раскаленный железный лом — полностью известен, если мы, во-первых, знаем, из каких волн он состоит и, во-вторых, какую долю они составляют в общем потоке излучения. В частности, цвет раскаленного тела определяют те волны, которых больше всего в спектре его излучения. При изменении температуры тела спектральный состав его излучения также меняется. Пока температура тела невысока, оно излучает, но не светится, то есть испускает только тепловые волны, невидимые для глаза. При повышении температуры оно начинает светиться: сначала красным, затем оранжевым, желтым и т. д. цветом. Например, при температуре 6000 °C больше всего’ излучается желтых лучей (именно по этому признаку определили температуру поверхности Солнца).
В конце прошлого века законы теплового излучения тел стали предметом пристального внимания ученых. В значительной мере это было обусловлено потребностями металлургии и, в частности, изобретением в 1856 г. Генрихом Бессемером (1813—1898) нового способа производства стали, получившего впоследствии название бессемеровского.
Спектральный состав излучения принято описывать с помощью спектральной функции и (у, Т), которая показывает, чему равна доля излучения с частотой v в его общем потоке при заданной температуре тела Т. Типичная спектральная функция и (v, Т) изображена на рисунке: примерно так выглядит спектральный состав излучения Солнца.
При попытке более детально изучить законы' теплового излучения вначале нужно было принять во внимание тот факт, что даже при одной и той же температуре спектр излучения и, следовательно, спектральная функция и(у,Т) зависят от вещества нагретого тела. В этом нетрудно убедиться, нагревая в темноте два одинаковых по размеру шара — каменный и стальной: первый из них будет светиться намного ярче. Вскоре выясни
Спектр излучения любого тела — будь то Солнце или раскаленный железный лом — полностью известен, если мы, во-первых, знаем, из каких волн он состоит и, во-вторых, какую долю они составляют в общем потоке излучения. В частности, цвет раскаленного тела определяют те волны, которых больше всего в спектре его излучения. При изменении температуры тела спектральный состав его излучения также меняется. Пока температура тела невысока, оно излучает, но не светится, то есть испускает только тепловые волны, невидимые для глаза. При повышении температуры оно начинает светиться: сначала красным, затем оранжевым, желтым и т. д. цветом. Например, при температуре 6000 °C больше всего’ излучается желтых лучей (именно по этому признаку определили температуру поверхности Солнца).
В конце прошлого века законы теплового излучения тел стали предметом пристального внимания ученых. В значительной мере это было обусловлено потребностями металлургии и, в частности, изобретением в 1856 г. Генрихом Бессемером (1813—1898) нового способа производства стали, получившего впоследствии название бессемеровского.
Спектральный состав излучения принято описывать с помощью спектральной функции и (у, Т), которая показывает, чему равна доля излучения с частотой v в его общем потоке при заданной температуре тела Т. Типичная спектральная функция и (v, Т) изображена на рисунке: примерно так выглядит спектральный состав излучения Солнца.
При попытке более детально изучить законы' теплового излучения вначале нужно было принять во внимание тот факт, что даже при одной и той же температуре спектр излучения и, следовательно, спектральная функция и(у,Т) зависят от вещества нагретого тела. В этом нетрудно убедиться, нагревая в темноте два одинаковых по размеру шара — каменный и стальной: первый из них будет светиться намного ярче. Вскоре выясни
 ли, однако, что если вместо сплошных шаров нагревать полые, а их излучение наблюдать через небольшое отверстие в стенке шара, то спектральный состав этого излучения уже не будет зависеть от вещества шара. Такой спектр назвали спектром абсолютно черного тела. Происхождение этого несколько необычного названия легко по-
нять. Представьте, что вы не нагреваете шар, а, наоборот, освещаете его снаружи. В этом случае вы всегда увидите перед собой одинаково черное отверстие — независимо от вещества шара, поскольку почти все лучи, попавшие внутрь полости, многократно в ней отражаются и наружу практически не выходят.
Универсальная спектральная функция и(у,Т), описывающая спектр излучения абсолютно черного тела, была введена в научный обиход выдающимся немецким физиком Густавом Робертом Кирхгофом (1824—1887) в 1859 г. Измерить ее оказалось не так просто: это удалось лишь Сэмюэлю Лэнглею (1834—1906), который в 1884 г. изобрел болометр — прибор для измерения энергии излучения. Важность функции u(v,T) поняли сразу же, но в течение 40 лет не удавалось найти для нее теоретическую формулу, которая бы правильно воспроизводила результаты измерений. Однако попытки эти никогда не прекращались: по-видимому, поиски абсолютного всегда привлекательны для человеческого ума.
ли, однако, что если вместо сплошных шаров нагревать полые, а их излучение наблюдать через небольшое отверстие в стенке шара, то спектральный состав этого излучения уже не будет зависеть от вещества шара. Такой спектр назвали спектром абсолютно черного тела. Происхождение этого несколько необычного названия легко по-
нять. Представьте, что вы не нагреваете шар, а, наоборот, освещаете его снаружи. В этом случае вы всегда увидите перед собой одинаково черное отверстие — независимо от вещества шара, поскольку почти все лучи, попавшие внутрь полости, многократно в ней отражаются и наружу практически не выходят.
Универсальная спектральная функция и(у,Т), описывающая спектр излучения абсолютно черного тела, была введена в научный обиход выдающимся немецким физиком Густавом Робертом Кирхгофом (1824—1887) в 1859 г. Измерить ее оказалось не так просто: это удалось лишь Сэмюэлю Лэнглею (1834—1906), который в 1884 г. изобрел болометр — прибор для измерения энергии излучения. Важность функции u(v,T) поняли сразу же, но в течение 40 лет не удавалось найти для нее теоретическую формулу, которая бы правильно воспроизводила результаты измерений. Однако попытки эти никогда не прекращались: по-видимому, поиски абсолютного всегда привлекательны для человеческого ума.
 Ученые Рэлей, Джинс, Вин и до Планка предлагали различные формулы для описания спектра абсолютно черного тела. (Среди этих попыток следует вспомнить и работу поразительно совпадала с результатами опытов, хоть и не становилась от этого более понятной. Только четверть века спустя новая наука — квантовая механика — объяснит истинный смысл революции, которую, подчиняясь логике научного исследования и во многом вопреки своей воле, совершил в физике Макс Планк.
Владимира Александровича Михельсона (1860—1927), которая решительным образом повлияла на направление исследований Вина.) Но каждый раз экспериментаторы Отто Люммер (1860—1925) и Эрнст Принсгейм (1859—1917) после тщательных измерений решительно отвергали их как несовершенные. Только формула Планка удовлетворила ученых: она
В пятницу 14 декабря 1900 г. в зале заседаний Немецкого физического общества родилась новая наука — учение о квантах. Сухо и обстоятельно ординарный профессор физики Макс Карл Эрнст Людвиг Планк прочел перед небольшой аудиторией сугубо специальный доклад «К теории закона распределения энергии в нормальном спектре». В тот день мало было людей, которые понимали величие момента: плохая погода или логические противоречия теории, вероятно, занимали аудиторию больше. Признание пришло потом, и лишь много позже осмыслили значение постоянной Планка для всего атомного мира. Она оказалась очень
Ученые Рэлей, Джинс, Вин и до Планка предлагали различные формулы для описания спектра абсолютно черного тела. (Среди этих попыток следует вспомнить и работу поразительно совпадала с результатами опытов, хоть и не становилась от этого более понятной. Только четверть века спустя новая наука — квантовая механика — объяснит истинный смысл революции, которую, подчиняясь логике научного исследования и во многом вопреки своей воле, совершил в физике Макс Планк.
Владимира Александровича Михельсона (1860—1927), которая решительным образом повлияла на направление исследований Вина.) Но каждый раз экспериментаторы Отто Люммер (1860—1925) и Эрнст Принсгейм (1859—1917) после тщательных измерений решительно отвергали их как несовершенные. Только формула Планка удовлетворила ученых: она
В пятницу 14 декабря 1900 г. в зале заседаний Немецкого физического общества родилась новая наука — учение о квантах. Сухо и обстоятельно ординарный профессор физики Макс Карл Эрнст Людвиг Планк прочел перед небольшой аудиторией сугубо специальный доклад «К теории закона распределения энергии в нормальном спектре». В тот день мало было людей, которые понимали величие момента: плохая погода или логические противоречия теории, вероятно, занимали аудиторию больше. Признание пришло потом, и лишь много позже осмыслили значение постоянной Планка для всего атомного мира. Она оказалась очень

 бурях и взрывах на Солнце, об элементах, из которых оно состоит,— надо только научиться ее понимать. Если пропустить луч Солнца через призму, то позади нее он «дробится» в набор разноцветных полос. Возникает спектр — явление всегда удивительное, хотя за двести лет к нему основательно привыкли. На первый взгляд, между отдельными частями спектра нет резких границ: красный постепенно переходит в оранжевый, оранжевый в желтый и т. д. Так и думали до тех пор, пока в 1802 г. английский врач и химик Уильям Хайд Волластон (1766—1828) не разглядел его более пристально. Он построил первый спектроскоп со щелью и благодаря ему обнаружил несколько резких темных линий, которые без видимого порядка пересекали спектр Солнца в разных местах. Он не придал им особого значения, полагая, что их появление зависит либо от призмы, либо от источника света, либо от других .побочных причин. Да и сами линии считал интересными только потому, что они отделяют друг от друга цветные полосы спектра. Впоследствии эти темные линии назвали фраунгоферовыми, как это часто бывает, по имени их настоящего исследователя, а не первооткрывателя.
Иосиф Фраунгофер (1787—1826) прожил недолго, но у него была удивительная судьба. В 11 лет, после смерти родителей, он пошел в ученье к шлифовальных дел мастеру. Работать приходилось так много, что на школу уже не оставалось времени, и потому до 14 лет он не умел ни читать, ни писать. Однажды дом хозяина рухнул, и Фраунгофера с трудом извлекли из-под его обломков. Случилось так, что как раз в этот момент мимо ехал наследный принц. Он пожалел юношу и вручил ему значительную сумму денег. Их оказалось достаточно, чтобы Иосиф смог купить себе шлифовальный станок и даже начать учиться грамоте.
То было время наполеоновских войн и больших перемен в Европе. А Фраунгофер между тем в заштатном городке Бенедиктбейрене шлифовал оптические стекла и тщательно изучал темные линии в спектре Солнца. Он насчитал их там 574, дал главным из них названия и указал их точное местоположение в спектре. Постепенно он убедился, .что положение их было строго неизменным, и с успехом использовал этот факт для контроля качества ахроматических линз: недаром телескопы Фраунгофера славились по всей Европе.
Среди многочисленных линий солнечного спектра Фраунгофер особо отметил несколько наиболее ярких, одна из которых — резкая двойная D-линия — всегда появлялась в желтой части спектра. В дальнейшем он обнаружил, что в
бурях и взрывах на Солнце, об элементах, из которых оно состоит,— надо только научиться ее понимать. Если пропустить луч Солнца через призму, то позади нее он «дробится» в набор разноцветных полос. Возникает спектр — явление всегда удивительное, хотя за двести лет к нему основательно привыкли. На первый взгляд, между отдельными частями спектра нет резких границ: красный постепенно переходит в оранжевый, оранжевый в желтый и т. д. Так и думали до тех пор, пока в 1802 г. английский врач и химик Уильям Хайд Волластон (1766—1828) не разглядел его более пристально. Он построил первый спектроскоп со щелью и благодаря ему обнаружил несколько резких темных линий, которые без видимого порядка пересекали спектр Солнца в разных местах. Он не придал им особого значения, полагая, что их появление зависит либо от призмы, либо от источника света, либо от других .побочных причин. Да и сами линии считал интересными только потому, что они отделяют друг от друга цветные полосы спектра. Впоследствии эти темные линии назвали фраунгоферовыми, как это часто бывает, по имени их настоящего исследователя, а не первооткрывателя.
Иосиф Фраунгофер (1787—1826) прожил недолго, но у него была удивительная судьба. В 11 лет, после смерти родителей, он пошел в ученье к шлифовальных дел мастеру. Работать приходилось так много, что на школу уже не оставалось времени, и потому до 14 лет он не умел ни читать, ни писать. Однажды дом хозяина рухнул, и Фраунгофера с трудом извлекли из-под его обломков. Случилось так, что как раз в этот момент мимо ехал наследный принц. Он пожалел юношу и вручил ему значительную сумму денег. Их оказалось достаточно, чтобы Иосиф смог купить себе шлифовальный станок и даже начать учиться грамоте.
То было время наполеоновских войн и больших перемен в Европе. А Фраунгофер между тем в заштатном городке Бенедиктбейрене шлифовал оптические стекла и тщательно изучал темные линии в спектре Солнца. Он насчитал их там 574, дал главным из них названия и указал их точное местоположение в спектре. Постепенно он убедился, .что положение их было строго неизменным, и с успехом использовал этот факт для контроля качества ахроматических линз: недаром телескопы Фраунгофера славились по всей Европе.
Среди многочисленных линий солнечного спектра Фраунгофер особо отметил несколько наиболее ярких, одна из которых — резкая двойная D-линия — всегда появлялась в желтой части спектра. В дальнейшем он обнаружил, что в
 спектре пламени спиртовки в том же месте шкалы спектроскопа видна точно такая же двойная, но уже не темная, а ярко-желтая линия. Смысл и значение этого наблюдения оценили только много лет спустя.
В 1819 г. Фраунгофер переехал в Мюнхен, стал там профессором, членом Академии наук и хранителем физического кабинета. Продолжая свои исследования темных линий в спектре Солнца, он убедился, что их причина — не оптический обман, а сама природа солнечного света. Побуждаемый странной природой этих линий к дальнейшим наблюдениям, он открыл их затем в спектре Венеры и Сириуса. Иосиф Фраунгофер умер и похоронен в Мюнхене в 1826 г. На его могиле — надпись: «Approximavit sidera» — «Приблизил звезды». Но лучший памятник ему — его открытия.
Среди них для нас особенно важно сейчас его наблюдение двойной D-линии. Тогда, в 1814 г., когда он опубликовал свои исследования, на них особого внимания не обратили. Однако мысли его не пропали: прошло 43 года, и Уильям Сван (1828—1914) установил, что двойная желтая D-линия в спектре пламени спиртовки возникает в присутствии металла натрия. (Его следы в составе поваренной соли почти всегда можно найти в различных веществах и в спиртовке — тоже.) Как и многие до него, Сван не понял значения своего открытия и потому не сказал решающих слов: «эта линия принадлежит металлу натрию».
К этой простой и важной мысли пришли только два года спустя, в 1859 г., два профессора: Густав Роберт Кирхгоф (1824—1887) и Роберт Вильгельм Бунзен (1811 —1899), В Гейдельберге, в старой университетской лаборатории, они поставили несложный опыт. До них через призму пропускали либо только солнечный свет, либо только свет от спиртовки. Кирхгоф и Бунзен пропустили и то и другое одновременно и обнаружили явление, о котором стоит рассказать подробно.
спектре пламени спиртовки в том же месте шкалы спектроскопа видна точно такая же двойная, но уже не темная, а ярко-желтая линия. Смысл и значение этого наблюдения оценили только много лет спустя.
В 1819 г. Фраунгофер переехал в Мюнхен, стал там профессором, членом Академии наук и хранителем физического кабинета. Продолжая свои исследования темных линий в спектре Солнца, он убедился, что их причина — не оптический обман, а сама природа солнечного света. Побуждаемый странной природой этих линий к дальнейшим наблюдениям, он открыл их затем в спектре Венеры и Сириуса. Иосиф Фраунгофер умер и похоронен в Мюнхене в 1826 г. На его могиле — надпись: «Approximavit sidera» — «Приблизил звезды». Но лучший памятник ему — его открытия.
Среди них для нас особенно важно сейчас его наблюдение двойной D-линии. Тогда, в 1814 г., когда он опубликовал свои исследования, на них особого внимания не обратили. Однако мысли его не пропали: прошло 43 года, и Уильям Сван (1828—1914) установил, что двойная желтая D-линия в спектре пламени спиртовки возникает в присутствии металла натрия. (Его следы в составе поваренной соли почти всегда можно найти в различных веществах и в спиртовке — тоже.) Как и многие до него, Сван не понял значения своего открытия и потому не сказал решающих слов: «эта линия принадлежит металлу натрию».
К этой простой и важной мысли пришли только два года спустя, в 1859 г., два профессора: Густав Роберт Кирхгоф (1824—1887) и Роберт Вильгельм Бунзен (1811 —1899), В Гейдельберге, в старой университетской лаборатории, они поставили несложный опыт. До них через призму пропускали либо только солнечный свет, либо только свет от спиртовки. Кирхгоф и Бунзен пропустили и то и другое одновременно и обнаружили явление, о котором стоит рассказать подробно.
 Если на призму падал только луч Солнца, то на шкале спектроскопа они видели спектр с темной линией на своем обычном месте. Темная линия по-прежнему оставалась там же и в том случае, когда исследователи ставили на пути света горящую спиртовку. Но если на пути солнечного света помещали экран и освещали призму только светом спиртовки, то на месте темной D-линии четко «проявлялась» яркая желтая D-линия натрия. Кирхгоф и Бунзен убирали экран — D-линия вновь становилась темной. Они заменяли луч Солнца светом от раскаленного тела — результат был всегда тот же: если через пламя спиртовки пропустить яркий луч, то на месте двойной ярко-желтой линии спектра спиртовки возникала точно такая же, но темная. То есть всегда пламя спиртовки поглощает те лучи, которые оно само испускает.
Чтобы понять, почему это событие взволновало двух профессоров, проследим за их рассуждениями.
Ярко-желтая D-линия в спектре пламени спиртовки возникает в присутствии натрия.
В спектре Солнца на этом же месте находится темная линия неизвестной природы.
Спектр излучения раскаленного тела — сплошной, и в нем нет темных линий. Однако если пропустить его через пламя спиртовки, то в его спектре также возникает темная линия и на том же самом месте. Но природу этой темной линии мы уже почти знаем, во всяком случае мы можем догадываться, что она принадлежит натрию. Следовательно, в зависимости от условий наблюдения D-линия натрия может быть либо ярко-желтой, либо темной на желтом фоне. Но в обоих случаях присутствие этой линии (все равно какой — желтой или темной!) означает, что в пламени спиртовки есть натрий. А поскольку такая линия спектра пламени спиртовки в проходящем свете совпадает с темной D-линией в спектре Солнца, то значит и на Солнце есть натрий. Причем он находится в газовом внешнем облаке, которое освещено изнутри раскаленным ядром Солнца.
Короткая заметка (всего две страницы), которую написал Кирхгоф в 1859 г., содержала сразу четыре открытия: каждому элементу присущ свой линейчатый спектр, то есть строго определенный набор спектральных линий;
эти линии можно использовать для анализа состава веществ не только на Земле, но и на звездах;
Солнце состоит из горячего ядра и сравнительно холодной атмосферы раскаленных газов;
на Солнце есть натрий.
Все эти открытия были вскоре подтверждены, в том числе и гипотеза о строении Солнца: экспедиция, которую Французская академия наук в 1868 г. во главе с астрономом Жансеном снарядила в Индию, обнаружила, что при полном солнечном затмении — в тот момент, когда его раскаленное ядро закрыто тенью Луны и светит только корона,— все темные линии в спектре Солнца вспыхивают ярким светом.
Сами Кирхгоф и Бунзен уже в следующем году с помощью спектроскопа открыли два новых элемента: рубидий и цезий.
В дальнейшем из скромного наблюдения над желтой двойной D-линией натрия родился спектральный анализ, с помощью которого мы сейчас можем узнавать химический состав далеких галактик, измерять температуру и скорость вращения звезд и многое другое.
Все это действительно интересно, но сейчас нам важно понять другое: что дали открытия Кирхгофа и Бунзена для науки об атоме и какова их связь с нашими прежними знаниями о нем?
Мы знаем теперь два вида спектров: сплошной (или тепловой) и линейчатый. Тепловой спектр содержит все длины волн, излучается он при нагревании твердых тел и не зависит от их природы. (Именно этот спектр описывается формулой Планка.) Линейчатый спектр состоит из набора отдельных резких линий, возникает при нагревании газов и паров (когда малы взаимодействия между атомами), и — что особенно важно — этот набор линий уникален для любого элемента. Более того, линейчатые спектры элементов не зависят от вида химических соединений, которые из этих элементов составлены. Следовательно, причину и объяснение спектров надо искать в свойствах атомов.
То, что элементы однозначно и вполне определяются видом линейчатого спектра, вскоре признали все; но то, что этот же спектр характеризует отдельный атом, осознали не сразу, а лишь в 1874 г. благодаря работам знаменитого английского астрофизика Нормана Локьера (1836—1920), хотя еще раньше те же мысли высказывали Максвелл (1860 г.) и Больцман (1866 г.). А когда осознали, сразу же пришли к неизбежному выводу: если линейчатый спектр возникает как следствие процессов внутри атома, то атом должен иметь структуру!
Если на призму падал только луч Солнца, то на шкале спектроскопа они видели спектр с темной линией на своем обычном месте. Темная линия по-прежнему оставалась там же и в том случае, когда исследователи ставили на пути света горящую спиртовку. Но если на пути солнечного света помещали экран и освещали призму только светом спиртовки, то на месте темной D-линии четко «проявлялась» яркая желтая D-линия натрия. Кирхгоф и Бунзен убирали экран — D-линия вновь становилась темной. Они заменяли луч Солнца светом от раскаленного тела — результат был всегда тот же: если через пламя спиртовки пропустить яркий луч, то на месте двойной ярко-желтой линии спектра спиртовки возникала точно такая же, но темная. То есть всегда пламя спиртовки поглощает те лучи, которые оно само испускает.
Чтобы понять, почему это событие взволновало двух профессоров, проследим за их рассуждениями.
Ярко-желтая D-линия в спектре пламени спиртовки возникает в присутствии натрия.
В спектре Солнца на этом же месте находится темная линия неизвестной природы.
Спектр излучения раскаленного тела — сплошной, и в нем нет темных линий. Однако если пропустить его через пламя спиртовки, то в его спектре также возникает темная линия и на том же самом месте. Но природу этой темной линии мы уже почти знаем, во всяком случае мы можем догадываться, что она принадлежит натрию. Следовательно, в зависимости от условий наблюдения D-линия натрия может быть либо ярко-желтой, либо темной на желтом фоне. Но в обоих случаях присутствие этой линии (все равно какой — желтой или темной!) означает, что в пламени спиртовки есть натрий. А поскольку такая линия спектра пламени спиртовки в проходящем свете совпадает с темной D-линией в спектре Солнца, то значит и на Солнце есть натрий. Причем он находится в газовом внешнем облаке, которое освещено изнутри раскаленным ядром Солнца.
Короткая заметка (всего две страницы), которую написал Кирхгоф в 1859 г., содержала сразу четыре открытия: каждому элементу присущ свой линейчатый спектр, то есть строго определенный набор спектральных линий;
эти линии можно использовать для анализа состава веществ не только на Земле, но и на звездах;
Солнце состоит из горячего ядра и сравнительно холодной атмосферы раскаленных газов;
на Солнце есть натрий.
Все эти открытия были вскоре подтверждены, в том числе и гипотеза о строении Солнца: экспедиция, которую Французская академия наук в 1868 г. во главе с астрономом Жансеном снарядила в Индию, обнаружила, что при полном солнечном затмении — в тот момент, когда его раскаленное ядро закрыто тенью Луны и светит только корона,— все темные линии в спектре Солнца вспыхивают ярким светом.
Сами Кирхгоф и Бунзен уже в следующем году с помощью спектроскопа открыли два новых элемента: рубидий и цезий.
В дальнейшем из скромного наблюдения над желтой двойной D-линией натрия родился спектральный анализ, с помощью которого мы сейчас можем узнавать химический состав далеких галактик, измерять температуру и скорость вращения звезд и многое другое.
Все это действительно интересно, но сейчас нам важно понять другое: что дали открытия Кирхгофа и Бунзена для науки об атоме и какова их связь с нашими прежними знаниями о нем?
Мы знаем теперь два вида спектров: сплошной (или тепловой) и линейчатый. Тепловой спектр содержит все длины волн, излучается он при нагревании твердых тел и не зависит от их природы. (Именно этот спектр описывается формулой Планка.) Линейчатый спектр состоит из набора отдельных резких линий, возникает при нагревании газов и паров (когда малы взаимодействия между атомами), и — что особенно важно — этот набор линий уникален для любого элемента. Более того, линейчатые спектры элементов не зависят от вида химических соединений, которые из этих элементов составлены. Следовательно, причину и объяснение спектров надо искать в свойствах атомов.
То, что элементы однозначно и вполне определяются видом линейчатого спектра, вскоре признали все; но то, что этот же спектр характеризует отдельный атом, осознали не сразу, а лишь в 1874 г. благодаря работам знаменитого английского астрофизика Нормана Локьера (1836—1920), хотя еще раньше те же мысли высказывали Максвелл (1860 г.) и Больцман (1866 г.). А когда осознали, сразу же пришли к неизбежному выводу: если линейчатый спектр возникает как следствие процессов внутри атома, то атом должен иметь структуру!
 Майкл Фарадей (1791 —1867) в 1834 г. установил количественные законы этого явления. Оказалось, что если через растворы различных веществ, молекулы которых построены из одновалентных атомов, пропускать одно и то же количество электричества, равное
96 485 Кл =2,895*1014 ед. СГСЭ,
то на электродах всегда выделяется одинаковое число атомов, равное 6,022*1023. Масса выделившегося вещества будет при этом, конечно, разной, поскольку массы атомов различаются между собой. Например, из расплава соли при этом выделится 23 г металла натрия и 37,5 г газа хлора. Величина, равная произведению постоянной Авогадро Nk на элементар-‘ ный электрический заряд электрона е, называется постоянной
Фарадея:
F = NA е=96 485,3 Кл/моль.
Закон электролиза Фарадея легко понять, если предположить, что в расплаве NaCl с каждым атомом связан определенный заряд, причем для ионов Na+ и Сl- эти заряды равны и противоположны по знаку. (Название ион — «странник» — таким «заряженным» атомам дал Фарадей по совету известного историка науки Уильяма Уэвелла (1794—1866), автора знаменитой «Истории индуктивных наук», который предложил также термины анион и катион и столь привычные теперь анод и катод.)
Зная закон Фарадея, не составляет труда вычислить заряд, который переносит с собой каждый одновалентный ион; легко сообразить, что он равен
e=F/NA=4,806*10-10 ед. СГСЭ.
Это значение очень мало, но мы уже немного привыкли к таким малым числам. Более удивительно другое: заряда меньшего, чем этот элементарный заряд е, обнаружить в природе до сих пор не удалось. С легкой руки Джонстона Стонея (1826—1911) в 1891 г. это наименьшее количество заряда получило название «электрон».
Майкл Фарадей (1791 —1867) в 1834 г. установил количественные законы этого явления. Оказалось, что если через растворы различных веществ, молекулы которых построены из одновалентных атомов, пропускать одно и то же количество электричества, равное
96 485 Кл =2,895*1014 ед. СГСЭ,
то на электродах всегда выделяется одинаковое число атомов, равное 6,022*1023. Масса выделившегося вещества будет при этом, конечно, разной, поскольку массы атомов различаются между собой. Например, из расплава соли при этом выделится 23 г металла натрия и 37,5 г газа хлора. Величина, равная произведению постоянной Авогадро Nk на элементар-‘ ный электрический заряд электрона е, называется постоянной
Фарадея:
F = NA е=96 485,3 Кл/моль.
Закон электролиза Фарадея легко понять, если предположить, что в расплаве NaCl с каждым атомом связан определенный заряд, причем для ионов Na+ и Сl- эти заряды равны и противоположны по знаку. (Название ион — «странник» — таким «заряженным» атомам дал Фарадей по совету известного историка науки Уильяма Уэвелла (1794—1866), автора знаменитой «Истории индуктивных наук», который предложил также термины анион и катион и столь привычные теперь анод и катод.)
Зная закон Фарадея, не составляет труда вычислить заряд, который переносит с собой каждый одновалентный ион; легко сообразить, что он равен
e=F/NA=4,806*10-10 ед. СГСЭ.
Это значение очень мало, но мы уже немного привыкли к таким малым числам. Более удивительно другое: заряда меньшего, чем этот элементарный заряд е, обнаружить в природе до сих пор не удалось. С легкой руки Джонстона Стонея (1826—1911) в 1891 г. это наименьшее количество заряда получило название «электрон».
 корпускулярную точку зрения). Такое стремление объясняется просто: все еще слишком хорошо помнили знаменитый спор Ньютона и Гюйгенса о природе света и потому всякую попытку объяснить наблюдаемые явления корпускулярным излучением воспринимали как возвращение к средним векам.
Поставьте себя на место этих исследователей в 70-е годы XIX века: у вас в руках набор интересных фактов, однако связи между ними не видно. С одной стороны, явление проводимости газов очень напоминает процессы электролиза, но, с другой,— происходят вещи совсем непонятные: например, проводимость растет с уменьшением плотности газа в трубке. Кроме того, обнаружен только поток отрицательных «лучей» и не обнаружено положительных. Нужна была руководящая идея.
Такая идея возникла под влиянием блестящих опытов, которые поставил Уильям Крукс (1832—1919) — английский физик и химик. Это был интересный человек, наделенный, к тому же, редким даром — предвидеть фундаментальные открытия.
Прежде всего, используя более совершенный насос, он гораздо сильнее откачал воздух из трубки. При этом от катода отделилось еще одно, более темное пространство, которое также постепенно заполнило всю трубку, после чего анод вспыхнул зеленоватым светом. Тот день 1878 г., когда это произошло, можно считать днем рождения электронно-лучевой трубки — основной части современного телевизора. Уже за одно это Круксу обеспечено признание потомков. Но для самого Крукса это было только началом — он стал тщательно изучать свойства «лучистой материи» (этот термин ввел все тот же Фарадей еще в 1816 г.). Крукс чувствовал, что столкнулся с совершенно новым явлением природы, и предлагал назвать его «четвертым состоянием вещества», которое «ни жидко, ни твердо, ни газообразно». Он писал:
«Изучая четвертое, лучистое состояние материи, мы, как мне кажется, имеем под руками и в сфере наших исследований те первичные атомы материи, из которых, как вполне основательно предполагают, состоят все тела природы. Мы видим, что лучистая* материя по одним своим свойствам так же материальна, как вот этот стол, по другим — она скорее похожа на лучистую энергию. Мы действительно коснулись той пограничной области, где материя и энергия переходят друг в друга. Я думаю, что величайшие задачи будущего найдут свое разрешение именно в этой пограничной области; более того, здесь, как мне кажется, лежит граница всего реального мира».
Чтобы оценить смелость Крукса, надо вспомнить, что в то время весь мир разделяли на материю и эфир и при этом противопоставляли их друг другу: с материей отождествляли частицы, а с эфиром — среду, колебания которой мы воспринимаем как лучи света. Таким образом, «лучистая материя» Крукса должна была совмещать в себе свойства несовместимые: волны и частицы. Через полстолетия все могли убедиться, насколько он был прав, но в то время (по словам Оливера Лоджа — современника и соотечественника Крукса) «предположение Крукса имело судьбу тех проблесков мысли, которые иногда разрешаются авторам, но подвергаются насмешкам со стороны ортодоксальной науки их времени».
Независимо от смысла, который Крукс вкладывал в понятие «лучистая материя», он бесспорными опытами обнаружил у нее такие свойства: она распространяется прямолинейно; вызывает свечение тел и может их даже расплавить; отклоняется в электрическом и магнитных полях; проникает сквозь твердые тела, а в воздухе проходит путь 7 см, в то время как атомы — только 0,002 см. Опираясь на эти факты, Уильям Крукс утверждал: катодные лучи, или «лучистая материя»,— это поток быстрых отрицательных частиц, размер которых значительно меньше размеров атомов. Легко убедиться, что одна эта гипотеза проясняла все свойства катодных лучей. В частности, таким способом можно было легко объяснить появление темного пространства у катода: его размер определялся просто средним расстоянием, которое пролетают электроны, не сталкиваясь с атомами газа. Очевидно, это расстояние растет по мере выкачивания газа из трубки. Но главное значение гипотезы в другом: именно она стала той руководящей идеей, которая позволила почувствовать себя устойчиво в море фактов, накопленных к тому времени.
Физики знали теперь, куда идти и что искать: необходимо было выделить этот гипотетический «атом электричества» и определить его свойства: заряд, массу и размеры.
На это понадобилось почти 20 лет и усилия таких больших физиков, как Джозеф Джон Томсон (1856—1940), Джон Таунсенд (1868—1957), Вильгельм Вин (1864—1928), Джордж Фитцджеральд (1851 —1901), Эмиль Вихерт (1861 — 1928), Жан Перрен (1870—1942), Роберт Эндрюс Милликен (1868—1953). У нас нет возможности рассказать сейчас об остроумии и тонкости опытов, которые придумали эти и многие другие ученые. Поэтому проследим просто, как гипотетический «атом электричества» обретал постепенно реальные свойства, пока не стал, наконец, основой физики.
Прежде всего, Жан Перрен в 1895 г. окончательно доказал: заряд катодных лучей отрицателен. В течение последующих двух лет выяснили: их скорость равна около одной десятой скорости света, то есть примерно в 10 тыс. раз больше скорости ружейной пули и скорости теплового движения атомов. Кроме того, эти и все остальные их свойства не зависят от
корпускулярную точку зрения). Такое стремление объясняется просто: все еще слишком хорошо помнили знаменитый спор Ньютона и Гюйгенса о природе света и потому всякую попытку объяснить наблюдаемые явления корпускулярным излучением воспринимали как возвращение к средним векам.
Поставьте себя на место этих исследователей в 70-е годы XIX века: у вас в руках набор интересных фактов, однако связи между ними не видно. С одной стороны, явление проводимости газов очень напоминает процессы электролиза, но, с другой,— происходят вещи совсем непонятные: например, проводимость растет с уменьшением плотности газа в трубке. Кроме того, обнаружен только поток отрицательных «лучей» и не обнаружено положительных. Нужна была руководящая идея.
Такая идея возникла под влиянием блестящих опытов, которые поставил Уильям Крукс (1832—1919) — английский физик и химик. Это был интересный человек, наделенный, к тому же, редким даром — предвидеть фундаментальные открытия.
Прежде всего, используя более совершенный насос, он гораздо сильнее откачал воздух из трубки. При этом от катода отделилось еще одно, более темное пространство, которое также постепенно заполнило всю трубку, после чего анод вспыхнул зеленоватым светом. Тот день 1878 г., когда это произошло, можно считать днем рождения электронно-лучевой трубки — основной части современного телевизора. Уже за одно это Круксу обеспечено признание потомков. Но для самого Крукса это было только началом — он стал тщательно изучать свойства «лучистой материи» (этот термин ввел все тот же Фарадей еще в 1816 г.). Крукс чувствовал, что столкнулся с совершенно новым явлением природы, и предлагал назвать его «четвертым состоянием вещества», которое «ни жидко, ни твердо, ни газообразно». Он писал:
«Изучая четвертое, лучистое состояние материи, мы, как мне кажется, имеем под руками и в сфере наших исследований те первичные атомы материи, из которых, как вполне основательно предполагают, состоят все тела природы. Мы видим, что лучистая* материя по одним своим свойствам так же материальна, как вот этот стол, по другим — она скорее похожа на лучистую энергию. Мы действительно коснулись той пограничной области, где материя и энергия переходят друг в друга. Я думаю, что величайшие задачи будущего найдут свое разрешение именно в этой пограничной области; более того, здесь, как мне кажется, лежит граница всего реального мира».
Чтобы оценить смелость Крукса, надо вспомнить, что в то время весь мир разделяли на материю и эфир и при этом противопоставляли их друг другу: с материей отождествляли частицы, а с эфиром — среду, колебания которой мы воспринимаем как лучи света. Таким образом, «лучистая материя» Крукса должна была совмещать в себе свойства несовместимые: волны и частицы. Через полстолетия все могли убедиться, насколько он был прав, но в то время (по словам Оливера Лоджа — современника и соотечественника Крукса) «предположение Крукса имело судьбу тех проблесков мысли, которые иногда разрешаются авторам, но подвергаются насмешкам со стороны ортодоксальной науки их времени».
Независимо от смысла, который Крукс вкладывал в понятие «лучистая материя», он бесспорными опытами обнаружил у нее такие свойства: она распространяется прямолинейно; вызывает свечение тел и может их даже расплавить; отклоняется в электрическом и магнитных полях; проникает сквозь твердые тела, а в воздухе проходит путь 7 см, в то время как атомы — только 0,002 см. Опираясь на эти факты, Уильям Крукс утверждал: катодные лучи, или «лучистая материя»,— это поток быстрых отрицательных частиц, размер которых значительно меньше размеров атомов. Легко убедиться, что одна эта гипотеза проясняла все свойства катодных лучей. В частности, таким способом можно было легко объяснить появление темного пространства у катода: его размер определялся просто средним расстоянием, которое пролетают электроны, не сталкиваясь с атомами газа. Очевидно, это расстояние растет по мере выкачивания газа из трубки. Но главное значение гипотезы в другом: именно она стала той руководящей идеей, которая позволила почувствовать себя устойчиво в море фактов, накопленных к тому времени.
Физики знали теперь, куда идти и что искать: необходимо было выделить этот гипотетический «атом электричества» и определить его свойства: заряд, массу и размеры.
На это понадобилось почти 20 лет и усилия таких больших физиков, как Джозеф Джон Томсон (1856—1940), Джон Таунсенд (1868—1957), Вильгельм Вин (1864—1928), Джордж Фитцджеральд (1851 —1901), Эмиль Вихерт (1861 — 1928), Жан Перрен (1870—1942), Роберт Эндрюс Милликен (1868—1953). У нас нет возможности рассказать сейчас об остроумии и тонкости опытов, которые придумали эти и многие другие ученые. Поэтому проследим просто, как гипотетический «атом электричества» обретал постепенно реальные свойства, пока не стал, наконец, основой физики.
Прежде всего, Жан Перрен в 1895 г. окончательно доказал: заряд катодных лучей отрицателен. В течение последующих двух лет выяснили: их скорость равна около одной десятой скорости света, то есть примерно в 10 тыс. раз больше скорости ружейной пули и скорости теплового движения атомов. Кроме того, эти и все остальные их свойства не зависят от
 состава газа в трубке. А это означало, что катодные частицы — непременная составная часть всех атомов. И, наконец, в 1897 г. Дж. Дж. Томсону удалось определить заряд е и массу tn отдельного «атома электричества»: оказалось, что масса этих частиц примерно в тысячу раз меньше массы атома водорода, а заряд равен заряду иона водорода, измеренному при изучении явления электролиза.
Это было неожиданно. Посудите сами: явления электролиза и проводимости газов изучали разные науки, которые развивались независимо друг от друга, и в них на протяжении десятилетий сформировались свои понятия. И вдруг они оказались тесно связанными. «Такие факты в истории науки,— говорил ученик Планка, лауреат Нобелевской премии по физике Макс Лауэ,— самое сильное доказательство ее истинности». Для физиков это всегда праздник.
История электрона — хороший способ усвоить логику открытий нынешней физики: исходя из наблюдений, ученые выдвигают на их основе гипотезы, которые вновь проверяют опытом, и, наконец, процесс этот завершается теорией, то есть сжатым объяснением частных явлений на основе немногих общих принципов.
Гипотеза об электроне возникла из наблюдений Фарадея, Плюккера и Крукса. Плодотворность ее была проверена и доказана в опытах Дж. Дж. Томсона и других физиков. И, наконец, Гендрик Антон Лоренц (1853—1928) настолько поверил в реальность электрона, что создал на основе этой гипотезы теорию, следствия из которой вновь можно было проверить. Процесс этот беспределен, но это — единственный способ движения науки.
В очередную пятницу 30 апреля 1897 г. на вечернем заседании Королевского института Джозеф Джон Томсон доложил о своих исследованиях. После сорока лет усилий в физике получила права гражданства первая «элементарная частица» — электрон. Это было самое важное событие со времени признания реальности атома. В тот год узнали, что существуют частицы значительно меньше атомов; что они входят в состав всех атомов; что не только материя, но и электричество имеет атомистическую структуру. Все это означало, что в природе реально существует материальный носитель наименьшего заряда.
Как и атом, электрон признали далеко не сразу. Еще в 1902 г. Оливер Лодж писал: «...электрон — это чисто гипотетический заряд, изолированный от атома». И даже в 1920 г. великий Рентген продолжал сомневаться в его существовании.
Физики, которые сразу поверили в реальность электронов, начали тщательно измерять его характеристики: заряд е и массу т. Благодаря их трудам (особенно трудам Роберта Милликена, который с 1909 по 1940 гг. периодически возвращался к этой задаче), мы сейчас знаем значения этих величин с большой точностью:
т = 9,109389-10~28 г,
е=4,803207 -10~10 ед. СГСЭ = 1,602177 -10 “19 Кл.
А размер? Каковы размеры электрона? Увы, нам это неизвестно до сих пор. Мы не уверены даже, имеет ли вообще этот вопрос четкий смысл. В самом деле, о свойствах электрона мы узнаём, изучая его взаимодействия с другими частицами и полями. Но для понимания результатов всех этих опытов нам достаточно знать только массу и заряд электрона и совершенно не нужны его размеры. Не исключено, что такого свойства у электронов и вправду нет. Ведь нельзя же указать толщину экватора, хотя длину его измерить можно. Или, быть может, размер электрона зависит от условий опыта? Такую возможность тоже нельзя отрицать заранее: ведь изменяет же комета свои размеры, приближаясь к Солнцу, хотя масса ее при этом остается постоянной. Все это — не праздные вопросы, и мы к ним еще возратимся.
состава газа в трубке. А это означало, что катодные частицы — непременная составная часть всех атомов. И, наконец, в 1897 г. Дж. Дж. Томсону удалось определить заряд е и массу tn отдельного «атома электричества»: оказалось, что масса этих частиц примерно в тысячу раз меньше массы атома водорода, а заряд равен заряду иона водорода, измеренному при изучении явления электролиза.
Это было неожиданно. Посудите сами: явления электролиза и проводимости газов изучали разные науки, которые развивались независимо друг от друга, и в них на протяжении десятилетий сформировались свои понятия. И вдруг они оказались тесно связанными. «Такие факты в истории науки,— говорил ученик Планка, лауреат Нобелевской премии по физике Макс Лауэ,— самое сильное доказательство ее истинности». Для физиков это всегда праздник.
История электрона — хороший способ усвоить логику открытий нынешней физики: исходя из наблюдений, ученые выдвигают на их основе гипотезы, которые вновь проверяют опытом, и, наконец, процесс этот завершается теорией, то есть сжатым объяснением частных явлений на основе немногих общих принципов.
Гипотеза об электроне возникла из наблюдений Фарадея, Плюккера и Крукса. Плодотворность ее была проверена и доказана в опытах Дж. Дж. Томсона и других физиков. И, наконец, Гендрик Антон Лоренц (1853—1928) настолько поверил в реальность электрона, что создал на основе этой гипотезы теорию, следствия из которой вновь можно было проверить. Процесс этот беспределен, но это — единственный способ движения науки.
В очередную пятницу 30 апреля 1897 г. на вечернем заседании Королевского института Джозеф Джон Томсон доложил о своих исследованиях. После сорока лет усилий в физике получила права гражданства первая «элементарная частица» — электрон. Это было самое важное событие со времени признания реальности атома. В тот год узнали, что существуют частицы значительно меньше атомов; что они входят в состав всех атомов; что не только материя, но и электричество имеет атомистическую структуру. Все это означало, что в природе реально существует материальный носитель наименьшего заряда.
Как и атом, электрон признали далеко не сразу. Еще в 1902 г. Оливер Лодж писал: «...электрон — это чисто гипотетический заряд, изолированный от атома». И даже в 1920 г. великий Рентген продолжал сомневаться в его существовании.
Физики, которые сразу поверили в реальность электронов, начали тщательно измерять его характеристики: заряд е и массу т. Благодаря их трудам (особенно трудам Роберта Милликена, который с 1909 по 1940 гг. периодически возвращался к этой задаче), мы сейчас знаем значения этих величин с большой точностью:
т = 9,109389-10~28 г,
е=4,803207 -10~10 ед. СГСЭ = 1,602177 -10 “19 Кл.
А размер? Каковы размеры электрона? Увы, нам это неизвестно до сих пор. Мы не уверены даже, имеет ли вообще этот вопрос четкий смысл. В самом деле, о свойствах электрона мы узнаём, изучая его взаимодействия с другими частицами и полями. Но для понимания результатов всех этих опытов нам достаточно знать только массу и заряд электрона и совершенно не нужны его размеры. Не исключено, что такого свойства у электронов и вправду нет. Ведь нельзя же указать толщину экватора, хотя длину его измерить можно. Или, быть может, размер электрона зависит от условий опыта? Такую возможность тоже нельзя отрицать заранее: ведь изменяет же комета свои размеры, приближаясь к Солнцу, хотя масса ее при этом остается постоянной. Все это — не праздные вопросы, и мы к ним еще возратимся.
 В то время было еще не ясно, имеют ли вообще такие вопросы смысл. К тому же в конце века отнюдь не все верили в существование атомов, а потому и попытки понять их внутреннее устройство воспринимались тогда как некая игра ума. Большинство, не утруждая себя фантазией, представляло ^ебе электрон маленьким шариком диаметром 10“13 см, который «как-то» закреплен внутри атома либо летает там наподобие мухи в соборе. Для начала хотели понять главное: почему атом излучает спектральные линии строго определенной длины волны и почему этих линий так много (у атома железа, например, только в видимой части спектра свыше 3000). Как всегда, в отсутствие глубоких идей мыслили аналогиями: все хорошо помнили, что частота колебаний пружины с грузиком зависит от ее упругости, следовательно, рассуждала часть физиков, и в атоме электроны связаны какими-то «пружинами» различной упругости. Когда мы возбуждаем атом, электроны начинают колебаться и при этом излучают свет с частотой колебания пружинок. Отсюда, по мысли Локьера, сразу следовало, что число электронов в атоме равно числу линий в спектре элемента. Кроме того, атом с подобным устройством будет наиболее охотно поглощать именно то излучение, которое он сам испускает. А ведь именно это и обнаружили Кирхгоф и Бунзен в своем знаменитом опыте с парами натрия!
Несмотря на эти успехи модели атома с упруго связанным электроном, многие понимали ее логическое или, точнее, эстетическое несовершенство. А вскоре обнаружились и прямые противоречия с опытом. Дж. Дж. Томсон, изучая рассеяние рентгеновского излучения на атомах различных элементов, пришел к выводу, что число электронов в атоме сравнительно невелико и равно примерно половине атомной массы элемента. В 1904 г. Дж. Дж. Томсон предложил свою модель атома, развив гипотезу Уильяма Томсона (лорда Кельвина): внутри положительного равномерно заряженного атома-шара диаметром 10“8 см плавают отрицательные электроны, квазиуп-руго с ним связанные. Число электронов равно заряду шара, так что в целом атом оказывается нейтральным, как это и следует из опыта. В начале века почти все физики приняли модель Томсона, и лишь немногие предлагали другие модели. Но все чувствовали: в науке об атоме наступает новая эпоха.
В то время было еще не ясно, имеют ли вообще такие вопросы смысл. К тому же в конце века отнюдь не все верили в существование атомов, а потому и попытки понять их внутреннее устройство воспринимались тогда как некая игра ума. Большинство, не утруждая себя фантазией, представляло ^ебе электрон маленьким шариком диаметром 10“13 см, который «как-то» закреплен внутри атома либо летает там наподобие мухи в соборе. Для начала хотели понять главное: почему атом излучает спектральные линии строго определенной длины волны и почему этих линий так много (у атома железа, например, только в видимой части спектра свыше 3000). Как всегда, в отсутствие глубоких идей мыслили аналогиями: все хорошо помнили, что частота колебаний пружины с грузиком зависит от ее упругости, следовательно, рассуждала часть физиков, и в атоме электроны связаны какими-то «пружинами» различной упругости. Когда мы возбуждаем атом, электроны начинают колебаться и при этом излучают свет с частотой колебания пружинок. Отсюда, по мысли Локьера, сразу следовало, что число электронов в атоме равно числу линий в спектре элемента. Кроме того, атом с подобным устройством будет наиболее охотно поглощать именно то излучение, которое он сам испускает. А ведь именно это и обнаружили Кирхгоф и Бунзен в своем знаменитом опыте с парами натрия!
Несмотря на эти успехи модели атома с упруго связанным электроном, многие понимали ее логическое или, точнее, эстетическое несовершенство. А вскоре обнаружились и прямые противоречия с опытом. Дж. Дж. Томсон, изучая рассеяние рентгеновского излучения на атомах различных элементов, пришел к выводу, что число электронов в атоме сравнительно невелико и равно примерно половине атомной массы элемента. В 1904 г. Дж. Дж. Томсон предложил свою модель атома, развив гипотезу Уильяма Томсона (лорда Кельвина): внутри положительного равномерно заряженного атома-шара диаметром 10“8 см плавают отрицательные электроны, квазиуп-руго с ним связанные. Число электронов равно заряду шара, так что в целом атом оказывается нейтральным, как это и следует из опыта. В начале века почти все физики приняли модель Томсона, и лишь немногие предлагали другие модели. Но все чувствовали: в науке об атоме наступает новая эпоха.
 ВОКРУГ КВАНТА
Слово «спектр» в физику ввел Ньютон. На классической латыни, которой он пользовался в своих научных трудах, слово «spectrum» означает «дух», «привидение», что довольно точно отражает суть явления: возникновение праздничной радуги при прохождении бесцветного солнечного света через прозрачную призму. Почти два столетия эти «духи» позволяли молча себя разглядывать, пока ученые не заставили их заговорить на языке квантовой физики.
Открытие спектрального анализа вызвало живой интерес даже у публики, далекой от науки, что по тем временам случалось весьма не часто. Как всегда в таких случаях, досужие любители отыскали множество других ученых, которые якобы все сделали задолго до Кирхгофа и Бунзена. Называли французского ученого Жака Бернара Леона Фуко (1819— 1868), предложившего аналогичный опыт за десять лет до них, знаменитого астронома Джона Фредерика Гершеля (1792—1871), изобретателя фотографии на бумаге Уильяма Генри Фокса Тальбота (1800—1877) и многих других. Англичане еще долгое время спустя утверждали, что спектральный анализ открыл их знаменитый соотечественник Джордж Габриэль Стокс (1819—1903), который в разговоре с Уильямом Томсоном (1824—1907) высказывал предположение, что D-линия в спектре Солнца возникает при прохождении белого солнечного света через пары натрия в газовой оболочке Солнца. Сам Стокс с присущим ему благородством отказывался от подобных притязаний, хотя и признавал, что излагал похожие мысли студентам на лекциях, считая, однако, их общеизвестными и не особенно важными. (Кстати, именно в то время у Питера Тэта (1831—1901) возникла идея научных обзоров: он упрекал Стокса и Уильяма Томсона за беспечность и плохое знание литературы, которые помешали им опубликовать очевидную идею.) Пожалуй, следует упомянуть здесь и Юлиуса Плюккера, который знал, что каждый газ светится своим характерным цветом, но выводов и обобщений из этого наблюдения не сделал.
В отличие от многочисленных предшественников, Кирхгоф и Бунзен сразу же поняли значение своего открытия. Они впервые отчетливо уяснили себе (и потому так легко убедили в этом других), что спектральные линии — это характеристика атомов вещества, а не особенностей строения призмы или свойств солнечных лучей. Кирхгоф немедленно стал составлять подробный атлас фраунгоферовых линий солнечного спектра и определил химический состав Солнца. За этой работой он испортил себе зрение и уже в 1861 г. вынужден был ее оставить.
История и существо открытия спектрального анализа могут составить предмет увлекательного повествования, на что мы сейчас, к сожалению, не можем отвлечься. Напомним только один любопытный случай, имевший место вскоре после открытия Кирхгофа и Бунзена.
18 августа 1868 г. французский астроном Пьер Жюль Сезар Жансен (1824—1907) во время солнечного затмения в Индии наблюдал в спектре солнечной короны желтую линию неизвестной природы. Два месяца спустя английский физик Джозеф Норман Локьер (1836—1920) научился наблюдать корону Солнца, не дожидаясь солнечных затмений, и при этом обнаружил в ее спектре ту же самую желтую линию. Неизвестный элемент, который ее испускал, он назвал гелием, то есть солнечным элементом. Оба ученых написали о своем открытии письма во Французскую академию наук, оба письма пришли туда одновременно и были зачитаны на заседании академии 26 октября 1868 г. Такое совпадение поразило академиков, и они решили в честь этого события выбить памятную золотую медаль: с одной стороны профили Жансена и Локьера, с другой — бог Аполлон на колеснице и надпись: «Анализ солнечных протуберанцев».
На Земле элемент гелий был открыт в 1895-г. Уильямом Рамзаем в минералах тория.
ВОКРУГ КВАНТА
Слово «спектр» в физику ввел Ньютон. На классической латыни, которой он пользовался в своих научных трудах, слово «spectrum» означает «дух», «привидение», что довольно точно отражает суть явления: возникновение праздничной радуги при прохождении бесцветного солнечного света через прозрачную призму. Почти два столетия эти «духи» позволяли молча себя разглядывать, пока ученые не заставили их заговорить на языке квантовой физики.
Открытие спектрального анализа вызвало живой интерес даже у публики, далекой от науки, что по тем временам случалось весьма не часто. Как всегда в таких случаях, досужие любители отыскали множество других ученых, которые якобы все сделали задолго до Кирхгофа и Бунзена. Называли французского ученого Жака Бернара Леона Фуко (1819— 1868), предложившего аналогичный опыт за десять лет до них, знаменитого астронома Джона Фредерика Гершеля (1792—1871), изобретателя фотографии на бумаге Уильяма Генри Фокса Тальбота (1800—1877) и многих других. Англичане еще долгое время спустя утверждали, что спектральный анализ открыл их знаменитый соотечественник Джордж Габриэль Стокс (1819—1903), который в разговоре с Уильямом Томсоном (1824—1907) высказывал предположение, что D-линия в спектре Солнца возникает при прохождении белого солнечного света через пары натрия в газовой оболочке Солнца. Сам Стокс с присущим ему благородством отказывался от подобных притязаний, хотя и признавал, что излагал похожие мысли студентам на лекциях, считая, однако, их общеизвестными и не особенно важными. (Кстати, именно в то время у Питера Тэта (1831—1901) возникла идея научных обзоров: он упрекал Стокса и Уильяма Томсона за беспечность и плохое знание литературы, которые помешали им опубликовать очевидную идею.) Пожалуй, следует упомянуть здесь и Юлиуса Плюккера, который знал, что каждый газ светится своим характерным цветом, но выводов и обобщений из этого наблюдения не сделал.
В отличие от многочисленных предшественников, Кирхгоф и Бунзен сразу же поняли значение своего открытия. Они впервые отчетливо уяснили себе (и потому так легко убедили в этом других), что спектральные линии — это характеристика атомов вещества, а не особенностей строения призмы или свойств солнечных лучей. Кирхгоф немедленно стал составлять подробный атлас фраунгоферовых линий солнечного спектра и определил химический состав Солнца. За этой работой он испортил себе зрение и уже в 1861 г. вынужден был ее оставить.
История и существо открытия спектрального анализа могут составить предмет увлекательного повествования, на что мы сейчас, к сожалению, не можем отвлечься. Напомним только один любопытный случай, имевший место вскоре после открытия Кирхгофа и Бунзена.
18 августа 1868 г. французский астроном Пьер Жюль Сезар Жансен (1824—1907) во время солнечного затмения в Индии наблюдал в спектре солнечной короны желтую линию неизвестной природы. Два месяца спустя английский физик Джозеф Норман Локьер (1836—1920) научился наблюдать корону Солнца, не дожидаясь солнечных затмений, и при этом обнаружил в ее спектре ту же самую желтую линию. Неизвестный элемент, который ее испускал, он назвал гелием, то есть солнечным элементом. Оба ученых написали о своем открытии письма во Французскую академию наук, оба письма пришли туда одновременно и были зачитаны на заседании академии 26 октября 1868 г. Такое совпадение поразило академиков, и они решили в честь этого события выбить памятную золотую медаль: с одной стороны профили Жансена и Локьера, с другой — бог Аполлон на колеснице и надпись: «Анализ солнечных протуберанцев».
На Земле элемент гелий был открыт в 1895-г. Уильямом Рамзаем в минералах тория.
 Крукс был удивительно богатой натурой: изобретатель, биржевой делец, издатель журнала «Химические новости» и чистый исследователь — в одно и то же время. Человек он был приветливый, уравновешенный, преданный своей семье и осмотрительный с людьми посторонними. Крукс нигде не служил, всецело был предан науке, что не помешало ему, однако, верить в спиритизм и в 1913 г. стать президентом Королевского общества.
История его занятий спиритизмом такова. В 1867 г. в Гаване от желтой лихорадки умер его младший брат Филипп, которого он горячо любил. Ученик Крукса Кромвель Вэрли посоветовал ему пообщаться с умершим братом с помощью спиритизма. В 1874 г. Крукс прекратил эти занятия, хотя так и не отказался от своих убеждений.
«Это был исключительно независимый, оригинальный и мужественный ум, он смотрел на явления по-своему и не боялся высказывать мнения, в корне отличные от утверждений всех прежних ортодоксов»,— говорил о нем впоследствии Дж. Дж. Томсон.
Крукс был удивительно богатой натурой: изобретатель, биржевой делец, издатель журнала «Химические новости» и чистый исследователь — в одно и то же время. Человек он был приветливый, уравновешенный, преданный своей семье и осмотрительный с людьми посторонними. Крукс нигде не служил, всецело был предан науке, что не помешало ему, однако, верить в спиритизм и в 1913 г. стать президентом Королевского общества.
История его занятий спиритизмом такова. В 1867 г. в Гаване от желтой лихорадки умер его младший брат Филипп, которого он горячо любил. Ученик Крукса Кромвель Вэрли посоветовал ему пообщаться с умершим братом с помощью спиритизма. В 1874 г. Крукс прекратил эти занятия, хотя так и не отказался от своих убеждений.
«Это был исключительно независимый, оригинальный и мужественный ум, он смотрел на явления по-своему и не боялся высказывать мнения, в корне отличные от утверждений всех прежних ортодоксов»,— говорил о нем впоследствии Дж. Дж. Томсон.

 Представьте себе крупного и шумного человека, который принужден сидеть в темной комнате и, глядя в микроскоп, считать на экране спинтарископа вспышки — сцинтилляции (от лат. scintilla — искра) а-частиц. Работа изнурительная: уже через две минуты глаза устают. Ему помогают опытный исследователь Ганс Гейгер (1882—1945) и двадцатилетний лаборант Эрнст Марсден (1889— 1970). Их прибор несложен: ампула с радием-С, испускающим а-частицы, диафрагма, которая выделяет из них узкий пучок и направляет его на экран из сернистого цинка, и микроскоп, через который наблюдают сцинтилляции а-частиц на экране. Место появления очередной сцинтилляции предугадать нельзя — они возникают беспорядочно, но так, что в целом на экране получается довольно резкое изображение щели диафрагмы.
Если на пути а-частиц поставить металлическую фольгу, то вместо резкого изображения щели на экране возникает размытая полоса. Она лишь немного шире изображения щели, получаемого в первом случае: частицы отклоняются от прямолинейного пути в среднем всего на 2°, однако несложный расчет показывает: чтобы объяснить даже такие небольшие отклонения, нужно допустить, что в атомах фольги могут возникать огромные электрические поля напряженностью свыше 200 кВ/см. В положительном шаре атома Томсона таких напряженностей быть не может. Столкновения с электронами — также не в счет: ведь по сравнению с ними а-частица, летящая со скоростью 20 км/с, все равно, что пушечное ядро рядом с горошиной. И все же пути а-частиц искривлялись. В поисках разгадки Резерфорд предложил Марсдену
Представьте себе крупного и шумного человека, который принужден сидеть в темной комнате и, глядя в микроскоп, считать на экране спинтарископа вспышки — сцинтилляции (от лат. scintilla — искра) а-частиц. Работа изнурительная: уже через две минуты глаза устают. Ему помогают опытный исследователь Ганс Гейгер (1882—1945) и двадцатилетний лаборант Эрнст Марсден (1889— 1970). Их прибор несложен: ампула с радием-С, испускающим а-частицы, диафрагма, которая выделяет из них узкий пучок и направляет его на экран из сернистого цинка, и микроскоп, через который наблюдают сцинтилляции а-частиц на экране. Место появления очередной сцинтилляции предугадать нельзя — они возникают беспорядочно, но так, что в целом на экране получается довольно резкое изображение щели диафрагмы.
Если на пути а-частиц поставить металлическую фольгу, то вместо резкого изображения щели на экране возникает размытая полоса. Она лишь немного шире изображения щели, получаемого в первом случае: частицы отклоняются от прямолинейного пути в среднем всего на 2°, однако несложный расчет показывает: чтобы объяснить даже такие небольшие отклонения, нужно допустить, что в атомах фольги могут возникать огромные электрические поля напряженностью свыше 200 кВ/см. В положительном шаре атома Томсона таких напряженностей быть не может. Столкновения с электронами — также не в счет: ведь по сравнению с ними а-частица, летящая со скоростью 20 км/с, все равно, что пушечное ядро рядом с горошиной. И все же пути а-частиц искривлялись. В поисках разгадки Резерфорд предложил Марсдену
 проверить: а не могут ли а-частицы отражаться от фольги назад? С точки зрения модели Томсона предположение совершенно бессмысленное: пушечное ядро не может отразиться от горошины. Прошло два года. За это время Гейгер и Марсден сосчитали более миллиона сцинтилляций и доказали, что назад отражается примерно одна а-частица из 8 тысяч.
7 марта 1911 г. Манчестерское философское общество — то самое,
президентом которого был когда-то Джон Дальтон,— услышало доклад Резерфорда «Рассеяние а- и р-лучей и строение атома». В тот день слушатели узнали, что атом подобен Солнечной системе: он состоит из ядра и электронов, которые обращаются вокруг него на расстояниях примерно
проверить: а не могут ли а-частицы отражаться от фольги назад? С точки зрения модели Томсона предположение совершенно бессмысленное: пушечное ядро не может отразиться от горошины. Прошло два года. За это время Гейгер и Марсден сосчитали более миллиона сцинтилляций и доказали, что назад отражается примерно одна а-частица из 8 тысяч.
7 марта 1911 г. Манчестерское философское общество — то самое,
президентом которого был когда-то Джон Дальтон,— услышало доклад Резерфорда «Рассеяние а- и р-лучей и строение атома». В тот день слушатели узнали, что атом подобен Солнечной системе: он состоит из ядра и электронов, которые обращаются вокруг него на расстояниях примерно
 10“8 см. Размеры ядра очень малы — всего 10“13—10“12 см, но в нем заключена практически вся масса атома. Заряд ядра положителен и численно равен примерно половине атомной массы элемента.
Сравнение с Солнечной системой не случайно: диаметр Солнца (1,4-106 км) почти во столько же раз меньше размеров Солнечной системы (6*109 км), во сколько размеры ядер (10“12 см) меньше диаметра атома (10~8 см).
Мы настолько свыклись с новыми понятиями, что, объясняя понятия электроники, ссылаемся на телевизор, а рассказывая о механике, приводим в пример паровоз. Поэтому сейчас нам трудно понять тогдашнее недоумение людей, по силе ума равных Резерфорду. Действительно, ведь все так прозрачно: просто а-частица отражается от ядер атомов. К этой картине мы привыкаем со школы. Но чтобы нарисовать ее в первый раз, необходима была выдающаяся научная смелость. Прежде чем эта картина попала в учебники, пришлось не только сосчитать свыше миллиона сцинтилляций: нужно было (как вспоминал в конце жизни Гейгер) «преодолеть такие трудности, смысл которых мы сейчас даже понять не в состоянии»; нужно было сначала в течение десяти (!) лет доказывать, что а-частицы — не что иное, как ядра атомов гелия. Обо всем этом постепенно забыли: результат был важнее и проще, чем путь, к нему приведший. О трудностях пути теперь можно было забыть: настало время думать о следствиях этого открытия.
Сообщение Резерфорда физики приняли сдержанно. Сам он в течение двух лет также не очень сильно настаивал на своей модели, хотя и был уверен в безошибочности опытов, которые к ней привели. Причина была все та же: если верить электродинамике, такая система существовать не может, поскольку электрон, вращающийся по ее законам, неизбежно и очень скоро упадет на ядро. Приходилось выбирать: либо электродинамика, либо планетарный атом. Физики молча выбрали первое. Молча, потому что опыты Резерфорда нельзя было ни забыть, ни опровергнуть. Физика атома зашла в тупик. И чтобы выйти из него, нужен был Нильс Бор.
10“8 см. Размеры ядра очень малы — всего 10“13—10“12 см, но в нем заключена практически вся масса атома. Заряд ядра положителен и численно равен примерно половине атомной массы элемента.
Сравнение с Солнечной системой не случайно: диаметр Солнца (1,4-106 км) почти во столько же раз меньше размеров Солнечной системы (6*109 км), во сколько размеры ядер (10“12 см) меньше диаметра атома (10~8 см).
Мы настолько свыклись с новыми понятиями, что, объясняя понятия электроники, ссылаемся на телевизор, а рассказывая о механике, приводим в пример паровоз. Поэтому сейчас нам трудно понять тогдашнее недоумение людей, по силе ума равных Резерфорду. Действительно, ведь все так прозрачно: просто а-частица отражается от ядер атомов. К этой картине мы привыкаем со школы. Но чтобы нарисовать ее в первый раз, необходима была выдающаяся научная смелость. Прежде чем эта картина попала в учебники, пришлось не только сосчитать свыше миллиона сцинтилляций: нужно было (как вспоминал в конце жизни Гейгер) «преодолеть такие трудности, смысл которых мы сейчас даже понять не в состоянии»; нужно было сначала в течение десяти (!) лет доказывать, что а-частицы — не что иное, как ядра атомов гелия. Обо всем этом постепенно забыли: результат был важнее и проще, чем путь, к нему приведший. О трудностях пути теперь можно было забыть: настало время думать о следствиях этого открытия.
Сообщение Резерфорда физики приняли сдержанно. Сам он в течение двух лет также не очень сильно настаивал на своей модели, хотя и был уверен в безошибочности опытов, которые к ней привели. Причина была все та же: если верить электродинамике, такая система существовать не может, поскольку электрон, вращающийся по ее законам, неизбежно и очень скоро упадет на ядро. Приходилось выбирать: либо электродинамика, либо планетарный атом. Физики молча выбрали первое. Молча, потому что опыты Резерфорда нельзя было ни забыть, ни опровергнуть. Физика атома зашла в тупик. И чтобы выйти из него, нужен был Нильс Бор.
 где % — длина волны спектральной линии, в ангстремах, k = 3, 4, 5, 6 — целые числа, а постоянная Ь = 3645,6 А.
Это простое соотношение заслуживает пристального внимания. Дело в том, что оно точное, в чем каждый желающий может легко убедиться сам. Взгляните на таблицу, которую Бальмер составил в 1885 г.:
где % — длина волны спектральной линии, в ангстремах, k = 3, 4, 5, 6 — целые числа, а постоянная Ь = 3645,6 А.
Это простое соотношение заслуживает пристального внимания. Дело в том, что оно точное, в чем каждый желающий может легко убедиться сам. Взгляните на таблицу, которую Бальмер составил в 1885 г.:
 А в 1890 г. шведский физик Иоганн Роберт Ридберг (1854— 1919) предложил записывать формулу в том виде, который она сохранила до сих пор:
Здесь п и k — целые числа, а постоянная R— 109 677,58 см-1 называется с тех пор постоянной Ридберга для атома водорода. Полагая в этой формуле п = 2, можно вычислить всю серию Бальмера, измеренную впоследствии вплоть до k «50.
Тогда же возникла мысль записывать частоту в виде разности двух величин — термов Тп и Tk\
Пока что в такой записи не видно глубокого смысла, да и особых преимуществ тоже. Однако в 1908 г. молодой, рано умерший швейцарский ученый Вальтер Ритц (1878—1909) объяснил преимущества такой формы записи. Продолжая работы Ридберга, он сформулировал так называемый комбинационный принцип: частоту произвольной линии в спектре
А в 1890 г. шведский физик Иоганн Роберт Ридберг (1854— 1919) предложил записывать формулу в том виде, который она сохранила до сих пор:
Здесь п и k — целые числа, а постоянная R— 109 677,58 см-1 называется с тех пор постоянной Ридберга для атома водорода. Полагая в этой формуле п = 2, можно вычислить всю серию Бальмера, измеренную впоследствии вплоть до k «50.
Тогда же возникла мысль записывать частоту в виде разности двух величин — термов Тп и Tk\
Пока что в такой записи не видно глубокого смысла, да и особых преимуществ тоже. Однако в 1908 г. молодой, рано умерший швейцарский ученый Вальтер Ритц (1878—1909) объяснил преимущества такой формы записи. Продолжая работы Ридберга, он сформулировал так называемый комбинационный принцип: частоту произвольной линии в спектре
 любого атома можно представить как разность двух термов Тп и Tk'
Vnk=Tn — Tk
даже в том случае, когда отдельный терм Тп уже нельзя записать в таком простом виде, как для атома водорода.
На первый взгляд в этом нет никакого выигрыша: просто от набора частот мы перешли к набору термов. Однако это не так: попытайтесь прочесть книгу, в которой отсутствуют промежутки между словами, и вы сразу почувствуете разницу. Особенно если эта книга на неизвестном языке. Кроме того, чисел стало значительно меньше: чтобы определить частоты 50 линий водорода, которые были известны в начале века, достаточно знать десяток термов.
Неожиданно в хаосе чисел обнаружилась система. Беспорядочный набор линий распался на серии. В непонятной книге чисел стали различать отдельные слова. В простейшем случае — атома водорода — удалось разглядеть даже буквы, из которых они составлены. Однако смысл слов и происхождение букв по-прежнему оставались неизвестными: иероглифы спектральных линий еще не заговорили, хотя и не казались теперь столь загадочными. Стремление осмыслить структуру спектра и в самом деле напоминало попытки почти вслепую расшифровать незнакомый текст. Утомительная работа длилась больше четверти века, и отсутствие общей идеи отталкивало от нее глубокие умы. Необходимо было найти ключ к шифру.
Это сделал Нильс Бор в 1913 г.
любого атома можно представить как разность двух термов Тп и Tk'
Vnk=Tn — Tk
даже в том случае, когда отдельный терм Тп уже нельзя записать в таком простом виде, как для атома водорода.
На первый взгляд в этом нет никакого выигрыша: просто от набора частот мы перешли к набору термов. Однако это не так: попытайтесь прочесть книгу, в которой отсутствуют промежутки между словами, и вы сразу почувствуете разницу. Особенно если эта книга на неизвестном языке. Кроме того, чисел стало значительно меньше: чтобы определить частоты 50 линий водорода, которые были известны в начале века, достаточно знать десяток термов.
Неожиданно в хаосе чисел обнаружилась система. Беспорядочный набор линий распался на серии. В непонятной книге чисел стали различать отдельные слова. В простейшем случае — атома водорода — удалось разглядеть даже буквы, из которых они составлены. Однако смысл слов и происхождение букв по-прежнему оставались неизвестными: иероглифы спектральных линий еще не заговорили, хотя и не казались теперь столь загадочными. Стремление осмыслить структуру спектра и в самом деле напоминало попытки почти вслепую расшифровать незнакомый текст. Утомительная работа длилась больше четверти века, и отсутствие общей идеи отталкивало от нее глубокие умы. Необходимо было найти ключ к шифру.
Это сделал Нильс Бор в 1913 г.
 общая энергия морских волн. Но энергия волн равномерно распределена по всему побережью, и нужны века, чтобы мы увидели результаты их ежедневной работы. По сравнению с этой работой энергия снаряда ничтожна, зато она сосредоточена в малом объеме и выделяется мгновенно. Еели к тому же снаряд достаточно велик, он разрушит утес. Последнее важно: действительно, все свойства снаряда, кроме размеров, присущи и пуле, однако сокрушить скалу ей не под силу.
Примерно так рассуждал Эйнштейн, когда предложил свое объяснение явления фотоэффекта. Он знал об открытии и сомнениях Планка, но для Эйнштейна с его непредвзятой манерой мышления гипотеза о квантах света не казалась столь ужасной, как самому Планку. Поэтому он был первый, кто не только поверил в нее, но и применил для объяснения новых опытов. Эйнштейн утверждал: свет не только испускается квантами, как того требовала гипотеза Планка, но и распространяется так же — квантами. (Кстати, сам термин «квант» принадлежит ему же: Планк говорил об «элементах энергии»). Поэтому свет, падающий на поверхность металла, подобен не морским волнам, а артиллерийским снарядам. Причем каждый такой снаряд-квант (в 1926 г. Дж. Льюис назовет их фотонами) может выбить из атома только один электрон.
Согласно Планку, энергия кванта равна hv. По мысли Эйнштейна, какая-то часть ее (назовем ее Р) расходуется на то, чтобы вырвать электрон из атома, а остальная часть — на то, чтобы разогнать его до скорости у, то есть сообщить ему кинетическую энергию T = mv2/2. Оба эти утверждения можно коротко записать в виде простого уравнения
, п 1 ту2
ftv=p+—
Стоит принять эту гипотезу — и явление фотоэффекта проясняется. Действительно, пока снаряды малы (красный свет), они не могут выбить электрон из атома (ftv<P), как бы много мы их ни посылали. Если же мы начнем увеличивать их величину (то есть частоту излучения, фиолетовый свет), то в конце концов их энергия станет достаточной для выбивания электронов (/rv> Р). Но по-прежнему энергия каждого «снаряда-кванта» будет зависеть только от их величины (то есть от их частоты v), а не от их числа.
Шестнадцать лет спустя классическую простоту уравнения Эйнштейна Шведская академия наук отметит Нобелевской премией. Но в 1905 г., когда уравнение было написано впервые, на него ополчились все, даже Планк. Он высоко ценил Эйнштейна, искренне хотел ему помочь и потому, убеждая прусское министерство просвещения пригласить его на работу в Берлин, просил «не слишком сильно ставить ему в упрек» гипотезу относительно явлений фотоэффекта.
Планка можно понять: совсем недавно вопреки общепринятым традициям (и даже своему желанию) он ввел в физику квант действия h. Лишь постепенно пришло к нему осознание неизбежности этого шага. Даже в 1909 г. он признавался Эйнштейну: «Я еще плохо верю в реальность световых квант». Однако дело было сделано: «...Планк посадил в ухо физикам блоху»,— говорил Эйнштейн двадцать лет спустя, и она не давала им покоя, хотя они и пытались ее не замечать. Во всяком случае, Планк постарался ввести квант действия так, чтобы не пострадала волновая оптика — здание чрезвычайной красоты, созданное в течение двух столетий. Поэтому, согласно Планку, свет только испускается квантами, но распространяется по-прежнему, как волна: лишь в этом случае удавалось сохранить все результаты волновой оптики.
А Эйнштейн поступал так, как будто до него вообще не существовало физики, или по крайней мере как человек, ничего не знающий об истинной природе света. Здесь сказалась замечательная особенность Эйнштейна: в совершенстве владея логикой, он больше доверял интуиции и фактам, причем случайных фактов в физике для него не существовало. Поэтому в явлениях фотоэффекта он видел не досадное исключение из правил волновой оптики, а сигнал природы о существовании еще неизвестных, но глубоких законов. Так уж случилось, что исторически сначала были изучены волновые свойства света. Только в явлениях фотоэффекта физики впервые столкнулись с его корпускулярными свойствами. У большинства из них инерция мышления была настолько велика, что они отказались этому верить. «Не может быть!» — повторяли они подобно фермеру, впервые в жизни увидевшему жирафа.
Эйнштейн, конечно, знал историю оптики не хуже других. Но его независимый ум равнодушно относился к ее солидному авторитету. Все прежние заслуги оптики для него не имели значения, если они не могли объяснить единственный, но бесспорный опыт. Он глубоко, религиозно, верил в единство природы, и один такой опыт значил для него не меньше, чем вся история оптики. А его честность не позволила ему пройти мимо неугодного факта.
В науке по-настоящему опасны только неверные опыты: опытам принято верить. Но любую гипотезу — какой бы привлекательной она ни была — всегда тщательно проверяют. Даже если она окажется ложной, опыты, которые ее опровергли, часто приводят к результатам более ценным, чем сама гипотеза. Проверили и гипотезу Эйнштейна — она оказалась истинной.
В 1911 г. Милликен, экспериментально проверяя уравнение Эйнштейна, определил из него значение постоянной Планка h. Она совпала с тем значением, которое* получил Планк из теории теплового излучения. А вскоре поставили опыт, идея которого в точности аналогична картине разрушения утесов на берегу моря. И снова оказался прав Эйнштейн, а не признанный авторитет волновой оптики.
Конечно, Эйнштейн не отрицал, что волновая оптика все-таки существует. И не оспаривал опытов, доказавших волновую природу света. Просто он довел возникшее противоречие до логического конца и предоставил разрешать его следующему поколению физиков. В 1909 г., выступая в Зальцбурге на собрании Общества немецких естествоиспытателей, он высказывал надежду, что «следующая фаза развития теоретической физики даст нам теорию света, которая будет в каком-то смысле слиянием волновой теории с теорией истечения». Двадцать лет спустя его предвидение сбылось.
Несмотря на единодушные протесты современников, мысль о квантах света не погибла и вскоре дала могучие всходы. Это произошло в 1913 г., когда в лабораторию Резерфорда в Манчестере пришел застенчивый и неторопливый датчанин Нильс Бор.
общая энергия морских волн. Но энергия волн равномерно распределена по всему побережью, и нужны века, чтобы мы увидели результаты их ежедневной работы. По сравнению с этой работой энергия снаряда ничтожна, зато она сосредоточена в малом объеме и выделяется мгновенно. Еели к тому же снаряд достаточно велик, он разрушит утес. Последнее важно: действительно, все свойства снаряда, кроме размеров, присущи и пуле, однако сокрушить скалу ей не под силу.
Примерно так рассуждал Эйнштейн, когда предложил свое объяснение явления фотоэффекта. Он знал об открытии и сомнениях Планка, но для Эйнштейна с его непредвзятой манерой мышления гипотеза о квантах света не казалась столь ужасной, как самому Планку. Поэтому он был первый, кто не только поверил в нее, но и применил для объяснения новых опытов. Эйнштейн утверждал: свет не только испускается квантами, как того требовала гипотеза Планка, но и распространяется так же — квантами. (Кстати, сам термин «квант» принадлежит ему же: Планк говорил об «элементах энергии»). Поэтому свет, падающий на поверхность металла, подобен не морским волнам, а артиллерийским снарядам. Причем каждый такой снаряд-квант (в 1926 г. Дж. Льюис назовет их фотонами) может выбить из атома только один электрон.
Согласно Планку, энергия кванта равна hv. По мысли Эйнштейна, какая-то часть ее (назовем ее Р) расходуется на то, чтобы вырвать электрон из атома, а остальная часть — на то, чтобы разогнать его до скорости у, то есть сообщить ему кинетическую энергию T = mv2/2. Оба эти утверждения можно коротко записать в виде простого уравнения
, п 1 ту2
ftv=p+—
Стоит принять эту гипотезу — и явление фотоэффекта проясняется. Действительно, пока снаряды малы (красный свет), они не могут выбить электрон из атома (ftv<P), как бы много мы их ни посылали. Если же мы начнем увеличивать их величину (то есть частоту излучения, фиолетовый свет), то в конце концов их энергия станет достаточной для выбивания электронов (/rv> Р). Но по-прежнему энергия каждого «снаряда-кванта» будет зависеть только от их величины (то есть от их частоты v), а не от их числа.
Шестнадцать лет спустя классическую простоту уравнения Эйнштейна Шведская академия наук отметит Нобелевской премией. Но в 1905 г., когда уравнение было написано впервые, на него ополчились все, даже Планк. Он высоко ценил Эйнштейна, искренне хотел ему помочь и потому, убеждая прусское министерство просвещения пригласить его на работу в Берлин, просил «не слишком сильно ставить ему в упрек» гипотезу относительно явлений фотоэффекта.
Планка можно понять: совсем недавно вопреки общепринятым традициям (и даже своему желанию) он ввел в физику квант действия h. Лишь постепенно пришло к нему осознание неизбежности этого шага. Даже в 1909 г. он признавался Эйнштейну: «Я еще плохо верю в реальность световых квант». Однако дело было сделано: «...Планк посадил в ухо физикам блоху»,— говорил Эйнштейн двадцать лет спустя, и она не давала им покоя, хотя они и пытались ее не замечать. Во всяком случае, Планк постарался ввести квант действия так, чтобы не пострадала волновая оптика — здание чрезвычайной красоты, созданное в течение двух столетий. Поэтому, согласно Планку, свет только испускается квантами, но распространяется по-прежнему, как волна: лишь в этом случае удавалось сохранить все результаты волновой оптики.
А Эйнштейн поступал так, как будто до него вообще не существовало физики, или по крайней мере как человек, ничего не знающий об истинной природе света. Здесь сказалась замечательная особенность Эйнштейна: в совершенстве владея логикой, он больше доверял интуиции и фактам, причем случайных фактов в физике для него не существовало. Поэтому в явлениях фотоэффекта он видел не досадное исключение из правил волновой оптики, а сигнал природы о существовании еще неизвестных, но глубоких законов. Так уж случилось, что исторически сначала были изучены волновые свойства света. Только в явлениях фотоэффекта физики впервые столкнулись с его корпускулярными свойствами. У большинства из них инерция мышления была настолько велика, что они отказались этому верить. «Не может быть!» — повторяли они подобно фермеру, впервые в жизни увидевшему жирафа.
Эйнштейн, конечно, знал историю оптики не хуже других. Но его независимый ум равнодушно относился к ее солидному авторитету. Все прежние заслуги оптики для него не имели значения, если они не могли объяснить единственный, но бесспорный опыт. Он глубоко, религиозно, верил в единство природы, и один такой опыт значил для него не меньше, чем вся история оптики. А его честность не позволила ему пройти мимо неугодного факта.
В науке по-настоящему опасны только неверные опыты: опытам принято верить. Но любую гипотезу — какой бы привлекательной она ни была — всегда тщательно проверяют. Даже если она окажется ложной, опыты, которые ее опровергли, часто приводят к результатам более ценным, чем сама гипотеза. Проверили и гипотезу Эйнштейна — она оказалась истинной.
В 1911 г. Милликен, экспериментально проверяя уравнение Эйнштейна, определил из него значение постоянной Планка h. Она совпала с тем значением, которое* получил Планк из теории теплового излучения. А вскоре поставили опыт, идея которого в точности аналогична картине разрушения утесов на берегу моря. И снова оказался прав Эйнштейн, а не признанный авторитет волновой оптики.
Конечно, Эйнштейн не отрицал, что волновая оптика все-таки существует. И не оспаривал опытов, доказавших волновую природу света. Просто он довел возникшее противоречие до логического конца и предоставил разрешать его следующему поколению физиков. В 1909 г., выступая в Зальцбурге на собрании Общества немецких естествоиспытателей, он высказывал надежду, что «следующая фаза развития теоретической физики даст нам теорию света, которая будет в каком-то смысле слиянием волновой теории с теорией истечения». Двадцать лет спустя его предвидение сбылось.
Несмотря на единодушные протесты современников, мысль о квантах света не погибла и вскоре дала могучие всходы. Это произошло в 1913 г., когда в лабораторию Резерфорда в Манчестере пришел застенчивый и неторопливый датчанин Нильс Бор.
 Но ведь это и есть та самая постоянная Лошмидта, которую он вычислил на основании молекулярно-кинетической гипотезы! Действительно, один моль гелия (как и любого одноатомного газа при 0 °C и атмосферном давлении) занимает объем 22,4 л и содержит 6,02 • 1023 атомов, то есть
6,02-Ю23моль
см
-з
22,4 • 103 см3/моль
Совпадение убедительное.
К 1912 г. насчитывалось уже более десяти способов определения постоянной Авогадро и от ее значения зависело объяснение многочисленных и на первый взгляд не связанных между собой явлений, таких, как броуновское движение и голубой цвет неба, вязкость газов и спектр абсолютно черного тела, радиоактивность и законы электролиза. Число Na оказалось очень большим, и, чтобы продемонстрировать его огромность, лорд Кельвин предлагал провести мысленный эксперимент: стакан воды с каким-то образом помеченными атомами вылить в океан и, хорошо перемешав его, вновь зачерпнуть воды из океана на другом краю Земли — в стакане окажется 200 меченых молекул воды (в действительности еще больше: около тысячи). Как и количество людей на Земле, число Авогадро не может быть дробным. Более того, это число мы знаем сейчас значительно точнее, чем численность жителей Земли: МА = 6,022136 • 1023.
«Если бы в результате какой-то мировой катастрофы все накопленные научные знания вдруг оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза (можете называть ее не гипотезой, а фактом — это ничего не меняет): все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому.
В одной этой фразе содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
Эти слова принадлежат Ричарду Фейнману, нашему современнику, лауреату Нобелевской премии 1965 г. И хотя они почти дословно повторяют Демокрита, понятия и образы, которые мы с этими словами связываем теперь, совсем другие: за 25 столетий об атоме узнали много нового. Это было непросто — просты только результаты науки.
Но ведь это и есть та самая постоянная Лошмидта, которую он вычислил на основании молекулярно-кинетической гипотезы! Действительно, один моль гелия (как и любого одноатомного газа при 0 °C и атмосферном давлении) занимает объем 22,4 л и содержит 6,02 • 1023 атомов, то есть
6,02-Ю23моль
см
-з
22,4 • 103 см3/моль
Совпадение убедительное.
К 1912 г. насчитывалось уже более десяти способов определения постоянной Авогадро и от ее значения зависело объяснение многочисленных и на первый взгляд не связанных между собой явлений, таких, как броуновское движение и голубой цвет неба, вязкость газов и спектр абсолютно черного тела, радиоактивность и законы электролиза. Число Na оказалось очень большим, и, чтобы продемонстрировать его огромность, лорд Кельвин предлагал провести мысленный эксперимент: стакан воды с каким-то образом помеченными атомами вылить в океан и, хорошо перемешав его, вновь зачерпнуть воды из океана на другом краю Земли — в стакане окажется 200 меченых молекул воды (в действительности еще больше: около тысячи). Как и количество людей на Земле, число Авогадро не может быть дробным. Более того, это число мы знаем сейчас значительно точнее, чем численность жителей Земли: МА = 6,022136 • 1023.
«Если бы в результате какой-то мировой катастрофы все накопленные научные знания вдруг оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза (можете называть ее не гипотезой, а фактом — это ничего не меняет): все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому.
В одной этой фразе содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
Эти слова принадлежат Ричарду Фейнману, нашему современнику, лауреату Нобелевской премии 1965 г. И хотя они почти дословно повторяют Демокрита, понятия и образы, которые мы с этими словами связываем теперь, совсем другие: за 25 столетий об атоме узнали много нового. Это было непросто — просты только результаты науки.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА

 ливала понятие «электрон». Квант действия /г, даже после работ Эйнштейна и Милликена, в Европе мало кто принимал всерьез, хотя отдельные попытки использовать его были. В 1910 г. Артур Эрих Гааз (1884—1941) обратился к соотношению Планка E = hv при установлении границ и периодов движения электронов в атоме Томсона; в 1912 г. Джон Николь-сон (1881—1955) хотел приспособить идею квантов для анализа спектров Солнца и туманностей, а Вальтер Фридрих Герман Нернст (1864—1941) применил ее для квантования молекулярных вращений.
Скептическое отношение к идее квантов лучше всего выразил сам Планк в докладе, который он прочел в Немецком химическом обществе 16 декабря 1911 г.— почти точно через одиннадцать лет после своего знаменитого сообщения: «Самым простым, так сказать, самым наивным объяснением было бы приписать атомистическую структуру самой энергии... Это последнее предположение делал раньше и я сам, но
теперь я отказался от него, так как нахожу его слишком радикальным...» В книге, которую он написал год спустя, Планк повторяет те же мысли: «Когда подумаешь о полном экспериментальном подтверждении, которое получила электродинамика Максвелла в самых тонких явлениях интерференции, когда подумаешь о невероятных трудностях, которые повлек бы за собой отказ от нее для всей теории электрических и магнитных явлений, то испытываешь какое-то отвращение, когда сразу же разрушаешь эти основы. По этой причине во всем дальнейшем изложении мы оставим в стороне гипотезу квантов света, тем более что ее развитие находится еще в зачаточном состоянии».
ливала понятие «электрон». Квант действия /г, даже после работ Эйнштейна и Милликена, в Европе мало кто принимал всерьез, хотя отдельные попытки использовать его были. В 1910 г. Артур Эрих Гааз (1884—1941) обратился к соотношению Планка E = hv при установлении границ и периодов движения электронов в атоме Томсона; в 1912 г. Джон Николь-сон (1881—1955) хотел приспособить идею квантов для анализа спектров Солнца и туманностей, а Вальтер Фридрих Герман Нернст (1864—1941) применил ее для квантования молекулярных вращений.
Скептическое отношение к идее квантов лучше всего выразил сам Планк в докладе, который он прочел в Немецком химическом обществе 16 декабря 1911 г.— почти точно через одиннадцать лет после своего знаменитого сообщения: «Самым простым, так сказать, самым наивным объяснением было бы приписать атомистическую структуру самой энергии... Это последнее предположение делал раньше и я сам, но
теперь я отказался от него, так как нахожу его слишком радикальным...» В книге, которую он написал год спустя, Планк повторяет те же мысли: «Когда подумаешь о полном экспериментальном подтверждении, которое получила электродинамика Максвелла в самых тонких явлениях интерференции, когда подумаешь о невероятных трудностях, которые повлек бы за собой отказ от нее для всей теории электрических и магнитных явлений, то испытываешь какое-то отвращение, когда сразу же разрушаешь эти основы. По этой причине во всем дальнейшем изложении мы оставим в стороне гипотезу квантов света, тем более что ее развитие находится еще в зачаточном состоянии».
 mvr — nh,
где п — целое число: л = 1, 2, 3, ... Это и есть то дополнительное условие Бора, которое выделяет стационарные орбиты (единственно допустимые в атоме) из бесконечного числа всех мыслимых. А поскольку при таком выделении основную роль играет квант действия /г, то и весь подход назвали квантованием.
Из этих двух условий, используя только правила алгебры, можно через массу электрона т, его заряд е и постоянную Планка h выразить радиус орбиты электрона г, его скорость v и полную энергию на орбите
mvr — nh,
где п — целое число: л = 1, 2, 3, ... Это и есть то дополнительное условие Бора, которое выделяет стационарные орбиты (единственно допустимые в атоме) из бесконечного числа всех мыслимых. А поскольку при таком выделении основную роль играет квант действия /г, то и весь подход назвали квантованием.
Из этих двух условий, используя только правила алгебры, можно через массу электрона т, его заряд е и постоянную Планка h выразить радиус орбиты электрона г, его скорость v и полную энергию на орбите
 равную сумме кинетической энергии электрона и потенциальной энергии кулоновского притяжения электрона к ядру. Эти значения зависят от номера орбиты п следующим образом:
ft2 2 в2 1 me4 1,
'•=Т7 £-=^7-
Таким образом, стационарные орбиты (а следовательно, и уровни энергии) нумеруются целыми числами п, которые пробегают бесконечный ряд значений: п=1, 2, 3, ...
Очень важно и чрезвычайно существенно то, что никакие другие, промежуточные значения энергии, кроме набора энергий Еп, пронумерованных целым числом п, в атоме невозможны. Это отсутствие непрерывности практически всех характеристик движения электрона в атоме — его энергии, скорости, орбитального момента — наиболее характерная черта квантовой теории, которая почему-то наиболее трудно воспринимается.
При переходе с уровня k на уровень п электрон излучает энергию AE = Ek—En, а частота излучения, которое при этом возникает, определяется по формуле Эйнштейна:
ЬЕ ЬЕ
v=---—---.
h
7t
равную сумме кинетической энергии электрона и потенциальной энергии кулоновского притяжения электрона к ядру. Эти значения зависят от номера орбиты п следующим образом:
ft2 2 в2 1 me4 1,
'•=Т7 £-=^7-
Таким образом, стационарные орбиты (а следовательно, и уровни энергии) нумеруются целыми числами п, которые пробегают бесконечный ряд значений: п=1, 2, 3, ...
Очень важно и чрезвычайно существенно то, что никакие другие, промежуточные значения энергии, кроме набора энергий Еп, пронумерованных целым числом п, в атоме невозможны. Это отсутствие непрерывности практически всех характеристик движения электрона в атоме — его энергии, скорости, орбитального момента — наиболее характерная черта квантовой теории, которая почему-то наиболее трудно воспринимается.
При переходе с уровня k на уровень п электрон излучает энергию AE = Ek—En, а частота излучения, которое при этом возникает, определяется по формуле Эйнштейна:
ЬЕ ЬЕ
v=---—---.
h
7t
 Отсюда сразу же следует знаменитая формула Бора для частоты излучения атома водорода:
_ те4 / 1 1 \
Если мы наблюдаем излучение, которое возникает при переходах электрона со всевозможных уровней k на какой-то определенный уровень п, то увидим не просто набор спектральных линий, а серию. Например, при переходах с уровней £ = 3, 4, 5, ... на уровень п = 2 воспроизводится серия Бальмера.
Формула, полученная Бором, очень напоминает формулу Ридберга для атома водорода, которую тот нашел эмпирически задолго до Бора и о которой мы подробно рассказали в предыдущей главе:
Сравнивая эти две формулы, можно найти значение R для атома водорода с бесконечной массой ядра:
=-^_ = 109 737,315 см-1.
И действительно, ее значение совпало с тем, которое было давно известно из спектроскопических измерений.
Это был первый успех теории Бора, и он произвел впечатление чуда. Но это еще не все. Из теории Бора следовало, что у атома водорода в основном, невозбужденном состоянии (п = 1) радиус
г, = -^- = 0,53- 10~8см = 0,53 А.
те
Это означает, что размеры атомов (10“8 см), вычисленные по его формуле, совпадали с предсказаниями кинетической теории материи.
И, наконец, теория Бора объяснила, как свойства линейчатого спектра связаны с внутренним строением атома. Интуитивно эту связь чувствовали всегда. Но только Бору впервые удалось выразить ее количественно. Оказалось, что эту связь осуществляет постоянная Планка h.
Это было неожиданно. Действительно, квант действия возник в теории теплового излучения и никаким очевидным образом не был связан ни с атомами, ни с лучами, которые эти атомы испускают. И тем не менее именно он позволил вычислить абсолютные размеры атома и предсказать частоту света, излучаемого им. Угадать эту связь Бору, как и многим до него, помогла глубокая вера в единство природы.
Постулаты Бора (как и всякие постулаты) нельзя обосновывать логически или вывести из более простых. Они остаются произвольными творениями человеческого разума до тех пор, пока опыт не подтвердит следствий, которые из них вытекают. Тогда на их основе развиваются теории, наиболее удачные из которых называют законами природы.
Мы ограничимся только упомянутыми тремя следствиями теории Бора — на самом деле их значительно больше, и все они демонстрируют несомненную силу непонятных постулатов. Конечно, Бор пришел к ним несколько иначе, чем мы сейчас: когда человек впервые поднимается на незнакомую вершину, трудно надеяться, что он придет на нее самым простым путем. Только поднявшись на вершину, он сможет увидеть кратчайшую тропу к ней.
Отсюда сразу же следует знаменитая формула Бора для частоты излучения атома водорода:
_ те4 / 1 1 \
Если мы наблюдаем излучение, которое возникает при переходах электрона со всевозможных уровней k на какой-то определенный уровень п, то увидим не просто набор спектральных линий, а серию. Например, при переходах с уровней £ = 3, 4, 5, ... на уровень п = 2 воспроизводится серия Бальмера.
Формула, полученная Бором, очень напоминает формулу Ридберга для атома водорода, которую тот нашел эмпирически задолго до Бора и о которой мы подробно рассказали в предыдущей главе:
Сравнивая эти две формулы, можно найти значение R для атома водорода с бесконечной массой ядра:
=-^_ = 109 737,315 см-1.
И действительно, ее значение совпало с тем, которое было давно известно из спектроскопических измерений.
Это был первый успех теории Бора, и он произвел впечатление чуда. Но это еще не все. Из теории Бора следовало, что у атома водорода в основном, невозбужденном состоянии (п = 1) радиус
г, = -^- = 0,53- 10~8см = 0,53 А.
те
Это означает, что размеры атомов (10“8 см), вычисленные по его формуле, совпадали с предсказаниями кинетической теории материи.
И, наконец, теория Бора объяснила, как свойства линейчатого спектра связаны с внутренним строением атома. Интуитивно эту связь чувствовали всегда. Но только Бору впервые удалось выразить ее количественно. Оказалось, что эту связь осуществляет постоянная Планка h.
Это было неожиданно. Действительно, квант действия возник в теории теплового излучения и никаким очевидным образом не был связан ни с атомами, ни с лучами, которые эти атомы испускают. И тем не менее именно он позволил вычислить абсолютные размеры атома и предсказать частоту света, излучаемого им. Угадать эту связь Бору, как и многим до него, помогла глубокая вера в единство природы.
Постулаты Бора (как и всякие постулаты) нельзя обосновывать логически или вывести из более простых. Они остаются произвольными творениями человеческого разума до тех пор, пока опыт не подтвердит следствий, которые из них вытекают. Тогда на их основе развиваются теории, наиболее удачные из которых называют законами природы.
Мы ограничимся только упомянутыми тремя следствиями теории Бора — на самом деле их значительно больше, и все они демонстрируют несомненную силу непонятных постулатов. Конечно, Бор пришел к ним несколько иначе, чем мы сейчас: когда человек впервые поднимается на незнакомую вершину, трудно надеяться, что он придет на нее самым простым путем. Только поднявшись на вершину, он сможет увидеть кратчайшую тропу к ней.
 «Пространственное квантование кеплеровских орбит является одним из самых неожиданных следствий квантовой теории. По простоте вывода и результатов оно похоже на волшебство»,— писал Зоммерфельд в 1916 г. (тогда же он ввел термин квантовое число, вместо правил целочисленности Бора).
Но даже два квантовых числа п и I не объяснили всех особенностей спектров. Например, если поместить излучающий атом в магнитное поле, то спектральные линии расщепляются совсем по-другому. Явление расщепления открыл Питер Зееман (1865—1943) еще в 1896 г. Теперь его стали толковать следующим образом: электрон, движущийся по замкнутой орбите, подобен витку в обмотке электромотора и, подобно этому витку, в магнитном поле орбита электрона поворачивается. Однако, в отличие от витка, она может занимать в атоме не любые положения, а лишь строго определенные. Эти допустимые положения орбит в атоме задает магнитное квантовое число т, которое (снова в духе идей Бора!) может принимать только целые значения
т=— I, — (/—1), .... —1, 0, 1, — 1), I — всего, как легко видеть, 2/-J-1 значений. А это означает, что в магнитном поле каждый уровень с заданными значе* ниями пи/ расщепится еще на 2/ +1 подуровня, каждый из которых однозначно определяется заданием трех целых квантовых чисел: п, I и tn.
Усложняясь, теория Бора постепенно теряла свое первоначальное изящество и наглядность. На ее место пришла формальная модель атома, от которой требовалось лишь одно: дать правильную систематику спектров и термов. Термин «квантование» постепенно потерял свой прежний смысл: им обозначили теперь формальный способ сопоставления целых (квантовых) чисел n, I и m каждому уровню энергии в атоме, а точнее — тому типу движения, в котором находится электрон. Квантовые числа п, I и m определяют стационарные орбиты в атоме. Внешние поля (электрическое и магнитное) влияют на движение электрона в атоме (расщепление уровней энергии), а это сразу же сказывается на структуре светового сигнала, который испускает атом (расщепление спектральных линий).
«Пространственное квантование кеплеровских орбит является одним из самых неожиданных следствий квантовой теории. По простоте вывода и результатов оно похоже на волшебство»,— писал Зоммерфельд в 1916 г. (тогда же он ввел термин квантовое число, вместо правил целочисленности Бора).
Но даже два квантовых числа п и I не объяснили всех особенностей спектров. Например, если поместить излучающий атом в магнитное поле, то спектральные линии расщепляются совсем по-другому. Явление расщепления открыл Питер Зееман (1865—1943) еще в 1896 г. Теперь его стали толковать следующим образом: электрон, движущийся по замкнутой орбите, подобен витку в обмотке электромотора и, подобно этому витку, в магнитном поле орбита электрона поворачивается. Однако, в отличие от витка, она может занимать в атоме не любые положения, а лишь строго определенные. Эти допустимые положения орбит в атоме задает магнитное квантовое число т, которое (снова в духе идей Бора!) может принимать только целые значения
т=— I, — (/—1), .... —1, 0, 1, — 1), I — всего, как легко видеть, 2/-J-1 значений. А это означает, что в магнитном поле каждый уровень с заданными значе* ниями пи/ расщепится еще на 2/ +1 подуровня, каждый из которых однозначно определяется заданием трех целых квантовых чисел: п, I и tn.
Усложняясь, теория Бора постепенно теряла свое первоначальное изящество и наглядность. На ее место пришла формальная модель атома, от которой требовалось лишь одно: дать правильную систематику спектров и термов. Термин «квантование» постепенно потерял свой прежний смысл: им обозначили теперь формальный способ сопоставления целых (квантовых) чисел n, I и m каждому уровню энергии в атоме, а точнее — тому типу движения, в котором находится электрон. Квантовые числа п, I и m определяют стационарные орбиты в атоме. Внешние поля (электрическое и магнитное) влияют на движение электрона в атоме (расщепление уровней энергии), а это сразу же сказывается на структуре светового сигнала, который испускает атом (расщепление спектральных линий).



 В невозбужденном атоме натрия электрон находится в состоянии 3s. А темная D-линия возникает в том случае, если при возбуждении атома электрон переходит в состояние Зр. При обратном переходе 3p->3s он излучает энергию и возникает ярко-желтая D-линия.
А что произойдет, если излучающий натрий поместить в магнитное поле? Вначале, следуя Зоммерфельду, предполагали, что при этом верхний уровень Зр должен расщепиться на 3 компоненты 2/ + 1 = 2-1 + 1 =3, а нижний останется без изменения. В итоге каждая из D\ и D2^hhhA должна расщепиться на 3 компоненты.
Опыт противоречит такому заключению: в действительности Di-линия расщепляется на 4 компоненты, a D2^hhhh — на 6. Это явление — частный случай так называемого аномального эффекта Зеемана. Чтобы понять его причину, необходимо немного возвратиться назад и уяснить себе вопрос, которого мы раньше сознательно избегали: почему даже без магнитного поля D-линия натрия состоит из двух тесно расположенных компонент D\ и D2?
Мучительно размышляя над этим вопросом, ученик Зом-мерфельда Вольфганг Паули (1900—1958) пришел в 1924 г. к открытию спина электрона. Он рассуждал примерно так: обе Di- и D2- линии соответствуют одному и тому же переходу с уровня п = 3, I = 1 на уровень п = 3, I = 0. Но их все-таки две! Значит, существует не один, а два верхних уровня Зр и еще какое-то дополнительное квантовое число, их различающее. Свойство, которому соответствует это четвертое квантовое число s, он назвал «неклассической двузначностью электрона» и предположил, что оно может принимать только два значения: +1/2 и —1/2. Паули считал, что наглядное представление этого свойства невозможно.
Но уже в следующем году Джордж Юджин Уленбек (р. 1900 г.) и Сэмюэл Абрахам Гаудсмит (1902—1978) придумали наглядную модель для объяснения этого свойства электрона, предположив, что он вращается вокруг своей оси. Такая модель прямо следовала из аналогии между атомом и Солнечной системой: ведь Земля вращается не только по эллипсу вокруг Солнца, но еще и вокруг своей оси (эту аналогию отмечал Комптон уже в 1921 г., но Паули резко против нее восстал).
Уленбек и Гаудсмит утверждали: кроме орбитального момента I электрону присущ внутренний момент враще-
+ 1/2
В невозбужденном атоме натрия электрон находится в состоянии 3s. А темная D-линия возникает в том случае, если при возбуждении атома электрон переходит в состояние Зр. При обратном переходе 3p->3s он излучает энергию и возникает ярко-желтая D-линия.
А что произойдет, если излучающий натрий поместить в магнитное поле? Вначале, следуя Зоммерфельду, предполагали, что при этом верхний уровень Зр должен расщепиться на 3 компоненты 2/ + 1 = 2-1 + 1 =3, а нижний останется без изменения. В итоге каждая из D\ и D2^hhhA должна расщепиться на 3 компоненты.
Опыт противоречит такому заключению: в действительности Di-линия расщепляется на 4 компоненты, a D2^hhhh — на 6. Это явление — частный случай так называемого аномального эффекта Зеемана. Чтобы понять его причину, необходимо немного возвратиться назад и уяснить себе вопрос, которого мы раньше сознательно избегали: почему даже без магнитного поля D-линия натрия состоит из двух тесно расположенных компонент D\ и D2?
Мучительно размышляя над этим вопросом, ученик Зом-мерфельда Вольфганг Паули (1900—1958) пришел в 1924 г. к открытию спина электрона. Он рассуждал примерно так: обе Di- и D2- линии соответствуют одному и тому же переходу с уровня п = 3, I = 1 на уровень п = 3, I = 0. Но их все-таки две! Значит, существует не один, а два верхних уровня Зр и еще какое-то дополнительное квантовое число, их различающее. Свойство, которому соответствует это четвертое квантовое число s, он назвал «неклассической двузначностью электрона» и предположил, что оно может принимать только два значения: +1/2 и —1/2. Паули считал, что наглядное представление этого свойства невозможно.
Но уже в следующем году Джордж Юджин Уленбек (р. 1900 г.) и Сэмюэл Абрахам Гаудсмит (1902—1978) придумали наглядную модель для объяснения этого свойства электрона, предположив, что он вращается вокруг своей оси. Такая модель прямо следовала из аналогии между атомом и Солнечной системой: ведь Земля вращается не только по эллипсу вокруг Солнца, но еще и вокруг своей оси (эту аналогию отмечал Комптон уже в 1921 г., но Паули резко против нее восстал).
Уленбек и Гаудсмит утверждали: кроме орбитального момента I электрону присущ внутренний момент враще-
+ 1/2

 и 3$i/2 расщепится еще на 2 подуровня, а уровень Зрз/2 — на 4. В результате возникает та схема уровней и переходов между ними, которая изображена на рисунке.
Из рисунка видно, как постепенно усложнялась первоначальная модель Бора, в которой существовал только один уровень сп=3. Когда приняли во внимание теорию относительности, он расщепился на два: 3р(п=3, /=1) и 3s (п = 3, 1 = 0). С учетом спина электрона уровень Зр расщепляется еще на 2 подуровня: 3pi/2 (п = 3, / = 1, / = 1/2) и Зрз/2 (п = 3, /= 1, j = 3/2). И, наконец, в магнитном поле мы получим систему уровней и переходов между ними, которая объясняет картину спектральных линий, наблюдаемую на опыте.
Гипотеза о спине электрона — одна из самых глубоких в физике, и вполне осмыслить ее значение не удалось до сих пор. Паули был, конечно, прав, предостерегая от прямолинейных попыток представлять электрон как вращающийся волчок. И дело даже не в том, что в этом случае скорость вращения на «экваторе» электрона должна превышать скорость света. (На это обстоятельство сразу же обратил внимание Лоренц, когда ему принесли на отзыв рукопись статьи Уленбека и Гаудсмита.) Дело в том, что влияние спина на физические процессы в атоме и на его строение проявляются иногда самым неожиданным образом. Одна из таких особенностей спина составляет содержание знаменитого принципа запрета Паули: в атоме не может быть двух электронов с одинаковыми квантовыми числами п, I, m, s. В дальнейшем мы увидим, что только этот принцип позволил найти рациональную основу периодической системы элементов Менделеева и объяснить суть периодического закона.
Даже по стилю изложения вы, наверное, сейчас заметили, насколько формальная модель атома беднее образами по сравнению с первоначальной моделью Бора, насколько труднее рассказать о ней привычными словами и представить наглядно без привлечения хотя бы простейших формул. И тем не менее вы, вероятно, ощутили ее силу: с ее помощью можно объяснить и предсказать довольно тонкие особенности спектров. Она помогла привести в относительный порядок то устрашающее количество спектральных линий, которое было накоплено за полвека. Теперь, чтобы однозначно определить любую линию в спектре атома, достаточно было задать 8 квантовых чисел: 4 для исходного уровня излучающего электрона (п<, Д-, si} и 4 для конечного (я*, Ik, Sk). К 1925 г. эта героическая работа была закончена. Иероглифы были расшифрованы, что позволило нарисовать первую и пока еще грубую картину внутреннего строения атома.
Конечно, расшифровать спектр какого-либо элемента — задача даже сегодня не особенно легкая, и вполне квалифицированно сделать это могут только специалисты; в конце концов научиться читать даже расшифрованные иероглифы не так уж просто, и к тому же не обязательно уметь это делать всем. Но поскольку ключ к шифру известен, то усвоить его может любой. И теперь уже никого не устрашают длинные таблицы спектральных линий, как не пугают зоологов и ботаников миллионы видов растений и животных: после трудов Линнея, Ламарка и Дарвина все они подчинены строгой систематике.
Со спектральными линиями произошло то же самое, что и с настоящими, египетскими иероглифами: пока их не прочли, ими занимались только египтологи, остальные интересовались этим лишь издали. Но когда иероглифы и спектры расшифровали, одним удалось прочесть историю целого народа, другим — узнать устройство атома. А это уже интересно всем.
Несмотря на все успехи формальной модели атома, она уже не удовлетворяла тому критерию логической простоты, которая производит впечатление очевидности (и которой так выгодно отличалась исходная модель Бора). Она стала слишком сложна, что вызывало недоверие к ней и некоторое чувство усталости, очень похожее на то, какое владело физиками до схемы Бора. К тому же все попытки распространить модель Бора на более сложные атомы кончались неудачей. Это приводило к тому, что физики стали подвергать сомнению все: справедливость закона Кулона, применимость электродинамики и механики в атомных системах и даже закон сохранения энергии. Все в общем понимали, что кризис этот возникает от формального соединения эмпирических данных с принципами теории квантов и остатками классических представлений, отказаться от которых пока было нельзя, поскольку взамен их не было предложено ничего определенного. Поэтому при изучении квантовых явлений исследователи продолжали пользоваться представлениями классической физики. Но у атомных объектов не было свойств, которые бы этим понятиям соответствовали, и потому природе задавали, в сущности, незаконные вопросы. Или — точнее — вопросы на языке, которого она не понимала. Тогда начались поиски общего принципа, из которого бы логически следовали и формальная модель атома, и другие особенности атомных объектов. «Пусть вначале этот единый принцип будет непонятным, но пусть он будет один» — таково было общее желание.
В ответ на это стремление в 1925 г. возникла квантовая механика — наука о движении электронов в атоме. Ее создало новое поколение физиков. По игре случая все они родились почти одновременно: Вернер Гейзенберг — в 1901 г., Поль Адриен Морис Дирак — в 1902 г., Вольфганг Паули — в 1900 г. Немного старше их были Луи де Бройль (1892 г.) и Эрвин Шрёдингер (1887 г.). Им выпало счастье записать образы и понятия атомной механики на языке формул.
и 3$i/2 расщепится еще на 2 подуровня, а уровень Зрз/2 — на 4. В результате возникает та схема уровней и переходов между ними, которая изображена на рисунке.
Из рисунка видно, как постепенно усложнялась первоначальная модель Бора, в которой существовал только один уровень сп=3. Когда приняли во внимание теорию относительности, он расщепился на два: 3р(п=3, /=1) и 3s (п = 3, 1 = 0). С учетом спина электрона уровень Зр расщепляется еще на 2 подуровня: 3pi/2 (п = 3, / = 1, / = 1/2) и Зрз/2 (п = 3, /= 1, j = 3/2). И, наконец, в магнитном поле мы получим систему уровней и переходов между ними, которая объясняет картину спектральных линий, наблюдаемую на опыте.
Гипотеза о спине электрона — одна из самых глубоких в физике, и вполне осмыслить ее значение не удалось до сих пор. Паули был, конечно, прав, предостерегая от прямолинейных попыток представлять электрон как вращающийся волчок. И дело даже не в том, что в этом случае скорость вращения на «экваторе» электрона должна превышать скорость света. (На это обстоятельство сразу же обратил внимание Лоренц, когда ему принесли на отзыв рукопись статьи Уленбека и Гаудсмита.) Дело в том, что влияние спина на физические процессы в атоме и на его строение проявляются иногда самым неожиданным образом. Одна из таких особенностей спина составляет содержание знаменитого принципа запрета Паули: в атоме не может быть двух электронов с одинаковыми квантовыми числами п, I, m, s. В дальнейшем мы увидим, что только этот принцип позволил найти рациональную основу периодической системы элементов Менделеева и объяснить суть периодического закона.
Даже по стилю изложения вы, наверное, сейчас заметили, насколько формальная модель атома беднее образами по сравнению с первоначальной моделью Бора, насколько труднее рассказать о ней привычными словами и представить наглядно без привлечения хотя бы простейших формул. И тем не менее вы, вероятно, ощутили ее силу: с ее помощью можно объяснить и предсказать довольно тонкие особенности спектров. Она помогла привести в относительный порядок то устрашающее количество спектральных линий, которое было накоплено за полвека. Теперь, чтобы однозначно определить любую линию в спектре атома, достаточно было задать 8 квантовых чисел: 4 для исходного уровня излучающего электрона (п<, Д-, si} и 4 для конечного (я*, Ik, Sk). К 1925 г. эта героическая работа была закончена. Иероглифы были расшифрованы, что позволило нарисовать первую и пока еще грубую картину внутреннего строения атома.
Конечно, расшифровать спектр какого-либо элемента — задача даже сегодня не особенно легкая, и вполне квалифицированно сделать это могут только специалисты; в конце концов научиться читать даже расшифрованные иероглифы не так уж просто, и к тому же не обязательно уметь это делать всем. Но поскольку ключ к шифру известен, то усвоить его может любой. И теперь уже никого не устрашают длинные таблицы спектральных линий, как не пугают зоологов и ботаников миллионы видов растений и животных: после трудов Линнея, Ламарка и Дарвина все они подчинены строгой систематике.
Со спектральными линиями произошло то же самое, что и с настоящими, египетскими иероглифами: пока их не прочли, ими занимались только египтологи, остальные интересовались этим лишь издали. Но когда иероглифы и спектры расшифровали, одним удалось прочесть историю целого народа, другим — узнать устройство атома. А это уже интересно всем.
Несмотря на все успехи формальной модели атома, она уже не удовлетворяла тому критерию логической простоты, которая производит впечатление очевидности (и которой так выгодно отличалась исходная модель Бора). Она стала слишком сложна, что вызывало недоверие к ней и некоторое чувство усталости, очень похожее на то, какое владело физиками до схемы Бора. К тому же все попытки распространить модель Бора на более сложные атомы кончались неудачей. Это приводило к тому, что физики стали подвергать сомнению все: справедливость закона Кулона, применимость электродинамики и механики в атомных системах и даже закон сохранения энергии. Все в общем понимали, что кризис этот возникает от формального соединения эмпирических данных с принципами теории квантов и остатками классических представлений, отказаться от которых пока было нельзя, поскольку взамен их не было предложено ничего определенного. Поэтому при изучении квантовых явлений исследователи продолжали пользоваться представлениями классической физики. Но у атомных объектов не было свойств, которые бы этим понятиям соответствовали, и потому природе задавали, в сущности, незаконные вопросы. Или — точнее — вопросы на языке, которого она не понимала. Тогда начались поиски общего принципа, из которого бы логически следовали и формальная модель атома, и другие особенности атомных объектов. «Пусть вначале этот единый принцип будет непонятным, но пусть он будет один» — таково было общее желание.
В ответ на это стремление в 1925 г. возникла квантовая механика — наука о движении электронов в атоме. Ее создало новое поколение физиков. По игре случая все они родились почти одновременно: Вернер Гейзенберг — в 1901 г., Поль Адриен Морис Дирак — в 1902 г., Вольфганг Паули — в 1900 г. Немного старше их были Луи де Бройль (1892 г.) и Эрвин Шрёдингер (1887 г.). Им выпало счастье записать образы и понятия атомной механики на языке формул.


 смешав эти «принципы» в надлежащих пропорциях, можно получить любое вещество в природе.
Как правило, со словом «алхимия» связывают сказки о превращении ртути в золото, о получении эликсира жизни и прочие чудеса. На этом основании укрепилось снисходительно-пренебрежительное отношение ко всей истории алхимии. А ведь
она насчитывает несколько веков! И трудно поверить, что ее тщательно разработанная философия и практические рецепты состояли только из одних заведомых глупостей. Мало кто знает, что алхимики изобрели спирт и, быть может, одним этим оправдали свое существование. Основная же их заслуга состоит в том, что стихийное экспериментирование, которому они предавались, привело постепенно к накоплению фактов, без которых наука химия никогда бы не возникла.
смешав эти «принципы» в надлежащих пропорциях, можно получить любое вещество в природе.
Как правило, со словом «алхимия» связывают сказки о превращении ртути в золото, о получении эликсира жизни и прочие чудеса. На этом основании укрепилось снисходительно-пренебрежительное отношение ко всей истории алхимии. А ведь
она насчитывает несколько веков! И трудно поверить, что ее тщательно разработанная философия и практические рецепты состояли только из одних заведомых глупостей. Мало кто знает, что алхимики изобрели спирт и, быть может, одним этим оправдали свое существование. Основная же их заслуга состоит в том, что стихийное экспериментирование, которому они предавались, привело постепенно к накоплению фактов, без которых наука химия никогда бы не возникла.
 Н, образуя молекулу воды НО. Именно так думал и Дальтон. В дальнейшем Берцелиус доказал, что он немного неправ, а именно: с каждым атомом кислорода соединяются два атома водорода и поэтому формула воды принимает привычный для нас вид: НгО. Но здесь самое важное — идея: с каждым атомом кислорода соединяется целое число атомов водорода. Поэтому если в 16 г кислорода содержится N атомов, то в 2 г водорода — 2N атомов. А это означает, что один атом кислорода в 16 раз тяжелее атома водорода.
Таким образом, появилась возможность сравнивать между собой массы атомов различных элементов. Ввели понятие атомная масса — число, которое показывает, во сколько раз атом какого-либо элемента тяжелее атома водорода, атомную массу которого по определению приняли за единицу.
К этим результатам Дальтон пришел в 1804—1805 гг., а в 1808 г. вышла его знаменитая книга «Новая система химической философии», открывшая в науке новую эпоху. Его выводы тут же проверил английский врач и химик Уильям Волластон (тот самый, который впервые обнаружил темные линии в спектре Солнца) и убедился в их справедливости.
Оставалось сделать последнее: научиться определять атомные массы элементов. Для этого нужно было выбрать простейшие вещества. Прежде всего обратили внимание на газы. Почти сразу же, в 1809 г., бывший ассистент Бертолле французский ученый Джозеф Луи Гей-Люссак (1778— 1850) — мы знаем его по «газовому закону Гей-Люссака» — сделал очень важное открытие: объемы двух газов, вступающих в реакцию, всегда относятся друг к другу как простые целые числа. Не массы, а объемы. Как мы скоро увидим, это очень важно. Например, чтобы получить воду, нужно в одном объеме кислорода сжечь ровно два объема водорода. Отсюда уже сам напрашивается вывод: в равных объемах газов содержится одинаковое число атомов.
Именно к такому выводу пришел в 1811 г. итальянский ученый Амедео Авогадро (1776—1856), только сформулировал его точнее: в равных объемах газов содержится одинаковое число молекул. Теперь мы знаем, что молекулы большинства газов (водорода, кислорода, азота и т. д.) состоят из двух атомов (Н2, О2, N2). После этого уже ничего не стоит
Н, образуя молекулу воды НО. Именно так думал и Дальтон. В дальнейшем Берцелиус доказал, что он немного неправ, а именно: с каждым атомом кислорода соединяются два атома водорода и поэтому формула воды принимает привычный для нас вид: НгО. Но здесь самое важное — идея: с каждым атомом кислорода соединяется целое число атомов водорода. Поэтому если в 16 г кислорода содержится N атомов, то в 2 г водорода — 2N атомов. А это означает, что один атом кислорода в 16 раз тяжелее атома водорода.
Таким образом, появилась возможность сравнивать между собой массы атомов различных элементов. Ввели понятие атомная масса — число, которое показывает, во сколько раз атом какого-либо элемента тяжелее атома водорода, атомную массу которого по определению приняли за единицу.
К этим результатам Дальтон пришел в 1804—1805 гг., а в 1808 г. вышла его знаменитая книга «Новая система химической философии», открывшая в науке новую эпоху. Его выводы тут же проверил английский врач и химик Уильям Волластон (тот самый, который впервые обнаружил темные линии в спектре Солнца) и убедился в их справедливости.
Оставалось сделать последнее: научиться определять атомные массы элементов. Для этого нужно было выбрать простейшие вещества. Прежде всего обратили внимание на газы. Почти сразу же, в 1809 г., бывший ассистент Бертолле французский ученый Джозеф Луи Гей-Люссак (1778— 1850) — мы знаем его по «газовому закону Гей-Люссака» — сделал очень важное открытие: объемы двух газов, вступающих в реакцию, всегда относятся друг к другу как простые целые числа. Не массы, а объемы. Как мы скоро увидим, это очень важно. Например, чтобы получить воду, нужно в одном объеме кислорода сжечь ровно два объема водорода. Отсюда уже сам напрашивается вывод: в равных объемах газов содержится одинаковое число атомов.
Именно к такому выводу пришел в 1811 г. итальянский ученый Амедео Авогадро (1776—1856), только сформулировал его точнее: в равных объемах газов содержится одинаковое число молекул. Теперь мы знаем, что молекулы большинства газов (водорода, кислорода, азота и т. д.) состоят из двух атомов (Н2, О2, N2). После этого уже ничего не стоит
 понять классический опыт по сжиганию водорода в кислороде. Известно, что при этом из 1 объема кислорода и 2 объемов водорода образуется 2 объема водяного пара. Коротко этот факт записывают уравнением
2Нг Ог = 2НгО.
В чем значение открытий Гей-Люссака и Авогадро и почему мы так подробно остановились на этих простых фактах?
Проследим еще раз цепочку рассуждений. В равных объемах газов содержится одинаковое число молекул. Известно, что 2 г водорода занимают объем 22,4 л; обозначим число молекул, которое содержится в этом объеме, через Мд- Те же самые Аа молекул кислорода занимают тот же объем 22,4 л, но масса их при этом не 2 г, а 32 г. Отсюда следует, что каждый атом кислорода в 16 раз тяжелее атома водорода; это означает, что, измерив плотность какого-либо газа и сравнив ее с плотностью водорода, мы сразу же определим его атомную массу.
Нигде до сих пор реальность атомной гипотезы не была видна так явно. Действительно, плотность — величина легко измеримая и привычная, поскольку она воздействует на наши органы чувств. Поразительно то, что таким простым способом можно измерить атомную массу — величину, недоступную непосредственному восприятию.
Число молекул А\, которые помещаются в 22,4 л любого газа при О °C и давлении 1 атмосфера, называют теперь постоянной Авогадро. Это одна из основных постоянных физики — подобно скорости света с или постоянной Планка h. Чтобы определить ее, достаточно знать абсолютную массу М одного атома водорода. И поскольку в 22,4 л содержится 2 г таких атомов, то число N^ — 2/М.
Гипотеза Авогадро была вскоре забыта, и лишь полстолетия спустя, в 1858 г., ей возвратил жизнь другой итальянский ученый — Станислао Каниццаро (1826—1910). Это было как нельзя более кстати, поскольку между химиками той поры не было согласия: почти каждый из них признавал только свою собственную таблицу атомных масс, органики не доверяли неорганикам, а созванный в 1860 г. в Карлсруэ съезд самых знаменитых химиков ни к какому соглашению не пришел. (Впрочем, резолюцией от 4 сентября 1860 г. он все-таки закрепил различие между атомом и молекулой.)
Только теперь, наконец, были достаточно правильно определены атомные массы элементов и можно было приступить к их классификации.
понять классический опыт по сжиганию водорода в кислороде. Известно, что при этом из 1 объема кислорода и 2 объемов водорода образуется 2 объема водяного пара. Коротко этот факт записывают уравнением
2Нг Ог = 2НгО.
В чем значение открытий Гей-Люссака и Авогадро и почему мы так подробно остановились на этих простых фактах?
Проследим еще раз цепочку рассуждений. В равных объемах газов содержится одинаковое число молекул. Известно, что 2 г водорода занимают объем 22,4 л; обозначим число молекул, которое содержится в этом объеме, через Мд- Те же самые Аа молекул кислорода занимают тот же объем 22,4 л, но масса их при этом не 2 г, а 32 г. Отсюда следует, что каждый атом кислорода в 16 раз тяжелее атома водорода; это означает, что, измерив плотность какого-либо газа и сравнив ее с плотностью водорода, мы сразу же определим его атомную массу.
Нигде до сих пор реальность атомной гипотезы не была видна так явно. Действительно, плотность — величина легко измеримая и привычная, поскольку она воздействует на наши органы чувств. Поразительно то, что таким простым способом можно измерить атомную массу — величину, недоступную непосредственному восприятию.
Число молекул А\, которые помещаются в 22,4 л любого газа при О °C и давлении 1 атмосфера, называют теперь постоянной Авогадро. Это одна из основных постоянных физики — подобно скорости света с или постоянной Планка h. Чтобы определить ее, достаточно знать абсолютную массу М одного атома водорода. И поскольку в 22,4 л содержится 2 г таких атомов, то число N^ — 2/М.
Гипотеза Авогадро была вскоре забыта, и лишь полстолетия спустя, в 1858 г., ей возвратил жизнь другой итальянский ученый — Станислао Каниццаро (1826—1910). Это было как нельзя более кстати, поскольку между химиками той поры не было согласия: почти каждый из них признавал только свою собственную таблицу атомных масс, органики не доверяли неорганикам, а созванный в 1860 г. в Карлсруэ съезд самых знаменитых химиков ни к какому соглашению не пришел. (Впрочем, резолюцией от 4 сентября 1860 г. он все-таки закрепил различие между атомом и молекулой.)
Только теперь, наконец, были достаточно правильно определены атомные массы элементов и можно было приступить к их классификации.

 Аристотеля и Демокрита о природе элементов. По горизонтали таблицы изменяется ненаблюдаемое свойство атома Демокрита — атомная масса (количество); по вертикали элементы естественно группируются в семейства с аналогичными химическими свойствами: валентность, способность вступать в реакции и т. д. Эти свойства наблюдаемы, воздействуют на наши органы чувств и сродни древним «качествам» Аристотеля.
Лагранж как-то сказал: «Счастлив Ньютон, ибо систему мира можно установить лишь однажды». Менделеев установил систему химического мира. Это тоже можно сделать только один раз. Поэтому его имя, как и имя Ньютона, никогда не будет забыто в истории науки.
Аристотеля и Демокрита о природе элементов. По горизонтали таблицы изменяется ненаблюдаемое свойство атома Демокрита — атомная масса (количество); по вертикали элементы естественно группируются в семейства с аналогичными химическими свойствами: валентность, способность вступать в реакции и т. д. Эти свойства наблюдаемы, воздействуют на наши органы чувств и сродни древним «качествам» Аристотеля.
Лагранж как-то сказал: «Счастлив Ньютон, ибо систему мира можно установить лишь однажды». Менделеев установил систему химического мира. Это тоже можно сделать только один раз. Поэтому его имя, как и имя Ньютона, никогда не будет забыто в истории науки.

 В согласии с законами ядер-яой физики заряд ядра атома примерно вдвое меньше, чем ei располагая элементы в порядке возрастания их атомных масс, мы более или менее правильно выстроим их в порядке возрастания зарядов ядер их атомов. Менделеев не знал о существовании ядер, но он почувствовал, что у атомов есть еще какое-то свойство, более глубокое, чем атомная масса, и поэтому, расставляя элементы в таблице, доверял больше интуиции, чем атомным массам. Он как бы заглянул под электронную оболочку атомов, пересчитал там положительные заряды в ядре и затем это число присвоил элементу (впоследствии Ван ден Брук назовет его порядковым номером, а Резерфорд — атомным номером). Очевидно, порядковый номер — внутренняя характеристика элемента, и, конечно, он не зависит от нашего произвола, как, например, номер дома на улице. (Если продолжить нашу аналогию с детской игрой-мозаикой, то можно сказать, что все ее кубики в действительности оказались пронумерованными. Только номера эти были запрятаны внутри кубиков.)
Теперь, наконец, можно дать точное определение элемента: элемент — это вещество, состоящее из атомов с одинаковым зарядом ядра.
Нам осталось выяснить последнее: почему монотонное изменение заряда ядра атомов приводит к периодическим изменениям их химических свойств? Изменяются при этом не только химические, но и физические свойства: плотность, твердость и даже агрегатное состояние. Очевидно, причину периодического изменения свойств элементов следует искать не в ядре, а в окружающей его электронной оболочке. Первая мысль, при этом возникающая, состоит в том, что электроны вокруг ядра расположены не беспорядочно, а слоями-оболочками. Начало заполнения новой оболочки совпадает с началом нового периода, и как раз в этот момент скачком изменяются химические свойства элементов. После работ Бора подобная мысль казалась очень естественной, и он сам же ее впервые высказал.
Однако приведенные соображения не подсказывают способа вычислить длину периода. На первый взгляд длина периодов в таблице меняется весьма прихотливо: в I периоде — 2 элемента, во II и III — 8, в IV и V — 18, в VI — 32. Но еще в 1906 г. Иоганн Ридберг заметил, что ряд чисел 2, 8, 18, 32 подчиняется простой формуле: 2п2. Эту закономерность удалось объяснить Паули только в 1924 г. после открытия им принципа запрета.
Ход рассуждений Паули легко понять. В самом деле, движение электронов в атоме описывается четырьмя квантовыми числами, о которых мы подробно говорили в предыдущей главе и которые напомним теперь еще раз:
п — главное квантовое число, которое может принимать значения 1, 2, 3...
I — орбитальное квантовое число, которое при заданном п принимает значения
/=0, 1, 2, ..., п-1.
tn — магнитное квантовое число; при заданных пи/ оно пробегает ряд значений
/п=-/, -(/-1), ..., -1, 0, 1, ..., (Z-1), /.
s — спиновое квантовое число, принимающее два значения + 1/2 и — 1/2.
Принцип запрета Паули гласит: в атоме не может быть двух электронов с одинаковыми квантовыми числами.
Сосчитаем вслед за Паули, сколько электронов помещается в слое с номером п. В слое п==1 возможны только значения / = 0 и m = 0, a s равно +1 /2 и — 1 /2, то есть на первой оболочке может поместиться только 2 электрона. В соответствии с этим в I периоде — только 2 элемента, водород и гелий.
В следующей оболочке с номером п — 2 орбитальный момент I может принимать два значения: / = 0 и /=1. При каждом I магнитное квантовое число принимает 2Z+1 значений, то есть одно при /=0 и три при /=1. При каждом из этих значений возможны два спина: +1/2 и — 1/2, то есть в состоянии с / = 0 помещается 2 электрона, а в состоянии с Z = 1 шесть электронов. Всего же на оболочке п — 2 помещается 2 + 6 = 8 электронов; именно такова длина II периода — от лития до неона.
Точно так же легко сосчитать, что в слое п = 3 помещается 18 электронов, то есть не более 2п2 электронов в слое с номером п. Теперь удалось также понять и существование особой группы элементов — лантаноидов — в VI периоде таблицы.
Каждый период в таблице Менделеева начинается щелочным металлом и заканчивается инертным газом, химические свойства которых резко различны. Теперь легко понять и причину их различия. Инертные газы гелий, неон, аргон и т. д. отличаются от всех остальных элементов тем, что у них электронные оболочки полностью заполнены.
Атомы щелочных металлов Li, Na, Кит. д., которые в таблице расположены следом за инертными газами, содержат по одному электрону в следующей, более высокой оболочке. Эти электроны связаны с ядром много слабее, чем остальные, поэтому атомы щелочных металлов легко их теряют и становятся положительными однозарядными ионами: Li + , Na + , К4* я т. д.
Наоборот, в атомах фтора (F), хлора (Ci), брома (Вг) недостает одного электрона, чтобы замкнуть их внешнюю оболочку до оболочки благородного газа. Поэтому-то галогены так охотно присоединяют электрон, образуя отрицательные ионы F“, С1“, Вг“ и т. д. Когда атомы натрия и хлора встречаются, то натрий отдает свой внешний электрон хлору, в результате чего возникают ионы Na+ и С1“. Ионы эти притягиваются, образуя молекулы NaCl, из которых состоит хорошо известная всем поваренная соль.
В прошлом веке числа 2, 8, 18, 32 вызывали недоумение и получили название «магических». Объяснить их пытались по-разному, например вспоминали, что октаэдр — самый прочный многогранник и что в буддийской философии есть учение о восьми путях добра. Но вряд ли кто предполагал, что для них существует такое простое и рациональное объяснение.
Эта гармония знания основана на квантовой механике, к знакомству с которой теперь и перейдем.
В согласии с законами ядер-яой физики заряд ядра атома примерно вдвое меньше, чем ei располагая элементы в порядке возрастания их атомных масс, мы более или менее правильно выстроим их в порядке возрастания зарядов ядер их атомов. Менделеев не знал о существовании ядер, но он почувствовал, что у атомов есть еще какое-то свойство, более глубокое, чем атомная масса, и поэтому, расставляя элементы в таблице, доверял больше интуиции, чем атомным массам. Он как бы заглянул под электронную оболочку атомов, пересчитал там положительные заряды в ядре и затем это число присвоил элементу (впоследствии Ван ден Брук назовет его порядковым номером, а Резерфорд — атомным номером). Очевидно, порядковый номер — внутренняя характеристика элемента, и, конечно, он не зависит от нашего произвола, как, например, номер дома на улице. (Если продолжить нашу аналогию с детской игрой-мозаикой, то можно сказать, что все ее кубики в действительности оказались пронумерованными. Только номера эти были запрятаны внутри кубиков.)
Теперь, наконец, можно дать точное определение элемента: элемент — это вещество, состоящее из атомов с одинаковым зарядом ядра.
Нам осталось выяснить последнее: почему монотонное изменение заряда ядра атомов приводит к периодическим изменениям их химических свойств? Изменяются при этом не только химические, но и физические свойства: плотность, твердость и даже агрегатное состояние. Очевидно, причину периодического изменения свойств элементов следует искать не в ядре, а в окружающей его электронной оболочке. Первая мысль, при этом возникающая, состоит в том, что электроны вокруг ядра расположены не беспорядочно, а слоями-оболочками. Начало заполнения новой оболочки совпадает с началом нового периода, и как раз в этот момент скачком изменяются химические свойства элементов. После работ Бора подобная мысль казалась очень естественной, и он сам же ее впервые высказал.
Однако приведенные соображения не подсказывают способа вычислить длину периода. На первый взгляд длина периодов в таблице меняется весьма прихотливо: в I периоде — 2 элемента, во II и III — 8, в IV и V — 18, в VI — 32. Но еще в 1906 г. Иоганн Ридберг заметил, что ряд чисел 2, 8, 18, 32 подчиняется простой формуле: 2п2. Эту закономерность удалось объяснить Паули только в 1924 г. после открытия им принципа запрета.
Ход рассуждений Паули легко понять. В самом деле, движение электронов в атоме описывается четырьмя квантовыми числами, о которых мы подробно говорили в предыдущей главе и которые напомним теперь еще раз:
п — главное квантовое число, которое может принимать значения 1, 2, 3...
I — орбитальное квантовое число, которое при заданном п принимает значения
/=0, 1, 2, ..., п-1.
tn — магнитное квантовое число; при заданных пи/ оно пробегает ряд значений
/п=-/, -(/-1), ..., -1, 0, 1, ..., (Z-1), /.
s — спиновое квантовое число, принимающее два значения + 1/2 и — 1/2.
Принцип запрета Паули гласит: в атоме не может быть двух электронов с одинаковыми квантовыми числами.
Сосчитаем вслед за Паули, сколько электронов помещается в слое с номером п. В слое п==1 возможны только значения / = 0 и m = 0, a s равно +1 /2 и — 1 /2, то есть на первой оболочке может поместиться только 2 электрона. В соответствии с этим в I периоде — только 2 элемента, водород и гелий.
В следующей оболочке с номером п — 2 орбитальный момент I может принимать два значения: / = 0 и /=1. При каждом I магнитное квантовое число принимает 2Z+1 значений, то есть одно при /=0 и три при /=1. При каждом из этих значений возможны два спина: +1/2 и — 1/2, то есть в состоянии с / = 0 помещается 2 электрона, а в состоянии с Z = 1 шесть электронов. Всего же на оболочке п — 2 помещается 2 + 6 = 8 электронов; именно такова длина II периода — от лития до неона.
Точно так же легко сосчитать, что в слое п = 3 помещается 18 электронов, то есть не более 2п2 электронов в слое с номером п. Теперь удалось также понять и существование особой группы элементов — лантаноидов — в VI периоде таблицы.
Каждый период в таблице Менделеева начинается щелочным металлом и заканчивается инертным газом, химические свойства которых резко различны. Теперь легко понять и причину их различия. Инертные газы гелий, неон, аргон и т. д. отличаются от всех остальных элементов тем, что у них электронные оболочки полностью заполнены.
Атомы щелочных металлов Li, Na, Кит. д., которые в таблице расположены следом за инертными газами, содержат по одному электрону в следующей, более высокой оболочке. Эти электроны связаны с ядром много слабее, чем остальные, поэтому атомы щелочных металлов легко их теряют и становятся положительными однозарядными ионами: Li + , Na + , К4* я т. д.
Наоборот, в атомах фтора (F), хлора (Ci), брома (Вг) недостает одного электрона, чтобы замкнуть их внешнюю оболочку до оболочки благородного газа. Поэтому-то галогены так охотно присоединяют электрон, образуя отрицательные ионы F“, С1“, Вг“ и т. д. Когда атомы натрия и хлора встречаются, то натрий отдает свой внешний электрон хлору, в результате чего возникают ионы Na+ и С1“. Ионы эти притягиваются, образуя молекулы NaCl, из которых состоит хорошо известная всем поваренная соль.
В прошлом веке числа 2, 8, 18, 32 вызывали недоумение и получили название «магических». Объяснить их пытались по-разному, например вспоминали, что октаэдр — самый прочный многогранник и что в буддийской философии есть учение о восьми путях добра. Но вряд ли кто предполагал, что для них существует такое простое и рациональное объяснение.
Эта гармония знания основана на квантовой механике, к знакомству с которой теперь и перейдем.
 действий над ними. Этим достигается та однозначность науки, которая позволяет общаться между собой ученым разных стран и поколений.
Связь
явление —образ —понятие —формула можно изобразить схематически и пояснить на примере возникновения понятия «волна».
Люди наблюдали различные явления: волны на море и круги от брошенного в пруд камня, распространение света и колебания струн. У них при этом возникали вполне конкретные образы. Постепенно им стало ясно, что этим разным явлениям присуще нечто общее: все они связаны с некоторым периодическим процессом, характерные признаки которого — явления интерференции и дифракции. Так в физике возникло новое понятие — волна. А чтобы сделать его вполне однозначным, >с ним связали четыре характеристики: амплитуду А, скорость распространения v, длину волны X и частоту v.
Точно так же понятие частица не предполагает, что у вас при этом возникает конкретный образ песчинки или макового зернышка. Физику вполне достаточно знать, что частица — это некий объект, внутренним строением которого он не интересуется, важно только, что у него есть масса т, скорость v, импульс p = mv и траектория движения, которую физик может проследить.
Траектория — еще одно понятие, которое необходимо использовать, определяя «движение частицы». На первый взгляд процесс этот беспределен: чтобы определить понятие, нужно использовать другое, а его, в свою очередь, тоже определять и т. д. Однако это не так. В физике существует несколько первичных понятий, которые можно определить без ссылок на другие, а именно — задав точные рецепты измерения величин, этим понятиям соответствующие. Таковы понятия: время t, координата х, заряд е и т. д.
Траектория движения частицы х(/) задана, если в каждый момент времени t мы можем указать ее координату х. Для этого нужно либо измерить координаты xt в моменты времени tiy либо вычислить их. Первую задачу решает экспериментальная физика, вторую — теоретическая, причем вторую задачу можно решить лишь в том случае, если известны физические законы, по которым частица движется.
Физический закон — это постоянная связь явлений и соответствующих им величин, записанная с помощью математических символов в виде уравнений. Для каждой группы явле-
нии существуют свои законы движения: в механике—одни законы (уравнения Ньютона), в электродинамике—другие (уравнения Максвелла). А все вместе, взятое в совокупности, т— понятия, физические законы, формулы, их выражающие, и следствия из них — принято называть точной наукой.
Каждая законченная наука должна быть логически непротиворечивой. Это означает, в частности, что каждое понятие в рамках этой науки можно употреблять только в одном, строго определенном смысле. Добиться этого трудно, но необходимо, поскольку ученые, как и все люди, общаются между собой-не формулами, а с помощью слов. Формулы нужны им для однозначной записи результатов исследований.
Примером логически завершенной науки долгое время служила механика, которую теперь называют классической. Механика — это наука о движении тел. Ее законам подчиняются почти все видимые движения в природе — будь то порхание мотылька или полет ракеты. Классическое совершенство механики долгое время гипнотизировало ученых, и они пытались объяснить с ее помощью не только механическое, но и все другие движения в природе. «Все единодушно признают, что задачей физики является подведение всех явлений природы под простые законы механики»,— писал Генрих Герц даже в 1894 г., на пороге революции в физике.
Движение — одно из самых сложных понятий физики. С ним воображение вольно связывать самые разные образы — от шелеста листьев до бегущего носорога. Однако даже самые фантастические картины движения содержат нечто общее: перемещение одних объектов относительно других с течением времени. После введения понятия траектории понятие движения становится более определенным, вероятно потому, что при этом оно вновь приобретает черты наглядности. Условия развития и воспитания человека таковы, что ему трудно вообразить иное движение, кроме механического, поэтому и все другие движения он пытается осмыслить также с помощью понятия о траектории. Это ему, естественно, не удается, например при попытке осмыслить электрические движения. Можно, конечно, представить себе высоковольтную линию передач или междугородний телефон и вообразить, что провода и есть «траектория» электрических сигналов, однако реального смысла такие образы не имеют: электромагнитные волны — это не жидкость, текущая по проводам.
Определить понятие движения в квантовой механике еще сложнее. Более того: именно тот день, когда его удалось определить непротиворечиво, можно считать днем рождения современной квантовой механики.
НО
действий над ними. Этим достигается та однозначность науки, которая позволяет общаться между собой ученым разных стран и поколений.
Связь
явление —образ —понятие —формула можно изобразить схематически и пояснить на примере возникновения понятия «волна».
Люди наблюдали различные явления: волны на море и круги от брошенного в пруд камня, распространение света и колебания струн. У них при этом возникали вполне конкретные образы. Постепенно им стало ясно, что этим разным явлениям присуще нечто общее: все они связаны с некоторым периодическим процессом, характерные признаки которого — явления интерференции и дифракции. Так в физике возникло новое понятие — волна. А чтобы сделать его вполне однозначным, >с ним связали четыре характеристики: амплитуду А, скорость распространения v, длину волны X и частоту v.
Точно так же понятие частица не предполагает, что у вас при этом возникает конкретный образ песчинки или макового зернышка. Физику вполне достаточно знать, что частица — это некий объект, внутренним строением которого он не интересуется, важно только, что у него есть масса т, скорость v, импульс p = mv и траектория движения, которую физик может проследить.
Траектория — еще одно понятие, которое необходимо использовать, определяя «движение частицы». На первый взгляд процесс этот беспределен: чтобы определить понятие, нужно использовать другое, а его, в свою очередь, тоже определять и т. д. Однако это не так. В физике существует несколько первичных понятий, которые можно определить без ссылок на другие, а именно — задав точные рецепты измерения величин, этим понятиям соответствующие. Таковы понятия: время t, координата х, заряд е и т. д.
Траектория движения частицы х(/) задана, если в каждый момент времени t мы можем указать ее координату х. Для этого нужно либо измерить координаты xt в моменты времени tiy либо вычислить их. Первую задачу решает экспериментальная физика, вторую — теоретическая, причем вторую задачу можно решить лишь в том случае, если известны физические законы, по которым частица движется.
Физический закон — это постоянная связь явлений и соответствующих им величин, записанная с помощью математических символов в виде уравнений. Для каждой группы явле-
нии существуют свои законы движения: в механике—одни законы (уравнения Ньютона), в электродинамике—другие (уравнения Максвелла). А все вместе, взятое в совокупности, т— понятия, физические законы, формулы, их выражающие, и следствия из них — принято называть точной наукой.
Каждая законченная наука должна быть логически непротиворечивой. Это означает, в частности, что каждое понятие в рамках этой науки можно употреблять только в одном, строго определенном смысле. Добиться этого трудно, но необходимо, поскольку ученые, как и все люди, общаются между собой-не формулами, а с помощью слов. Формулы нужны им для однозначной записи результатов исследований.
Примером логически завершенной науки долгое время служила механика, которую теперь называют классической. Механика — это наука о движении тел. Ее законам подчиняются почти все видимые движения в природе — будь то порхание мотылька или полет ракеты. Классическое совершенство механики долгое время гипнотизировало ученых, и они пытались объяснить с ее помощью не только механическое, но и все другие движения в природе. «Все единодушно признают, что задачей физики является подведение всех явлений природы под простые законы механики»,— писал Генрих Герц даже в 1894 г., на пороге революции в физике.
Движение — одно из самых сложных понятий физики. С ним воображение вольно связывать самые разные образы — от шелеста листьев до бегущего носорога. Однако даже самые фантастические картины движения содержат нечто общее: перемещение одних объектов относительно других с течением времени. После введения понятия траектории понятие движения становится более определенным, вероятно потому, что при этом оно вновь приобретает черты наглядности. Условия развития и воспитания человека таковы, что ему трудно вообразить иное движение, кроме механического, поэтому и все другие движения он пытается осмыслить также с помощью понятия о траектории. Это ему, естественно, не удается, например при попытке осмыслить электрические движения. Можно, конечно, представить себе высоковольтную линию передач или междугородний телефон и вообразить, что провода и есть «траектория» электрических сигналов, однако реального смысла такие образы не имеют: электромагнитные волны — это не жидкость, текущая по проводам.
Определить понятие движения в квантовой механике еще сложнее. Более того: именно тот день, когда его удалось определить непротиворечиво, можно считать днем рождения современной квантовой механики.
НО
 тории. Нельзя, потому что электрон не шарик, а нечто более изощренное, и проследить за движением этого «нечто» столь же подробно, как за движением бильярдного шара, невозможно. Поэтому, пытаясь определить траекторию электрона в атоме, мы задаем природе незаконные вопросы. Вроде тех, которые задавали в древности: «На чем держится Земля?», «Где у нее край?», а немного позднее: «Где у нее верх и низ?»
Гейзенберг утверждал: уравнения, с помощью которых мы хотим описать движение в атоме, не должны содержать никаких величин, кроме тех, которые можно измерить на опыте. Из опытов следовало, что атом устойчив, состоит из ядра и электронов и может излучать, если его вывести из состояния равновесия. Это излучение имеет строго определенную длину волны и, если верить Бору, возникает при перескоке электрона с одной стационарной орбиты на другую. При этом схема Бора ничего не говорила о том, что происходит с электроном в момент скачка, так сказать, «в полете» между двумя стационарными состояниями. А все, и Гейзенберг в том числе, по привычке добивались ответа именно на этот вопрос. Но в какой-то момент ему стало ясно: электрон не бывает «между» стационарными состояниями, такого свойства у него просто нет!
А что есть? Есть нечто, чему он не знал пока даже названия, но был убежден: оно должно зависеть только от того, куда перешел электрон и откуда он пришел.
До сих пор, исходя из уравнений электродинамики, все пытались найти гипотетическую траекторию x(t) электрона в атоме, которая непрерывно зависит от времени и которую можно задать рядом чисел Xi, х2, хз, отмечающих положение электрона в моменты времени 6, /2, /з, ... Гейзенберг утверждал: такой траектории в атоме нет, а вместо непрерывной кривой x(t) есть набор дискретных чисел xnky значения которых зависят от номеров k и п — начального и конечного состояний электрона.
Это очень важное и довольно сложное утверждение можно пояснить простой аналогией. Представьте, что перед вами шахматная доска, по которой ползет муха. При желании можно очень подробно проследить ее путь, если в каждый момент времени Ь отмечать ее положение X/. По этим измерениям вы затем легко сможете начертить кривую х(/),
то есть траекторию движения мухи. Если у вас нет такого желания, достаточно указать квадраты, I
тории. Нельзя, потому что электрон не шарик, а нечто более изощренное, и проследить за движением этого «нечто» столь же подробно, как за движением бильярдного шара, невозможно. Поэтому, пытаясь определить траекторию электрона в атоме, мы задаем природе незаконные вопросы. Вроде тех, которые задавали в древности: «На чем держится Земля?», «Где у нее край?», а немного позднее: «Где у нее верх и низ?»
Гейзенберг утверждал: уравнения, с помощью которых мы хотим описать движение в атоме, не должны содержать никаких величин, кроме тех, которые можно измерить на опыте. Из опытов следовало, что атом устойчив, состоит из ядра и электронов и может излучать, если его вывести из состояния равновесия. Это излучение имеет строго определенную длину волны и, если верить Бору, возникает при перескоке электрона с одной стационарной орбиты на другую. При этом схема Бора ничего не говорила о том, что происходит с электроном в момент скачка, так сказать, «в полете» между двумя стационарными состояниями. А все, и Гейзенберг в том числе, по привычке добивались ответа именно на этот вопрос. Но в какой-то момент ему стало ясно: электрон не бывает «между» стационарными состояниями, такого свойства у него просто нет!
А что есть? Есть нечто, чему он не знал пока даже названия, но был убежден: оно должно зависеть только от того, куда перешел электрон и откуда он пришел.
До сих пор, исходя из уравнений электродинамики, все пытались найти гипотетическую траекторию x(t) электрона в атоме, которая непрерывно зависит от времени и которую можно задать рядом чисел Xi, х2, хз, отмечающих положение электрона в моменты времени 6, /2, /з, ... Гейзенберг утверждал: такой траектории в атоме нет, а вместо непрерывной кривой x(t) есть набор дискретных чисел xnky значения которых зависят от номеров k и п — начального и конечного состояний электрона.
Это очень важное и довольно сложное утверждение можно пояснить простой аналогией. Представьте, что перед вами шахматная доска, по которой ползет муха. При желании можно очень подробно проследить ее путь, если в каждый момент времени Ь отмечать ее положение X/. По этим измерениям вы затем легко сможете начертить кривую х(/),
то есть траекторию движения мухи. Если у вас нет такого желания, достаточно указать квадраты, I
 которые посетила муха на своем 1
пути. Это тоже даст некую инфор- ц мацию о ее перемещении, но легко сообразить, что с точки зрения классической механики такое описание будет неполным.
Теперь представьте, что вы за той же доской играете в шахматы и решили, например, сделать традиционный ход е2 — е4. В этом случае результат вашего хода совершенно не связан с тем, по какому пути вы передвинули пешку. Это и понятно: правила шахматной игры не зависят от законов механики, а потому и не нуждаются в понятии траектории.
Гейзенберг сообразил, что «правила атомной игры» тоже не требуют знания траектории. В соответствии с этим он представил состояние атома в виде бесконечной шахматной доски, в каждом квадрате которой написаны числа Естественно, что значения этих чисел зависят от положения квадрата на «атомной доске», то есть от номера п строки и номера k столбца, на пересечении которых стоит число xnk-
Никого не удивляет тот факт, что запись шахматной партии позволяет воспроизвести ее даже много лет спустя. Конечно, при этом мы не узнаем, как долго она длилась в действительности, что переживали тогда шахматисты и как именно двигали они пешки и фигуры. Но это и неважно, коль скоро нам интересна только игра сама по себе.
Точно так же, если нам известны числа xnk — эта своеобразная запись «атомной игры»,— мы знаем об атоме все необходимое, чтобы предсказать его наблюдаемые свойства: спектр атома, интенсивность его спектральных линий, число и скорость электронов, выбитых из атома ультрафиолетовыми лучами, а также многое другое. Числа хпь нельзя назвать координатами электрона в атоме. Они заменяют их, или, как стали говорить позже, представляют их. Но что означают эти слова — на первых порах не понимал и сам Гейзенберг.
Действительно, вместо квадратной таблицы чисел xnk с таким же успехом можно нарисовать все, что угодно, скажем куб, и сказать, что именно он представляет движение электрона в атоме. Однако тут же с помощью Макса Борна удалось понять, что таблица чисел хпь не просто таблица, а матрица.
Что означает это слово? Математика имеет дело с числами и символами, и каждый символ в ней подчиняется своим правилам действия. Например, числа можно складывать и вычитать, умножать и делить, и результат этих действий не зависит от того, в каком порядке мы их производим:
54-3 = 34-5 и 5-3 = 3-5.
Но в математике есть и более сложные объекты: отрицательные и комплексные числа, векторы, матрицы и т. д. Матрицы — это таблицы величин типа Xnk, для которых определены свои операции сложения и умножения, непохожие на правила действий с обыкновенными числами. Например, складывать и вычитать матрицы, как и обычные числа, можно в произвольном порядке. Однако результат умножения двух матриц зависит от порядка умножения, то есть %nk * Pkn Pnk • Xkn‘
Например, произведение матриц
а, -°.) ;)
явно отличается от такого же произведения, но в котором порядок умножаемых матриц обратный:
Правило умножения матриц может показаться странным и подозрительным, но никакого произвола в себе не содержит. По существу, именно оно отличает матрицы от других величин. Конечно, математики о матрицах знали задолго до Гейзенберга и умели с ними работать. Однако для всех было полной неожиданностью, что эти странные объекты с непривычными свойствами соответствуют чему-то реальному в природе. Заслуга Гейзенберга и Борна в том и состоит, что они преодолели психологический барьер, нашли соответствие между свойствами матриц и особенностями движения электронов в атоме и тем самым основали новую, атомную, квантовую, матричную механику.
Атомную — потому, что она описывает движение электронов в атоме.
Квантовую — ибо главную роль в этом описании играет понятие кванта действия h.
Матричную — поскольку необходимый для этого математический аппарат — матрицы. -
В новой механике каждой характеристике электрона: координате х, импульсу р, энергии Е — ставились в соответствие матрицы Xnk, Pnk, Enk, и уже для них (а не для чисел) записывали уравнения движения, известные из классической механики. А затем надо было только проследить, чтобы все действия над величинами xnk, pnk, Enk не нарушали правил математики.
Макс Борн установил даже нечто большее: он выяснил, что квантовомеханические матрицы координаты xnk и импульса pnk — это не любые матрицы, а только те из них, которые подчиняются перестановочному (или коммутационному) соотношению
Хдй • Pkn Pnk * Xkn = /Д,
где — 1 — мнимая единица, a h = h/2n.
В новой механике это перестановочное соотношение играло точно такую же роль, как условие квантования Бора в старой механике. И точно так же, как условия Бора выделяли стационарные орбиты из набора всех возможных, коммутационные соотношения выбирают из множества всех матриц только квантовомеханические. Не случайно, что в обоих случаях — ив условиях квантования Бора, и в перестановочных соотношениях — всегда присутствует постоянная Планка h: она непременно входит во все уравнения квантовой механики, и по этому признаку их можно безошибочно отличить от всех других уравнений.
Новые уравнения, которые нашел Гейзенберг, не были похожи ни на уравнения механики, ни на уравнения электродинамики и потому никак не могли их нарушить. На языке новых уравнений состояние атома полностью задано, если известны все числа xnk и pnk, то есть известны матрицы, соответствующие координате и импульсу электрона.
Обратите внимание: в наших рассуждениях мы нигде не использовали понятие «движение электрона в атоме». Теперь оно просто не нужно. Согласно Гейзенбергу, движение — это не перемещение электрона-шарика по какой-либо траекто-рии вокруг ядра, а изменение состояния системы «атом» во времени, которое описывается матрицами xnk и pnk- Вместе с вопросами о характере движения электрона в атоме сам собой отпал и вопрос об устройчивости атома. С новой точки зрения в-невозбужденном атоме электрон покоится, а потому и не должен излучать.
Можно и дальше пытаться без формул излагать следствия механики Гейзенберга. Однако это будет так же неестественно, как попытка пересказать словами музыку. Чтобы постигнуть суть и детали квантовой механики, необходимо изучать математику, учиться работать с матрицами — одним словом, надо овладевать ремеслом физика. В матрицах нет ничего мистического или непостижимого; изучить их значительно проще, чем усвоить, скажем, латынь. Но этому, как и музыке, не следует учиться на ходу. Иначе неприятный осадок полузнания отравит даже то удовольствие, которое доступно каждому: без формул и вычислений почувствовать красоту образов и законченность понятий любой глубокой науки.
Появление матричной механики Гейзенберга физики встретили с облегчением: «Механика Гейзенберга снова вернула мне радость жизни и надежду. Хотя она и не дает решения загадки, но я верю, что теперь снова можно продвигаться вперед»,— писал Паули 9 октября 1925 г. Свою веру он вскоре сам же и оправдал: применив новую механику к атому водорода, он получил те же формулы, что и Нильс Бор на основании своих постулатов. Конечно, при этом возникли новые проблемы, однако это уже были трудности роста, а не безнадежность тупика.
которые посетила муха на своем 1
пути. Это тоже даст некую инфор- ц мацию о ее перемещении, но легко сообразить, что с точки зрения классической механики такое описание будет неполным.
Теперь представьте, что вы за той же доской играете в шахматы и решили, например, сделать традиционный ход е2 — е4. В этом случае результат вашего хода совершенно не связан с тем, по какому пути вы передвинули пешку. Это и понятно: правила шахматной игры не зависят от законов механики, а потому и не нуждаются в понятии траектории.
Гейзенберг сообразил, что «правила атомной игры» тоже не требуют знания траектории. В соответствии с этим он представил состояние атома в виде бесконечной шахматной доски, в каждом квадрате которой написаны числа Естественно, что значения этих чисел зависят от положения квадрата на «атомной доске», то есть от номера п строки и номера k столбца, на пересечении которых стоит число xnk-
Никого не удивляет тот факт, что запись шахматной партии позволяет воспроизвести ее даже много лет спустя. Конечно, при этом мы не узнаем, как долго она длилась в действительности, что переживали тогда шахматисты и как именно двигали они пешки и фигуры. Но это и неважно, коль скоро нам интересна только игра сама по себе.
Точно так же, если нам известны числа xnk — эта своеобразная запись «атомной игры»,— мы знаем об атоме все необходимое, чтобы предсказать его наблюдаемые свойства: спектр атома, интенсивность его спектральных линий, число и скорость электронов, выбитых из атома ультрафиолетовыми лучами, а также многое другое. Числа хпь нельзя назвать координатами электрона в атоме. Они заменяют их, или, как стали говорить позже, представляют их. Но что означают эти слова — на первых порах не понимал и сам Гейзенберг.
Действительно, вместо квадратной таблицы чисел xnk с таким же успехом можно нарисовать все, что угодно, скажем куб, и сказать, что именно он представляет движение электрона в атоме. Однако тут же с помощью Макса Борна удалось понять, что таблица чисел хпь не просто таблица, а матрица.
Что означает это слово? Математика имеет дело с числами и символами, и каждый символ в ней подчиняется своим правилам действия. Например, числа можно складывать и вычитать, умножать и делить, и результат этих действий не зависит от того, в каком порядке мы их производим:
54-3 = 34-5 и 5-3 = 3-5.
Но в математике есть и более сложные объекты: отрицательные и комплексные числа, векторы, матрицы и т. д. Матрицы — это таблицы величин типа Xnk, для которых определены свои операции сложения и умножения, непохожие на правила действий с обыкновенными числами. Например, складывать и вычитать матрицы, как и обычные числа, можно в произвольном порядке. Однако результат умножения двух матриц зависит от порядка умножения, то есть %nk * Pkn Pnk • Xkn‘
Например, произведение матриц
а, -°.) ;)
явно отличается от такого же произведения, но в котором порядок умножаемых матриц обратный:
Правило умножения матриц может показаться странным и подозрительным, но никакого произвола в себе не содержит. По существу, именно оно отличает матрицы от других величин. Конечно, математики о матрицах знали задолго до Гейзенберга и умели с ними работать. Однако для всех было полной неожиданностью, что эти странные объекты с непривычными свойствами соответствуют чему-то реальному в природе. Заслуга Гейзенберга и Борна в том и состоит, что они преодолели психологический барьер, нашли соответствие между свойствами матриц и особенностями движения электронов в атоме и тем самым основали новую, атомную, квантовую, матричную механику.
Атомную — потому, что она описывает движение электронов в атоме.
Квантовую — ибо главную роль в этом описании играет понятие кванта действия h.
Матричную — поскольку необходимый для этого математический аппарат — матрицы. -
В новой механике каждой характеристике электрона: координате х, импульсу р, энергии Е — ставились в соответствие матрицы Xnk, Pnk, Enk, и уже для них (а не для чисел) записывали уравнения движения, известные из классической механики. А затем надо было только проследить, чтобы все действия над величинами xnk, pnk, Enk не нарушали правил математики.
Макс Борн установил даже нечто большее: он выяснил, что квантовомеханические матрицы координаты xnk и импульса pnk — это не любые матрицы, а только те из них, которые подчиняются перестановочному (или коммутационному) соотношению
Хдй • Pkn Pnk * Xkn = /Д,
где — 1 — мнимая единица, a h = h/2n.
В новой механике это перестановочное соотношение играло точно такую же роль, как условие квантования Бора в старой механике. И точно так же, как условия Бора выделяли стационарные орбиты из набора всех возможных, коммутационные соотношения выбирают из множества всех матриц только квантовомеханические. Не случайно, что в обоих случаях — ив условиях квантования Бора, и в перестановочных соотношениях — всегда присутствует постоянная Планка h: она непременно входит во все уравнения квантовой механики, и по этому признаку их можно безошибочно отличить от всех других уравнений.
Новые уравнения, которые нашел Гейзенберг, не были похожи ни на уравнения механики, ни на уравнения электродинамики и потому никак не могли их нарушить. На языке новых уравнений состояние атома полностью задано, если известны все числа xnk и pnk, то есть известны матрицы, соответствующие координате и импульсу электрона.
Обратите внимание: в наших рассуждениях мы нигде не использовали понятие «движение электрона в атоме». Теперь оно просто не нужно. Согласно Гейзенбергу, движение — это не перемещение электрона-шарика по какой-либо траекто-рии вокруг ядра, а изменение состояния системы «атом» во времени, которое описывается матрицами xnk и pnk- Вместе с вопросами о характере движения электрона в атоме сам собой отпал и вопрос об устройчивости атома. С новой точки зрения в-невозбужденном атоме электрон покоится, а потому и не должен излучать.
Можно и дальше пытаться без формул излагать следствия механики Гейзенберга. Однако это будет так же неестественно, как попытка пересказать словами музыку. Чтобы постигнуть суть и детали квантовой механики, необходимо изучать математику, учиться работать с матрицами — одним словом, надо овладевать ремеслом физика. В матрицах нет ничего мистического или непостижимого; изучить их значительно проще, чем усвоить, скажем, латынь. Но этому, как и музыке, не следует учиться на ходу. Иначе неприятный осадок полузнания отравит даже то удовольствие, которое доступно каждому: без формул и вычислений почувствовать красоту образов и законченность понятий любой глубокой науки.
Появление матричной механики Гейзенберга физики встретили с облегчением: «Механика Гейзенберга снова вернула мне радость жизни и надежду. Хотя она и не дает решения загадки, но я верю, что теперь снова можно продвигаться вперед»,— писал Паули 9 октября 1925 г. Свою веру он вскоре сам же и оправдал: применив новую механику к атому водорода, он получил те же формулы, что и Нильс Бор на основании своих постулатов. Конечно, при этом возникли новые проблемы, однако это уже были трудности роста, а не безнадежность тупика.


 то уже не сомневались в его волновой природе. Потому, собственно, все сразу и признали гипотезу де Бройля о волнах материи, увидев первые снимки дифракции электронов.
Для нынешнего поколения физиков волновые свойства электрона уже не вопрос веры, а факт точного знания и даже средство для технических приложений.
В стройной теории волновой оптики оставалась одна неувязка: луч света мы воспринимаем все-таки как луч, а не как волну. Как объяснить такой факт с точки зрения волновой оптики? Эту задачу решил Огюстен Жан Френель (1788—1827), и его объяснение можно найти теперь в любом учебнике физики. Оказывается, интерференция приводит к тому, что все волны от источника света гасят друг друга, кроме тех, которые находятся внутри узкого канала, соединяющего источник света и глаз наблюдателя. Толщина этого канала равна половине длины волны света, то есть равна Z/2^2-10”5 см. Если мы пренебрежем толщиной этого «светового канала», то получим ту самую траекторию светового луча, к которой все мы привыкли в обычной жизни.
Известен даже способ ее построения: сначала нужно провести линии через все гребни волн — как говорят в физике, отметить фронт волны, а затем от источника света провести линию, которая перпендикулярна к фронту волны. Это и будет траектория светового луча. Если вблизи препятствия фронт волны искажается, то одновременно с этим искривляется и траектория луча — луч света огибает препятствие, происходит дифракция.
В 1834 г. Уильям Роуан Гамильтон (1805—1865), знаменитый на весь мир профессор астрономии в Дублинском университете, занимался непонятной для современников задачей. Он хотел доказать, что формальная аналогия между траекторией движения частицы и траекторией светового луча имеет строгий математический смысл. Мы уже знаем: в физике понятию закона движения соответствуют формулы — уравнения движения. Для волн и частиц они совершенно
различны: решая одни, мы вычисляем траекторию частицы,
решая другие, находим форму и скорость фронта волны. Но мы также знаем, что в оптике можно нарисовать траекторию светового луча, зная движение фронта его волны. Гамильтон доказал, что в механике можно сделать нечто противоположное: заменить траекторию движения частицы распространением фронта некоторой волны. Или, более точно, уравнения движения механики можно записать в таком виде, что они полностью совпадут с уравнениями геометрической оптики, которые описывают распространение луча света без учета его волновых свойств. Тем самым Гамильтон доказал оптико-механическую аналогию: движение частицы по траектории можно представить как распространение луча света без учета его волновых свойств.
то уже не сомневались в его волновой природе. Потому, собственно, все сразу и признали гипотезу де Бройля о волнах материи, увидев первые снимки дифракции электронов.
Для нынешнего поколения физиков волновые свойства электрона уже не вопрос веры, а факт точного знания и даже средство для технических приложений.
В стройной теории волновой оптики оставалась одна неувязка: луч света мы воспринимаем все-таки как луч, а не как волну. Как объяснить такой факт с точки зрения волновой оптики? Эту задачу решил Огюстен Жан Френель (1788—1827), и его объяснение можно найти теперь в любом учебнике физики. Оказывается, интерференция приводит к тому, что все волны от источника света гасят друг друга, кроме тех, которые находятся внутри узкого канала, соединяющего источник света и глаз наблюдателя. Толщина этого канала равна половине длины волны света, то есть равна Z/2^2-10”5 см. Если мы пренебрежем толщиной этого «светового канала», то получим ту самую траекторию светового луча, к которой все мы привыкли в обычной жизни.
Известен даже способ ее построения: сначала нужно провести линии через все гребни волн — как говорят в физике, отметить фронт волны, а затем от источника света провести линию, которая перпендикулярна к фронту волны. Это и будет траектория светового луча. Если вблизи препятствия фронт волны искажается, то одновременно с этим искривляется и траектория луча — луч света огибает препятствие, происходит дифракция.
В 1834 г. Уильям Роуан Гамильтон (1805—1865), знаменитый на весь мир профессор астрономии в Дублинском университете, занимался непонятной для современников задачей. Он хотел доказать, что формальная аналогия между траекторией движения частицы и траекторией светового луча имеет строгий математический смысл. Мы уже знаем: в физике понятию закона движения соответствуют формулы — уравнения движения. Для волн и частиц они совершенно
различны: решая одни, мы вычисляем траекторию частицы,
решая другие, находим форму и скорость фронта волны. Но мы также знаем, что в оптике можно нарисовать траекторию светового луча, зная движение фронта его волны. Гамильтон доказал, что в механике можно сделать нечто противоположное: заменить траекторию движения частицы распространением фронта некоторой волны. Или, более точно, уравнения движения механики можно записать в таком виде, что они полностью совпадут с уравнениями геометрической оптики, которые описывают распространение луча света без учета его волновых свойств. Тем самым Гамильтон доказал оптико-механическую аналогию: движение частицы по траектории можно представить как распространение луча света без учета его волновых свойств.
 В свое время эти исследования Гамильтона (как и многие другие, например, исчисление гиперкомплексных чисёл — кватернионов) не были по достоинству оценены современниками. Лишь почти столетие спустя эти работы нашли достойное продолжение в трудах Шрёдингера и Дирака.
В свое время эти исследования Гамильтона (как и многие другие, например, исчисление гиперкомплексных чисёл — кватернионов) не были по достоинству оценены современниками. Лишь почти столетие спустя эти работы нашли достойное продолжение в трудах Шрёдингера и Дирака.
 Как и всякое глубокое открытие, гипотеза Шрёдингера ниоткуда логически • не следовала. Но, как всякое истинное открытие, логические следствия она имела. Прежде всего, если Шрёдингер прав, то движение частиц должно обнаруживать волновые свойства в тех областях пространства, размеры которых сравнимы с длиной волны этих частиц. В большой мере это относится и к движению электрона в атоме: сравнив формулы де Бройля \ = h/mv и Бора mvr = h/2ny легко усмотреть, что радиус атома г — — Х/2л примерно в шесть раз меньше, чем длина волны электрона X. Если эту длину отождествить с размером электро-
Как и всякое глубокое открытие, гипотеза Шрёдингера ниоткуда логически • не следовала. Но, как всякое истинное открытие, логические следствия она имела. Прежде всего, если Шрёдингер прав, то движение частиц должно обнаруживать волновые свойства в тех областях пространства, размеры которых сравнимы с длиной волны этих частиц. В большой мере это относится и к движению электрона в атоме: сравнив формулы де Бройля \ = h/mv и Бора mvr = h/2ny легко усмотреть, что радиус атома г — — Х/2л примерно в шесть раз меньше, чем длина волны электрона X. Если эту длину отождествить с размером электро-

 черта и каждый символ исполнены смысла. Вверху — королевские лилии, которые появились в геральдических знаках Франции уже в конце V века — после победы короля Хлодвига над гуннами у берегов реки Ли. (По преданию, воины Хлодвига, возвращаясь домой, украсили свои шлемы и щиты цветами белых лилий «ли-ли», что в переводе с галльского означает «белый-белый».) Внизу герба — корабль, похожий очертаниями на Ситэ — остров посреди Сены, где в древности обитало племя паризиев, по имени которых назван Париж. А форма герба напоминает парус — в память об основном занятии древних обитателей Парижа. Как видите, понять символику герба несложно, хотя по-настоящему близка и естественна она только парижанам.
Подойдем к уравнению Шрёдингера точно так же. Примем его вначале просто как символ квантовой механики, как некий герб квантовой страны, по которой мы теперь путешествуем, и постараемся понять, почему он именно таков. Некоторые символы в этом гербе нам уже понятны: т — это масса электрона, К — постоянная Планка Л, деленная на 2л, Е — полная энергия электрона в атоме, V(x) — его потенциальная энергия, х — расстояние от ядра до электрона. Несколько сложнее понять символ дифференцирования d2/dx2, но с этим пока ничего нельзя поделать, вначале придется просто запомнить, что это символ второй производной от функции ф, из-за которого уравнение Шрёдингера — не простое, а дифференциальное.
Самое сложное — понять, что собой представляет ф-функция (пси-функция): достаточно сказать, что вначале даже сам Шрёдингер истолковал ее неверно. Мы также поймем это несколько позднее, а пока что просто поверим в то, что ф-функция «как-то» представляет движение электрона в атоме. По-другому, чем матрицы Гейзенберга Xnk и pnkt но все-таки представляет, и притом — хорошо. Настолько хорошо, что с ее помощью все задачи квантовой механики можно решать значительно проще и быстрее, чем с помощью матриц Гейзенберга. Физики довольно быстро оценили преимущества волновой механики: ее универсальность, изящество и простоту — и с тех пор почти забросили механику матричную.
черта и каждый символ исполнены смысла. Вверху — королевские лилии, которые появились в геральдических знаках Франции уже в конце V века — после победы короля Хлодвига над гуннами у берегов реки Ли. (По преданию, воины Хлодвига, возвращаясь домой, украсили свои шлемы и щиты цветами белых лилий «ли-ли», что в переводе с галльского означает «белый-белый».) Внизу герба — корабль, похожий очертаниями на Ситэ — остров посреди Сены, где в древности обитало племя паризиев, по имени которых назван Париж. А форма герба напоминает парус — в память об основном занятии древних обитателей Парижа. Как видите, понять символику герба несложно, хотя по-настоящему близка и естественна она только парижанам.
Подойдем к уравнению Шрёдингера точно так же. Примем его вначале просто как символ квантовой механики, как некий герб квантовой страны, по которой мы теперь путешествуем, и постараемся понять, почему он именно таков. Некоторые символы в этом гербе нам уже понятны: т — это масса электрона, К — постоянная Планка Л, деленная на 2л, Е — полная энергия электрона в атоме, V(x) — его потенциальная энергия, х — расстояние от ядра до электрона. Несколько сложнее понять символ дифференцирования d2/dx2, но с этим пока ничего нельзя поделать, вначале придется просто запомнить, что это символ второй производной от функции ф, из-за которого уравнение Шрёдингера — не простое, а дифференциальное.
Самое сложное — понять, что собой представляет ф-функция (пси-функция): достаточно сказать, что вначале даже сам Шрёдингер истолковал ее неверно. Мы также поймем это несколько позднее, а пока что просто поверим в то, что ф-функция «как-то» представляет движение электрона в атоме. По-другому, чем матрицы Гейзенберга Xnk и pnkt но все-таки представляет, и притом — хорошо. Настолько хорошо, что с ее помощью все задачи квантовой механики можно решать значительно проще и быстрее, чем с помощью матриц Гейзенберга. Физики довольно быстро оценили преимущества волновой механики: ее универсальность, изящество и простоту — и с тех пор почти забросили механику матричную.
 ВОКРУГ КВАНТА
Руджер Иосип Бошкович (1711 —1787) сейчас известен только узкому кругу специалистов, но в начале прошлого века он был знаменит, а его теория атома оказала влияние даже на мировоззрение таких людей, как Фарадей и Максвелл.
Бошкович родился и провел детские годы в Далмации, в Дубровнике (в то время Рагуса). Он был восьмым ребенком из девяти и самым младшим из шести сыновей в семье крупного торговца. То было время, когда любая деятельность людей получала смысл и признание лишь в том случае, если она была освящена церковью или связана с нею. Уже с 8 лет Бошкович учился в местном иезуитском колледже, а в 14 лет отправился на родину матери, в Рим, и после двух лет искуса был принят в Collegium Romanum. Там он отличился в математике, физике и астрономии и в 1736 г. опубликовал первую научную работу о солнечном экваторе и периоде вращения Солнца. В 29 лет он стал преподавателем, а в 33 — священником и членом общества Иисуса. В продолжение четырнадцати лет он преподает физику и математику, изучает аберрацию света и форму Земли, создает карту Ватикана. В 1760 г. Петербургская академия наук избрала его своим иностранным членом.
Бошкович был не только ученый, но и поэт: в 1779 г. он посвятил поэму Людовику XVI, в которой предсказывал ему царствование без солнечных затмений. Яркие качества его богатой натуры в сочетании с блестящим интеллектом открыли ему доступ в высшие духовные, академические и дипломатические круги Европы.
В 1757 г. он едет в Вену в составе посольства и там за 11 месяцев пишет книгу «Теория натуральной философии, приведенная к единому закону сил, существующих в природе», которую он обдумывал в течение двенадцати лет. После возвращения из Вены он отправился в четырехлетнее путешествие в Париж, Лондон, Константинополь, затем читал лекции, работал в обсерватории в Милане, снискал ненависть коллег независимостью взглядов и в 1772 г. оказался в Венеции без средств к жизни. Друзья выхлопотали ему место в Париже, где он прожил десять лет и лишь в 1783 г. возвратился в Италию — умирать. В конце 1786 г. он почувство-
вал признаки умственного расстройства, которое перешло в патологическую меланхолию. После попытки самоубийства он сошел с ума и 13 февраля 1787 г. закончил свою полную страстей жизнь.
ВОКРУГ КВАНТА
Руджер Иосип Бошкович (1711 —1787) сейчас известен только узкому кругу специалистов, но в начале прошлого века он был знаменит, а его теория атома оказала влияние даже на мировоззрение таких людей, как Фарадей и Максвелл.
Бошкович родился и провел детские годы в Далмации, в Дубровнике (в то время Рагуса). Он был восьмым ребенком из девяти и самым младшим из шести сыновей в семье крупного торговца. То было время, когда любая деятельность людей получала смысл и признание лишь в том случае, если она была освящена церковью или связана с нею. Уже с 8 лет Бошкович учился в местном иезуитском колледже, а в 14 лет отправился на родину матери, в Рим, и после двух лет искуса был принят в Collegium Romanum. Там он отличился в математике, физике и астрономии и в 1736 г. опубликовал первую научную работу о солнечном экваторе и периоде вращения Солнца. В 29 лет он стал преподавателем, а в 33 — священником и членом общества Иисуса. В продолжение четырнадцати лет он преподает физику и математику, изучает аберрацию света и форму Земли, создает карту Ватикана. В 1760 г. Петербургская академия наук избрала его своим иностранным членом.
Бошкович был не только ученый, но и поэт: в 1779 г. он посвятил поэму Людовику XVI, в которой предсказывал ему царствование без солнечных затмений. Яркие качества его богатой натуры в сочетании с блестящим интеллектом открыли ему доступ в высшие духовные, академические и дипломатические круги Европы.
В 1757 г. он едет в Вену в составе посольства и там за 11 месяцев пишет книгу «Теория натуральной философии, приведенная к единому закону сил, существующих в природе», которую он обдумывал в течение двенадцати лет. После возвращения из Вены он отправился в четырехлетнее путешествие в Париж, Лондон, Константинополь, затем читал лекции, работал в обсерватории в Милане, снискал ненависть коллег независимостью взглядов и в 1772 г. оказался в Венеции без средств к жизни. Друзья выхлопотали ему место в Париже, где он прожил десять лет и лишь в 1783 г. возвратился в Италию — умирать. В конце 1786 г. он почувство-
вал признаки умственного расстройства, которое перешло в патологическую меланхолию. После попытки самоубийства он сошел с ума и 13 февраля 1787 г. закончил свою полную страстей жизнь.
 очень похоже на уравнение Шрёдингера. Несколько решений этого уравнения — функции Uk(x) — изображены на рисунке. Это обычные, знакомые всем синусоиды, и смысл их очевиден: они изображают форму струны в какой-то момент времени, то есть моментальную фотографию процесса ее колебания. Форма колебаний струны зависит от числа узлов k, то есть числа точек, остающихся неподвижными в процессе колебания. Им соответствует бесконечный набор решений мл(х), которые различаются между собой числом узлов k. Очень важно то, что никаких других, промежуточных, типов колебаний, кроме пронумерованных индексом k, не существует.
По форме уравнение Шрёдингера лишь несущественно отличается от уравнения струны. Чтобы последнее утверждение не выглядело голословным, введем обозначение
очень похоже на уравнение Шрёдингера. Несколько решений этого уравнения — функции Uk(x) — изображены на рисунке. Это обычные, знакомые всем синусоиды, и смысл их очевиден: они изображают форму струны в какой-то момент времени, то есть моментальную фотографию процесса ее колебания. Форма колебаний струны зависит от числа узлов k, то есть числа точек, остающихся неподвижными в процессе колебания. Им соответствует бесконечный набор решений мл(х), которые различаются между собой числом узлов k. Очень важно то, что никаких других, промежуточных, типов колебаний, кроме пронумерованных индексом k, не существует.
По форме уравнение Шрёдингера лишь несущественно отличается от уравнения струны. Чтобы последнее утверждение не выглядело голословным, введем обозначение

 Если потенциал взаимодействия V(x) = 0, то есть электрон движется свободно вдали от ядра, то энергия Е равна его кинетической энергии, E = mv2/2, и, следовательно, длина его волны постоянна: и равна длине волны де Бройля. В этом случае уравнение Шрёдингера в точности совпадает с уравнением струны. При движении в атоме электрон взаимодействует с протоном по закону Кулона, поэтому V(х) = —-е2/х, где е — заряд
электрона и протона. Теперь уже «длина волны электрона» __h_______
V2m[£-V(x)]
не имеет определенного значения и меняется от точки к точке. Однако и в теории колебаний струны такой случай — не новость: если вместо однородной струны колеблется неоднородная, то есть со всевозможными грузами и утолщениями на ней, то ее колебания будут описываться именно таким уравнением. Решения его лишь отдаленно напоминают правильные синусоиды, но они сохраняют главное свойство прежних решений: для них характерно наличие узлов, неподвижных в процессе колебаний, по числу которых эти решения можно пронумеровать.
Таким образом, формально уравнение Шрёдингера ничем не отличается от уравнения нагруженной струны, но смысл их решений, конечно, различен. Вся его сложность — в понятиях, которые мы связываем с величинами, удовлетворяющими этому уравнению.
Взгляните на рисунок, где рядом с синусоидами струны Uk(x) изображены решения фл(х) уравнения Шрёдингера для атома водорода. Они очень похожи. И если даже никаких реальных колебаний, подобных движениям струны, в атоме не происходит, то аналогия не становится от этого менее полезной.
Отмеченная аналогия позволяет пронумеровать решения фя(х) целым числом п точно так же, как решения Uk(x) нумеруются целым числом k, причем никаких других решений, кроме этих, собственных решений в уравнении Шрёдингера не содержится. Более того, целое число п — это и есть то самое непонятное квантовое число, которым Бор нумеровал орбиты электрона в атоме. Теперь оно потеряло свой мистический оттенок: п — это не что иное, как число узлов волновой функции, увеличенное на единицу: п = k + 1.
Первый постулат Бор
Если потенциал взаимодействия V(x) = 0, то есть электрон движется свободно вдали от ядра, то энергия Е равна его кинетической энергии, E = mv2/2, и, следовательно, длина его волны постоянна: и равна длине волны де Бройля. В этом случае уравнение Шрёдингера в точности совпадает с уравнением струны. При движении в атоме электрон взаимодействует с протоном по закону Кулона, поэтому V(х) = —-е2/х, где е — заряд
электрона и протона. Теперь уже «длина волны электрона» __h_______
V2m[£-V(x)]
не имеет определенного значения и меняется от точки к точке. Однако и в теории колебаний струны такой случай — не новость: если вместо однородной струны колеблется неоднородная, то есть со всевозможными грузами и утолщениями на ней, то ее колебания будут описываться именно таким уравнением. Решения его лишь отдаленно напоминают правильные синусоиды, но они сохраняют главное свойство прежних решений: для них характерно наличие узлов, неподвижных в процессе колебаний, по числу которых эти решения можно пронумеровать.
Таким образом, формально уравнение Шрёдингера ничем не отличается от уравнения нагруженной струны, но смысл их решений, конечно, различен. Вся его сложность — в понятиях, которые мы связываем с величинами, удовлетворяющими этому уравнению.
Взгляните на рисунок, где рядом с синусоидами струны Uk(x) изображены решения фл(х) уравнения Шрёдингера для атома водорода. Они очень похожи. И если даже никаких реальных колебаний, подобных движениям струны, в атоме не происходит, то аналогия не становится от этого менее полезной.
Отмеченная аналогия позволяет пронумеровать решения фя(х) целым числом п точно так же, как решения Uk(x) нумеруются целым числом k, причем никаких других решений, кроме этих, собственных решений в уравнении Шрёдингера не содержится. Более того, целое число п — это и есть то самое непонятное квантовое число, которым Бор нумеровал орбиты электрона в атоме. Теперь оно потеряло свой мистический оттенок: п — это не что иное, как число узлов волновой функции, увеличенное на единицу: п = k + 1.
Первый постулат Бор
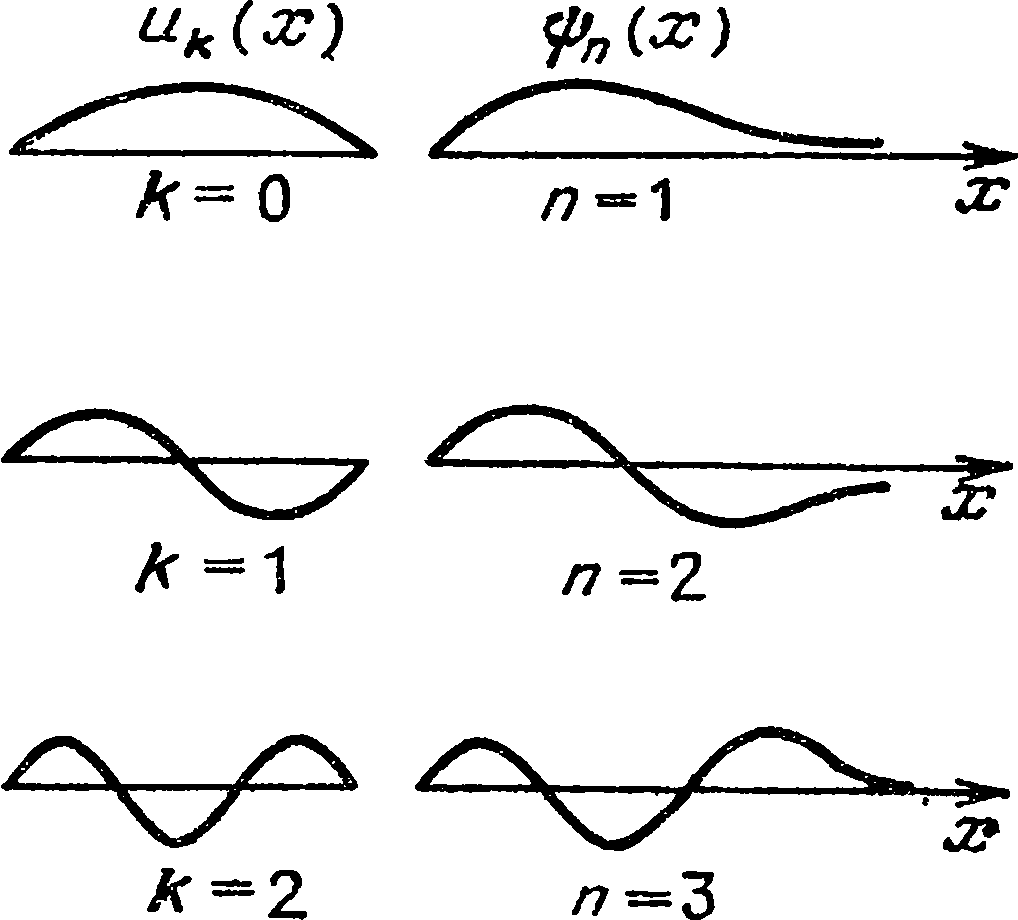 а неким «усилием воли» предписывал электронам двигаться только по тем орбитам в атоме, которые удовлетворяют квантовому условию: mvr = nh. Это был плодотворный, но неестественный для физики принцип, и потому он вызвал у современников сложную смесь восхищения и
недовольства. Требование Шрёдингера значительно понятнее: как бы хитро ни двигался электрон в а‘томе, он должен все-таки находиться внутри атома. Поэтому ф-функция, которая это движение «представляет», независимо от своей природы должна быть сосредоточена вблизи ядра. Вот из этого единственного и естественного граничного условия однозначно следует, что уравнение Шрёдингера имеет решение не всегда, а только при определенных значениях энергии Еп, которым соответствуют собственные функции фл(х). Возможные значения энергии электрона в атоме водорода можно найти, решив уравнение Шрёдингера с потенциалом е2
V(x)=--.
Эти дискретные значения энергии
4 1
me 1
2Й2 п2
стационарных состояний нумеруются целым числом п. Легко видеть, что эти значения в точности совпадают с энергией электрона на стационарных орбитах в атоме Бора, и поэтому надобность в постулатах Бора отпадает — при сохранении всех положительных результатов его модели.
В свое время эти следствия теории Шрёдингера покорили многих своей простотой и естественностью, в уравнение Шрёдингера поверили и стали выяснять последнее: что представляет собой сама функция фл(х). И если функция Uk(x) изображает форму колеблющейся струны, то форму чего изображает ф-функция?
а неким «усилием воли» предписывал электронам двигаться только по тем орбитам в атоме, которые удовлетворяют квантовому условию: mvr = nh. Это был плодотворный, но неестественный для физики принцип, и потому он вызвал у современников сложную смесь восхищения и
недовольства. Требование Шрёдингера значительно понятнее: как бы хитро ни двигался электрон в а‘томе, он должен все-таки находиться внутри атома. Поэтому ф-функция, которая это движение «представляет», независимо от своей природы должна быть сосредоточена вблизи ядра. Вот из этого единственного и естественного граничного условия однозначно следует, что уравнение Шрёдингера имеет решение не всегда, а только при определенных значениях энергии Еп, которым соответствуют собственные функции фл(х). Возможные значения энергии электрона в атоме водорода можно найти, решив уравнение Шрёдингера с потенциалом е2
V(x)=--.
Эти дискретные значения энергии
4 1
me 1
2Й2 п2
стационарных состояний нумеруются целым числом п. Легко видеть, что эти значения в точности совпадают с энергией электрона на стационарных орбитах в атоме Бора, и поэтому надобность в постулатах Бора отпадает — при сохранении всех положительных результатов его модели.
В свое время эти следствия теории Шрёдингера покорили многих своей простотой и естественностью, в уравнение Шрёдингера поверили и стали выяснять последнее: что представляет собой сама функция фл(х). И если функция Uk(x) изображает форму колеблющейся струны, то форму чего изображает ф-функция?
 Однако форма возбужденных атомов уже отличается от сферической, и тем больше, чем сильнее возбужден атом. Возбуждая атом, мы затрачиваем энергию как раз на пере-
Однако форма возбужденных атомов уже отличается от сферической, и тем больше, чем сильнее возбужден атом. Возбуждая атом, мы затрачиваем энергию как раз на пере-
 стройку его электронного облака. Каждой форме облака соответствует своя, вполне определенная энергия. Поэтому, чтобы перевести атом из одной формы в другую, мы должны затратить строго отмеренное количество энергии — квант ftv, как того и требует второй постулат Бора.
До сих пор мы говорили только об атоме водорода. По существу, это единственный атом, который физик знает сейчас во всех деталях и может представить себе его правдоподобный образ. Форма электронного облака в сложных атомах в целом также не очень сильно отличается от наших рисунков. Но рассчитать ее достаточно точно удалось лишь после работ советского физика Владимира Александровича Фока (1898—1974) и английского ученого Дугласа Хартри (1897—1958). Это очень сложная задача, которая под силу только современным вычислительным машинам.
Говоря о форме тел, мы, как правило, предполагаем, что у них есть также и размеры. Это не всегда верно: у бильярдного шара есть и форма и размеры, но о размерах облака говорить уже трудно, хотя форма его обычно не вызывает сомнений. Самое неожиданное следствие новой модели атома состоит в том, что атом не имеет определенных геометрических размеров. Размеров в том смысле, какой мы вкладываем в это понятие, имея перед глазами, например, бильярдный шар. Конечно, поскольку атом имеет определенные очертания, можно выделить из него ту его часть, в которой плотность электронного облака максимальна, и назвать эту часть его размером. Такое определение правомерно, и мы его исполь-
142
зуем (мы постоянно говорим о размерах атома), но при этом следует помнить, что определить строго размеры облака нельзя — это всегда вопрос разумного соглашения.
Уже одно это следствие квантовой механики позволяет объяснить многие наблюдаемые свойства тел. Например, разнообразие геометрических форм кристаллов не должно нас теперь особенно удивлять: из одинаковых кирпичей построены самые разные дома, но нам не кажется странным, что кирпичи — это не дом в миниатюре, а просто кирпичи. У тел, окружающих нас, есть цвет, запах, есть размеры, но атомы, из которых построены эти тела, не обладают ни одним из этих качеств. Точно так же у них нет определенной формы. Неизменны лишь законы квантовой механики, которые управляют этой формой.
Но почему атом, у которого даже нет определенных размеров, так устойчив? Нас не должно удивлять и это: Земля ведь не стоит на трех китах, а наоборот, повиснув в пустоте, уже миллионы лет сохраняет свою орбиту неизменной. Секрет ее устойчивости — в движении и в неизменности динамических законов, которые этим движением управляют. В этом же причина устойчивости атомов, хотя законы, управляющие движением электронов, совсем не похожи на законы небесной механики.
Справедливости ради следует заметить, что квантовая устойчивость значительно надежнее, чем динамическая устойчивость классической механики: разрушенный атом восстанавливает свою структуру, но орбита Земли уже никогда не станет прежней, если однажды ее нарушит внезапное вмешательство инородного космического тела.
Атомы различных элементов разнятся между собой массой и зарядом ядра. Но по какому признаку различить два атома одного и того же элемента? Для арбузов такой вопрос неактуален: никто никогда не видел двух совершенноодинаковых арбузов. Отличить один кирпич от другого уже много сложнее, и только в том случае, если кирпичи битые, задача немного упрощается.
С атомами дело обстоит точно так же. Если их массы и заряды ядер равны, то различить их можно только по форме электронного облака, которая зависит от степени возбуждения атомов. Все невозбужденные атомы одного и того же элемента неразличимы между собой, как кирпичи из одной формы. Роль такой формы для атомов играют динамические законы квантовой механики, для всех них одинаковые.
Портреты атома на рисунках отражают наш нынешний уровень знаний о нем. Это и есть тот современный образ
атома, который заменил собой модели Демокрита, Томсона и Бора. Конечно, и теперешние «портреты» не следует понимать слишком буквально: это отнюдь не «фотографии атомов», подобные фотографиям колеблющейся струны. Ни простыми, ни сложными приборами мы не можем прямо измерить распределение электронной плотности внутри атома, потому что это неизбежно разрушит его (даже арбуз, чтобы проверить его качества, необходимо предварительно разрезать). И все же у нас есть много оснований, чтобы верить найденной картине: с ее помощью мы можем последовательно объяснить все опыты, которые привели нас к такому образу атома.
Теперь нас не должно удивлять, что а-частицы в опытах Резерфорда беспрепятственно пролетали сквозь миллиарды атомов, как через пустоту. Ведь пронизывая кометные хвосты, Земля тоже никогда не отклоняется от своей орбиты. Понятен должен быть нам и механизм появления спектральных линий: просто атом скачком изменяет форму распределения электронного облака, излучая при этом квант энергии. Мы должны теперь понимать и причину расщепления спектральных линий в электрическом (эффект Штарка) и в магнитном (эффект Зеемана) полях: электронное облако заряжено, и различные его формы под воздействием полей немного изменяются, расщепляясь на близкие «подформы», а вместе с ними изменяется и энергия кванта, которую необходимо затратить, чтобы перевести облако из одной формы в другую, и длина волны спектральной линии, которая этому кванту соответствует. Используя уравнения квантовой механики, эти простые качественные рассуждения можно подтвердить точными расчетами и убедиться, что они совпадают с экспериментальными фактами.
Можно и дальше на основе новой модели атома продолжать анализ многочисленных опытов атомной физики. Но сейчас нам важнее понять другое: а почему мы уверены, что найденный нами образ атома соответствует истине?
стройку его электронного облака. Каждой форме облака соответствует своя, вполне определенная энергия. Поэтому, чтобы перевести атом из одной формы в другую, мы должны затратить строго отмеренное количество энергии — квант ftv, как того и требует второй постулат Бора.
До сих пор мы говорили только об атоме водорода. По существу, это единственный атом, который физик знает сейчас во всех деталях и может представить себе его правдоподобный образ. Форма электронного облака в сложных атомах в целом также не очень сильно отличается от наших рисунков. Но рассчитать ее достаточно точно удалось лишь после работ советского физика Владимира Александровича Фока (1898—1974) и английского ученого Дугласа Хартри (1897—1958). Это очень сложная задача, которая под силу только современным вычислительным машинам.
Говоря о форме тел, мы, как правило, предполагаем, что у них есть также и размеры. Это не всегда верно: у бильярдного шара есть и форма и размеры, но о размерах облака говорить уже трудно, хотя форма его обычно не вызывает сомнений. Самое неожиданное следствие новой модели атома состоит в том, что атом не имеет определенных геометрических размеров. Размеров в том смысле, какой мы вкладываем в это понятие, имея перед глазами, например, бильярдный шар. Конечно, поскольку атом имеет определенные очертания, можно выделить из него ту его часть, в которой плотность электронного облака максимальна, и назвать эту часть его размером. Такое определение правомерно, и мы его исполь-
142
зуем (мы постоянно говорим о размерах атома), но при этом следует помнить, что определить строго размеры облака нельзя — это всегда вопрос разумного соглашения.
Уже одно это следствие квантовой механики позволяет объяснить многие наблюдаемые свойства тел. Например, разнообразие геометрических форм кристаллов не должно нас теперь особенно удивлять: из одинаковых кирпичей построены самые разные дома, но нам не кажется странным, что кирпичи — это не дом в миниатюре, а просто кирпичи. У тел, окружающих нас, есть цвет, запах, есть размеры, но атомы, из которых построены эти тела, не обладают ни одним из этих качеств. Точно так же у них нет определенной формы. Неизменны лишь законы квантовой механики, которые управляют этой формой.
Но почему атом, у которого даже нет определенных размеров, так устойчив? Нас не должно удивлять и это: Земля ведь не стоит на трех китах, а наоборот, повиснув в пустоте, уже миллионы лет сохраняет свою орбиту неизменной. Секрет ее устойчивости — в движении и в неизменности динамических законов, которые этим движением управляют. В этом же причина устойчивости атомов, хотя законы, управляющие движением электронов, совсем не похожи на законы небесной механики.
Справедливости ради следует заметить, что квантовая устойчивость значительно надежнее, чем динамическая устойчивость классической механики: разрушенный атом восстанавливает свою структуру, но орбита Земли уже никогда не станет прежней, если однажды ее нарушит внезапное вмешательство инородного космического тела.
Атомы различных элементов разнятся между собой массой и зарядом ядра. Но по какому признаку различить два атома одного и того же элемента? Для арбузов такой вопрос неактуален: никто никогда не видел двух совершенноодинаковых арбузов. Отличить один кирпич от другого уже много сложнее, и только в том случае, если кирпичи битые, задача немного упрощается.
С атомами дело обстоит точно так же. Если их массы и заряды ядер равны, то различить их можно только по форме электронного облака, которая зависит от степени возбуждения атомов. Все невозбужденные атомы одного и того же элемента неразличимы между собой, как кирпичи из одной формы. Роль такой формы для атомов играют динамические законы квантовой механики, для всех них одинаковые.
Портреты атома на рисунках отражают наш нынешний уровень знаний о нем. Это и есть тот современный образ
атома, который заменил собой модели Демокрита, Томсона и Бора. Конечно, и теперешние «портреты» не следует понимать слишком буквально: это отнюдь не «фотографии атомов», подобные фотографиям колеблющейся струны. Ни простыми, ни сложными приборами мы не можем прямо измерить распределение электронной плотности внутри атома, потому что это неизбежно разрушит его (даже арбуз, чтобы проверить его качества, необходимо предварительно разрезать). И все же у нас есть много оснований, чтобы верить найденной картине: с ее помощью мы можем последовательно объяснить все опыты, которые привели нас к такому образу атома.
Теперь нас не должно удивлять, что а-частицы в опытах Резерфорда беспрепятственно пролетали сквозь миллиарды атомов, как через пустоту. Ведь пронизывая кометные хвосты, Земля тоже никогда не отклоняется от своей орбиты. Понятен должен быть нам и механизм появления спектральных линий: просто атом скачком изменяет форму распределения электронного облака, излучая при этом квант энергии. Мы должны теперь понимать и причину расщепления спектральных линий в электрическом (эффект Штарка) и в магнитном (эффект Зеемана) полях: электронное облако заряжено, и различные его формы под воздействием полей немного изменяются, расщепляясь на близкие «подформы», а вместе с ними изменяется и энергия кванта, которую необходимо затратить, чтобы перевести облако из одной формы в другую, и длина волны спектральной линии, которая этому кванту соответствует. Используя уравнения квантовой механики, эти простые качественные рассуждения можно подтвердить точными расчетами и убедиться, что они совпадают с экспериментальными фактами.
Можно и дальше на основе новой модели атома продолжать анализ многочисленных опытов атомной физики. Но сейчас нам важнее понять другое: а почему мы уверены, что найденный нами образ атома соответствует истине?
 ла обращения с ними. После этого мы можем предсказать все: как изменится цвет тела при нагревании, какие спектральные линии оно при этом испустит и как изменится их частота, если поместить тело в электрическое или магнитное поле. Мы можем предсказать форму кристаллов, их теплоемкость и электропроводность. Мы можем, наконец, построить атомную электростанцию и атомный ледокол — и они будут исправно работать. И все это — без малейших ссылок на истинную форму атома.
На этом основании многие (с легкой руки Гейзенберга) предлагают обходиться в квантовой механике вообще без наглядных образов. Целесообразность такой крайности можно оспаривать, но отрицать ее возможность безоговорочно нельзя. На вопрос: «Что такое атом?»— сторонники крайних мер отвечают лаконично: «Атом есть система дифференциальных уравнений». К сожалению, в этой шутке много правды. По сравнению с целым арбузом «атом арбуза» очень беден свойствами. Однако свойства эти противоречивы и слить их воедино без насилий над логикой и здравым смыслом можно только в уравнениях квантовой механики.
Квантовая механика — это математическая схема, позволяющая вычислять физически измеримые характеристики атомных явлений. Если бы задача физики заключалась только в этом, то построение механики атома можно было бы считать законченным. Однако физика призвана дать нам нечто большее — рациональную картину мира. Выполнить столь обширную программу с одними формулами и числами нельзя — для этого необходимо найти образы и сформулировать понятия, им соответствующие. Особенно важно это для всех нефизиков, которые не знают и не понимают формул квантовой механики. Для них язык образов и понятий — единственный способ проникнуть в глубь атома. Со времен Демокрита мы продвинулись на этом пути довольно далеко и сейчас нарисовали себе более или менее удовлетворительную картину атома. Однако до совершенства ей не хватает нескольких штрихов.
ла обращения с ними. После этого мы можем предсказать все: как изменится цвет тела при нагревании, какие спектральные линии оно при этом испустит и как изменится их частота, если поместить тело в электрическое или магнитное поле. Мы можем предсказать форму кристаллов, их теплоемкость и электропроводность. Мы можем, наконец, построить атомную электростанцию и атомный ледокол — и они будут исправно работать. И все это — без малейших ссылок на истинную форму атома.
На этом основании многие (с легкой руки Гейзенберга) предлагают обходиться в квантовой механике вообще без наглядных образов. Целесообразность такой крайности можно оспаривать, но отрицать ее возможность безоговорочно нельзя. На вопрос: «Что такое атом?»— сторонники крайних мер отвечают лаконично: «Атом есть система дифференциальных уравнений». К сожалению, в этой шутке много правды. По сравнению с целым арбузом «атом арбуза» очень беден свойствами. Однако свойства эти противоречивы и слить их воедино без насилий над логикой и здравым смыслом можно только в уравнениях квантовой механики.
Квантовая механика — это математическая схема, позволяющая вычислять физически измеримые характеристики атомных явлений. Если бы задача физики заключалась только в этом, то построение механики атома можно было бы считать законченным. Однако физика призвана дать нам нечто большее — рациональную картину мира. Выполнить столь обширную программу с одними формулами и числами нельзя — для этого необходимо найти образы и сформулировать понятия, им соответствующие. Особенно важно это для всех нефизиков, которые не знают и не понимают формул квантовой механики. Для них язык образов и понятий — единственный способ проникнуть в глубь атома. Со времен Демокрита мы продвинулись на этом пути довольно далеко и сейчас нарисовали себе более или менее удовлетворительную картину атома. Однако до совершенства ей не хватает нескольких штрихов.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
 Кентацр
В начале 20-х годов физики Макс Борн и Джеймс Франк и математик Давид Гильберт организовали в Гёттингене «Семинар по материи», на котором задолго до работ Гейзенберга и Шрёдингера стали употреблять термин «квантовая механика». В нем принимали участие и признанные в то время ученые, и знаменитая впоследствии молодежь. Почти каждый семинар Гильберт начинал вопросом: «Итак, господа, подобно вам, я хотел бы, чтобы мне сказали точно — что такое атом?»
Сейчас мы знаем об атоме больше, чем все участники семинара тех лет, однако ответить Гильберту с полным знанием дела мы еще не готовы. Нам известно теперь довольно много фактов квантовой физики, но пока еще недостает понятий, чтобы эти факты правильно истолковать.
Благодаря Нильсу Бору даже сейчас, много лет спустя, при слове «атом» непроизвольно приходит на ум именно «планетарный атом», то есть маленькая планетная система из ядра и электронов. Только потом усилием воли мы заставляем себя вспомнить, что атому присущи также и волновые свойства. Сейчас, как и прежде, обе идеи — «электрон-волна» и «электрон-частица» существуют в нашем сознании независимо, и невольно мы пытаемся от одной из них избавиться. «Частица или волна?»— к этому вопросу в 20-х годах физики возвращались постоянно: стремление к определенности заложено в человеке очень глубоко.
К весне 1926 г. в атомной физике сложилось любопытное положение: порознь и независимо возникли сразу две квантовые механики, исходные посылки которых резко различались. Гейзенберг вслед за Бором был убежден, что электрон — частица, и свои матричные уравнения написал в этом убеждении. Шрёдингер смог вывести свое дифференциальное уравнение, лишь поверив вместе с де Бройлем в волновые свойства электрона.
Гейзенберг требовал, чтобы в уравнения входили только те величины, которые можно непосредственно измерить на опыте: частоты спектральных линий и их интенсивности. На этом основании он исключил из теории понятие «траектория электронов в атоме» как величину принципиально ненаблюдаемую. Шрёдингер тоже не использовал понятия траектории, однако записал свое уравнение для ф-функции, которая сама по себе измерена быть не может и физический смысл которой поначалу не был ясен никому, включая и самого Шрёдингера.
Опыт — последний судья во всех спорах — вначале решительно был на стороне матричной механики. В самом деле, из опытов Фарадея следовала неделимость электрического заряда, и дальнейшие опыты Крукса и Дж. Дж. Томсона определенно это доказали. Таким свойством может обладать только частица. Опыты Милликена и фотографии следов электрона в камере Вильсона устранили последние в этом сомнения. Но планетарный атом неустойчив, то есть представления об электроне-частице резко противоречили факту удивительной стабильности атома. Постулаты Бора были специально придуманы для того, чтобы обеспечить устойчивость атома при условии, что электрон — это частица. Де Бройль и Шрёдингер пошли другим путем и показали, что наиболее естественно устойчивость атома можно объяснить, допустив, что электрон — это волна, а не частица. Эту гипотезу вскоре подтвердили прямыми опытами Дэвиссон, Джермер и Дж. П. Томсон, обнаружив у электрона способность к интерференции и дифракции.
Опытам принято верить. Но как поверить сразу двум опытам, если они исключают друг друга? Возникшая ситуация имела примеры в истории физики и все же была настолько необычна, что вначале никто не подозревал о единстве двух механик, а потому все стремились доказать истинность одной из них и ложность другой. Между сторонниками обеих теорий шли ожесточенные споры: одни отстаивали право первородства матричной механики, другие — предпочитали математическую простоту волновой. Конец этим спорам положил Шрёдингер в начале 1926 г., доказав, что обе механики математически эквивалентны. Для каждого физика это означало, что они эквивалентны также и физически, то есть — что перед нами одна и та же механика — механика атома, но записанная в разных формах. Это означало также, что верны исходные предпосылки обеих механик: представления матричной механики'об электроне-частице и представления волновой механики об электроне-волне.
Кентацр
В начале 20-х годов физики Макс Борн и Джеймс Франк и математик Давид Гильберт организовали в Гёттингене «Семинар по материи», на котором задолго до работ Гейзенберга и Шрёдингера стали употреблять термин «квантовая механика». В нем принимали участие и признанные в то время ученые, и знаменитая впоследствии молодежь. Почти каждый семинар Гильберт начинал вопросом: «Итак, господа, подобно вам, я хотел бы, чтобы мне сказали точно — что такое атом?»
Сейчас мы знаем об атоме больше, чем все участники семинара тех лет, однако ответить Гильберту с полным знанием дела мы еще не готовы. Нам известно теперь довольно много фактов квантовой физики, но пока еще недостает понятий, чтобы эти факты правильно истолковать.
Благодаря Нильсу Бору даже сейчас, много лет спустя, при слове «атом» непроизвольно приходит на ум именно «планетарный атом», то есть маленькая планетная система из ядра и электронов. Только потом усилием воли мы заставляем себя вспомнить, что атому присущи также и волновые свойства. Сейчас, как и прежде, обе идеи — «электрон-волна» и «электрон-частица» существуют в нашем сознании независимо, и невольно мы пытаемся от одной из них избавиться. «Частица или волна?»— к этому вопросу в 20-х годах физики возвращались постоянно: стремление к определенности заложено в человеке очень глубоко.
К весне 1926 г. в атомной физике сложилось любопытное положение: порознь и независимо возникли сразу две квантовые механики, исходные посылки которых резко различались. Гейзенберг вслед за Бором был убежден, что электрон — частица, и свои матричные уравнения написал в этом убеждении. Шрёдингер смог вывести свое дифференциальное уравнение, лишь поверив вместе с де Бройлем в волновые свойства электрона.
Гейзенберг требовал, чтобы в уравнения входили только те величины, которые можно непосредственно измерить на опыте: частоты спектральных линий и их интенсивности. На этом основании он исключил из теории понятие «траектория электронов в атоме» как величину принципиально ненаблюдаемую. Шрёдингер тоже не использовал понятия траектории, однако записал свое уравнение для ф-функции, которая сама по себе измерена быть не может и физический смысл которой поначалу не был ясен никому, включая и самого Шрёдингера.
Опыт — последний судья во всех спорах — вначале решительно был на стороне матричной механики. В самом деле, из опытов Фарадея следовала неделимость электрического заряда, и дальнейшие опыты Крукса и Дж. Дж. Томсона определенно это доказали. Таким свойством может обладать только частица. Опыты Милликена и фотографии следов электрона в камере Вильсона устранили последние в этом сомнения. Но планетарный атом неустойчив, то есть представления об электроне-частице резко противоречили факту удивительной стабильности атома. Постулаты Бора были специально придуманы для того, чтобы обеспечить устойчивость атома при условии, что электрон — это частица. Де Бройль и Шрёдингер пошли другим путем и показали, что наиболее естественно устойчивость атома можно объяснить, допустив, что электрон — это волна, а не частица. Эту гипотезу вскоре подтвердили прямыми опытами Дэвиссон, Джермер и Дж. П. Томсон, обнаружив у электрона способность к интерференции и дифракции.
Опытам принято верить. Но как поверить сразу двум опытам, если они исключают друг друга? Возникшая ситуация имела примеры в истории физики и все же была настолько необычна, что вначале никто не подозревал о единстве двух механик, а потому все стремились доказать истинность одной из них и ложность другой. Между сторонниками обеих теорий шли ожесточенные споры: одни отстаивали право первородства матричной механики, другие — предпочитали математическую простоту волновой. Конец этим спорам положил Шрёдингер в начале 1926 г., доказав, что обе механики математически эквивалентны. Для каждого физика это означало, что они эквивалентны также и физически, то есть — что перед нами одна и та же механика — механика атома, но записанная в разных формах. Это означало также, что верны исходные предпосылки обеих механик: представления матричной механики'об электроне-частице и представления волновой механики об электроне-волне.

 Все эти примеры приведены здесь для того, чтобы легче понять конечный итог размышлений о проблеме «волна — частица»: вопрос «волна или частица?» неправильно поставлен: атомный объект — «и волна, и частица» одновременно. Более того, все тела в природе обладают одновременно и волновыми, и корпускулярными свойствами, и свойства эти — лишь различные проявления единого корпускулярно-волнового дуализма. К этой мысли пришли еще в 1924 г. Бор, Крамере и Слэтер. В совместной работе они с определенностью заявили, что «волно
вой характер распространения света, с одной стороны, и его поглощение и испускание квантами, с другой, являются теми экспериментальными фактами, которые следует положить в основу любой атомной теории и для которых не следует искать каких-либо объяснений».
Непривычное, но несомненное единство свойств «волна — частица» отражено в формулах Планка (E = hv) и де Бройля (k = h/mv). Энергия Е и масса т — характеристики частицы; частота v и длина волны X — признаки волнового процесса. А единственная причина, по которой мы не замечаем этого дуализма в повседневной жизни,— малость постоянной Планка. Даже если это случайное обстоятельство, с ним надо считаться.
Если бы мы жили в мире, где значение постоянной Планка сравнимо с его привычными масштабами, наши представления об этом мире резко отличались бы от нынешних. Предметы в нем не имели бы определенных границ, их нельзя было бы двигать произвольно, и нельзя было бы заранее планировать встречи друзей. К счастью, этот мир — гипотетический, поскольку постоянную Планка мы не мбжем менять по своему произволу — она всегда неизменна и очень мала. Но атомы тоже очень малы, поэтому для них этот необычный мир реально существует, и его непривычную логику нам предстоит теперь понять — точно так же, как Гулливеру пришлось постигать образ мыслей лилипутов.
Все эти примеры приведены здесь для того, чтобы легче понять конечный итог размышлений о проблеме «волна — частица»: вопрос «волна или частица?» неправильно поставлен: атомный объект — «и волна, и частица» одновременно. Более того, все тела в природе обладают одновременно и волновыми, и корпускулярными свойствами, и свойства эти — лишь различные проявления единого корпускулярно-волнового дуализма. К этой мысли пришли еще в 1924 г. Бор, Крамере и Слэтер. В совместной работе они с определенностью заявили, что «волно
вой характер распространения света, с одной стороны, и его поглощение и испускание квантами, с другой, являются теми экспериментальными фактами, которые следует положить в основу любой атомной теории и для которых не следует искать каких-либо объяснений».
Непривычное, но несомненное единство свойств «волна — частица» отражено в формулах Планка (E = hv) и де Бройля (k = h/mv). Энергия Е и масса т — характеристики частицы; частота v и длина волны X — признаки волнового процесса. А единственная причина, по которой мы не замечаем этого дуализма в повседневной жизни,— малость постоянной Планка. Даже если это случайное обстоятельство, с ним надо считаться.
Если бы мы жили в мире, где значение постоянной Планка сравнимо с его привычными масштабами, наши представления об этом мире резко отличались бы от нынешних. Предметы в нем не имели бы определенных границ, их нельзя было бы двигать произвольно, и нельзя было бы заранее планировать встречи друзей. К счастью, этот мир — гипотетический, поскольку постоянную Планка мы не мбжем менять по своему произволу — она всегда неизменна и очень мала. Но атомы тоже очень малы, поэтому для них этот необычный мир реально существует, и его непривычную логику нам предстоит теперь понять — точно так же, как Гулливеру пришлось постигать образ мыслей лилипутов.
 дят только квантом: или — все, или — ничего. Мы не можем как угодно слабо воздействовать на квантовую систему — до определенного момента она этого воздействия вообще не почувствует. Но коль скоро воздействие выросло настолько, что система готова его воспринять,—
она скачком переходит в новое (тоже квантовое) состояние или же просто гибнет.
Процесс наблюдения в квантовой механике напоминает скорее вкус, чем зрение. «Для того чтобы узнать свойства пудинга, его необходимо съесть»,— любили повторять создатели квантовой механики. И подобно тому как, съев однажды пудинг, мы не в состоянии еще раз проверить свое впечатление о его достоинствах, мы не можем беспредельно уточнять наши сведения о квантовой системе: ее разрушит, как правило, уже первое измерение. Гейзенберг не только понял впервые этот суровый факт, но и сумел записать его на строгом языке формул.
Соотношение неопределенностей — одна из самых важных формул квантовой механики, в ней как бы сконцентрированы ее самые существенные особенности. После его открытия пришлось пересмотреть не только основы физики, но и теорию познания. Этот последний шаг оказался под силу лишь Нильсу Бору, который счастливо сочетал в себе могучий интеллект настоящего ученого и философский склад ума истинного мыслителя. В свое время он создал систему образов квантовой механики, теперь, четырнадцать лет спустя, он тщательно оттачивал систему ее понятий. После Бора стало ясно, что и соотношение неопределенностей, и корпускулярно-волновой дуализм — лишь частные проявления более общего принципа — принципа дополнительности.
дят только квантом: или — все, или — ничего. Мы не можем как угодно слабо воздействовать на квантовую систему — до определенного момента она этого воздействия вообще не почувствует. Но коль скоро воздействие выросло настолько, что система готова его воспринять,—
она скачком переходит в новое (тоже квантовое) состояние или же просто гибнет.
Процесс наблюдения в квантовой механике напоминает скорее вкус, чем зрение. «Для того чтобы узнать свойства пудинга, его необходимо съесть»,— любили повторять создатели квантовой механики. И подобно тому как, съев однажды пудинг, мы не в состоянии еще раз проверить свое впечатление о его достоинствах, мы не можем беспредельно уточнять наши сведения о квантовой системе: ее разрушит, как правило, уже первое измерение. Гейзенберг не только понял впервые этот суровый факт, но и сумел записать его на строгом языке формул.
Соотношение неопределенностей — одна из самых важных формул квантовой механики, в ней как бы сконцентрированы ее самые существенные особенности. После его открытия пришлось пересмотреть не только основы физики, но и теорию познания. Этот последний шаг оказался под силу лишь Нильсу Бору, который счастливо сочетал в себе могучий интеллект настоящего ученого и философский склад ума истинного мыслителя. В свое время он создал систему образов квантовой механики, теперь, четырнадцать лет спустя, он тщательно оттачивал систему ее понятий. После Бора стало ясно, что и соотношение неопределенностей, и корпускулярно-волновой дуализм — лишь частные проявления более общего принципа — принципа дополнительности.
 ВОКРУГ КВАНТА
В пору становления квантовой механики даже хорошие физики с горечью шутили, что теперь им приходится по понедельникам, средам и пятницам представлять электрон частицей, а в остальные дни — волной. Нильс Бор с присущим ему юмором в 1924 г. говорил: «Даже если Эйнштейн пришлет мне телеграмму с сообщением об окончательном доказательстве реальности световых квантов, то и тогда она дойдет до меня только благодаря существованию радиоволн».
«Это в высшей степени парадоксально и способно привести в замешательство,— писал Дэвиссон в своей знаменитой статье 1928 г. с характерным названием «Существуют ли электронные волны?» — Мы должны поверить не только в то, что в определенном смысле кролики суть кошки, но также в то, что в неком смысле кошки суть кролики».
Такой способ мышления приводил к множеству парадоксов, от которых мы будем избавлены, если сразу же заставим себя не разделять в электроне свойства «волна — частица». Только после этого соотношение неопределенностей Гейзенберга перестанет быть чем-то странным и превратится в простое следствие корпускулярно-волнового дуализма.
В волновой оптике давно знали, что ни в какой микроскоп нельзя разглядеть частицу, если ее размеры меньше чем половина длины волны света, которым она освещена. В этом не видели ничего странного: волны света существуют сами по себе, частица — сама по себе. Но когда выяснилось, что частице тоже можно приписать длину волны, тогда это утверждение волновой оптики превратилось в соотношение неопределенностей: не может частица сама себя локализовать точнее, чем на половине длины своей волны.
ВОКРУГ КВАНТА
В пору становления квантовой механики даже хорошие физики с горечью шутили, что теперь им приходится по понедельникам, средам и пятницам представлять электрон частицей, а в остальные дни — волной. Нильс Бор с присущим ему юмором в 1924 г. говорил: «Даже если Эйнштейн пришлет мне телеграмму с сообщением об окончательном доказательстве реальности световых квантов, то и тогда она дойдет до меня только благодаря существованию радиоволн».
«Это в высшей степени парадоксально и способно привести в замешательство,— писал Дэвиссон в своей знаменитой статье 1928 г. с характерным названием «Существуют ли электронные волны?» — Мы должны поверить не только в то, что в определенном смысле кролики суть кошки, но также в то, что в неком смысле кошки суть кролики».
Такой способ мышления приводил к множеству парадоксов, от которых мы будем избавлены, если сразу же заставим себя не разделять в электроне свойства «волна — частица». Только после этого соотношение неопределенностей Гейзенберга перестанет быть чем-то странным и превратится в простое следствие корпускулярно-волнового дуализма.
В волновой оптике давно знали, что ни в какой микроскоп нельзя разглядеть частицу, если ее размеры меньше чем половина длины волны света, которым она освещена. В этом не видели ничего странного: волны света существуют сами по себе, частица — сама по себе. Но когда выяснилось, что частице тоже можно приписать длину волны, тогда это утверждение волновой оптики превратилось в соотношение неопределенностей: не может частица сама себя локализовать точнее, чем на половине длины своей волны.
 Как и при игре в «орел — решку», эту вероятность можно измерить. Допустим, мы произвели 100 выстрелов и 40 раз попали в «десятку», 30 раз — в «девятку», 15 — в «восьмерку» и так далее — до нуля. Тогда вероятность попадания в «десятку», «девятку», «восьмерку» и т. д. соответственно
IFio = 4O/1OO = O,4,
№9 = 0,3, 1^8 = 0,15 и т. д.
Можно даже построить диаграмму эллипса рассеяния, отложив по горизонтали числа 1, 2, 3, ..., а по вертикали — вероятности попадания в соответствующие им области мишени.
Если мы возьмем теперь точно такую же мишень и вновь 100 раз по ней выстрелим, то расположение отверстий на ней будет совсем другим, чем на первой мишени. Но число попаданий в «десятку», «девятку» и т. д. останется примерно тем же самым, а следовательно, и диаграмма эллипса рассеяния также останется без изменений. Конечно, для разных стрелков диаграммы различны: для опытного стрелка она уже, для неопытного — шире. Но для каждого отдельного стрелка она остается неизменной, так что опытный тренер по одному виду мишени может установить, кому из его учеников она принадлежит.
Даже на этом простом примере видно, что «законы случая» — не пустая игра слов. Конечно, каждая из пуль попадает в случайную точку мишени, которую нельзя предсказать заранее. Однако при большом числе выстрелов попадания образуют настолько закономерную картину, что мы воспринимаем ее как достоверную и совершенно забываем о вероятности, лежащей в ее основе.
Как и при игре в «орел — решку», эту вероятность можно измерить. Допустим, мы произвели 100 выстрелов и 40 раз попали в «десятку», 30 раз — в «девятку», 15 — в «восьмерку» и так далее — до нуля. Тогда вероятность попадания в «десятку», «девятку», «восьмерку» и т. д. соответственно
IFio = 4O/1OO = O,4,
№9 = 0,3, 1^8 = 0,15 и т. д.
Можно даже построить диаграмму эллипса рассеяния, отложив по горизонтали числа 1, 2, 3, ..., а по вертикали — вероятности попадания в соответствующие им области мишени.
Если мы возьмем теперь точно такую же мишень и вновь 100 раз по ней выстрелим, то расположение отверстий на ней будет совсем другим, чем на первой мишени. Но число попаданий в «десятку», «девятку» и т. д. останется примерно тем же самым, а следовательно, и диаграмма эллипса рассеяния также останется без изменений. Конечно, для разных стрелков диаграммы различны: для опытного стрелка она уже, для неопытного — шире. Но для каждого отдельного стрелка она остается неизменной, так что опытный тренер по одному виду мишени может установить, кому из его учеников она принадлежит.
Даже на этом простом примере видно, что «законы случая» — не пустая игра слов. Конечно, каждая из пуль попадает в случайную точку мишени, которую нельзя предсказать заранее. Однако при большом числе выстрелов попадания образуют настолько закономерную картину, что мы воспринимаем ее как достоверную и совершенно забываем о вероятности, лежащей в ее основе.
 Конечно, вовсе не обязательно для каждого электрона брать отдельную пластинку, вполне достаточно одной пла
Этот простой по идее опыт прост настолько, что может даже обидеть некоторых читателей своей тривиальностью. Не случайно, что он был поставлен лишь в 1949 г.: до такой степени физики не сомневались в его исходе, хотя и признавали его желательность и убедительность. (Этот опыт, технически довольно сложный, поставил советский ученый Валентин Александрович Фабрикант.) стинки-мишени, только по-прежнему надо пускать электроны-пули поодиночке. Как и прежде, мы не можем заранее предсказать, в какую точку пластинки попадет каждый следующий электрон. Это — случайное событие. Однако если мы выпустим достаточно много электронов, то получим закономерную дифракционную картину.
С такими явлениями мы уже сталкивались при игре в «орел — решку», при бросании кости, при стрельбе в тире. Эта аналогия приводит к естественному предположению: процесс рассеяния электронов подчиняется законам теории вероятностей. При дальнейшем размышлении и после знакомства с идеями Макса Борна эта догадка сменяется уверенностью.
Конечно, вовсе не обязательно для каждого электрона брать отдельную пластинку, вполне достаточно одной пла
Этот простой по идее опыт прост настолько, что может даже обидеть некоторых читателей своей тривиальностью. Не случайно, что он был поставлен лишь в 1949 г.: до такой степени физики не сомневались в его исходе, хотя и признавали его желательность и убедительность. (Этот опыт, технически довольно сложный, поставил советский ученый Валентин Александрович Фабрикант.) стинки-мишени, только по-прежнему надо пускать электроны-пули поодиночке. Как и прежде, мы не можем заранее предсказать, в какую точку пластинки попадет каждый следующий электрон. Это — случайное событие. Однако если мы выпустим достаточно много электронов, то получим закономерную дифракционную картину.
С такими явлениями мы уже сталкивались при игре в «орел — решку», при бросании кости, при стрельбе в тире. Эта аналогия приводит к естественному предположению: процесс рассеяния электронов подчиняется законам теории вероятностей. При дальнейшем размышлении и после знакомства с идеями Макса Борна эта догадка сменяется уверенностью.
 и даже вычислить их длину. Однако по-прежнему не удавалось объяснить, что следует понимать под словами «волны материи». Пульсацию электрона-шарика? Колебания какого-то эфира? Или вибрацию чего-либо еще более гипотетического? То есть насколько материальны сами «волны материи»?
Летом 1926 г. Макс Борн пришел к следующему выводу: «волны материи» — это «волны вероятности». Они характеризуют движение отдельного электрона и в частности вероятность его попадания в определенную точку фотопластинки.
Всякая новая и глубокая идея не имеет логических оснований, хотя нестрогие аналогии, которые к ней привели, можно проследить почти всегда. Поэтому вместо того, чтобы логически доказывать правоту Борна (это невозможно), попытаемся почувствовать естественность его гипотезы. Обратимся снова к игре в «орел — решку» и вспомним причины, которые вынудили нас тогда применить теорию вероятностей. Их три:
независимость каждого последующего бросания монеты от предыдущего;
полная неразличимость отдельных бросаний; случайность исхода любого отдельного бросания, которая проистекает от полного незнания начальных условий каждого опыта, то есть от неопределенности начальных координаты и импульса монеты.
Все три условия выполняются в атомных явлениях, и в частности в опытах по рассеянию электронов. В самом деле:
электрон как частица должен рассеиваться независимо от других;
электроны так бедны свойствами (заряд, масса, спин — и это все), что в квантовой механике они неразличимы, а вместе с тем неразличимы и отдельные акты рассеяния;
и, наконец, главное: точные значения координат и импульсов электронов нельзя задать в принципе, поскольку это запрещено соотношением неопределенностей Гейзенберга.
В таких условиях бессмысленно искать траекторию каждого электрона. Вместо этого мы должны научиться вычислять вероятность р(х) попадания электронов в определенное
место х фотопластинки (или, как принято говорить в физике, вычислить функцию распределения р(х)).
При игре в «орел — решку» это очень просто: даже без вычислений ясно, что вероятность выпадания «орла» равна 1 /2. В квантовой механике дело немного осложняется. Чтобы вычислить функцию р(х), описывающую распределение электронов на фотопластинке, необходимо решить уравнение Шрёдингера.
Макс Борн утверждал: вероятность р(х) найти электрон в точке х равна квадрату волновой функции ф(х): p(x)=|t|>(x)|2.
График функции р(х) выглядит сложнее, чем диаграмма эллипса рассеяния при стрельбе в тире. Но если вид эллипса нам предсказать не под силу, то функцию р(х) мы можем вычислить заранее. Ее вид однозначно определяется законами квантовой механики; несмотря на свою необычность, они все-таки существуют, чего нельзя сказать с уверенностью о законах поведения человека, от которого зависит эллипс рассеяния.
и даже вычислить их длину. Однако по-прежнему не удавалось объяснить, что следует понимать под словами «волны материи». Пульсацию электрона-шарика? Колебания какого-то эфира? Или вибрацию чего-либо еще более гипотетического? То есть насколько материальны сами «волны материи»?
Летом 1926 г. Макс Борн пришел к следующему выводу: «волны материи» — это «волны вероятности». Они характеризуют движение отдельного электрона и в частности вероятность его попадания в определенную точку фотопластинки.
Всякая новая и глубокая идея не имеет логических оснований, хотя нестрогие аналогии, которые к ней привели, можно проследить почти всегда. Поэтому вместо того, чтобы логически доказывать правоту Борна (это невозможно), попытаемся почувствовать естественность его гипотезы. Обратимся снова к игре в «орел — решку» и вспомним причины, которые вынудили нас тогда применить теорию вероятностей. Их три:
независимость каждого последующего бросания монеты от предыдущего;
полная неразличимость отдельных бросаний; случайность исхода любого отдельного бросания, которая проистекает от полного незнания начальных условий каждого опыта, то есть от неопределенности начальных координаты и импульса монеты.
Все три условия выполняются в атомных явлениях, и в частности в опытах по рассеянию электронов. В самом деле:
электрон как частица должен рассеиваться независимо от других;
электроны так бедны свойствами (заряд, масса, спин — и это все), что в квантовой механике они неразличимы, а вместе с тем неразличимы и отдельные акты рассеяния;
и, наконец, главное: точные значения координат и импульсов электронов нельзя задать в принципе, поскольку это запрещено соотношением неопределенностей Гейзенберга.
В таких условиях бессмысленно искать траекторию каждого электрона. Вместо этого мы должны научиться вычислять вероятность р(х) попадания электронов в определенное
место х фотопластинки (или, как принято говорить в физике, вычислить функцию распределения р(х)).
При игре в «орел — решку» это очень просто: даже без вычислений ясно, что вероятность выпадания «орла» равна 1 /2. В квантовой механике дело немного осложняется. Чтобы вычислить функцию р(х), описывающую распределение электронов на фотопластинке, необходимо решить уравнение Шрёдингера.
Макс Борн утверждал: вероятность р(х) найти электрон в точке х равна квадрату волновой функции ф(х): p(x)=|t|>(x)|2.
График функции р(х) выглядит сложнее, чем диаграмма эллипса рассеяния при стрельбе в тире. Но если вид эллипса нам предсказать не под силу, то функцию р(х) мы можем вычислить заранее. Ее вид однозначно определяется законами квантовой механики; несмотря на свою необычность, они все-таки существуют, чего нельзя сказать с уверенностью о законах поведения человека, от которого зависит эллипс рассеяния.
 в силу соотношения неопределенностей мы в принципе не можем знать настоящее во всех деталях. Заключение же остается верным, если понимать его теперь по-новому.
Можно без конца жонглировать парадоксами «закономерная случайность», «достоверная вероятность», однако это ничего не прибавит к нашим знаниям об атоме. Суть не в этом. Просто нужно понять хотя бы однажды, что вероятностное описание атома — это не результат усреднения пока еще неизвестных субатомных явлений, а принципиальный предел возможностей нынешней науки: пока остается в силе соотношение неопределенностей Гейзенберга, мы не можем беспредельно уточнять наши сведения об индивидуальных квантовых объектах. По существу, нам это и не нужно: все тела в природе состоят из огромного числа атомов, а свойства таких систем квантовая механика предсказывает однозначно и без всякого произвола.
Понятие о вероятности завершило логическую схему квантовой механики. Только с его помощью удалось логически непротиворечиво осуществить высший синтез дополнительных пар понятий: волна — частица, непрерывность —дискретность, причинность — случайность, явление — наблюдение. Лишь после этого удалось, наконец, установить, что все эти понятия образуют неделимую систему и каждое из них зависит от контекста других. Точно так же, как нельзя объяснить, кто такой Геракл, не упоминая при этом Зевса, Атланта, Медузу Горгону, кентавра Хирона: только все вместе они образуют неповторимую ткань единого древнего мифа.
Ответы квантовой механики на вопросы, которые мы задаем природе, зависят от того, какую сторону атомного явления мы хотим изучить более пристально.
Изучая природу, мы всегда — сознательно или бессознательно — расчленяем ее на две части: на объект и наблюдателя. Разделение это неоднозначно и зависит от того, какое явление мы изучаем и что мы хотим о нем узнать. Если под явлением мы понимаем движение отдельной частицы, то это событие дискретно, случайно и большей частью ненаблюдаемо. Но если явлением мы называем результат наблюдения за движением многочисленных одинаковых квантовых объектов, то это событие непрерывно, закономерно и описывается волновой функцией.
Квантовая механика изучает только такие явления и объекты. Для них она дает достоверные и однозначные предсказания, которые до сих пор ни разу не были опровергнуты опытом.
в силу соотношения неопределенностей мы в принципе не можем знать настоящее во всех деталях. Заключение же остается верным, если понимать его теперь по-новому.
Можно без конца жонглировать парадоксами «закономерная случайность», «достоверная вероятность», однако это ничего не прибавит к нашим знаниям об атоме. Суть не в этом. Просто нужно понять хотя бы однажды, что вероятностное описание атома — это не результат усреднения пока еще неизвестных субатомных явлений, а принципиальный предел возможностей нынешней науки: пока остается в силе соотношение неопределенностей Гейзенберга, мы не можем беспредельно уточнять наши сведения об индивидуальных квантовых объектах. По существу, нам это и не нужно: все тела в природе состоят из огромного числа атомов, а свойства таких систем квантовая механика предсказывает однозначно и без всякого произвола.
Понятие о вероятности завершило логическую схему квантовой механики. Только с его помощью удалось логически непротиворечиво осуществить высший синтез дополнительных пар понятий: волна — частица, непрерывность —дискретность, причинность — случайность, явление — наблюдение. Лишь после этого удалось, наконец, установить, что все эти понятия образуют неделимую систему и каждое из них зависит от контекста других. Точно так же, как нельзя объяснить, кто такой Геракл, не упоминая при этом Зевса, Атланта, Медузу Горгону, кентавра Хирона: только все вместе они образуют неповторимую ткань единого древнего мифа.
Ответы квантовой механики на вопросы, которые мы задаем природе, зависят от того, какую сторону атомного явления мы хотим изучить более пристально.
Изучая природу, мы всегда — сознательно или бессознательно — расчленяем ее на две части: на объект и наблюдателя. Разделение это неоднозначно и зависит от того, какое явление мы изучаем и что мы хотим о нем узнать. Если под явлением мы понимаем движение отдельной частицы, то это событие дискретно, случайно и большей частью ненаблюдаемо. Но если явлением мы называем результат наблюдения за движением многочисленных одинаковых квантовых объектов, то это событие непрерывно, закономерно и описывается волновой функцией.
Квантовая механика изучает только такие явления и объекты. Для них она дает достоверные и однозначные предсказания, которые до сих пор ни разу не были опровергнуты опытом.
 людей, знавших в то время матричное исчисление, поскольку именно он помогал Рихарду Куранту готовить к печати вышедший в 1924 г. знаменитый курс «Методы математической физики» Куранта и Гильберта. На вокзале в Ганновере Йордан представился Борну и предложил свою помощь. Это было как нельзя более кстати, поскольку Паули сотрудничать с Борном отказался и советовал ему вообще не вмешиваться в развитие событий, искренне считая, что новая наука — это «Knabenphysik», фи
зика для мальчиков (Борну в то время было 42 года — слишком много, по мнению Паули). Борн и Йордан за^ вершили свою статью к осени, вскоре к ним присоединился Гейзенберг, и совместно они дали первое последовательное изложение матричной механики (16 ноября 1925 г. их статья «О квантовой механике» поступила в редакцию журнала).
Чуть раньше, 7 ноября того же года, в редакцию поступила статья Дирака «Основные уравнения квантовой механики», в которой он предложил свое математическое оформление идей Гейзенберга. По образованию Дирак был инженером-электриком, но в годы послевоенной депрессии он не нашел работы по специальности и решил продолжить образование в Кембридже под руководством Фаулера, от которого он и узнал о статье Гейзенберга, после того как в сентябре 1925 г. Фаулер получил ее гранки от Борна.
Той же осенью Борн уехал в длительную командировку в Америку и во время пребывания там зимой 1926 г. совместно с Норбертом Винером — будущим создателем кибернетики — ввел одно из самых важных понятий квантовой механики — понятие оператора физической величины, который, в частности, может быть представлен и матрицей, как в схеме Гейзенберга.
Той же зимой Вольфганг Паули с помощью матричной механики нашел энергии уровней атома водорода и показал, что они совпадают с энергиями стационарных состояний в модели атома Бора.
Годом раньше, 29 ноября 1924 г., Луи де Бройль защитил диссертацию «Исследования по теории квантов». В 1910 г. он получил в Сорбонне звание лиценциата литературы по разделу истории, однако под влиянием брата, лекций Ланжевена по теории относительности и чтения книг Пуанкаре «Наука и гипотеза», «Ценность науки» он со всем пылом юности отдался изучению физики.
Брат Луи де Бройля Морис был признанным специалистом в физике рентгеновских лучей и много думал над их природой. Он был согласен с Уильямом Брэггом, который еще в 1912 г., сразу после открытия Лауэ и за 10 лет до опыта Комптона, писал: «Проблема теперь состоит не в том, чтобы выбрать между двумя теориями рентгеновских лучей, а в том, чтобы найти... одну теорию, обладающую возможностями обеих».
людей, знавших в то время матричное исчисление, поскольку именно он помогал Рихарду Куранту готовить к печати вышедший в 1924 г. знаменитый курс «Методы математической физики» Куранта и Гильберта. На вокзале в Ганновере Йордан представился Борну и предложил свою помощь. Это было как нельзя более кстати, поскольку Паули сотрудничать с Борном отказался и советовал ему вообще не вмешиваться в развитие событий, искренне считая, что новая наука — это «Knabenphysik», фи
зика для мальчиков (Борну в то время было 42 года — слишком много, по мнению Паули). Борн и Йордан за^ вершили свою статью к осени, вскоре к ним присоединился Гейзенберг, и совместно они дали первое последовательное изложение матричной механики (16 ноября 1925 г. их статья «О квантовой механике» поступила в редакцию журнала).
Чуть раньше, 7 ноября того же года, в редакцию поступила статья Дирака «Основные уравнения квантовой механики», в которой он предложил свое математическое оформление идей Гейзенберга. По образованию Дирак был инженером-электриком, но в годы послевоенной депрессии он не нашел работы по специальности и решил продолжить образование в Кембридже под руководством Фаулера, от которого он и узнал о статье Гейзенберга, после того как в сентябре 1925 г. Фаулер получил ее гранки от Борна.
Той же осенью Борн уехал в длительную командировку в Америку и во время пребывания там зимой 1926 г. совместно с Норбертом Винером — будущим создателем кибернетики — ввел одно из самых важных понятий квантовой механики — понятие оператора физической величины, который, в частности, может быть представлен и матрицей, как в схеме Гейзенберга.
Той же зимой Вольфганг Паули с помощью матричной механики нашел энергии уровней атома водорода и показал, что они совпадают с энергиями стационарных состояний в модели атома Бора.
Годом раньше, 29 ноября 1924 г., Луи де Бройль защитил диссертацию «Исследования по теории квантов». В 1910 г. он получил в Сорбонне звание лиценциата литературы по разделу истории, однако под влиянием брата, лекций Ланжевена по теории относительности и чтения книг Пуанкаре «Наука и гипотеза», «Ценность науки» он со всем пылом юности отдался изучению физики.
Брат Луи де Бройля Морис был признанным специалистом в физике рентгеновских лучей и много думал над их природой. Он был согласен с Уильямом Брэггом, который еще в 1912 г., сразу после открытия Лауэ и за 10 лет до опыта Комптона, писал: «Проблема теперь состоит не в том, чтобы выбрать между двумя теориями рентгеновских лучей, а в том, чтобы найти... одну теорию, обладающую возможностями обеих».

 Атотархо
Формулировка и уточнение понятий — занятие сложное и не всегда безопасное. В свое время Сократ поплатился жизнью за настойчивые попытки уяснить смысл основных морально-этических понятий: добро и зло, истина и заблуждение, справедливость и закон... Сократ жил в античной Греции времен ее наивысшего расцвета. Как истинный мудрец, он проводил свои дни на солнечных площадях Афин и испытывал сограждан вопросами такого рода: «Скажи мне, многоученый Гиппий, что есть прекрасное?» Ученый собеседник с жаром принимался за объяснения, но вскоре убеждался, что не может выйти за круг примеров: он толковал более или менее понятно, что такое прекрасная женщина, прекрасный горшок с кашей или прекрасная лошадь, но объяснить, что есть прекрасное само по себе, ему всякий раз оказывалось не под силу.
Трагизм этой типичной мыслительной ситуации понимали во все времена. Понимали и смирялись: «Истина лежит за пределами сознания и потому не может быть выражена словами»,— говорили в Древней Индии. В своем стремлении ответить на вопрос «Что такое атом?» мы неизбежно приходим к тем же трудностям. На частных примерах мы постепенно убедились, что атом — это не спектральные линии, им испускаемые, и не многообразие кристаллов, которые из атомов построены, не тепло раскаленного железа и не электроны, вылетающие из атомов.
Подобно собеседникам Сократа, мы теперь вынуждены лризнать, что атом — это нечто неопределимое само по себе, некая общая причина квантовых явлений, которые все в той или иной степени необходимы для его определения. Наблюдая раскаленное железо и спектральные линии, кристаллы и процесс электролиза, электроны в трубке Крукса и рассеяние частиц, мы так или иначе касались различных граней атома. Можем ли мы теперь осмысленно ответить на два основных вопроса, которые задали в самом начале?
Атотархо
Формулировка и уточнение понятий — занятие сложное и не всегда безопасное. В свое время Сократ поплатился жизнью за настойчивые попытки уяснить смысл основных морально-этических понятий: добро и зло, истина и заблуждение, справедливость и закон... Сократ жил в античной Греции времен ее наивысшего расцвета. Как истинный мудрец, он проводил свои дни на солнечных площадях Афин и испытывал сограждан вопросами такого рода: «Скажи мне, многоученый Гиппий, что есть прекрасное?» Ученый собеседник с жаром принимался за объяснения, но вскоре убеждался, что не может выйти за круг примеров: он толковал более или менее понятно, что такое прекрасная женщина, прекрасный горшок с кашей или прекрасная лошадь, но объяснить, что есть прекрасное само по себе, ему всякий раз оказывалось не под силу.
Трагизм этой типичной мыслительной ситуации понимали во все времена. Понимали и смирялись: «Истина лежит за пределами сознания и потому не может быть выражена словами»,— говорили в Древней Индии. В своем стремлении ответить на вопрос «Что такое атом?» мы неизбежно приходим к тем же трудностям. На частных примерах мы постепенно убедились, что атом — это не спектральные линии, им испускаемые, и не многообразие кристаллов, которые из атомов построены, не тепло раскаленного железа и не электроны, вылетающие из атомов.
Подобно собеседникам Сократа, мы теперь вынуждены лризнать, что атом — это нечто неопределимое само по себе, некая общая причина квантовых явлений, которые все в той или иной степени необходимы для его определения. Наблюдая раскаленное железо и спектральные линии, кристаллы и процесс электролиза, электроны в трубке Крукса и рассеяние частиц, мы так или иначе касались различных граней атома. Можем ли мы теперь осмысленно ответить на два основных вопроса, которые задали в самом начале?

 физике состоит в том, чтобы излагать непривычные вещи привычными словами, но каждый раз немного с новой точки зрения. Тем самым добиваются погружения новых понятий из сферы логической и сознательной в сферу интуитивную и подсознательную — необходимое условие всякого творчества.
Такой способ обучения физиков неуловимо деформирует систему их образов, понятий и даже систему ассоциаций. Как всякого человека, хорошо владеющего иностранным языком, физиков коробят безукоризненно правильные словесные конструкции большинства научно-популярных книг: в них они безошибочно различают еле уловимый чужеродный акцент. Невозможно адекватно передать смысл иностранной фразы, не разрушив при этом ее первоначальную структуру. Язык, на котором общаются между собой физики, только по названию и отдельным словам русский, английский или еще какой-то. В действительности это особый язык, словарь и грамматические конструкции которого приводят в отчаяние литературных редакторов. Но при всякой попытке «причесать» корявую физическую фразу по нормам литературного языка она что-то теряет — как иностранные стихи даже в хорошем переводе.
Непричесанная физическая правда состоит в том, что: квантовая механика — это система формул, понятий и образов, которая позволяет объяснить и предсказать наблюдаемые свойства квантовых объектов;
квантовый объект — это физическая реальность, дуальная в своей первооснове, свойства которой можно описать с помощью уравнений квантовой механики.
Два приведенных определения, поставленные рядом, выглядят как насмешка над здравым смыслом. Их точный 194
смысл и в самом деле нельзя вполне понять, если использовать их порознь: только взятые вместе они становятся осмысленными. Конечно, для того чтобы понять и представить себе все многообразие и единство квантовых явлений, одних формальных определений недостаточно: нужно знать их истоки и эволюцию. Именно поэтому мы так долго и тщательно знакомились с опытами, из которых впоследствии выкристаллизовалось понятие «квантовый объект». Само по себе, в отрыве от этих опытов, оно ничего не означает; оно лишь закрепляет на языке формальной логики тот интуитивный образ, который постепенно формируется в нашем сознании во многом помимо нашей воли. Наше теперешнее определение квантовой механики почти дословно совпадает с тем, которое мы привели в самом начале книги. И если теперь оно звучит для вас совсем по-другому, значит, все остальное вы прочли не напрасно.
Рассказ о квантовой механике на этом можно было бы закончить, если бы не одно важное обстоятельство. Дело в том, что, сказав слова: «Атом — это физическая реальность...», мы невольно коснулись обширной пограничной области между физикой и философией.
Физическая реальность — последнее понятие, к которому неизбежно приходят при любой серьезной попытке объяснить что-либо в физике. В силу своей универсальности оно настолько обширно и всеобъемлюще, что определить его только средствами физики оказывается невозможным. Для этого необходимо привлечь философию с ее понятием объективной реальности.
Как известно, объективная реальность — это все то, что есть и было, независимо от нашего сознания. Однако для науки такое определение недостаточно конкретно, поскольку оно ни к чему не обязывает, кроме веры в объективную сущность познаваемого мира. А в это все ученые верят — иначе они не отдавали бы всю свою жизнь познанию этой реальности. Мнения расходятся лишь о природе физической реальности, ее истинности и однозначности. Большая часть физиков признает, что физическая реальность — это та часть объективной реальности, которую мы познаем с помощью опыта и нашего сознания, то есть все те факты и числа, которые мы получаем с помощью приборов, а также их обобщения на языке понятий, придуманных учеными.
Мнения — очень зыбкая вещь. Почему же мы уверены, что картина физической реальности, добытая таким путем, истинна? Или более мягко (кто знает, «что такое истина?») — почему мы убеждены, что эта картина единственно возможна?
физике состоит в том, чтобы излагать непривычные вещи привычными словами, но каждый раз немного с новой точки зрения. Тем самым добиваются погружения новых понятий из сферы логической и сознательной в сферу интуитивную и подсознательную — необходимое условие всякого творчества.
Такой способ обучения физиков неуловимо деформирует систему их образов, понятий и даже систему ассоциаций. Как всякого человека, хорошо владеющего иностранным языком, физиков коробят безукоризненно правильные словесные конструкции большинства научно-популярных книг: в них они безошибочно различают еле уловимый чужеродный акцент. Невозможно адекватно передать смысл иностранной фразы, не разрушив при этом ее первоначальную структуру. Язык, на котором общаются между собой физики, только по названию и отдельным словам русский, английский или еще какой-то. В действительности это особый язык, словарь и грамматические конструкции которого приводят в отчаяние литературных редакторов. Но при всякой попытке «причесать» корявую физическую фразу по нормам литературного языка она что-то теряет — как иностранные стихи даже в хорошем переводе.
Непричесанная физическая правда состоит в том, что: квантовая механика — это система формул, понятий и образов, которая позволяет объяснить и предсказать наблюдаемые свойства квантовых объектов;
квантовый объект — это физическая реальность, дуальная в своей первооснове, свойства которой можно описать с помощью уравнений квантовой механики.
Два приведенных определения, поставленные рядом, выглядят как насмешка над здравым смыслом. Их точный 194
смысл и в самом деле нельзя вполне понять, если использовать их порознь: только взятые вместе они становятся осмысленными. Конечно, для того чтобы понять и представить себе все многообразие и единство квантовых явлений, одних формальных определений недостаточно: нужно знать их истоки и эволюцию. Именно поэтому мы так долго и тщательно знакомились с опытами, из которых впоследствии выкристаллизовалось понятие «квантовый объект». Само по себе, в отрыве от этих опытов, оно ничего не означает; оно лишь закрепляет на языке формальной логики тот интуитивный образ, который постепенно формируется в нашем сознании во многом помимо нашей воли. Наше теперешнее определение квантовой механики почти дословно совпадает с тем, которое мы привели в самом начале книги. И если теперь оно звучит для вас совсем по-другому, значит, все остальное вы прочли не напрасно.
Рассказ о квантовой механике на этом можно было бы закончить, если бы не одно важное обстоятельство. Дело в том, что, сказав слова: «Атом — это физическая реальность...», мы невольно коснулись обширной пограничной области между физикой и философией.
Физическая реальность — последнее понятие, к которому неизбежно приходят при любой серьезной попытке объяснить что-либо в физике. В силу своей универсальности оно настолько обширно и всеобъемлюще, что определить его только средствами физики оказывается невозможным. Для этого необходимо привлечь философию с ее понятием объективной реальности.
Как известно, объективная реальность — это все то, что есть и было, независимо от нашего сознания. Однако для науки такое определение недостаточно конкретно, поскольку оно ни к чему не обязывает, кроме веры в объективную сущность познаваемого мира. А в это все ученые верят — иначе они не отдавали бы всю свою жизнь познанию этой реальности. Мнения расходятся лишь о природе физической реальности, ее истинности и однозначности. Большая часть физиков признает, что физическая реальность — это та часть объективной реальности, которую мы познаем с помощью опыта и нашего сознания, то есть все те факты и числа, которые мы получаем с помощью приборов, а также их обобщения на языке понятий, придуманных учеными.
Мнения — очень зыбкая вещь. Почему же мы уверены, что картина физической реальности, добытая таким путем, истинна? Или более мягко (кто знает, «что такое истина?») — почему мы убеждены, что эта картина единственно возможна?
 тому числу проверенных образов. Такое стремление заложено в человеке очень глубоко, и поэтому у физиков постепенно развилась своя причудливая система образов, которая почти наверное ничему реальному в природе не соответствует, о ней нельзя рассказать словами, но тем не менее она помогает отыскивать связи между явлениями в моменты наивысшего напряжения мысли.
Те цепочки познания, которые мы рисовали,— от явления, через понятия и формулы, к образам — не более чем схемы, дающие довольно слабое представление о сложных процессах, происходящих в сознании ученого, когда в беспорядочном наборе фактов он пытается увидеть простые связи, определить их словами и найти им место в общей картине природы.
Отдельное слово еще не образует языка,— необходим набор слов и правила грамматики, по которым они сочетаются. Точно так же отдельный научный факт, каким бы важным он ни казался, еще ничего не означает сам по себе, если неизвестно его место в общей системе знаний, и лишь вместе со своим толкованием он получает смысл и значение.
Вспомните историю D-линии натрия. Ее наблюдал уже Фраунгофер, но разве мог он подозревать, что держит в руках ключ ко всей квантовой механике? Он видел, что D-линия расщеплена на два компонента. Но разве знал он, что это — влияние спина электрона? Электрон, квантовая механика, спин — во времена Фраунгофера эти понятия еще не были изобретены. А без них D-линия натрия — просто любопытный факт, не ведущий ни к каким глубоким следствиям. Лишь после опытов Крукса, Резерфорда, Томсона, после создания системы понятий и формул, которую назвали квантовой механикой, стало ясно, что D-линия натрия — это один из тех фактов, понимание смысла которых меняет самую основу наших представлений о природе.
Понятия возникают на основе новых фактов,— с этим согласны все. Однако не все отдают себе отчет в том, насколь-
ко смысл новых фактов зависит от понятий, которые используются для их толкования. Гармонию явлений атомного мира мы можем оценить лишь благодаря теории: всякое описание только экспериментальной установки будет безнадежно скучным и неинтересным. Теория делает картину природы не только связной, но также эстетически приемлемой. «Лишь идеи делают экспериментатора — физиком, хронолога — историком, исследователя рукописей — филологом»,— писал и говорил Планк.
Теория — это интуитивное проникновение в сущность наблюдаемых явлений. Она позволяет описать те их свойства, которые лежат по ту сторону нашего сознания и чувственного опыта, и с их помощью объяснить видимую сложность явлений их невидимой простотой. Именно эта форма мышления гением ученых, подобных Дальтону и Бору, создала современную атомистику.
Сложное переплетение фактов, понятий, формул и образов науки очень трудно, да, пожалуй, и невозможно распутать. При всех попытках подобного рода мы неизбежно придем к сакраментальному вопросу: «Что возникло раньше: яйцо или курица?» Никто никогда не узнает тот первый научный факт и то первое научное понятие, с которых началась нынешняя наука. Поэтому все чаще вместо «объяснения природы» естествоиспытатели говорят об описании природы.
«Мы теперь лучше, чем прежнее естествознание, сознаем, что не существует такого надежного исходного пункта, от которого бы шли пути во все области нашего познания, но что все познание, в известной мере, вынуждено парить над бездонной пропастью. Нам приходится всегда начинать где-то с середины и, обсуждая действительность, употреблять понятия, которые лишь постепенно приобретают определенный смысл благодаря их применению...» Эти слова Гейзенберга близки и понятны каждому физику. «Единственная загадка мира — его познаваемость»,— часто повторял Эйнштейн.
Физическая реальность — очень глубокое понятие и, как все глубокие понятия нашего языка, не имеет однозначного смысла. Это понятие первично, и его нельзя достаточно строго определить логически через более простые. Его необходимо принять, предварительно вложив в него тот смысл, который диктует нам вся наша прежняя жизнь и приобретенные в ней знания. Очевидно, с развитием науки смысл этот меняется — точно так же, как и смысл понятия «атом».
С приходом науки понятие реальности изменилось неузнаваемо, и реальность человека XX века так же далека от реальности древних греков, как современный атом от атома
/99
Демокрита Решающие штрихи в новой картине физической реальности дорисовала квантовая физика. Пожалуй, это главная причина, которая будит желание людей понять, «что такое квантовая механика». Как правило, стремление это глубже, чем естественныйпрофессиональный интерес. Дело в том, что при изученйи квантовой механики человек приобретает не только специальные навыки, позволяющие ему рассчитать лазер или атомный котел. Знакомство с квантовой механикой — это некоторый эмоциональный процесс, который заставляет заново пережить всю ее историю. Как всякий нелогический процесс, он строго индивидуален и оставляет неистребимые следы в сознании человека. Это абстрактное знание, приобретенное однажды, необратимо влияет на всю последующую жизнь человека — на его отношение к физике, к другим наукам и даже на его нравственные критерии. Вероятно, так же изменяет человека изучение музыки.
Прочитав предыдущие главы, вы узнали только первые ноты квантовой механики и, быть может, научились брать несколько звучных аккордов. Конечно, только музыкант вполне оценит глубину музыкального замысла, и только физик способен испытывать эстетическое удовлетворение от красоты формул и принципов, и те из вас, кто посвятит себя науке, быть может, поймут это со временем. Однако если, не вникая в «законы гармонии» квантовой механики, вы все же почувствовали красоту ее «мелодии» — задача предыдущего рассказа выполнена.
тому числу проверенных образов. Такое стремление заложено в человеке очень глубоко, и поэтому у физиков постепенно развилась своя причудливая система образов, которая почти наверное ничему реальному в природе не соответствует, о ней нельзя рассказать словами, но тем не менее она помогает отыскивать связи между явлениями в моменты наивысшего напряжения мысли.
Те цепочки познания, которые мы рисовали,— от явления, через понятия и формулы, к образам — не более чем схемы, дающие довольно слабое представление о сложных процессах, происходящих в сознании ученого, когда в беспорядочном наборе фактов он пытается увидеть простые связи, определить их словами и найти им место в общей картине природы.
Отдельное слово еще не образует языка,— необходим набор слов и правила грамматики, по которым они сочетаются. Точно так же отдельный научный факт, каким бы важным он ни казался, еще ничего не означает сам по себе, если неизвестно его место в общей системе знаний, и лишь вместе со своим толкованием он получает смысл и значение.
Вспомните историю D-линии натрия. Ее наблюдал уже Фраунгофер, но разве мог он подозревать, что держит в руках ключ ко всей квантовой механике? Он видел, что D-линия расщеплена на два компонента. Но разве знал он, что это — влияние спина электрона? Электрон, квантовая механика, спин — во времена Фраунгофера эти понятия еще не были изобретены. А без них D-линия натрия — просто любопытный факт, не ведущий ни к каким глубоким следствиям. Лишь после опытов Крукса, Резерфорда, Томсона, после создания системы понятий и формул, которую назвали квантовой механикой, стало ясно, что D-линия натрия — это один из тех фактов, понимание смысла которых меняет самую основу наших представлений о природе.
Понятия возникают на основе новых фактов,— с этим согласны все. Однако не все отдают себе отчет в том, насколь-
ко смысл новых фактов зависит от понятий, которые используются для их толкования. Гармонию явлений атомного мира мы можем оценить лишь благодаря теории: всякое описание только экспериментальной установки будет безнадежно скучным и неинтересным. Теория делает картину природы не только связной, но также эстетически приемлемой. «Лишь идеи делают экспериментатора — физиком, хронолога — историком, исследователя рукописей — филологом»,— писал и говорил Планк.
Теория — это интуитивное проникновение в сущность наблюдаемых явлений. Она позволяет описать те их свойства, которые лежат по ту сторону нашего сознания и чувственного опыта, и с их помощью объяснить видимую сложность явлений их невидимой простотой. Именно эта форма мышления гением ученых, подобных Дальтону и Бору, создала современную атомистику.
Сложное переплетение фактов, понятий, формул и образов науки очень трудно, да, пожалуй, и невозможно распутать. При всех попытках подобного рода мы неизбежно придем к сакраментальному вопросу: «Что возникло раньше: яйцо или курица?» Никто никогда не узнает тот первый научный факт и то первое научное понятие, с которых началась нынешняя наука. Поэтому все чаще вместо «объяснения природы» естествоиспытатели говорят об описании природы.
«Мы теперь лучше, чем прежнее естествознание, сознаем, что не существует такого надежного исходного пункта, от которого бы шли пути во все области нашего познания, но что все познание, в известной мере, вынуждено парить над бездонной пропастью. Нам приходится всегда начинать где-то с середины и, обсуждая действительность, употреблять понятия, которые лишь постепенно приобретают определенный смысл благодаря их применению...» Эти слова Гейзенберга близки и понятны каждому физику. «Единственная загадка мира — его познаваемость»,— часто повторял Эйнштейн.
Физическая реальность — очень глубокое понятие и, как все глубокие понятия нашего языка, не имеет однозначного смысла. Это понятие первично, и его нельзя достаточно строго определить логически через более простые. Его необходимо принять, предварительно вложив в него тот смысл, который диктует нам вся наша прежняя жизнь и приобретенные в ней знания. Очевидно, с развитием науки смысл этот меняется — точно так же, как и смысл понятия «атом».
С приходом науки понятие реальности изменилось неузнаваемо, и реальность человека XX века так же далека от реальности древних греков, как современный атом от атома
/99
Демокрита Решающие штрихи в новой картине физической реальности дорисовала квантовая физика. Пожалуй, это главная причина, которая будит желание людей понять, «что такое квантовая механика». Как правило, стремление это глубже, чем естественныйпрофессиональный интерес. Дело в том, что при изученйи квантовой механики человек приобретает не только специальные навыки, позволяющие ему рассчитать лазер или атомный котел. Знакомство с квантовой механикой — это некоторый эмоциональный процесс, который заставляет заново пережить всю ее историю. Как всякий нелогический процесс, он строго индивидуален и оставляет неистребимые следы в сознании человека. Это абстрактное знание, приобретенное однажды, необратимо влияет на всю последующую жизнь человека — на его отношение к физике, к другим наукам и даже на его нравственные критерии. Вероятно, так же изменяет человека изучение музыки.
Прочитав предыдущие главы, вы узнали только первые ноты квантовой механики и, быть может, научились брать несколько звучных аккордов. Конечно, только музыкант вполне оценит глубину музыкального замысла, и только физик способен испытывать эстетическое удовлетворение от красоты формул и принципов, и те из вас, кто посвятит себя науке, быть может, поймут это со временем. Однако если, не вникая в «законы гармонии» квантовой механики, вы все же почувствовали красоту ее «мелодии» — задача предыдущего рассказа выполнена.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА

 Открытие Рентгена вызвало беспрецедентный и повсеместный интерес среди ученых и широкой публики: достаточно сказать, что статью Рентгена в течение нескольких недель издали пять раз отдельной брошюрой и перевели на несколько языков. Только в течение 1896 г. было опубликовано свыше 1000 научных работ и около 50 книг, посвященных изучению свойств Х-лучей, а в медицинской практике Х-лучи стали использовать уже через несколько недель. Сразу же были «открыты» Г-лучи, N-лучи, лучи Блондло и т. д.
Газеты немедленно подхватили и разнесли сенсацию, и вскоре некая английская фирма начала рекламировать нижнее белье, защищающее от Х-лучей, в сенат одного из североамериканских штатов внесли законопроект о запрещении использования Х-лучей в театральных биноклях, а самого Рентгена уже в середине января вызвали ко двору кайзера для демонстрации открытых им лучей. Публичные показы нового явления проводились повсеместно, на них ходили, как в театр, при виде человеческих костей на экране в публике случались истерики и обмороки. В мае 1896 г. знаменитый Эдисон построил в Нью-Йорке демонстрационный аппарат, который позволял каждому посетителю увидеть тень от костей своей руки. (Этот опыт окончился трагически: демонстратор Эдисона умер от тяжелых ожогов. Вероятно, и для самого Рентгена работа с Х-лучами не прошла бесследно: четверть века спустя он умрет от рака.)
Вспыхнули и споры о приоритете: на открытие рентгеновских лучей со свойственной ему агрессивностью претендовал Ленард (он умудрился до конца жизни сохранить враждебность к Рентгену), нашли даже фотографию в рентгеновских лучах, полученную в Америке за пять лет до Рентгена, вспомнили и Крукса, который жаловался на потемнение фотопластинок, лежащих вблизи работающей трубки. Но, как всегда в таких спорах, претенденты на открытие забыли, что в свое время они говорили и писали не совсем то и далеко не так, как это стало возможным после открытия Рентгена.
Открытие Рентгена вызвало беспрецедентный и повсеместный интерес среди ученых и широкой публики: достаточно сказать, что статью Рентгена в течение нескольких недель издали пять раз отдельной брошюрой и перевели на несколько языков. Только в течение 1896 г. было опубликовано свыше 1000 научных работ и около 50 книг, посвященных изучению свойств Х-лучей, а в медицинской практике Х-лучи стали использовать уже через несколько недель. Сразу же были «открыты» Г-лучи, N-лучи, лучи Блондло и т. д.
Газеты немедленно подхватили и разнесли сенсацию, и вскоре некая английская фирма начала рекламировать нижнее белье, защищающее от Х-лучей, в сенат одного из североамериканских штатов внесли законопроект о запрещении использования Х-лучей в театральных биноклях, а самого Рентгена уже в середине января вызвали ко двору кайзера для демонстрации открытых им лучей. Публичные показы нового явления проводились повсеместно, на них ходили, как в театр, при виде человеческих костей на экране в публике случались истерики и обмороки. В мае 1896 г. знаменитый Эдисон построил в Нью-Йорке демонстрационный аппарат, который позволял каждому посетителю увидеть тень от костей своей руки. (Этот опыт окончился трагически: демонстратор Эдисона умер от тяжелых ожогов. Вероятно, и для самого Рентгена работа с Х-лучами не прошла бесследно: четверть века спустя он умрет от рака.)
Вспыхнули и споры о приоритете: на открытие рентгеновских лучей со свойственной ему агрессивностью претендовал Ленард (он умудрился до конца жизни сохранить враждебность к Рентгену), нашли даже фотографию в рентгеновских лучах, полученную в Америке за пять лет до Рентгена, вспомнили и Крукса, который жаловался на потемнение фотопластинок, лежащих вблизи работающей трубки. Но, как всегда в таких спорах, претенденты на открытие забыли, что в свое время они говорили и писали не совсем то и далеко не так, как это стало возможным после открытия Рентгена.


 П. Кюри М. Кюри
цвет. С помощью электрометра Мария Кюри терпеливо проверила на радиоактивность практически все известные в то время элементы (более 80) и вскоре обнаружила, что из них только торий также обладает этим свойством — и даже в большей степени, чем уран (одновременно с нею и независимо этот факт установил также немецкий ученый Эрхард Карл Шмидт (1865—1949)). Это был важный результат, поскольку он сразу же устранял вопрос об исключительности урана: если существует два радиоактивных элемента, то почему их не может быть больше?
После небольшого перерыва в исследованиях (она ждет ребенка), уже через два месяца после рождения Ирэн, в декабре 1897 г., Мария Кюри с новой энергией возвращается к работе. Среди многочисленных химических веществ и минералов ее особое внимание привлекла смоляная обманка из рудника близ Иоахимсталя в Чехии, из которой в то время добывали уран. Радиоактивность смоляной обманки оказалась в четыре раза выше, чем урана, в ней содержавшегося. Это было неожиданно, поскольку химические анализы показали, что торий в смоляной обманке отсутствует. Тогда Мария Кюри предположила (это была смелая, хотя и строго логичная гипотеза), что в смоляной обманке присутствует не известный ранее радиоактивный элемент в количествах, недоступных обычному химическому анализу. Если это действительно так, то его активность должна быть в тысячи раз больше, чем активность урана, который составлял около 30 % от общего веса руды.
16 декабря 1897 г. появляется первая запись Марии Кюри в лабораторном журнале. В марте 1898 г. Пьер Кюри
оставил свои работы и присоединился к ней. Уже к 12 мая 1898 г. они были уверены, что открыли новый элемент, который впоследствии получит имя «радий», что означает «луч». В июле они обнаружили в отходах руды еще один радиоактивный элемент, названный ими полонием — в память о родине Марии. Наконец, 26 декабря 1898 г. они доложили о своих результатах Французской академии наук. В то время Мария и Пьер уже могли продемонстрировать слушателям препарат радия, который был в 900 раз активнее, чем равное ему по массе количество урана.
Отныне все мысли Марии Кюри сосредоточились на одном желании: выделить радий в чистом виде. Но как это сделать? Без лаборатории, без помощников, без руды, которая к тому же стоит дорого? Однако ясно осознанное желание, как правило, осуществимо, если оно опирается на сильную волю и готовность к лишениям.
При содействии геофизика Эдуарда Зюсса, тогдашнего президента Австрийской академии наук, австрийское правительство согласилось подарить супругам Кюри тонну урановой смоляной обманки. Удалось найти подходящий сарай, куда свалили эту руду, а также другие десять тонн, которые оплатил миллионер барон Эгмон Ротшильд. Для Марии Кюри начались годы напряженной, однообразной и утомительной работы: изо дня в день, в течение многих лет растворять, выпаривать и снова растворять. Ей пришлось почти вручную переработать 11 т руды и провести только одних кристаллизаций несколько тысяч. Впоследствии Мария Кюри вспоминала: «...открытие радия было сделано в жалких условиях: сарай, в котором произошло это событие, уже овеян легендой. Но эта романтическая подробность не была преимуществом: она поглотила наши силы и замедлила осуществление открытия...»
Это была черная и тяжелая работа, в жару и холод, в старом сарае, без всяких мер предосторожности: счетчик радиоактивного излучения и сейчас продолжает угрожающе щелкать, когда к нему подносят страничку из лабораторного журнала Марии и Пьера Кюри тех лет. «Мы сознавали, что наше здоровье не на высоте, что мы подвергаем его тяжелым испытаниям. Как это случается со всеми, кто знает цену совместной жизни, нас иногда охватывал страх перед непоправимым. Тогда какое-то чувство, быть может просто храбрость, приводило Пьера неизменно к одному и тому же выводу: пусть мы будем казаться бездушными существами, нам все равно надо работать»,— писала Мария Кюри много лет спустя.
216
Оба они безвременно ушли из жизни: Пьер в 1906 г. был сбит на улице Парижа ломовым извозчиком, Мария умерла в 1934 г. от последствий радиоактивного облучения.
К 1902 г. Мария Кюри выделила из тонны руды несколько десятых долей грамма концентрированного препарата радия, еще три года спустя она имела 0,4 г чистого хлорида радия и лишь в 1910 г., через 12 лет после начала работы, исполнилась ее мечта: она увидела, наконец, серебристо-белую капельку чистого металла радия массой 0,0085 г. Но эта капелька излучала в 3 млн. раз активнее, чем такая же капелька урана.
Научный подвиг Пьера и Марии Кюри был признан во всем мире еще при их жизни: в 1903 г. они совместно с Анри Беккерелем удостоены Нобелевской премии по физике. В 1911 г., уже после смерти Пьера Кюри, Шведская академия наук присуждает Марии Кюри вторую Нобелевскую премию (по химии) — этой чести за всю историю Нобелевских премий удостоены только три исследователя.
П. Кюри М. Кюри
цвет. С помощью электрометра Мария Кюри терпеливо проверила на радиоактивность практически все известные в то время элементы (более 80) и вскоре обнаружила, что из них только торий также обладает этим свойством — и даже в большей степени, чем уран (одновременно с нею и независимо этот факт установил также немецкий ученый Эрхард Карл Шмидт (1865—1949)). Это был важный результат, поскольку он сразу же устранял вопрос об исключительности урана: если существует два радиоактивных элемента, то почему их не может быть больше?
После небольшого перерыва в исследованиях (она ждет ребенка), уже через два месяца после рождения Ирэн, в декабре 1897 г., Мария Кюри с новой энергией возвращается к работе. Среди многочисленных химических веществ и минералов ее особое внимание привлекла смоляная обманка из рудника близ Иоахимсталя в Чехии, из которой в то время добывали уран. Радиоактивность смоляной обманки оказалась в четыре раза выше, чем урана, в ней содержавшегося. Это было неожиданно, поскольку химические анализы показали, что торий в смоляной обманке отсутствует. Тогда Мария Кюри предположила (это была смелая, хотя и строго логичная гипотеза), что в смоляной обманке присутствует не известный ранее радиоактивный элемент в количествах, недоступных обычному химическому анализу. Если это действительно так, то его активность должна быть в тысячи раз больше, чем активность урана, который составлял около 30 % от общего веса руды.
16 декабря 1897 г. появляется первая запись Марии Кюри в лабораторном журнале. В марте 1898 г. Пьер Кюри
оставил свои работы и присоединился к ней. Уже к 12 мая 1898 г. они были уверены, что открыли новый элемент, который впоследствии получит имя «радий», что означает «луч». В июле они обнаружили в отходах руды еще один радиоактивный элемент, названный ими полонием — в память о родине Марии. Наконец, 26 декабря 1898 г. они доложили о своих результатах Французской академии наук. В то время Мария и Пьер уже могли продемонстрировать слушателям препарат радия, который был в 900 раз активнее, чем равное ему по массе количество урана.
Отныне все мысли Марии Кюри сосредоточились на одном желании: выделить радий в чистом виде. Но как это сделать? Без лаборатории, без помощников, без руды, которая к тому же стоит дорого? Однако ясно осознанное желание, как правило, осуществимо, если оно опирается на сильную волю и готовность к лишениям.
При содействии геофизика Эдуарда Зюсса, тогдашнего президента Австрийской академии наук, австрийское правительство согласилось подарить супругам Кюри тонну урановой смоляной обманки. Удалось найти подходящий сарай, куда свалили эту руду, а также другие десять тонн, которые оплатил миллионер барон Эгмон Ротшильд. Для Марии Кюри начались годы напряженной, однообразной и утомительной работы: изо дня в день, в течение многих лет растворять, выпаривать и снова растворять. Ей пришлось почти вручную переработать 11 т руды и провести только одних кристаллизаций несколько тысяч. Впоследствии Мария Кюри вспоминала: «...открытие радия было сделано в жалких условиях: сарай, в котором произошло это событие, уже овеян легендой. Но эта романтическая подробность не была преимуществом: она поглотила наши силы и замедлила осуществление открытия...»
Это была черная и тяжелая работа, в жару и холод, в старом сарае, без всяких мер предосторожности: счетчик радиоактивного излучения и сейчас продолжает угрожающе щелкать, когда к нему подносят страничку из лабораторного журнала Марии и Пьера Кюри тех лет. «Мы сознавали, что наше здоровье не на высоте, что мы подвергаем его тяжелым испытаниям. Как это случается со всеми, кто знает цену совместной жизни, нас иногда охватывал страх перед непоправимым. Тогда какое-то чувство, быть может просто храбрость, приводило Пьера неизменно к одному и тому же выводу: пусть мы будем казаться бездушными существами, нам все равно надо работать»,— писала Мария Кюри много лет спустя.
216
Оба они безвременно ушли из жизни: Пьер в 1906 г. был сбит на улице Парижа ломовым извозчиком, Мария умерла в 1934 г. от последствий радиоактивного облучения.
К 1902 г. Мария Кюри выделила из тонны руды несколько десятых долей грамма концентрированного препарата радия, еще три года спустя она имела 0,4 г чистого хлорида радия и лишь в 1910 г., через 12 лет после начала работы, исполнилась ее мечта: она увидела, наконец, серебристо-белую капельку чистого металла радия массой 0,0085 г. Но эта капелька излучала в 3 млн. раз активнее, чем такая же капелька урана.
Научный подвиг Пьера и Марии Кюри был признан во всем мире еще при их жизни: в 1903 г. они совместно с Анри Беккерелем удостоены Нобелевской премии по физике. В 1911 г., уже после смерти Пьера Кюри, Шведская академия наук присуждает Марии Кюри вторую Нобелевскую премию (по химии) — этой чести за всю историю Нобелевских премий удостоены только три исследователя.
 этот факт, в то время даже таким людям, как Резерфорд, Содди и Рамзай, потребовалось не менее пяти лет работы.
В нем состояла сложность задачи? Прежде всего, такого понятия, как «ядро атома», тогда еще не изобрели: оно появится только через 11 лет. И хотя электрон уже два года как был известен, само существование атомов не было в то время строго доказано: опыты Перрена будут поставлены лишь 9 лет спустя. Отголосок трудностей тех дней мы чувствуем даже сейчас, при попытке последовательно изложить историю открытий радиоактивности. В самом деле, как мы хорошо теперь знаем, все эти явления относятся к области ядерной физики, а нам приходится анализировать их, тщательно избегая употребления слова «ядро».
В год открытия радия Эрнест Резерфорд был докторантом знаменитого Дж. Дж. Томсона в лаборатории Кавендиша. Узнав об открытиях Беккереля и Кюри, он оставляет свои исследования ионизации газов и уже осенью 1898 г. завершает большую работу по изучению радиоактивности урана. Вскоре он переехал в Канаду, возглавил в Монреале кафедру физики университета Мак-Гилла и с присущими ему энергией и размахом занялся всесторонним изучением нового явления. В отличие от Марии Кюри, которая сосредоточилась на химическом выделении радия в чистом виде, Резерфорда больше всего интересовала физическая природа радиоактивности.
В чем суть явления радиоактивности? Каков ее внутренний механизм? И в чем ее истинная причина? Вот что хотел понять Резерфорд прежде всего.
Для начала он решил изучить свойства а-частиц.
Через три года напряженной работы («Шесть дней в неделю сижу в лаборатории допоздна»,— писал он невесте в Новую Зеландию) Резерфорд был уже почти уверен, что а-частицы — это не что иное, как дважды ионизованные атомы гелия. Он опирался при этом на простой и общеизвестный факт: во всех соединениях урана и тория был обнаружен гелий, причем в больших количествах. Например, из 1 г тория можно прокаливанием выделить около 10 см3 гелия, что примерно в 100 раз превышает объем взятого тория. Гелий, который нашли на Земле за семь лет до этого (кстати, именно в минералах тория), к 1902 г. был уже хорошо изучен, и о нем было известно, что он относится к группе благородных газов и ни в какие химические реакции не вступает. Поэтому объяснить химическими причинами присутствие такого количества гелия в тории не представлялось возможным. 218
Итак, гелий образуется из радиоактивных элементов. Но что при этом происходит с самими элементами?
Вскоре после приезда в Канаду Резерфорд смог объяснить одно наблюдение своего препаратора: оказалось, что соединения тория выделяют какой-то неизвестный радиоактивный газ, который он назвал «эманацией» (дословно — «то, что выделяется»).
Годом позже Пьер и Мария Кюри наблюдали такую же эманацию радия. Дополнительные опыты показали, что это очень тяжелый газ и что он довольно быстро теряет свою радиоактивность: каждые четыре дня она уменьшается вдвое.
Это была новая загадка: к тому времени радиоактивность уже привыкли считать неизменной характеристикой элемента, примерно такой же, как его атомная масса. Что же происходит с радием? И откуда берутся теперь уже два газа — гелий и эманация радия?
Осенью 1900 г. к Резерфорду присоединился молодой и талантливый химик Фредерик Содди (1877—1956). Вскоре они доказали, что эманация радия — это инертный газ, химические свойства которого подобны свойствам всех благородных газов: гелия, неона, аргона, криптона и ксенона. (Совместно с Уильямом Рэлеем их открыл Уильям Рамзай и в 1901 г. догадался, что в таблице Д. И. Менделеева они образуют особую 8-ю группу с нулевой валентностью.)
Через два года вдохновенной работы (оба они были так молоды тогда: одному 29 лет, другому — всего 23!) Резерфорд и Содди пришли к поразительному заключению: радиоактивность есть не что иное, как распад атома на заряженную частицу (именно ее мы воспринимаем как радиоактивное излучение) и атом другого элемента, по своим химическим свойствам отличный от исходного. Образовавшийся при распаде атом также может оказаться радиоактивным и испытать дальнейший распад.
Это утверждение, известное теперь как гипотеза радиоактивного распада, в то время казалось неожиданным и очень смелым. Посудите сами: только в конце века начали соглашаться (да и то не все!) с тем, что атомы существуют. Но при этом никто не допускал даже мысли о том, что они могут быть изменены, а тем более распадаться самопроизвольно. Это убеждение продолжало многовековую традицию атомистов — от Демокрита до Ньютона и Максвелла, поэтому допущение о распаде атомов означало крутую ломку основных представлений о структуре
материи. Кроме того, все это очень смахивало на утверждение алхимиков о возможности превращения элементов, а говорить такое в цивилизованный век было уж и вовсе неприлично. Можно понять поэтому опасения физиков Монреаля в том, что опубликование новых идей о превращении элементов нанесет ущерб научному престижу молодого университета.
Тем не менее дело было сделано, а слово — сказано. Гипотеза радиоактивного распада, как и всякая плодотворная гипотеза, имела следствия и допускала их опытную проверку. Первую из них осуществил Содди совместно с Уильямом Рамзаем уже летом 1903 г., вскоре после возвращения из Монреаля в Лондон. Идея их опыта была предельно проста: они собирали эманацию радия, которая выделялась из имеющихся у них 50 мг бромида радия, в тонкую стеклянную трубку и, пропуская через нее электрический разряд, наблюдали характерный, ни на что другое не похожий спектр нового элемента. С течением времени, однако, этот спектр слабел, а на его месте все более отчетливо проступал спектр гелия: эманация радия распадалась на гелий и радий А, Участники и очевидцы этого эксперимента даже много лет спустя не могли скрыть волнения, рассказывая о нем,— настолько он поразил их воображение: видеть воочию, как один элемент превращается в другой,— это для физика и химика равносильно тому, как если бы зоолог наяву увидел превращение кошки в собаку. Немного позднее «эманация радия» получит от Резерфорда свое настоящее имя — радон (символ Rn), а Рамзай проявит чудеса экспериментального искусства и, имея всего 0,1 мм3 радона, измеритего атомную массу: она окажется равной 222. Атомная масса радия (226) была измерена Марией Кюри в 1902 г., а атомная масса гелия (4) была определена в работах Рамзая за три года до этого. Теперь гипотезу радиоактивного распада радия по схеме
Ra--->• Rn Не
этот факт, в то время даже таким людям, как Резерфорд, Содди и Рамзай, потребовалось не менее пяти лет работы.
В нем состояла сложность задачи? Прежде всего, такого понятия, как «ядро атома», тогда еще не изобрели: оно появится только через 11 лет. И хотя электрон уже два года как был известен, само существование атомов не было в то время строго доказано: опыты Перрена будут поставлены лишь 9 лет спустя. Отголосок трудностей тех дней мы чувствуем даже сейчас, при попытке последовательно изложить историю открытий радиоактивности. В самом деле, как мы хорошо теперь знаем, все эти явления относятся к области ядерной физики, а нам приходится анализировать их, тщательно избегая употребления слова «ядро».
В год открытия радия Эрнест Резерфорд был докторантом знаменитого Дж. Дж. Томсона в лаборатории Кавендиша. Узнав об открытиях Беккереля и Кюри, он оставляет свои исследования ионизации газов и уже осенью 1898 г. завершает большую работу по изучению радиоактивности урана. Вскоре он переехал в Канаду, возглавил в Монреале кафедру физики университета Мак-Гилла и с присущими ему энергией и размахом занялся всесторонним изучением нового явления. В отличие от Марии Кюри, которая сосредоточилась на химическом выделении радия в чистом виде, Резерфорда больше всего интересовала физическая природа радиоактивности.
В чем суть явления радиоактивности? Каков ее внутренний механизм? И в чем ее истинная причина? Вот что хотел понять Резерфорд прежде всего.
Для начала он решил изучить свойства а-частиц.
Через три года напряженной работы («Шесть дней в неделю сижу в лаборатории допоздна»,— писал он невесте в Новую Зеландию) Резерфорд был уже почти уверен, что а-частицы — это не что иное, как дважды ионизованные атомы гелия. Он опирался при этом на простой и общеизвестный факт: во всех соединениях урана и тория был обнаружен гелий, причем в больших количествах. Например, из 1 г тория можно прокаливанием выделить около 10 см3 гелия, что примерно в 100 раз превышает объем взятого тория. Гелий, который нашли на Земле за семь лет до этого (кстати, именно в минералах тория), к 1902 г. был уже хорошо изучен, и о нем было известно, что он относится к группе благородных газов и ни в какие химические реакции не вступает. Поэтому объяснить химическими причинами присутствие такого количества гелия в тории не представлялось возможным. 218
Итак, гелий образуется из радиоактивных элементов. Но что при этом происходит с самими элементами?
Вскоре после приезда в Канаду Резерфорд смог объяснить одно наблюдение своего препаратора: оказалось, что соединения тория выделяют какой-то неизвестный радиоактивный газ, который он назвал «эманацией» (дословно — «то, что выделяется»).
Годом позже Пьер и Мария Кюри наблюдали такую же эманацию радия. Дополнительные опыты показали, что это очень тяжелый газ и что он довольно быстро теряет свою радиоактивность: каждые четыре дня она уменьшается вдвое.
Это была новая загадка: к тому времени радиоактивность уже привыкли считать неизменной характеристикой элемента, примерно такой же, как его атомная масса. Что же происходит с радием? И откуда берутся теперь уже два газа — гелий и эманация радия?
Осенью 1900 г. к Резерфорду присоединился молодой и талантливый химик Фредерик Содди (1877—1956). Вскоре они доказали, что эманация радия — это инертный газ, химические свойства которого подобны свойствам всех благородных газов: гелия, неона, аргона, криптона и ксенона. (Совместно с Уильямом Рэлеем их открыл Уильям Рамзай и в 1901 г. догадался, что в таблице Д. И. Менделеева они образуют особую 8-ю группу с нулевой валентностью.)
Через два года вдохновенной работы (оба они были так молоды тогда: одному 29 лет, другому — всего 23!) Резерфорд и Содди пришли к поразительному заключению: радиоактивность есть не что иное, как распад атома на заряженную частицу (именно ее мы воспринимаем как радиоактивное излучение) и атом другого элемента, по своим химическим свойствам отличный от исходного. Образовавшийся при распаде атом также может оказаться радиоактивным и испытать дальнейший распад.
Это утверждение, известное теперь как гипотеза радиоактивного распада, в то время казалось неожиданным и очень смелым. Посудите сами: только в конце века начали соглашаться (да и то не все!) с тем, что атомы существуют. Но при этом никто не допускал даже мысли о том, что они могут быть изменены, а тем более распадаться самопроизвольно. Это убеждение продолжало многовековую традицию атомистов — от Демокрита до Ньютона и Максвелла, поэтому допущение о распаде атомов означало крутую ломку основных представлений о структуре
материи. Кроме того, все это очень смахивало на утверждение алхимиков о возможности превращения элементов, а говорить такое в цивилизованный век было уж и вовсе неприлично. Можно понять поэтому опасения физиков Монреаля в том, что опубликование новых идей о превращении элементов нанесет ущерб научному престижу молодого университета.
Тем не менее дело было сделано, а слово — сказано. Гипотеза радиоактивного распада, как и всякая плодотворная гипотеза, имела следствия и допускала их опытную проверку. Первую из них осуществил Содди совместно с Уильямом Рамзаем уже летом 1903 г., вскоре после возвращения из Монреаля в Лондон. Идея их опыта была предельно проста: они собирали эманацию радия, которая выделялась из имеющихся у них 50 мг бромида радия, в тонкую стеклянную трубку и, пропуская через нее электрический разряд, наблюдали характерный, ни на что другое не похожий спектр нового элемента. С течением времени, однако, этот спектр слабел, а на его месте все более отчетливо проступал спектр гелия: эманация радия распадалась на гелий и радий А, Участники и очевидцы этого эксперимента даже много лет спустя не могли скрыть волнения, рассказывая о нем,— настолько он поразил их воображение: видеть воочию, как один элемент превращается в другой,— это для физика и химика равносильно тому, как если бы зоолог наяву увидел превращение кошки в собаку. Немного позднее «эманация радия» получит от Резерфорда свое настоящее имя — радон (символ Rn), а Рамзай проявит чудеса экспериментального искусства и, имея всего 0,1 мм3 радона, измеритего атомную массу: она окажется равной 222. Атомная масса радия (226) была измерена Марией Кюри в 1902 г., а атомная масса гелия (4) была определена в работах Рамзая за три года до этого. Теперь гипотезу радиоактивного распада радия по схеме
Ra--->• Rn Не

 Дифракция и интерференция рентгеновских лучей были открыты в 1912 г. в Мюнхене — и это не случайно. В то время там директором Института физики был Рентген, кафедрой теоретической физики заведовал Зоммерфельд, а Лауэ работал у него приват-доцентом. Все они интересовались рентгеновскими лучами и верили в их волновую природу, правда, по-разному. Сам Рентген полагал, что он открыл продольные колебания эфира, подобные звуковым. Зоммерфельд считал, что Х-лучи возбуждаются при резком торможении электронов, и на основе этой модели даже оценил их длину волны.
В феврале 1912 г. ассистент Зоммерфельда Петер Пауль Эвальд (1888—1985), решая задачу о рассеянии световых волн на пространственной решетке, обратился за помощью к Лауэ. Ответа Лауэ не знал, но при обсуждении задачи ему пришла в голову мысль пропустить через кристалл рентгеновские лучи — мысль сама по себе не новая, поскольку многие, включая самого Рентгена, уже неоднократно этот опыт ставили. Но Лауэ не просто предлагал, он предсказывал. Ход его рассуждений был прост и логичен: «Если рентгеновские лучи — это очень короткие волны, а кристаллы — действительно упорядоченные решетки атомов, расстояния между которыми сравнимы с длиной волны рентгеновских лучей, то при пропускании их через кристалл должна происходить их дифракция и интерференция». Однако оба эти предположения отнюдь не были в то время очевидными и казались многим (включая Планка и Зоммерфельда) «остроумной, но все-таки фантастичной комбинацией идей».
Молодые физики, узнавшие о предложении Лауэ в кафе, где они собирались по средам, были настроены менее консервативно. Один из них, ассистент Зоммерфельда Вальтер Фридрих (1883—1968), сразу же решил проверить гипотезу Лауэ. Зоммерфельд вначале не одобрил его энтузиазма (он поручил ему другую работу), но Фридрих продолжал заниматься этим вечерами, а вскоре, в апреле 1912 г., ему на помощь пришел докторант Рентгена Пауль Книппинг (1883—1935). Совместными усилиями они уже 21 апреля обнаружили явление, которое предсказывал Лауэ и которое почти два десятилетия ускользало от
223
Дифракция и интерференция рентгеновских лучей были открыты в 1912 г. в Мюнхене — и это не случайно. В то время там директором Института физики был Рентген, кафедрой теоретической физики заведовал Зоммерфельд, а Лауэ работал у него приват-доцентом. Все они интересовались рентгеновскими лучами и верили в их волновую природу, правда, по-разному. Сам Рентген полагал, что он открыл продольные колебания эфира, подобные звуковым. Зоммерфельд считал, что Х-лучи возбуждаются при резком торможении электронов, и на основе этой модели даже оценил их длину волны.
В феврале 1912 г. ассистент Зоммерфельда Петер Пауль Эвальд (1888—1985), решая задачу о рассеянии световых волн на пространственной решетке, обратился за помощью к Лауэ. Ответа Лауэ не знал, но при обсуждении задачи ему пришла в голову мысль пропустить через кристалл рентгеновские лучи — мысль сама по себе не новая, поскольку многие, включая самого Рентгена, уже неоднократно этот опыт ставили. Но Лауэ не просто предлагал, он предсказывал. Ход его рассуждений был прост и логичен: «Если рентгеновские лучи — это очень короткие волны, а кристаллы — действительно упорядоченные решетки атомов, расстояния между которыми сравнимы с длиной волны рентгеновских лучей, то при пропускании их через кристалл должна происходить их дифракция и интерференция». Однако оба эти предположения отнюдь не были в то время очевидными и казались многим (включая Планка и Зоммерфельда) «остроумной, но все-таки фантастичной комбинацией идей».
Молодые физики, узнавшие о предложении Лауэ в кафе, где они собирались по средам, были настроены менее консервативно. Один из них, ассистент Зоммерфельда Вальтер Фридрих (1883—1968), сразу же решил проверить гипотезу Лауэ. Зоммерфельд вначале не одобрил его энтузиазма (он поручил ему другую работу), но Фридрих продолжал заниматься этим вечерами, а вскоре, в апреле 1912 г., ему на помощь пришел докторант Рентгена Пауль Книппинг (1883—1935). Совместными усилиями они уже 21 апреля обнаружили явление, которое предсказывал Лауэ и которое почти два десятилетия ускользало от
223
 внимания исследователей. Через две недели после получения первых фотографий Лауэ завершил теоретическую картину обнаруженного явления и 8 июня 1912 г. доложил о результатах работы Немецкому физическому обществу. В этот день он продемонстрировал те самые знаменитые лауэграммы кристаллов медного купороса, которые до сих пор неизменно воспроизводятся во всех учебниках атомной физики.
Реакция научного сообщества была мгновенной и бурной. Эйнштейн писал: «Это самое удивительное из всего, что
я когда-либо видел», Уильям и Лоуренс Брэгги немедленно
создали свой кристалл-дифракционный спектрометр для определения длин волн Х-лучей (его тут же использовал Генри Мозли в своей знаменитой работе), а Шведская академия наук уже через полтора года присудила Лауэ Нобелевскую премию — случай в ее практике чрезвычайно
редкий.
лась «настолько само собой разумеющейся», что он «ни
Эта реакция современников сейчас может показаться нам неоправданно восторженной (вспомним: Планк получил Нобелевскую премию в 1918 г., а Эйнштейн — лишь в 1921 г.), но это объясняется, по-видимому, тем, что открытие Лауэ слишком быстро перешло в разряд «очевидных». Даже самому Лауэ его идея впоследствии казакогда не мог понять удивления, которое она вызвала в мире специалистов». Не следует, однако, забывать, что эта «очевидность» того же сорта, что и «яйцо Колумба» или астрономические открытия Галилея: сотни людей до него держали в руках подзорную трубу, но никому из них не пришло в голову направить ее на небо. Точно так же в Мюнхенском университете, который в течение многих лет был центром кристаллографических исследований, во многих лабораториях можно было постоянно видеть каркасные модели кристаллов, но именно над привычным задуматься труднее всего — для этого необходим элемент гениальности.
Были и другие причины, обусловившие чрезвычайную популярность открытия Лауэ. Прежде всего, оно появилось необычайно вовремя, чтобы окончательно закрепить победу сторонников идеи реальности атомов: как раз в это время Жан Перрен завершал опыты с эмульсиями, Резерфорд предложил планетарную модель атома, а Чарльз Вильсон построил свою знаменитую камеру, позволявшую увидеть движение атомов.. Именно после этой серии открытий Вильгельм Оствальд напишет в 1913 г.: «Атомы стали видимыми!»
И последнее: Лауэ объяснил, наконец, природу открытых Рентгеном Х-лучей и уже одним этим обеспечил себе достойное место в истории физики. (Макс Планк в 1939 г. на юбилее Лауэ говорил, что 1879 г. для науки — особый: в этот год родились Эйнштейн, Ган, Лауэ и на несколько месяцев раньше их — любознательная девочка Лизе Мейт-нер...)
8 Л. И. Пономарев
внимания исследователей. Через две недели после получения первых фотографий Лауэ завершил теоретическую картину обнаруженного явления и 8 июня 1912 г. доложил о результатах работы Немецкому физическому обществу. В этот день он продемонстрировал те самые знаменитые лауэграммы кристаллов медного купороса, которые до сих пор неизменно воспроизводятся во всех учебниках атомной физики.
Реакция научного сообщества была мгновенной и бурной. Эйнштейн писал: «Это самое удивительное из всего, что
я когда-либо видел», Уильям и Лоуренс Брэгги немедленно
создали свой кристалл-дифракционный спектрометр для определения длин волн Х-лучей (его тут же использовал Генри Мозли в своей знаменитой работе), а Шведская академия наук уже через полтора года присудила Лауэ Нобелевскую премию — случай в ее практике чрезвычайно
редкий.
лась «настолько само собой разумеющейся», что он «ни
Эта реакция современников сейчас может показаться нам неоправданно восторженной (вспомним: Планк получил Нобелевскую премию в 1918 г., а Эйнштейн — лишь в 1921 г.), но это объясняется, по-видимому, тем, что открытие Лауэ слишком быстро перешло в разряд «очевидных». Даже самому Лауэ его идея впоследствии казакогда не мог понять удивления, которое она вызвала в мире специалистов». Не следует, однако, забывать, что эта «очевидность» того же сорта, что и «яйцо Колумба» или астрономические открытия Галилея: сотни людей до него держали в руках подзорную трубу, но никому из них не пришло в голову направить ее на небо. Точно так же в Мюнхенском университете, который в течение многих лет был центром кристаллографических исследований, во многих лабораториях можно было постоянно видеть каркасные модели кристаллов, но именно над привычным задуматься труднее всего — для этого необходим элемент гениальности.
Были и другие причины, обусловившие чрезвычайную популярность открытия Лауэ. Прежде всего, оно появилось необычайно вовремя, чтобы окончательно закрепить победу сторонников идеи реальности атомов: как раз в это время Жан Перрен завершал опыты с эмульсиями, Резерфорд предложил планетарную модель атома, а Чарльз Вильсон построил свою знаменитую камеру, позволявшую увидеть движение атомов.. Именно после этой серии открытий Вильгельм Оствальд напишет в 1913 г.: «Атомы стали видимыми!»
И последнее: Лауэ объяснил, наконец, природу открытых Рентгеном Х-лучей и уже одним этим обеспечил себе достойное место в истории физики. (Макс Планк в 1939 г. на юбилее Лауэ говорил, что 1879 г. для науки — особый: в этот год родились Эйнштейн, Ган, Лауэ и на несколько месяцев раньше их — любознательная девочка Лизе Мейт-нер...)
8 Л. И. Пономарев
 периодов полураспада элементов, попавших в эту группу, поместить их в одну и ту же клетку таблицы Д. И. Менделеева. («Изотоп» в переводе с греческого именно это и означает: «занимающий одно и то же место».)
В наше время эта мысль может показаться попросту тривиальной. В самом деле, общеизвестно, что атом — это система, состоящая из ядра и электронов. Ядро имеет две характеристики: заряд и массу. Заряд ядра равен количеству электронов в атоме и полностью определяет химические свойства элемента. Масса ядра определяет его атомную массу и период полураспада, но никак не влияет на его химические свойства и вовсе не обязана быть одинаковой у всех ядер атомов одного и того же элемента. Поэтому не следует удивляться, если в одной клетке таблицы Д. И. Менделеева окажется несколько атомов с разной атомной массой, но — обязательно — одинаковым зарядом ядра. Такая смесь изотопов совершенно однородна и неразложима никакими химическими способами, хотя, с точки зрения радиохимика, представляет собой совокупность различных радиоэлементов с характерным для каждого из них периодом полураспада.
Обращаясь к нашей аналогии с монетами, химиков можно уподобить обычным людям — они интересуются лишь достоинством монет. Радиохимики же напоминают нумизматов, для которых наибольший интерес представляет как раз год выпуска монеты, а не их достоинство.
Глубокий смысл гипотезы об изотопах окончательно прояснится лишь в 1932 г., после того, как будет открыт нейтрон и утвердится протонно-нейтронная модель ядра. Однако следствия из этой гипотезы можно было извлечь немедленно. Прежде всего, теперь для полного определения элемента необходимо было задавать две характеристики: заряд и массу ядра, которые обычно пишут слева от символа элемента. Например, символ означает изотоп радия с зарядом ядра 88 и массой 226, символ 1Н — тяжелый изотоп водорода — дейтерий, а символ 1Не2+ — дважды ионизированный атом гелия с массой 4, то есть попросту а-частицу.
Радиоактивный распад радия на радон и гелий можно представить теперь в виде схемы которая очень напоминает уравнения обычных химических реакций. В действительности это и есть настоящая реакция, только реакция ядерная (наконец-то мы можем пользоваться этим термином!). В реакции а-распада масса исходного ядра уменьшается на 4 единицы, а заряд — на 2, поэтому химические свойства образовавшегося атома полностью отличны от свойств исходного, так как в таблице Менделеева он смещается на 2 клетки влево.
226 -г. ОС
88 Ra
1600 лет
222
86
Rn +*Не,
При p-распаде, согласно тогдашним представлениям, из ядра каким-то образом излучается электрон, в результате чего заряд исходного ядра увеличивается на 1 (в таблице Менделеева исходный элемент смещается на 1 клетку вправо), а его масса остается практически неизменной. Например, именно так образуется из радиоактивного висмута полоний, открытый Марией и Пьером Кюри:
210
83
Bi
Р
5 дней
210
84
Ро + е.
С помощью этих простых правил (так называемых правил смещения Содди — Фаянса) ухалось, наконец, распутать цепочки радиоактивных превращений и каждому радиоэлементу найти свое место в периодической системе: все они спокойно уместились в семь клеток таблицы Менделеева в промежутке между свинцом и ураном. Оказалось, кроме того, что все известные в то время радиоэлементы группируются в три радиоактивных семейства: урана, тория и актиния, в которых каждый последующий элемент ряда получается из предыдущего путем излучения а- или р-частицы.
периодов полураспада элементов, попавших в эту группу, поместить их в одну и ту же клетку таблицы Д. И. Менделеева. («Изотоп» в переводе с греческого именно это и означает: «занимающий одно и то же место».)
В наше время эта мысль может показаться попросту тривиальной. В самом деле, общеизвестно, что атом — это система, состоящая из ядра и электронов. Ядро имеет две характеристики: заряд и массу. Заряд ядра равен количеству электронов в атоме и полностью определяет химические свойства элемента. Масса ядра определяет его атомную массу и период полураспада, но никак не влияет на его химические свойства и вовсе не обязана быть одинаковой у всех ядер атомов одного и того же элемента. Поэтому не следует удивляться, если в одной клетке таблицы Д. И. Менделеева окажется несколько атомов с разной атомной массой, но — обязательно — одинаковым зарядом ядра. Такая смесь изотопов совершенно однородна и неразложима никакими химическими способами, хотя, с точки зрения радиохимика, представляет собой совокупность различных радиоэлементов с характерным для каждого из них периодом полураспада.
Обращаясь к нашей аналогии с монетами, химиков можно уподобить обычным людям — они интересуются лишь достоинством монет. Радиохимики же напоминают нумизматов, для которых наибольший интерес представляет как раз год выпуска монеты, а не их достоинство.
Глубокий смысл гипотезы об изотопах окончательно прояснится лишь в 1932 г., после того, как будет открыт нейтрон и утвердится протонно-нейтронная модель ядра. Однако следствия из этой гипотезы можно было извлечь немедленно. Прежде всего, теперь для полного определения элемента необходимо было задавать две характеристики: заряд и массу ядра, которые обычно пишут слева от символа элемента. Например, символ означает изотоп радия с зарядом ядра 88 и массой 226, символ 1Н — тяжелый изотоп водорода — дейтерий, а символ 1Не2+ — дважды ионизированный атом гелия с массой 4, то есть попросту а-частицу.
Радиоактивный распад радия на радон и гелий можно представить теперь в виде схемы которая очень напоминает уравнения обычных химических реакций. В действительности это и есть настоящая реакция, только реакция ядерная (наконец-то мы можем пользоваться этим термином!). В реакции а-распада масса исходного ядра уменьшается на 4 единицы, а заряд — на 2, поэтому химические свойства образовавшегося атома полностью отличны от свойств исходного, так как в таблице Менделеева он смещается на 2 клетки влево.
226 -г. ОС
88 Ra
1600 лет
222
86
Rn +*Не,
При p-распаде, согласно тогдашним представлениям, из ядра каким-то образом излучается электрон, в результате чего заряд исходного ядра увеличивается на 1 (в таблице Менделеева исходный элемент смещается на 1 клетку вправо), а его масса остается практически неизменной. Например, именно так образуется из радиоактивного висмута полоний, открытый Марией и Пьером Кюри:
210
83
Bi
Р
5 дней
210
84
Ро + е.
С помощью этих простых правил (так называемых правил смещения Содди — Фаянса) ухалось, наконец, распутать цепочки радиоактивных превращений и каждому радиоэлементу найти свое место в периодической системе: все они спокойно уместились в семь клеток таблицы Менделеева в промежутке между свинцом и ураном. Оказалось, кроме того, что все известные в то время радиоэлементы группируются в три радиоактивных семейства: урана, тория и актиния, в которых каждый последующий элемент ряда получается из предыдущего путем излучения а- или р-частицы.


 человеку с его несовершенными органами чувств. Но иногда это неосязаемое отличие становится очевидным и гибельным: оставшиеся в живых жители Хиросимы навсегда запомнят разницу между безобидным изотопом урана 2э1и и изотопом 292U, которым была начинена испепелившая их го род атомная бомба.
человеку с его несовершенными органами чувств. Но иногда это неосязаемое отличие становится очевидным и гибельным: оставшиеся в живых жители Хиросимы навсегда запомнят разницу между безобидным изотопом урана 2э1и и изотопом 292U, которым была начинена испепелившая их го род атомная бомба.

 Учитывая, что заряд протона е = 4,8-10 10 ед. СГСЭ, а среднее расстояние между протонами в ядре гелия 240
а«2-10 13 см, найдем
г (4,8.10-’° ед. СГСЭ)2_, t 1Л_6
эрг = 0,7
МэВ.
~FTo^'cm ’
Это очень много, но все же меньше, чем энергия ядерного притяжения. Теперь хорошо известно, что ядро любого атома построено из нуклонов, то есть из протонов и нейтронов, массы которых немного различаются между собой:
Шр= 1,007276 а.е.м., нгп = 1,008665 а.е.м.
При объединении двух протонов с двумя нейтронами возникает ядро гелия (а-частица) с массой та=4,001506 а. е.м., то есть дефект массы ядра гелия
Am = 2mp + 2mn — та=0,030377 а.е.м.,
а его энергия связи
Е = Ат-с2 = 0,030377* 931,5 МэВ = 28,3 МэВ
в 40 раз больше, чем энергия электрического отталкивания протонов в ядре.
Можно ввести, наконец, некоторую среднюю характеристику прочности ядра, которую называют энергией связинуклона в ядре Ei и которая равна полной энергии связи, деленной на число нуклонов в ядре. Например, для гелия Ei=28,3 МэВ/4 = 7,1 МэВ. Для более тяжелых ядер энергия связи нуклона вначале возрастает (то есть ядра становятся прочнее), достигает максимума Ei=8,5 МэВ примерно в середине таблицы Менделеева для элементов, расположенных вблизи олова, и затем вновь монотонно уменьшается до значения Ei==7fi МэВ для ядра урана. (Для сравнения напомним, что энергия химической связи между двумя атомами водорода в молекуле равна 4,5 эВ, то есть более чем в миллион раз меньше, а для испарения молекулы воды, то есть для преодоления притяжения между молекулами, достаточно затратить всего около 0,1 эВ.)
При чтении этой главы могло сложиться впечатление, что ядерная физика — очень простая наука. В самом деле, для выяснения источников энергии радиоактивного распада и понимания причины стабильности большинства ядер достаточно знать формулу Эйнштейна Е = тс2, значения масс изотопов и четыре правила арифметики. Однако эти простые вычисления не помогают ответить на вопрос: почему распадаются ядра радиоактивных элементов? Ведь для того чтобы вырвать из ядра урана хотя бы один нуклон, надо затратить энергию АЕ|=7,6 МэВ, а а-частица состоит из четырех нуклонов! Так что же заставляет а-частицы покидать ядра урана, радия и других радиоэлементов, и притом с энергией в несколько мегаэлектронвольт?
Ответ на этот вопрос будет получен только в 1928 г.— через 3 года после создания квантовой механики и через 32 года после открытия радиоактивности.
Учитывая, что заряд протона е = 4,8-10 10 ед. СГСЭ, а среднее расстояние между протонами в ядре гелия 240
а«2-10 13 см, найдем
г (4,8.10-’° ед. СГСЭ)2_, t 1Л_6
эрг = 0,7
МэВ.
~FTo^'cm ’
Это очень много, но все же меньше, чем энергия ядерного притяжения. Теперь хорошо известно, что ядро любого атома построено из нуклонов, то есть из протонов и нейтронов, массы которых немного различаются между собой:
Шр= 1,007276 а.е.м., нгп = 1,008665 а.е.м.
При объединении двух протонов с двумя нейтронами возникает ядро гелия (а-частица) с массой та=4,001506 а. е.м., то есть дефект массы ядра гелия
Am = 2mp + 2mn — та=0,030377 а.е.м.,
а его энергия связи
Е = Ат-с2 = 0,030377* 931,5 МэВ = 28,3 МэВ
в 40 раз больше, чем энергия электрического отталкивания протонов в ядре.
Можно ввести, наконец, некоторую среднюю характеристику прочности ядра, которую называют энергией связинуклона в ядре Ei и которая равна полной энергии связи, деленной на число нуклонов в ядре. Например, для гелия Ei=28,3 МэВ/4 = 7,1 МэВ. Для более тяжелых ядер энергия связи нуклона вначале возрастает (то есть ядра становятся прочнее), достигает максимума Ei=8,5 МэВ примерно в середине таблицы Менделеева для элементов, расположенных вблизи олова, и затем вновь монотонно уменьшается до значения Ei==7fi МэВ для ядра урана. (Для сравнения напомним, что энергия химической связи между двумя атомами водорода в молекуле равна 4,5 эВ, то есть более чем в миллион раз меньше, а для испарения молекулы воды, то есть для преодоления притяжения между молекулами, достаточно затратить всего около 0,1 эВ.)
При чтении этой главы могло сложиться впечатление, что ядерная физика — очень простая наука. В самом деле, для выяснения источников энергии радиоактивного распада и понимания причины стабильности большинства ядер достаточно знать формулу Эйнштейна Е = тс2, значения масс изотопов и четыре правила арифметики. Однако эти простые вычисления не помогают ответить на вопрос: почему распадаются ядра радиоактивных элементов? Ведь для того чтобы вырвать из ядра урана хотя бы один нуклон, надо затратить энергию АЕ|=7,6 МэВ, а а-частица состоит из четырех нуклонов! Так что же заставляет а-частицы покидать ядра урана, радия и других радиоэлементов, и притом с энергией в несколько мегаэлектронвольт?
Ответ на этот вопрос будет получен только в 1928 г.— через 3 года после создания квантовой механики и через 32 года после открытия радиоактивности.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
 Первая мировая война для многих ученых явилась неожиданным и тяжелым испытанием. От повсеместных успехов позитивных наук и возвышенных идей о вездесущем прогрессе Европа внезапно опустилась до уровня худших образцов средневекового варварства. В эти годы научная жизнь в лабораториях едва теплилась: Мария Кюри вместе с дочерью Ирэн налаживала рентгеновские установки в госпиталях, Луи де Бройль служил связистом, Макс Борн и Макс Лауэ воевали по другую сторону фронта, Фрэнсис Астон и Джордж Томсон работали на авиационном заводе, а Генри Мозли — погиб. Ученые впервые поняли тогда, что наука — не всегда благо и что добытое ими знание можно обернуть против людей: они могли видеть, как от изобретенных химиками ядовитых газов задыхались в окопах солдаты.
В то время многим стало ясно, что наука больше не защищена «башней из слоновой кости» и отныне ей придется жить у всех на виду, под пристальным вниманием репортеров и бизнесменов, генералов и политиков. Ученые с обостренным чувством нравственных ценностей уже тогда пытались отделить инстинкт познания от страха перед его неконтролируемыми последствиями. Тридцать лет спустя эта дилемма обернется для ученых трагедией, и многие из них вслед за Отто Ганом захотят сказать после Хиросимы и Нагасаки: «Я не имею к этому никакого отношения!»
Первая мировая война для многих ученых явилась неожиданным и тяжелым испытанием. От повсеместных успехов позитивных наук и возвышенных идей о вездесущем прогрессе Европа внезапно опустилась до уровня худших образцов средневекового варварства. В эти годы научная жизнь в лабораториях едва теплилась: Мария Кюри вместе с дочерью Ирэн налаживала рентгеновские установки в госпиталях, Луи де Бройль служил связистом, Макс Борн и Макс Лауэ воевали по другую сторону фронта, Фрэнсис Астон и Джордж Томсон работали на авиационном заводе, а Генри Мозли — погиб. Ученые впервые поняли тогда, что наука — не всегда благо и что добытое ими знание можно обернуть против людей: они могли видеть, как от изобретенных химиками ядовитых газов задыхались в окопах солдаты.
В то время многим стало ясно, что наука больше не защищена «башней из слоновой кости» и отныне ей придется жить у всех на виду, под пристальным вниманием репортеров и бизнесменов, генералов и политиков. Ученые с обостренным чувством нравственных ценностей уже тогда пытались отделить инстинкт познания от страха перед его неконтролируемыми последствиями. Тридцать лет спустя эта дилемма обернется для ученых трагедией, и многие из них вслед за Отто Ганом захотят сказать после Хиросимы и Нагасаки: «Я не имею к этому никакого отношения!»


 Ферми был одним из первых, кто сразу же понял, что нейтрон — это идеальное средство для исследования
ядерных реакций и простейший способ получения новых радиоизотопов. Главное отличие и преимущество нейтрона — его электронейтральность, которая позволяет ему беспрепятственно проникать в ядра любых, даже самых тяжелых элементов.
Летом 1934 г. группа молодых итальянских физиков, из которых самому младшему — Бруно Понтекорво — было 20, а самому старшему — Ферми — всего 33, увлеченно экспериментировала. Их приборы были просты: радон-бериллиевый источник нейтронов и счетчики Гейгера — Мюллера. Постановка задачи предельно ясная: облучить различные элементы нейтронами и посмотреть, что при этом происходит. Поле деятельности обширное — вся периодическая система элементов, а сил и энтузиазма — не занимать: впоследствии понадобилось написать более десяти статей, чтобы описать свойства нескольких десятков новых радиоизотопов, которые они при этом получили.
Когда нейтрон поглощается каким-либо ядром /X с зарядом Z и массовым числом N, оно превращается в изотоп N + zX, который в свою очередь стремится избавиться от лишнего нейтрона. Самый простой путь — превратить нейтрон в протон, испустив при этом электрон и антинейтрино. При таком ^-распаде ядра образуется ядро нового элемента Y с зарядом ядра Z + 1 и массовым числом N+ 1, то есть происходит последовательность ядерных реакций:
n + NX —. n+ix _Д n + >Y+e + v-.
Несмотря на внешнее сходство, этот процесс получения искусственных изотопов сильно отличается от схемы Жолио-Кюри, которую можно представить в следующем 253
виде:
Ферми был одним из первых, кто сразу же понял, что нейтрон — это идеальное средство для исследования
ядерных реакций и простейший способ получения новых радиоизотопов. Главное отличие и преимущество нейтрона — его электронейтральность, которая позволяет ему беспрепятственно проникать в ядра любых, даже самых тяжелых элементов.
Летом 1934 г. группа молодых итальянских физиков, из которых самому младшему — Бруно Понтекорво — было 20, а самому старшему — Ферми — всего 33, увлеченно экспериментировала. Их приборы были просты: радон-бериллиевый источник нейтронов и счетчики Гейгера — Мюллера. Постановка задачи предельно ясная: облучить различные элементы нейтронами и посмотреть, что при этом происходит. Поле деятельности обширное — вся периодическая система элементов, а сил и энтузиазма — не занимать: впоследствии понадобилось написать более десяти статей, чтобы описать свойства нескольких десятков новых радиоизотопов, которые они при этом получили.
Когда нейтрон поглощается каким-либо ядром /X с зарядом Z и массовым числом N, оно превращается в изотоп N + zX, который в свою очередь стремится избавиться от лишнего нейтрона. Самый простой путь — превратить нейтрон в протон, испустив при этом электрон и антинейтрино. При таком ^-распаде ядра образуется ядро нового элемента Y с зарядом ядра Z + 1 и массовым числом N+ 1, то есть происходит последовательность ядерных реакций:
n + NX —. n+ix _Д n + >Y+e + v-.
Несмотря на внешнее сходство, этот процесс получения искусственных изотопов сильно отличается от схемы Жолио-Кюри, которую можно представить в следующем 253
виде:


 В обоих случаях из элемента с зарядом ядра Z образуется элемент Y с зарядом ядра Z+1, но изотопы при этом получаются разные: в опытах Ферми — с массовым числом N-j-1, а в опытах Жолио-Кюри — с N+3. И, конечно, если у Жолио-Кюри облученная а-частицами мишень испускала позитроны, то у Ферми та же мишень, облученная нейтронами, испускала электроны.
Например, при облучении алюминия у Жолио-Кюри получалось:
В обоих случаях из элемента с зарядом ядра Z образуется элемент Y с зарядом ядра Z+1, но изотопы при этом получаются разные: в опытах Ферми — с массовым числом N-j-1, а в опытах Жолио-Кюри — с N+3. И, конечно, если у Жолио-Кюри облученная а-частицами мишень испускала позитроны, то у Ферми та же мишень, облученная нейтронами, испускала электроны.
Например, при облучении алюминия у Жолио-Кюри получалось:
 а у Ферми:
а у Ферми:

 (Земная кора на 28 % состоит из смеси изотопов кремния; из них uSi составляет 92,2 %, ilSi — 4,7 % и i2Si — 3,1 %.)
Достаточно очевидно, что способ Ферми получения новых изотопов предпочтительнее: он проще и универсальнее. В короткое время «мальчики» Ферми облучили 68 элементов и в 47 из них наблюдали искусственную радиоактивность, то есть синтезировали сразу полсотни новых изотопов.
(Земная кора на 28 % состоит из смеси изотопов кремния; из них uSi составляет 92,2 %, ilSi — 4,7 % и i2Si — 3,1 %.)
Достаточно очевидно, что способ Ферми получения новых изотопов предпочтительнее: он проще и универсальнее. В короткое время «мальчики» Ферми облучили 68 элементов и в 47 из них наблюдали искусственную радиоактивность, то есть синтезировали сразу полсотни новых изотопов.
 Но главное их открытие состояло не в этом: 22 октября 1934 г. они вдруг с удивлением обнаружили, что нейтроны в сотни раз эффективнее захватываются ядрами атомов, если между мишенью и источником нейтронов поместить кусок парафина либо же опустить мишень под воду (благо, во дворе института в Риме был бассейн с золотыми рыбками). Их удивление длилось целых два часа — до тех пор, пока Ферми с присущим ему изяществом не набросал контуры нового физического явления. Суть его объяснения проста. Молекулы воды НгО состоят из кислорода и водорода, а масса нейтрона практически равна массе протона. Поэто-
му при столкновениях нейтрона с ядрами водорода он быстро замедляется — в десятки раз быстрее, чем при столкновении с тяжелыми ядрами,— а после этого легко вступает в ядер-ные реакции.
Удивление обычно является следствием столкновения неожиданных фактов с инерцией мышления. За много лет физики привыкли к мысли, что ядро — это хоть и неосязаемое, но весьма прочное нечто, и чтобы его изменить, необходимо как можно сильнее разогнать снаряд — будь то а-частица или протон. Для этой цели изобрели даже ускорители. А для нейтрона все оказалось строго наоборот: чем медленнее он двигался, тем охотнее поглощался ядрами. Причин тому две: во-первых, он не отталкивается, а притягивается ядрами, и, во-вторых, он подчиняется законам квантовой механики.
Открытие ядерных реакций, вызванных замедленными нейтронами, не выглядит столь эффектно, как открытие самого нейтрона или искусственной радиоактивности, однако именно ему суждено было великое будущее: без него нельзя ни запустить ядерный реактор, ни понять принцип его работы.
Участники этого исторического эксперимента безошибочно почувствовали его значительность: в тот же вечер 22 октября 1934 г. они-собрались на квартире Ферми и глубокой ночью закончили статью под названием «Влияние водородосодержащих веществ на радиоактивность, наведенную нейтронами». В 1938 г. «за открытие искусственной радиоактивности, вызванной бомбардировкой медленными нейтронами», Энрико Ферми был удостоен Нобелевской премии.
Но главное их открытие состояло не в этом: 22 октября 1934 г. они вдруг с удивлением обнаружили, что нейтроны в сотни раз эффективнее захватываются ядрами атомов, если между мишенью и источником нейтронов поместить кусок парафина либо же опустить мишень под воду (благо, во дворе института в Риме был бассейн с золотыми рыбками). Их удивление длилось целых два часа — до тех пор, пока Ферми с присущим ему изяществом не набросал контуры нового физического явления. Суть его объяснения проста. Молекулы воды НгО состоят из кислорода и водорода, а масса нейтрона практически равна массе протона. Поэто-
му при столкновениях нейтрона с ядрами водорода он быстро замедляется — в десятки раз быстрее, чем при столкновении с тяжелыми ядрами,— а после этого легко вступает в ядер-ные реакции.
Удивление обычно является следствием столкновения неожиданных фактов с инерцией мышления. За много лет физики привыкли к мысли, что ядро — это хоть и неосязаемое, но весьма прочное нечто, и чтобы его изменить, необходимо как можно сильнее разогнать снаряд — будь то а-частица или протон. Для этой цели изобрели даже ускорители. А для нейтрона все оказалось строго наоборот: чем медленнее он двигался, тем охотнее поглощался ядрами. Причин тому две: во-первых, он не отталкивается, а притягивается ядрами, и, во-вторых, он подчиняется законам квантовой механики.
Открытие ядерных реакций, вызванных замедленными нейтронами, не выглядит столь эффектно, как открытие самого нейтрона или искусственной радиоактивности, однако именно ему суждено было великое будущее: без него нельзя ни запустить ядерный реактор, ни понять принцип его работы.
Участники этого исторического эксперимента безошибочно почувствовали его значительность: в тот же вечер 22 октября 1934 г. они-собрались на квартире Ферми и глубокой ночью закончили статью под названием «Влияние водородосодержащих веществ на радиоактивность, наведенную нейтронами». В 1938 г. «за открытие искусственной радиоактивности, вызванной бомбардировкой медленными нейтронами», Энрико Ферми был удостоен Нобелевской премии.
 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
 что мы пока сообщаем только тебе... Они отделяются от всех элементов, кроме бария... Хотя еще нельзя исключить случайного стечения обстоятельств, мы все же все более приходим к ужасному заключению: наши изотопы радия ведут себя не как радий, а как барий... Я договорился со Штрассманом, что мы пока скажем это только тебе. Может быть, ты сможешь предложить какое-нибудь фантастическое объяснение. Мы, конечно, знаем, что не может произойти распад в барий, но хотим еще проверить, не имеет ли возникающий из «радия» изотоп актиния свойств лантана, а не актиния... Не верится, чтобы мы так долго заблуждались...»
21 декабря 1938 г., Мейтнер — Гану: «Ваши результаты с радием ошеломляют. Процесс, обусловленный медленными нейтронами и приводящий к барию!.. Признать такой необычный распад, мне кажется, пока очень трудно, но мы пережили в ядерной физике столько неожиданностей, что уже ни о чем нельзя сказать прямо: это невозможно...»
21 декабря 1938 г., Ган — Мейтнер: «Со вчерашнего дня мы суммируем наши доказательства о барии — радии... На их основе, как «химики», мы должны сделать заключение, что три хорошо изученных нами изотопа являются не радием, но, с точки зрения химика, барием... Актиний, возникающий из изотопов, вовсе не актиний, но, скорее всего, излучающий лантан!!»
22 декабря 1938 г. статья Гана и Штрассмана поступила в редакцию журнала. В ней они писали: «Кроме того, мы должны сказать о некоторых новых исследованиях, результаты которых из-за их странности мы сообщаем лишь с колебанием... Мы приходим к заключению: наши «изотопы радия» имеют свойства бария. Как химики, мы, собственно, должны сказать, что новое вещество — не радий, а барий; о других элементах не может быть и речи».
28 декабря 1938 г., Ган — Мейтнер: «Я хочу поскорее сообщить тебе еще кое-что о моих бариевых догадках: может, Отто-Роберт сейчас у тебя в Кунгалве и вы сможете обсудить это... Вот моя новая догадка: если бы было возможно урану-239 расщепиться на барий и мазурий, 138 + 101 дали бы 239!.. Возможно ли это энергетически? Я этого не знаю; я знаю только, что наш радий обладает свсйствами бария...»
что мы пока сообщаем только тебе... Они отделяются от всех элементов, кроме бария... Хотя еще нельзя исключить случайного стечения обстоятельств, мы все же все более приходим к ужасному заключению: наши изотопы радия ведут себя не как радий, а как барий... Я договорился со Штрассманом, что мы пока скажем это только тебе. Может быть, ты сможешь предложить какое-нибудь фантастическое объяснение. Мы, конечно, знаем, что не может произойти распад в барий, но хотим еще проверить, не имеет ли возникающий из «радия» изотоп актиния свойств лантана, а не актиния... Не верится, чтобы мы так долго заблуждались...»
21 декабря 1938 г., Мейтнер — Гану: «Ваши результаты с радием ошеломляют. Процесс, обусловленный медленными нейтронами и приводящий к барию!.. Признать такой необычный распад, мне кажется, пока очень трудно, но мы пережили в ядерной физике столько неожиданностей, что уже ни о чем нельзя сказать прямо: это невозможно...»
21 декабря 1938 г., Ган — Мейтнер: «Со вчерашнего дня мы суммируем наши доказательства о барии — радии... На их основе, как «химики», мы должны сделать заключение, что три хорошо изученных нами изотопа являются не радием, но, с точки зрения химика, барием... Актиний, возникающий из изотопов, вовсе не актиний, но, скорее всего, излучающий лантан!!»
22 декабря 1938 г. статья Гана и Штрассмана поступила в редакцию журнала. В ней они писали: «Кроме того, мы должны сказать о некоторых новых исследованиях, результаты которых из-за их странности мы сообщаем лишь с колебанием... Мы приходим к заключению: наши «изотопы радия» имеют свойства бария. Как химики, мы, собственно, должны сказать, что новое вещество — не радий, а барий; о других элементах не может быть и речи».
28 декабря 1938 г., Ган — Мейтнер: «Я хочу поскорее сообщить тебе еще кое-что о моих бариевых догадках: может, Отто-Роберт сейчас у тебя в Кунгалве и вы сможете обсудить это... Вот моя новая догадка: если бы было возможно урану-239 расщепиться на барий и мазурий, 138 + 101 дали бы 239!.. Возможно ли это энергетически? Я этого не знаю; я знаю только, что наш радий обладает свсйствами бария...»
 29 декабря 1938 г., Мейтнер — Гану: «Ваши результаты с радием — барием очень интересны. Отто-Роберт и я уже сломали себе головы».
1 января 1939 г., Мейтнер — Гану, после прочтения рукописи статьи Гана и Штрассмана: «Может быть, это энергетически и возможно расщепиться тяжелому ядру».
3 января 1939 г., Мейтнер — Гану: «Теперь я почти убеждена, открыли распад в барий, и считаю это действительно прекрасным результатом, с которым сердечно поздравляю тебя и Штрассмана...»
5 января 1939 г., Ган — Мейтнер: «Сегодня я больше не уверен, даже снова боюсь за барий; не радий ли это все-таки? Никак не могу поверить в это».
6 января 1939 г. вышел номер журнала «Naturwissen-schaften» со статьей Гана и Штрассмана «О доказательстве существования и свойствах щелочноземельных металлов, возникающих при облучении урана нейтронами».
10 января 1939 г., Фриш — Гану: «Я накопил уже столько аргументов против трансуранов, что мне трудно согласиться с их оживлением».
16 января 1939 г. в редакцию журнала «Nature» направлены две статьи: «Физическое доказательство деления тяжелых ядер при бомбардировке их нейтронами» Отто Фриша и «Расщепление урана нейтронами: новый тип ядер-ной реакции» Мейтнер и Фриша.
22 января 1939 г., Ган — Мейтнер (после получения рукописей статей Фриша и Мейтнер): «...выходит, все наши трудоемкие опыты после убедительного опыта Отто-Роберта не нужны...»
25 января 1939 г., Мейтнер — Гану: «Вовсе не «нужны», без вашего прекрасного результата о барии вместо радия мы никогда бы не пришли к этому...»
26 января 1939 г., Мейтнер — Гану: «Все сделанное вами в последнее время мне представляется фантастическим. Добрая половина периодической системы встречается среди этих осколков урана...»
Упорное нежелание Гана признать неоспоримые факты, полученные им самим же, кроме объективной сложности явления деления, имело еще и психологические основания. 260
Прежде всего, было нелегко признаться самому себе, что трехлетний напряженный труд по поиску трансурановых элементов (круглосуточное — в трисмены — дежурство у счетчиков) оказался напрасным. Кроме того, признавая это публично, он невольно ставил в ложное положение Лизе Мейтнер, поскольку опровергал результаты их совместных работ, но уже без нее. И, наконец, непросто было признать и частичную правоту Ирэн Жолио-Кюри с ее «лантаноподобным веществом», которое в Берлине называли не иначе, как «кюрьозий». И все же научная честность и профессиональная добросовестность победили...
ГЛАВА 15
29 декабря 1938 г., Мейтнер — Гану: «Ваши результаты с радием — барием очень интересны. Отто-Роберт и я уже сломали себе головы».
1 января 1939 г., Мейтнер — Гану, после прочтения рукописи статьи Гана и Штрассмана: «Может быть, это энергетически и возможно расщепиться тяжелому ядру».
3 января 1939 г., Мейтнер — Гану: «Теперь я почти убеждена, открыли распад в барий, и считаю это действительно прекрасным результатом, с которым сердечно поздравляю тебя и Штрассмана...»
5 января 1939 г., Ган — Мейтнер: «Сегодня я больше не уверен, даже снова боюсь за барий; не радий ли это все-таки? Никак не могу поверить в это».
6 января 1939 г. вышел номер журнала «Naturwissen-schaften» со статьей Гана и Штрассмана «О доказательстве существования и свойствах щелочноземельных металлов, возникающих при облучении урана нейтронами».
10 января 1939 г., Фриш — Гану: «Я накопил уже столько аргументов против трансуранов, что мне трудно согласиться с их оживлением».
16 января 1939 г. в редакцию журнала «Nature» направлены две статьи: «Физическое доказательство деления тяжелых ядер при бомбардировке их нейтронами» Отто Фриша и «Расщепление урана нейтронами: новый тип ядер-ной реакции» Мейтнер и Фриша.
22 января 1939 г., Ган — Мейтнер (после получения рукописей статей Фриша и Мейтнер): «...выходит, все наши трудоемкие опыты после убедительного опыта Отто-Роберта не нужны...»
25 января 1939 г., Мейтнер — Гану: «Вовсе не «нужны», без вашего прекрасного результата о барии вместо радия мы никогда бы не пришли к этому...»
26 января 1939 г., Мейтнер — Гану: «Все сделанное вами в последнее время мне представляется фантастическим. Добрая половина периодической системы встречается среди этих осколков урана...»
Упорное нежелание Гана признать неоспоримые факты, полученные им самим же, кроме объективной сложности явления деления, имело еще и психологические основания. 260
Прежде всего, было нелегко признаться самому себе, что трехлетний напряженный труд по поиску трансурановых элементов (круглосуточное — в трисмены — дежурство у счетчиков) оказался напрасным. Кроме того, признавая это публично, он невольно ставил в ложное положение Лизе Мейтнер, поскольку опровергал результаты их совместных работ, но уже без нее. И, наконец, непросто было признать и частичную правоту Ирэн Жолио-Кюри с ее «лантаноподобным веществом», которое в Берлине называли не иначе, как «кюрьозий». И все же научная честность и профессиональная добросовестность победили...
ГЛАВА 15

 циал V(х): не правда ли, это
сменяется притяжением, а-частицы движутся в узкой и глубокой потенциальной яме и от внешнего мира отделены потенциальным барьером. Оказалось, что даже этих знаний о потенциале У(х) достаточно, чтобы понять основные закономерности а-распада ядер.
Взгляните еще раз на рисунок, изображающий потен-<оже на вулкан в разрезе? Да и само явление радиоактивности чем-то сродни извержению вулкана: а-частицы внутри ядра можно уподобить магме, которая кипит в жерле вулкана и выплескивается из него наружу в моменты извержений. Однако в отличие от магмы а-частицы подчиняются квантовым законам, и потому их энергия Е «квантована», то есть может принимать лишь дискретный набор значений Е\, Еъ, ..., Еп. Поэтому в жерле «квантового вулкана» они могут находиться лишь на определенной высоте. Если а-частица движется ниже линии горизонта (Ел<0), то самопроизвольное испускание а-частиц невозможно, ядро стабильно, вулкан потух. Если же EnZ> О, то есть энергия а-частицы превышает энергию ядра, из которого удалена а-частица, то а-распад энергетически выгоден и, как мы сейчас увидим, неизбежен.
Глубоко в жерле вулкана магма кипит постоянно, однако настоящее извержение начинается лишь тогда, когда магма поднимается до кратера вулкана и начинает переливаться через край. В отличие от магмы (и в согласии с законами квантовой механики!) а-частица может «просочиться» из «ядерной ямы» через «потенциальный барьер» наружу даже в том случае, если ее энергия недостаточна, чтобы его преодолеть. Это типично квантовое явление получило название туннельного эффекта, и понятно почему: представьте, что в боковой стенке вулкана пробит туннель — ясно, что в этом случае магма начнет изливаться через него задолго до начала извержения вулкана.
Просочившись сквозь потенциальный барьер, а-частица с огромной силой отталкивается кулоновским полем ядра и, скатываясь по «склону вулкана», приобретает у его «подножия» как раз ту кинетическую энергию Еп, которой она обладала в скрытом виде до а-распада. Тогда мы наблюдаем ее как след в камере Вильсона или как вспышку в спинтарископе Крукса. Конечно, эти вспышки не столь эффектны и зрелищны, как дымящийся Везувий, однако мы вскоре убедимся, что а-частицы — лишь тихие вестники ядерных катастроф, а «извержение ядра» — намного более страшная картина, чем вид раскаленной лавы.
В квантовой механике нет, вероятно, ни одного явления, которое бы пытались объяснить «для пешеходов» чаще, чем туннельный эффект. Для пущей наглядности просили представить себе автомобиль, который исчезает из запертого гаража, человека, который проходит сквозь стену тюрьмы, и т. д. и т. п. Такой способ объяснения, однако, не проясняет специфику явления и, кроме того, неверен по существу: попытка рассказать о самой сути квантовых явлений без использования основных понятий квантовой физики не может быть успешной — даже при условии искренности побуждений и серьезности намерений.
Туннельный эффект — это прежде всего следствие корпускулярно-волнового дуализма квантовых объектов. Конечно, аналогии для него в классической физике найти можно, но искать их надо не в явлениях движения частиц (и автомобилей), а в явлениях распространения и дифракции волн. Свойство любого излучения огибать препятствие, то есть проникать в область геометрической тени, хорошо известно. Особенно отчетливо оно проявляется в том случае, если длина волны излучения сравнима с размерами препятствия. Например, сантиметровые волны, которые используют для передачи телевизионных изображений, не могут обогнуть гору, поэтому приходится строить ретрансляционные станции. Таких проблем не возникает с радиоволнами, длина которых может достигать нескольких сот метров: они свободно огибают все неровности земной поверхности.
Еще пример. Всем хорошо знакомо явление полного внутреннего отражения: если луч света, распространяясь, скажем, в стекле, падает на границу раздела с воздухом под углом, большим некоего критического угла 0кр, то он полностью от нее отражается. Если к этому куску стекла плотно прижать снизу другой такой же кусок стекла, то луч света распространяется прямолинейно, не замечая условной границы раздела. А что произойдет, если эти куски стекла немного раздвинуть?
Прежде всего, что значит «немного»? Например, на толщину волоса — это много или мало? С точки зрения геометрической оптики этот вопрос не имеет смысла, он некорректно поставлен: «немного» — по сравнению с чем? В волновой оптике он вполне осмыслен, поскольку в этом случае
циал V(х): не правда ли, это
сменяется притяжением, а-частицы движутся в узкой и глубокой потенциальной яме и от внешнего мира отделены потенциальным барьером. Оказалось, что даже этих знаний о потенциале У(х) достаточно, чтобы понять основные закономерности а-распада ядер.
Взгляните еще раз на рисунок, изображающий потен-<оже на вулкан в разрезе? Да и само явление радиоактивности чем-то сродни извержению вулкана: а-частицы внутри ядра можно уподобить магме, которая кипит в жерле вулкана и выплескивается из него наружу в моменты извержений. Однако в отличие от магмы а-частицы подчиняются квантовым законам, и потому их энергия Е «квантована», то есть может принимать лишь дискретный набор значений Е\, Еъ, ..., Еп. Поэтому в жерле «квантового вулкана» они могут находиться лишь на определенной высоте. Если а-частица движется ниже линии горизонта (Ел<0), то самопроизвольное испускание а-частиц невозможно, ядро стабильно, вулкан потух. Если же EnZ> О, то есть энергия а-частицы превышает энергию ядра, из которого удалена а-частица, то а-распад энергетически выгоден и, как мы сейчас увидим, неизбежен.
Глубоко в жерле вулкана магма кипит постоянно, однако настоящее извержение начинается лишь тогда, когда магма поднимается до кратера вулкана и начинает переливаться через край. В отличие от магмы (и в согласии с законами квантовой механики!) а-частица может «просочиться» из «ядерной ямы» через «потенциальный барьер» наружу даже в том случае, если ее энергия недостаточна, чтобы его преодолеть. Это типично квантовое явление получило название туннельного эффекта, и понятно почему: представьте, что в боковой стенке вулкана пробит туннель — ясно, что в этом случае магма начнет изливаться через него задолго до начала извержения вулкана.
Просочившись сквозь потенциальный барьер, а-частица с огромной силой отталкивается кулоновским полем ядра и, скатываясь по «склону вулкана», приобретает у его «подножия» как раз ту кинетическую энергию Еп, которой она обладала в скрытом виде до а-распада. Тогда мы наблюдаем ее как след в камере Вильсона или как вспышку в спинтарископе Крукса. Конечно, эти вспышки не столь эффектны и зрелищны, как дымящийся Везувий, однако мы вскоре убедимся, что а-частицы — лишь тихие вестники ядерных катастроф, а «извержение ядра» — намного более страшная картина, чем вид раскаленной лавы.
В квантовой механике нет, вероятно, ни одного явления, которое бы пытались объяснить «для пешеходов» чаще, чем туннельный эффект. Для пущей наглядности просили представить себе автомобиль, который исчезает из запертого гаража, человека, который проходит сквозь стену тюрьмы, и т. д. и т. п. Такой способ объяснения, однако, не проясняет специфику явления и, кроме того, неверен по существу: попытка рассказать о самой сути квантовых явлений без использования основных понятий квантовой физики не может быть успешной — даже при условии искренности побуждений и серьезности намерений.
Туннельный эффект — это прежде всего следствие корпускулярно-волнового дуализма квантовых объектов. Конечно, аналогии для него в классической физике найти можно, но искать их надо не в явлениях движения частиц (и автомобилей), а в явлениях распространения и дифракции волн. Свойство любого излучения огибать препятствие, то есть проникать в область геометрической тени, хорошо известно. Особенно отчетливо оно проявляется в том случае, если длина волны излучения сравнима с размерами препятствия. Например, сантиметровые волны, которые используют для передачи телевизионных изображений, не могут обогнуть гору, поэтому приходится строить ретрансляционные станции. Таких проблем не возникает с радиоволнами, длина которых может достигать нескольких сот метров: они свободно огибают все неровности земной поверхности.
Еще пример. Всем хорошо знакомо явление полного внутреннего отражения: если луч света, распространяясь, скажем, в стекле, падает на границу раздела с воздухом под углом, большим некоего критического угла 0кр, то он полностью от нее отражается. Если к этому куску стекла плотно прижать снизу другой такой же кусок стекла, то луч света распространяется прямолинейно, не замечая условной границы раздела. А что произойдет, если эти куски стекла немного раздвинуть?
Прежде всего, что значит «немного»? Например, на толщину волоса — это много или мало? С точки зрения геометрической оптики этот вопрос не имеет смысла, он некорректно поставлен: «немного» — по сравнению с чем? В волновой оптике он вполне осмыслен, поскольку в этом случае
 существует естественный масштаб — длина волны. Например, для видимого света (длина волны Х«500 нм=5‘10~5 см) толщина волоса (примерно 10“2 см) —это много, а для тепловых лучей (Х«0,1 см) — мало. Когда ширина зазора d сравнима с длиной волны X излучения, часть этого излучения все-таки проникает через воздушный зазор из первого куска стекла во второй, и тем ус-d. Явление это хорошо изучено, явление — наиболее близкий аналог туннельного эффекта в квантовой физике.
пешнее, чем меньше зазор
его можно довольно легко наблюдать. Именно это оптическое
Корпускулярные свойства а-частиц (импульс, масса, заряд) особенно хорошо заметны вне ядра, например при движении их в камере Вильсона. Внутри ядра преобладают (то есть более заметны) волновые свойства а-частиц: частота и длина волны. Ясно, что длина волны а-частиц в ядре не может превышать размеров ядра: см, а их скорости движения примерно в сто раз меньше скорости света, поэтому частота их колебаний внутри ядра v — v/K достигает значений v«4-1020 с~1. Наталкиваясь на стенки потенциального барьера, волны а-частиц, как правило, испытывают «полное внутреннее отражение», но иногда, с ничтожной вероятностью, все же проникают сквозь барьер — точно так же, как проникает свет через воздушный зазор, разделяющий два куска стекла. Чем больше энергия а-частиц в ядре, тем меньше ширина потенциального барьера, который ей необходимо преодолеть, и тем с большей вероятностью мы можем обнаружить ее вне ядра.
Вероятность проникновения а-частицы через потенциальный барьер равна
су = |-ф(Г1)12л;ехр V2m[V(x) — £] dx^ .
Л)
Тем, кто далек от математики, это выражение, вероятно, покажется слишком сложным. В действительности же оно немедленно следует из уравнения Шрёдингера. А если учесть, что с его помощью удается понять практически все особенности а-распада, то следует признать его даже слишком простым. Эта вероятность чрезвычайно мала: цапример, для ядра радия она составляет лишь w«3,3* 10~32, но она все же не равна нулю, и это принципиально отличает квантовые объекты (а-частицы) от классических (магма). Каждую секунду а-частица подходит к стенке барьера v«4-102° раз и каждый раз с вероятностью w«3,3-10~32 может покинуть ядро, то есть каждое ядро радия каждую секунду может распасться с вероятностью
A =v • w= 1,4* 10~п с-1.
Следовательно, среднее время жизни ядра радия т=1/Л = = 7,4-101° с «2300 лет, а период полураспада радия 71/2==0,7т = 1600 лет. В одном грамме радия содержится Na=A =6-1О23/226=2,7-1О21 ядер радия, и каждую секунду из них распадается
(2,7-1021) - (1,4-10-11) =3,7- Ю10 ядер.
Именно это число радиоактивных распадов в секунду условились принять за единицу радиоактивности и назвали ее кюри — в память о выдающемся вкладе семьи Кюри в науку о радиоактивности.
Теперь, наконец, мы можем ответить на все вопросы о природе, причине и законах радиоактивности, которые мы задали в начале этой главы.
Почему а-частицы вылетают из ядра? Потому, что радиоактивные ядра нестабильны по своей природе, они, как и люди, уже в момент своего рождения обречены на смерть.
Чем объясняется моноэнергетичностъ вылетающих а-частиц? а-частица в ядре имеет строго определенную квантованную энергию, с которой она и движется, покинув ядро.
От чего зависит период полураспада ядер? Он определяется, в основном, энергией а-частиц: чем больше эта энергия, тем уже барьер, который ей необходимо преодолеть, тем больше вероятность просочиться сквозь него и тем меньше время жизни радиоактивного ядра. Зависимость эта очень сильная: при изменении энергии а-частиц всего в полтора раза их период полурапада изменяется в миллиарды раз (для урана-238 £л=4,2 МэВ, 7\/2=4,5*109 лет, для радия-226 £я=4,8 МэВ, Т1/2 = 1,в*1О3 лет, для радона-222 (эманация радия) £«=5,5 МэВ, 71/2 = 3,8 дня, для полония-218 Еп— =6,0 МэВ, 71/2=3 мин, а для полония-214 £й=7,7 МэВ, 71/2 = 1,6-10"4 с). Зависимость между периодом полураспада ядер и энергией испускаемых а-частиц, известная как закон Гейгера — Нэттола, была обнаружена еще в 1909 г., но лишь 20 лет спустя получила удовлетворительное объяснение.
Чем определяется время и место распада радиоактивных ядер? Законами случая. Ядро — это микрообъёкт, подчиняющийся законам квантовой механики, поэтому при его описании понятие вероятности является основным. Можно достоверно предсказать среднее время жизни ядра и сколько в среднем ядер из большого их числа распадется в секунду. Но момент распада каждого отдельного ядра предсказать нельзя. Это — некорректно поставленный вопрос. Среднее время жизни ядра радия-226 т = 2300 лет, но это совсем не означает, что ядро радия, которое только что образовалось при распаде тория-230, проживет именно столько: с равной вероятностью оно может распасться и в следующую секунду, и через миллион лет. Радиоактивные ядра можно уподобить людям, больным неизлечимой болезнью: рано или поздно они умирают. Однако в отличие от людей, смертность которых с возрастом увеличивается, радиоактивные ядра не стареют: вероятность их распада не зависит от времени, которое они «прожили» к моменту распада.
На эту особенность радиоактивных явлений обратил внимание еще в 1905 г. австрийский физик Эгон Швейдлер (1873—1948). По существу, это было первое свидетельство о квантовом характере внутриядерных процессов, хотя глубокий смысл наблюдения Швейдлера стал ясным только четверть века спустя.
Оглядываясь назад, трудно удержаться от мысли, что а-распад — значительно более простое явление, чем извержение вулкана, и лишь предрассудок о заведомой трудности и непонятности квантовой механики мешает признать это сразу. В самом деле, никому еще не удалось предвидеть, когда проснется вулкан и сколько камней он при этом выбросит. А свойства а-распада мы можем предсказать вполне надежно.
Объяснение радиоактивности, столь просто и естественно следующее из основных представлений квантовой механики, произвело на современников исключительное впечатление. Снежный ком противоречивых гипотез и безнадежных вопросов, скопившихся за 30 лет вокруг явления радиоактивности, неожиданно распался. Резерфорд и Мария Кюри дожили до этого времени и могли видеть, как новое знание осветило путь, впервые пройденный ими ощупью, и объяснило смысл их гиганской работы, проделанной много лет назад со страстью и энтузиазмом юности.
С работы Гамова, Гёрни и Кондона берет начало современная ядерная физика. Именно они заставили поверить, что квантовая механика — это не узкоспециальная наука о строе-268
нии атомов и молекул (вначале ее так и называли: атомная механика), а наука о всех явлениях атомной и ядерной физики. (По прихоти судьбы Эдвард Кондон родился в том самом году, когда Резерфорд и Содди впервые поняли природу радиоактивности, в местечке Аламогордо на краю той самой пустыни, где 43 года спустя взметнется пламя первого атомного взрыва.)
существует естественный масштаб — длина волны. Например, для видимого света (длина волны Х«500 нм=5‘10~5 см) толщина волоса (примерно 10“2 см) —это много, а для тепловых лучей (Х«0,1 см) — мало. Когда ширина зазора d сравнима с длиной волны X излучения, часть этого излучения все-таки проникает через воздушный зазор из первого куска стекла во второй, и тем ус-d. Явление это хорошо изучено, явление — наиболее близкий аналог туннельного эффекта в квантовой физике.
пешнее, чем меньше зазор
его можно довольно легко наблюдать. Именно это оптическое
Корпускулярные свойства а-частиц (импульс, масса, заряд) особенно хорошо заметны вне ядра, например при движении их в камере Вильсона. Внутри ядра преобладают (то есть более заметны) волновые свойства а-частиц: частота и длина волны. Ясно, что длина волны а-частиц в ядре не может превышать размеров ядра: см, а их скорости движения примерно в сто раз меньше скорости света, поэтому частота их колебаний внутри ядра v — v/K достигает значений v«4-1020 с~1. Наталкиваясь на стенки потенциального барьера, волны а-частиц, как правило, испытывают «полное внутреннее отражение», но иногда, с ничтожной вероятностью, все же проникают сквозь барьер — точно так же, как проникает свет через воздушный зазор, разделяющий два куска стекла. Чем больше энергия а-частиц в ядре, тем меньше ширина потенциального барьера, который ей необходимо преодолеть, и тем с большей вероятностью мы можем обнаружить ее вне ядра.
Вероятность проникновения а-частицы через потенциальный барьер равна
су = |-ф(Г1)12л;ехр V2m[V(x) — £] dx^ .
Л)
Тем, кто далек от математики, это выражение, вероятно, покажется слишком сложным. В действительности же оно немедленно следует из уравнения Шрёдингера. А если учесть, что с его помощью удается понять практически все особенности а-распада, то следует признать его даже слишком простым. Эта вероятность чрезвычайно мала: цапример, для ядра радия она составляет лишь w«3,3* 10~32, но она все же не равна нулю, и это принципиально отличает квантовые объекты (а-частицы) от классических (магма). Каждую секунду а-частица подходит к стенке барьера v«4-102° раз и каждый раз с вероятностью w«3,3-10~32 может покинуть ядро, то есть каждое ядро радия каждую секунду может распасться с вероятностью
A =v • w= 1,4* 10~п с-1.
Следовательно, среднее время жизни ядра радия т=1/Л = = 7,4-101° с «2300 лет, а период полураспада радия 71/2==0,7т = 1600 лет. В одном грамме радия содержится Na=A =6-1О23/226=2,7-1О21 ядер радия, и каждую секунду из них распадается
(2,7-1021) - (1,4-10-11) =3,7- Ю10 ядер.
Именно это число радиоактивных распадов в секунду условились принять за единицу радиоактивности и назвали ее кюри — в память о выдающемся вкладе семьи Кюри в науку о радиоактивности.
Теперь, наконец, мы можем ответить на все вопросы о природе, причине и законах радиоактивности, которые мы задали в начале этой главы.
Почему а-частицы вылетают из ядра? Потому, что радиоактивные ядра нестабильны по своей природе, они, как и люди, уже в момент своего рождения обречены на смерть.
Чем объясняется моноэнергетичностъ вылетающих а-частиц? а-частица в ядре имеет строго определенную квантованную энергию, с которой она и движется, покинув ядро.
От чего зависит период полураспада ядер? Он определяется, в основном, энергией а-частиц: чем больше эта энергия, тем уже барьер, который ей необходимо преодолеть, тем больше вероятность просочиться сквозь него и тем меньше время жизни радиоактивного ядра. Зависимость эта очень сильная: при изменении энергии а-частиц всего в полтора раза их период полурапада изменяется в миллиарды раз (для урана-238 £л=4,2 МэВ, 7\/2=4,5*109 лет, для радия-226 £я=4,8 МэВ, Т1/2 = 1,в*1О3 лет, для радона-222 (эманация радия) £«=5,5 МэВ, 71/2 = 3,8 дня, для полония-218 Еп— =6,0 МэВ, 71/2=3 мин, а для полония-214 £й=7,7 МэВ, 71/2 = 1,6-10"4 с). Зависимость между периодом полураспада ядер и энергией испускаемых а-частиц, известная как закон Гейгера — Нэттола, была обнаружена еще в 1909 г., но лишь 20 лет спустя получила удовлетворительное объяснение.
Чем определяется время и место распада радиоактивных ядер? Законами случая. Ядро — это микрообъёкт, подчиняющийся законам квантовой механики, поэтому при его описании понятие вероятности является основным. Можно достоверно предсказать среднее время жизни ядра и сколько в среднем ядер из большого их числа распадется в секунду. Но момент распада каждого отдельного ядра предсказать нельзя. Это — некорректно поставленный вопрос. Среднее время жизни ядра радия-226 т = 2300 лет, но это совсем не означает, что ядро радия, которое только что образовалось при распаде тория-230, проживет именно столько: с равной вероятностью оно может распасться и в следующую секунду, и через миллион лет. Радиоактивные ядра можно уподобить людям, больным неизлечимой болезнью: рано или поздно они умирают. Однако в отличие от людей, смертность которых с возрастом увеличивается, радиоактивные ядра не стареют: вероятность их распада не зависит от времени, которое они «прожили» к моменту распада.
На эту особенность радиоактивных явлений обратил внимание еще в 1905 г. австрийский физик Эгон Швейдлер (1873—1948). По существу, это было первое свидетельство о квантовом характере внутриядерных процессов, хотя глубокий смысл наблюдения Швейдлера стал ясным только четверть века спустя.
Оглядываясь назад, трудно удержаться от мысли, что а-распад — значительно более простое явление, чем извержение вулкана, и лишь предрассудок о заведомой трудности и непонятности квантовой механики мешает признать это сразу. В самом деле, никому еще не удалось предвидеть, когда проснется вулкан и сколько камней он при этом выбросит. А свойства а-распада мы можем предсказать вполне надежно.
Объяснение радиоактивности, столь просто и естественно следующее из основных представлений квантовой механики, произвело на современников исключительное впечатление. Снежный ком противоречивых гипотез и безнадежных вопросов, скопившихся за 30 лет вокруг явления радиоактивности, неожиданно распался. Резерфорд и Мария Кюри дожили до этого времени и могли видеть, как новое знание осветило путь, впервые пройденный ими ощупью, и объяснило смысл их гиганской работы, проделанной много лет назад со страстью и энтузиазмом юности.
С работы Гамова, Гёрни и Кондона берет начало современная ядерная физика. Именно они заставили поверить, что квантовая механика — это не узкоспециальная наука о строе-268
нии атомов и молекул (вначале ее так и называли: атомная механика), а наука о всех явлениях атомной и ядерной физики. (По прихоти судьбы Эдвард Кондон родился в том самом году, когда Резерфорд и Содди впервые поняли природу радиоактивности, в местечке Аламогордо на краю той самой пустыни, где 43 года спустя взметнется пламя первого атомного взрыва.)
 Таким образом: если каждую секунду со скоростью и (см/с) через площадь в 1 см2 пролетает одна дробинка, то е вероятностью w== —воспо она попадет в одно из «ядер».
Эта очень важная формула справедлива и в квантовой механике, только под оо там надо понимать не геометрическое сечение ядра о0 = лго, а некоторое другое, «эффективное сечение», которое может быть как меньше, так и больше геометрического,— в зависимости от вида реакции, которую мы изучаем. Нанример, если мы интересуемся только теми столкновениями дробинок с «ядрами», при которых последние раскалываются, то ясно, что число таких столкновений всегда меньше, чем число простых попадании.
Это уменьшение можно учесть е помощью некоторого коэффициента w?, после чего прежняя формула примет вид W = W fGQVrio — Gvn^.
Величину Q = WfOo называют эффективным сечением реакции. При желании его можно представить себе наглядно, как некую «работающую» часть геометрического сечения ядер. Полезнее, однако, помнить его истинный физический смысл: эффективное сечение или просто сечение — это мера вероятности ядерной реакции, которую оно характеризует.
В ядерной физике сечения принято измерять в специальных единицах барнах-.
1 барн = 1 б==10“24 см2
Барн — это английское слово «Ьагп», то есть «амбар». Очевидная несообразность этого термина объясняется историей его происхождения. Во время войны все работы по делению урана в Америке были строго засекречены. Поэтому даже в секретных отчетах писали не 2э1и или 29?Ри, а элемент-25 и элемент-49 — по последним цифрам атомного номера и массового числа элементов. Точно так же значения сечений ядерных процессов сообщали в засекреченных единицах площади — «барнах». «Потому что,— объясняли физики, предложившие этот термин,— в ядерной физике сечение 10“24 см2 — такая же большая величина, как амбар в обычной жизни». Но, несмотря на грустную анекдотичность своего происхождения, термин этот прижился. За единицу измерения сечений барн выбран, конечно, не столь случайно, как 170
слово для его обозначения. Радиусы ядер меняются от го = = 0,13» 10“12 см (для водорода) до го=О,8»1О“12 см (для урана), и, следовательно, их геометрические сечения о0= = лг2 заключены в пределах от 0,05 до 2,1 барн, то есть соизмеримы с выбранной единицей сечения.
До сих пор мы молчаливо предполагали, что эффективные сечения реакций не зависят от энергии налетающих частиц. Можно подозревать, что это — очень грубое допущение, и опыт подтверждает наше сомнение. В действительности эффективные сечения очень прихотливо зависят от энергии столкновений, а для разных реакций могут различаться в десятки, тысячи и миллионы раз. Одна из заслуг квантовой механики состоит как раз в том, что она дает способ вычислить эти сечения и тем самым определить относительную вероятность различных ядерных реакций. Из формул квантовой механики следует также, что эффективное сечение упругого рассеяния ядер не равно их геометрическому сечению. Это — важное утверждение, и мы к нему еще вернемся.
Таким образом: если каждую секунду со скоростью и (см/с) через площадь в 1 см2 пролетает одна дробинка, то е вероятностью w== —воспо она попадет в одно из «ядер».
Эта очень важная формула справедлива и в квантовой механике, только под оо там надо понимать не геометрическое сечение ядра о0 = лго, а некоторое другое, «эффективное сечение», которое может быть как меньше, так и больше геометрического,— в зависимости от вида реакции, которую мы изучаем. Нанример, если мы интересуемся только теми столкновениями дробинок с «ядрами», при которых последние раскалываются, то ясно, что число таких столкновений всегда меньше, чем число простых попадании.
Это уменьшение можно учесть е помощью некоторого коэффициента w?, после чего прежняя формула примет вид W = W fGQVrio — Gvn^.
Величину Q = WfOo называют эффективным сечением реакции. При желании его можно представить себе наглядно, как некую «работающую» часть геометрического сечения ядер. Полезнее, однако, помнить его истинный физический смысл: эффективное сечение или просто сечение — это мера вероятности ядерной реакции, которую оно характеризует.
В ядерной физике сечения принято измерять в специальных единицах барнах-.
1 барн = 1 б==10“24 см2
Барн — это английское слово «Ьагп», то есть «амбар». Очевидная несообразность этого термина объясняется историей его происхождения. Во время войны все работы по делению урана в Америке были строго засекречены. Поэтому даже в секретных отчетах писали не 2э1и или 29?Ри, а элемент-25 и элемент-49 — по последним цифрам атомного номера и массового числа элементов. Точно так же значения сечений ядерных процессов сообщали в засекреченных единицах площади — «барнах». «Потому что,— объясняли физики, предложившие этот термин,— в ядерной физике сечение 10“24 см2 — такая же большая величина, как амбар в обычной жизни». Но, несмотря на грустную анекдотичность своего происхождения, термин этот прижился. За единицу измерения сечений барн выбран, конечно, не столь случайно, как 170
слово для его обозначения. Радиусы ядер меняются от го = = 0,13» 10“12 см (для водорода) до го=О,8»1О“12 см (для урана), и, следовательно, их геометрические сечения о0= = лг2 заключены в пределах от 0,05 до 2,1 барн, то есть соизмеримы с выбранной единицей сечения.
До сих пор мы молчаливо предполагали, что эффективные сечения реакций не зависят от энергии налетающих частиц. Можно подозревать, что это — очень грубое допущение, и опыт подтверждает наше сомнение. В действительности эффективные сечения очень прихотливо зависят от энергии столкновений, а для разных реакций могут различаться в десятки, тысячи и миллионы раз. Одна из заслуг квантовой механики состоит как раз в том, что она дает способ вычислить эти сечения и тем самым определить относительную вероятность различных ядерных реакций. Из формул квантовой механики следует также, что эффективное сечение упругого рассеяния ядер не равно их геометрическому сечению. Это — важное утверждение, и мы к нему еще вернемся.
 нейтронов с энергией 1 МэВ или больше сечения ядерных реакций примерно совпадают с геометрическими сечениями ядер; однако при меньших энергиях столкновения эффективные сечения ведут себя весьма причудливо.
На рисунке приведены сечения поглощения нейтронов ядрами кадмия и урана. При малых энергиях (Е< 100 эВ) они очень велики: 10 000 барн и более. Такие всплески называют резонансами в сечениях реакций. Кроме того, глядя на графики, можно заметить, что при очень малых энергиях нейтронов E<z\ эВ (их называют тепловыми, поскольку средняя энергия движения атомов при комнатной температуре 7° = 20°С равна примерно 0,04 эВ) сечения начинают резко и монотонно возрастать. Чтобы понять все эти особенности нейтронных сечений, необходимо вновь вспомнить о квантовой природе ядерных реакций и, в частности, о волновых свойствах нейтрона.
Уже в 1936 г., через четыре года после открытия нейтрона, Вальтер Эльзассер (еще до создания квантовой механики он указал на волны де Бройля как на причину аномалий в опытах Джермера) предсказал, что нейтрону, как и электрону, должны быть присущи волновые свойства. В том же году .Петер Прейсверк (1907—1972) и Ханс Халбан (1908—1964) в Институте радия в Париже подтвердили экспериментально его предсказание. Масса нейтрона /ип = 1,67-Ю-24 г, при энергии 1 эВ его скорость v = 1,4 • 106 см/с, а соответствующую длину волны легко вычислить по формуле де Бройля:
нейтронов с энергией 1 МэВ или больше сечения ядерных реакций примерно совпадают с геометрическими сечениями ядер; однако при меньших энергиях столкновения эффективные сечения ведут себя весьма причудливо.
На рисунке приведены сечения поглощения нейтронов ядрами кадмия и урана. При малых энергиях (Е< 100 эВ) они очень велики: 10 000 барн и более. Такие всплески называют резонансами в сечениях реакций. Кроме того, глядя на графики, можно заметить, что при очень малых энергиях нейтронов E<z\ эВ (их называют тепловыми, поскольку средняя энергия движения атомов при комнатной температуре 7° = 20°С равна примерно 0,04 эВ) сечения начинают резко и монотонно возрастать. Чтобы понять все эти особенности нейтронных сечений, необходимо вновь вспомнить о квантовой природе ядерных реакций и, в частности, о волновых свойствах нейтрона.
Уже в 1936 г., через четыре года после открытия нейтрона, Вальтер Эльзассер (еще до создания квантовой механики он указал на волны де Бройля как на причину аномалий в опытах Джермера) предсказал, что нейтрону, как и электрону, должны быть присущи волновые свойства. В том же году .Петер Прейсверк (1907—1972) и Ханс Халбан (1908—1964) в Институте радия в Париже подтвердили экспериментально его предсказание. Масса нейтрона /ип = 1,67-Ю-24 г, при энергии 1 эВ его скорость v = 1,4 • 106 см/с, а соответствующую длину волны легко вычислить по формуле де Бройля:

 обсуждений и, как теперь понятно, без всяких к тому оснований. Если «снаряд» больше «мишени», то естественно их поменять местами и считать, что ядро налетает на нейтрон, «геометрическое сечение» которого о0 = лго при энергии 1 эВ равно 1,5-105 барн, то есть 150 000 барн. Как правило, нейтронные сечения о меньше <т0, но иногда, а именно при резонансных энергиях, эффективные сечения реакций нейтронов достигают своего верхнего предела о0, а на графиках сечений при этих энергиях видны характерные максимумы — резонансы.
Причину появления резонансов в сечениях поглощения нейтронов ядрами довольно легко понять. Предположим, что нейтрон сталкивается с ядром 29®и и захватывается им. При этом выделяется энергия связи нейтрона в ядре, равная приближенно 7,6 МэВ, и образуется новый изотоп урана 292U. Ядро, как и атом,— сложная квантовая система, энергия которой принимает разные, но всегда определенные квантованные значения. Поэтому она может перейти из одного состояния в другое, только поглотив вполне определенную порцию (квант) энергии.
Вспомните знаменитый опыт Франка и Герца: они облучали атомы ртути электронами, но атомы не поглощали эту энергию до тех пор, пока она была недостаточной, чтобы возбудить атом. Но когда энергия электронов достигала значения 4,9 эВ, вероятность возбуждения атомов резко возрастала, или, как мы говорим теперь, в сечении возбуждения атомов ртути электронным ударом при энергии 4,9 эВ наблюдался резонанс.
Точно так же при облучении урана нейтронами реакция
n+TsU-► W,
в результате которой образуется ядро нового изотопа урана в возбужденном состоянии, происходит с большой вероятностью (имеет большое сечение) только при некоторых, резонансных энергиях. Таких резонансов в сечении может быть довольно много, например в сечении поглощения нейтронов ядрами урана-238 наблюдается восемь резонансов в интервале энергий нейтронов от 5 до 200 эВ.
Образовавшийся изотоп урана немедленно переходит в основное состояние, испуская у-квант, то есть в действительности реакция протекает по схеме
п + T2U---> 2i92U*---> 2f2U + у.
Это— наиболее частая реакция, так называемая (п, у)-реакция, которая впоследствии, при постройке атомного котла, доставит много хлопот.
При энергиях Ес 1 эВ резонансы в нейтронных сечениях исчезают, но сами сечения с уменьшением энергии нейтронов продолжают расти, как это и можно было ожидать, глядя на формулу
2 ( h \2
Оо = лго = л(---) .
\ mv /
В действительности, как показывает строгий квантовомеханический расчет, обычно сечения растут не так быстро, а именно согласно знаменитому «закону 1/v», то есть
<т = С/у,
где v — скорость нейтрона, а С — некоторая постоянная величина. Теперь мы, наконец, можем понять эффект, который наблюдал Ферми в тот солнечный день октября 1934 г., поместив источник нейтронов в бассейн с золотыми рыбками: сталкиваясь с ядрами водорода, нейтроны из радон-бериллиевого источника замедлялись и поэтому с большой вероятностью поглощались ядрами элементов.
Просто, не правда ли? Особенно если вспомнить, что речь идет о процессах внутри ядер атомов, то есть микрообъектов с размерами 10“12 см, структуру и свойства которых мы, по существу, сами воссоздали силой своего воображения. Конечно, созданная нами картина не произвольна — она опирается на данные опытов, но от этого удивление силой человеческого воображения не становится меньше.
обсуждений и, как теперь понятно, без всяких к тому оснований. Если «снаряд» больше «мишени», то естественно их поменять местами и считать, что ядро налетает на нейтрон, «геометрическое сечение» которого о0 = лго при энергии 1 эВ равно 1,5-105 барн, то есть 150 000 барн. Как правило, нейтронные сечения о меньше <т0, но иногда, а именно при резонансных энергиях, эффективные сечения реакций нейтронов достигают своего верхнего предела о0, а на графиках сечений при этих энергиях видны характерные максимумы — резонансы.
Причину появления резонансов в сечениях поглощения нейтронов ядрами довольно легко понять. Предположим, что нейтрон сталкивается с ядром 29®и и захватывается им. При этом выделяется энергия связи нейтрона в ядре, равная приближенно 7,6 МэВ, и образуется новый изотоп урана 292U. Ядро, как и атом,— сложная квантовая система, энергия которой принимает разные, но всегда определенные квантованные значения. Поэтому она может перейти из одного состояния в другое, только поглотив вполне определенную порцию (квант) энергии.
Вспомните знаменитый опыт Франка и Герца: они облучали атомы ртути электронами, но атомы не поглощали эту энергию до тех пор, пока она была недостаточной, чтобы возбудить атом. Но когда энергия электронов достигала значения 4,9 эВ, вероятность возбуждения атомов резко возрастала, или, как мы говорим теперь, в сечении возбуждения атомов ртути электронным ударом при энергии 4,9 эВ наблюдался резонанс.
Точно так же при облучении урана нейтронами реакция
n+TsU-► W,
в результате которой образуется ядро нового изотопа урана в возбужденном состоянии, происходит с большой вероятностью (имеет большое сечение) только при некоторых, резонансных энергиях. Таких резонансов в сечении может быть довольно много, например в сечении поглощения нейтронов ядрами урана-238 наблюдается восемь резонансов в интервале энергий нейтронов от 5 до 200 эВ.
Образовавшийся изотоп урана немедленно переходит в основное состояние, испуская у-квант, то есть в действительности реакция протекает по схеме
п + T2U---> 2i92U*---> 2f2U + у.
Это— наиболее частая реакция, так называемая (п, у)-реакция, которая впоследствии, при постройке атомного котла, доставит много хлопот.
При энергиях Ес 1 эВ резонансы в нейтронных сечениях исчезают, но сами сечения с уменьшением энергии нейтронов продолжают расти, как это и можно было ожидать, глядя на формулу
2 ( h \2
Оо = лго = л(---) .
\ mv /
В действительности, как показывает строгий квантовомеханический расчет, обычно сечения растут не так быстро, а именно согласно знаменитому «закону 1/v», то есть
<т = С/у,
где v — скорость нейтрона, а С — некоторая постоянная величина. Теперь мы, наконец, можем понять эффект, который наблюдал Ферми в тот солнечный день октября 1934 г., поместив источник нейтронов в бассейн с золотыми рыбками: сталкиваясь с ядрами водорода, нейтроны из радон-бериллиевого источника замедлялись и поэтому с большой вероятностью поглощались ядрами элементов.
Просто, не правда ли? Особенно если вспомнить, что речь идет о процессах внутри ядер атомов, то есть микрообъектов с размерами 10“12 см, структуру и свойства которых мы, по существу, сами воссоздали силой своего воображения. Конечно, созданная нами картина не произвольна — она опирается на данные опытов, но от этого удивление силой человеческого воображения не становится меньше.
 протонов и нейтронов. Основой его концепции было представление о составном ядре, которое возникает при захвате нейтрона, протона, а-частицы обычным ядром. При этом, утверждал Бор, новые частицы теряют свою индивидуальность, «растворяются» в ядре, а энергия, которую они с собой принесли, распределяется между всеми нуклонами ядра. Ядро возбуждается и, чтобы освободиться от избыточной энергии, может поступить по-разному: испустить у-квант, выбросить электрон и антинейтрино или же а-частицу. Развивая эти представления, Бор смог связать воедино разрозненные факты из физики ядерных реакций и даже вывести формулу для энергии связи ядер, которая довольно хорошо совпала с опытом.
Узнав об открытии деления урана, Бор £разу же понял, что оно наиболее естественно объясняется в рамках капельной модели ядра. В самом деле, возбужденное ядро деформируется, иногда настолько сильно, что ему проще разделиться на две части, чтобы избавиться от энергии возбуждения, чем испустить несколько частиц. Совместно со своим учеником Джоном Арчибальдом Уилером (р. 1911 г.) Нильс Бор развил теорию деления ядер. (Ту же задачу независимо решил советский физик Яков Ильич Френкель (1894—1952).)
Сейчас о процессе деления урана известно очень много. Точно измерено сечение деления 2giU тепловыми нейтронами — оно оказалось довольно большим, 582 барн. Известно, что ядро урана делится не одним, а примерно 50 различными способами, причем вероятности их сильно различаются, но не превышают 8 % каждый. Например, барий, который впервые обнаружили Ган и Штрассман в осколках деления урана, образуется при следующих способах деления (их вероятности около 6 %):
протонов и нейтронов. Основой его концепции было представление о составном ядре, которое возникает при захвате нейтрона, протона, а-частицы обычным ядром. При этом, утверждал Бор, новые частицы теряют свою индивидуальность, «растворяются» в ядре, а энергия, которую они с собой принесли, распределяется между всеми нуклонами ядра. Ядро возбуждается и, чтобы освободиться от избыточной энергии, может поступить по-разному: испустить у-квант, выбросить электрон и антинейтрино или же а-частицу. Развивая эти представления, Бор смог связать воедино разрозненные факты из физики ядерных реакций и даже вывести формулу для энергии связи ядер, которая довольно хорошо совпала с опытом.
Узнав об открытии деления урана, Бор £разу же понял, что оно наиболее естественно объясняется в рамках капельной модели ядра. В самом деле, возбужденное ядро деформируется, иногда настолько сильно, что ему проще разделиться на две части, чтобы избавиться от энергии возбуждения, чем испустить несколько частиц. Совместно со своим учеником Джоном Арчибальдом Уилером (р. 1911 г.) Нильс Бор развил теорию деления ядер. (Ту же задачу независимо решил советский физик Яков Ильич Френкель (1894—1952).)
Сейчас о процессе деления урана известно очень много. Точно измерено сечение деления 2giU тепловыми нейтронами — оно оказалось довольно большим, 582 барн. Известно, что ядро урана делится не одним, а примерно 50 различными способами, причем вероятности их сильно различаются, но не превышают 8 % каждый. Например, барий, который впервые обнаружили Ган и Штрассман в осколках деления урана, образуется при следующих способах деления (их вероятности около 6 %):
 Р г
1,7 с
Р г
1,7 с
 Р г
25 с
Р г
25 с
 Р г
18 мин
Р г
18 мин
 Р ?
3,7 ч
Р ?
3,7 ч

 В одном из каналов деления образуется также 15?Ьа с периодом полураспада 3,7 ч, который впервые наблюдали Ирэн Кюри и Павле Савич. Любопытно, что ядро урана почти никогда не делится на две равные части: вероятность такого способа деления меньше 0,01 %. (Как правило, массы осколков распределены в отношении 3:2.) В осколках деления содержится свыше сотни различных радиоактивных изотопов, с разными химическими свойствами и периодами полураспада. Эти изотопы выделяют, сортируют и затем используют как «меченые атомы» в разнообразных исследованиях.
При делении ядра урана кроме осколков вылетают еще 2 или 3 нейтрона — в зависимости от способа деления. Если усреднить их число по всем способам деления, то на каждое деление приходится v/ = 2,42 нейтрона с энергией около 1,3 МэВ. И если бы это число Vf оказалось всего на 10 % меньше, то ядерный реактор на естественном уране был бы невозможен.
В одном из каналов деления образуется также 15?Ьа с периодом полураспада 3,7 ч, который впервые наблюдали Ирэн Кюри и Павле Савич. Любопытно, что ядро урана почти никогда не делится на две равные части: вероятность такого способа деления меньше 0,01 %. (Как правило, массы осколков распределены в отношении 3:2.) В осколках деления содержится свыше сотни различных радиоактивных изотопов, с разными химическими свойствами и периодами полураспада. Эти изотопы выделяют, сортируют и затем используют как «меченые атомы» в разнообразных исследованиях.
При делении ядра урана кроме осколков вылетают еще 2 или 3 нейтрона — в зависимости от способа деления. Если усреднить их число по всем способам деления, то на каждое деление приходится v/ = 2,42 нейтрона с энергией около 1,3 МэВ. И если бы это число Vf оказалось всего на 10 % меньше, то ядерный реактор на естественном уране был бы невозможен.



 усовершенствованного масс-спектрометра обнаружил редкий изотоп урана 292U, причем оказалось, что природный уран на 99,28 % состоит из изотопа и лишь на 0,72 % — из изотопа 292U. Бор предположил, что медленными нейтронами делится уран-235, а быстрые нейтроны, которые при этом делении испускаются, сразу же поглощаются ядрами урана-238, поэтому нейтронная вспышка гаснет, как спичка, брошенная в поленницу сырых дров. Альфред Нир (р. 1911 г.) и Джон Даннинг (1907—1975) подтвердят эту гипотезу Бора только через год, 1 марта 1940 г., но поверили в нее сразу и во всех дальнейших исследованиях принимали ее во внимание.
Сразу же встало три новых вопроса: Сколько нейтронов и с какой энергией вылетает из ядра изотопа урана-235 при каждом делении? Что происходит с ядрами изотопа урана-238 после захвата нейтрона? При каких условиях возможно осуществить незатухающую цепную ядерную реакцию в уране?
Ответ на первый вопрос уже в середине марта получили сразу четыре группы исследователей: Фредерик Жолио-Кюри, Хальбан и Коварски во Франции, Флеров и Русинов в России, Ферми, Андерсон и Ханштейн, а также Сцилард и Зинн в США. Оказалось, что при каждом делении ядра урана-235 испускается примерно два-три вторичных нейтрона со средней энергией 1,3 МэВ. (Точное число нейтронов деления v=2,42, измеренное впоследствии, оставалось государственной тайной вплоть до 1950 г.)
При попытке ответить на второй вопрос вспомнили сразу одну из работ Мейтнер, Гана и Штрассмана. Еще в 1937 г., повторяя эксперименты группы Ферми, они заметили, что ядра урана особенно эффективно поглощают нейтроны с энергией 25 эВ (так тогда думали, в действительности — 6,8 эВ). Такое резонансное поглощение нейтронов всегда сопровождается 0-активностью с периодом полураспада 23 мин, в отличие от случая поглощения медленных «тепловых» нейтронов с энергией 0,04 эВ, когда наблюдается сложная смесь различных периодов полураспада. Теперь причина такого различия прояснилась: уран-235 наиболее эффективно делится медленными нейтронами (его сечение деления велико), и образующиеся в этом случае продукты деления имеют различные периоды полураспада. Напротив, при энергии нейтронов в несколько электрон-вольт сечение резонансного поглощения ураном-238 значительно превышает сечение деления урана-235, поэтому основным процессом является превращение урана-238 в нептуний-238 путем 0-распада.
усовершенствованного масс-спектрометра обнаружил редкий изотоп урана 292U, причем оказалось, что природный уран на 99,28 % состоит из изотопа и лишь на 0,72 % — из изотопа 292U. Бор предположил, что медленными нейтронами делится уран-235, а быстрые нейтроны, которые при этом делении испускаются, сразу же поглощаются ядрами урана-238, поэтому нейтронная вспышка гаснет, как спичка, брошенная в поленницу сырых дров. Альфред Нир (р. 1911 г.) и Джон Даннинг (1907—1975) подтвердят эту гипотезу Бора только через год, 1 марта 1940 г., но поверили в нее сразу и во всех дальнейших исследованиях принимали ее во внимание.
Сразу же встало три новых вопроса: Сколько нейтронов и с какой энергией вылетает из ядра изотопа урана-235 при каждом делении? Что происходит с ядрами изотопа урана-238 после захвата нейтрона? При каких условиях возможно осуществить незатухающую цепную ядерную реакцию в уране?
Ответ на первый вопрос уже в середине марта получили сразу четыре группы исследователей: Фредерик Жолио-Кюри, Хальбан и Коварски во Франции, Флеров и Русинов в России, Ферми, Андерсон и Ханштейн, а также Сцилард и Зинн в США. Оказалось, что при каждом делении ядра урана-235 испускается примерно два-три вторичных нейтрона со средней энергией 1,3 МэВ. (Точное число нейтронов деления v=2,42, измеренное впоследствии, оставалось государственной тайной вплоть до 1950 г.)
При попытке ответить на второй вопрос вспомнили сразу одну из работ Мейтнер, Гана и Штрассмана. Еще в 1937 г., повторяя эксперименты группы Ферми, они заметили, что ядра урана особенно эффективно поглощают нейтроны с энергией 25 эВ (так тогда думали, в действительности — 6,8 эВ). Такое резонансное поглощение нейтронов всегда сопровождается 0-активностью с периодом полураспада 23 мин, в отличие от случая поглощения медленных «тепловых» нейтронов с энергией 0,04 эВ, когда наблюдается сложная смесь различных периодов полураспада. Теперь причина такого различия прояснилась: уран-235 наиболее эффективно делится медленными нейтронами (его сечение деления велико), и образующиеся в этом случае продукты деления имеют различные периоды полураспада. Напротив, при энергии нейтронов в несколько электрон-вольт сечение резонансного поглощения ураном-238 значительно превышает сечение деления урана-235, поэтому основным процессом является превращение урана-238 в нептуний-238 путем 0-распада.
 Если смесь двух газов пропустить сквозь пористую перегородку с отверстиями, которые чуть больше самих атомов, то за перегородкой легкого газа в смеси станет немного больше, чем до перегородки, и, повторяя этот процесс многократно, смесь газов можно в принципе разделить полностью. По удивительной прихоти природы среди примерно 200 соединений урана есть только одно газообразное — шестифтористый уран UF6 — ядовитый газ, который уже при 56° конденсируется в виде игольчатых кристаллов. Если этот газ пропустить через специальную пористую перегородку, то за ней урана-235 станет на 0,14 % больше, чем до нее, а поставив несколько тысяч таких перегородок, можно в конце концов отделить уран-235 от урана-238. Все это станет возможным, однако, только пять лет спустя, а летом 1939 г. ученые были озабочены другим: как осуществить незатухающую ядерную реакцию в природном уране?
Прежде всего, вместо воды следовало выбрать другой замедлитель. Выбор оказался небогатым: либо углерод (сечение захвата им нейтронов о = 0,0034 барн), либо тяжелая вода D2O, то есть вода, в которой водород замещен дейтерием (сечение захвата о = 0,0012 барн). Легко видеть, что тяжелая вода предпочтительнее. Однако ее очень трудно добывать: в литре обычной воды содержится всего 0,15 г тяжелой. К тому же в 1939 г. это умели делать только в одном месте в мире — в Норвегии, на небольшом заводе в Веморке. Из двух возможностей Жолио-Кюри и Гейзенберг независимо друг от друга выбрали тяжелую воду, в то время как Ферми, Сцилард и Курчатов решили попытать счастья с графитом.
. Условие, при котором цепная ядерная реакция возможна, принято записывать с помощью простой и знаменитой «формулы четырех сомножителей»:
^оо = т^ефО.
Коэффициент размножения — это число вторичных нейтронов, возникающих в реакторе бесконечных размеров на каждый первичный нейтрон деления. Ясно, что расходящаяся цепная реакция возможна лишь в том случае, если kOQ> 1, то есть в каждом последующем «поколении» нейтронов будет больше, чем в предыдущем.
Коэффициент ц — это число вторичных тепловых нейтронов в естественном уране, которое отличается от среднего числа нейтронов деления в чистом уране-235. Дело в том, что при захвате медленного нейтрона ядрами урана-235 они делятся только в 84 % случаев, а в остальных 16 % испускают у-квант и превращаются в ядра изотопа урана-236. Кроме того, даже тепловые нейтроны захватываются изотопом урана-238, хотя и много слабее, чем резонансные. Но в естественной смеси изотопов урана-238 в 149 раз больше, чем урана-235, поэтому для такой смеси коэффициент т) = 1,34 — много меньше исходного коэффициента размножения v = 2,42, хотя все еще и превышает единицу.
Коэффициент е учитывает то обстоятельство, что быстрые нейтроны деления, пока их энергия больше чем 1,5 МэВ, способны также делить и ядра урана-238, то есть реально увеличивают число вторичных нейтронов. Для уран-графитовых реакторов е=1,03.
Много хлопот доставил коэффициент ф — вероятность избежать резонансного захвата нейтронов в уране-238 в процессе их замедления. Если бы все нейтроны деления достигали тепловых энергий без потерь в уране-238, то коэффициент ф был бы равен единице. Как всякий идеал, значение ф=1 недостижимо, но можно пытаться к нему приблизиться. Способ увеличить коэффициент ф придумали почти сразу же, летом 1939 г.: во Франции, США и Германии независимо возникла идея гетерогенного реактора. Суть идеи проста и состоит в следующем: вместо того чтобы перемешивать равномерно уран и замедлитель, нужно разместить блоки урана в пространстве на некотором расстоянии друг от друга, наподобие атомов в кристаллической решетке, а затем уже заполнить этот объем замедлителем. В этом случае нейтроны деления, вылетая из блоков урана с энергией около 2 МэВ, большую часть пути будут проходить в замедлителе и к тому времени, когда они достигнут другого блока урана, уже минуют опасную резонансную область энергий. К тому же нейтроны деления, образовавшиеся в блоках урана с большой начальной энергией 2 МэВ, проходят его толщу, не успевая замедлиться до резонансных энергий, что еще более повышает эффективность такого гетерогенного реактора. (В работе Исая Исидоровича Гуревича и Исаака Яковлевича Померанчука, которая стала важным элементом советской урановой программы, это явление названо «блок-эффектом».) Должным образом подбирая расстояния между блоками урана, на этом пути достигли значения ф = 0,93 (для гомогенного реактора ф=0,65).
286
Если смесь двух газов пропустить сквозь пористую перегородку с отверстиями, которые чуть больше самих атомов, то за перегородкой легкого газа в смеси станет немного больше, чем до перегородки, и, повторяя этот процесс многократно, смесь газов можно в принципе разделить полностью. По удивительной прихоти природы среди примерно 200 соединений урана есть только одно газообразное — шестифтористый уран UF6 — ядовитый газ, который уже при 56° конденсируется в виде игольчатых кристаллов. Если этот газ пропустить через специальную пористую перегородку, то за ней урана-235 станет на 0,14 % больше, чем до нее, а поставив несколько тысяч таких перегородок, можно в конце концов отделить уран-235 от урана-238. Все это станет возможным, однако, только пять лет спустя, а летом 1939 г. ученые были озабочены другим: как осуществить незатухающую ядерную реакцию в природном уране?
Прежде всего, вместо воды следовало выбрать другой замедлитель. Выбор оказался небогатым: либо углерод (сечение захвата им нейтронов о = 0,0034 барн), либо тяжелая вода D2O, то есть вода, в которой водород замещен дейтерием (сечение захвата о = 0,0012 барн). Легко видеть, что тяжелая вода предпочтительнее. Однако ее очень трудно добывать: в литре обычной воды содержится всего 0,15 г тяжелой. К тому же в 1939 г. это умели делать только в одном месте в мире — в Норвегии, на небольшом заводе в Веморке. Из двух возможностей Жолио-Кюри и Гейзенберг независимо друг от друга выбрали тяжелую воду, в то время как Ферми, Сцилард и Курчатов решили попытать счастья с графитом.
. Условие, при котором цепная ядерная реакция возможна, принято записывать с помощью простой и знаменитой «формулы четырех сомножителей»:
^оо = т^ефО.
Коэффициент размножения — это число вторичных нейтронов, возникающих в реакторе бесконечных размеров на каждый первичный нейтрон деления. Ясно, что расходящаяся цепная реакция возможна лишь в том случае, если kOQ> 1, то есть в каждом последующем «поколении» нейтронов будет больше, чем в предыдущем.
Коэффициент ц — это число вторичных тепловых нейтронов в естественном уране, которое отличается от среднего числа нейтронов деления в чистом уране-235. Дело в том, что при захвате медленного нейтрона ядрами урана-235 они делятся только в 84 % случаев, а в остальных 16 % испускают у-квант и превращаются в ядра изотопа урана-236. Кроме того, даже тепловые нейтроны захватываются изотопом урана-238, хотя и много слабее, чем резонансные. Но в естественной смеси изотопов урана-238 в 149 раз больше, чем урана-235, поэтому для такой смеси коэффициент т) = 1,34 — много меньше исходного коэффициента размножения v = 2,42, хотя все еще и превышает единицу.
Коэффициент е учитывает то обстоятельство, что быстрые нейтроны деления, пока их энергия больше чем 1,5 МэВ, способны также делить и ядра урана-238, то есть реально увеличивают число вторичных нейтронов. Для уран-графитовых реакторов е=1,03.
Много хлопот доставил коэффициент ф — вероятность избежать резонансного захвата нейтронов в уране-238 в процессе их замедления. Если бы все нейтроны деления достигали тепловых энергий без потерь в уране-238, то коэффициент ф был бы равен единице. Как всякий идеал, значение ф=1 недостижимо, но можно пытаться к нему приблизиться. Способ увеличить коэффициент ф придумали почти сразу же, летом 1939 г.: во Франции, США и Германии независимо возникла идея гетерогенного реактора. Суть идеи проста и состоит в следующем: вместо того чтобы перемешивать равномерно уран и замедлитель, нужно разместить блоки урана в пространстве на некотором расстоянии друг от друга, наподобие атомов в кристаллической решетке, а затем уже заполнить этот объем замедлителем. В этом случае нейтроны деления, вылетая из блоков урана с энергией около 2 МэВ, большую часть пути будут проходить в замедлителе и к тому времени, когда они достигнут другого блока урана, уже минуют опасную резонансную область энергий. К тому же нейтроны деления, образовавшиеся в блоках урана с большой начальной энергией 2 МэВ, проходят его толщу, не успевая замедлиться до резонансных энергий, что еще более повышает эффективность такого гетерогенного реактора. (В работе Исая Исидоровича Гуревича и Исаака Яковлевича Померанчука, которая стала важным элементом советской урановой программы, это явление названо «блок-эффектом».) Должным образом подбирая расстояния между блоками урана, на этом пути достигли значения ф = 0,93 (для гомогенного реактора ф=0,65).
286


 всегда меньше единицы. Очевидно, существуют какие-то критические размеры реактора, при которых произведение k = kco р=1. Оставалось выяснить, насколько велики эти размеры.
В декабре 1940 г. Ганс Халбан и Лео Коварски в Англии, куда они после оккупации Франции эмигрировали со всем запасом урана и тяжелой воды, установили, что для осуществления незатухающей ядерной реакции достаточно взять около 5 т тяжелой воды и разместить в ней должным образом примерно столько же тонн урана. К аналогичному выводу пришел и Гейзенберг в Германии. Однако такого количества тяжелой воды не было тогда во всем мире, и трудно было ожидать, что она появится в ближайшее время. Поэтому Ферми пытался определить критические размеры уран-гр афитового реактора и в течение последующих двух лет достиг цели.
Итак, ядерный реактор построить можно. Но можно ли им управлять? Не взорвется ли он, как только значение коэффициента размножения нейтронов k превысит единицу? Оказалось, что природа и здесь пошла навстречу человеку.
В лавине работ, которые появились сразу вслед за открытием деления урана, была одна, которую вначале не оценили должным образом. В марте 1939 г. Робертс, Мейер и Вонг из Колумбийского университета обнаружили, что примерно 1 % нейтронов вылетает при делении урана не вместе с осколками, а чуть позже — через 0,2, 0,9 и даже через 56 с. Физика этого явления вскоре стала понятной: запаздывающие нейтроны, в отличие от мгновенных, вылетают не из ядра урана, а из его осколков.
Осколки эти — свыше сотни изотопов около сорока различных элементов из середины таблицы Менделеева — отягощены избытком нейтронов и стремятся от них избавиться. Большая часть изотопов освобождается от нейтронов путем Р-распада, то есть превращая их в протоны,— точно так же, как это происходило в опытах Ферми по поглощению нейтронов ядрами. Однако небольшая часть образовавшихся изотопов, после некоторых колебаний, выбрасывает лишний нейтрон целиком, не расщепляя его на протон и электрон. Именно эти запаздывающие нейтроны, которые составляют всего 0,64 % от общего их числа, позволяют управлять работой ядерного реактора. В самом деле, если по какой-то причине число нейтронов в реакторе внезапно увеличится, то благодаря запаздывающим нейтронам они станут размножаться лавинообразно не сразу, а только через несколько 288
секунд. Этого времени вполне достаточно, чтобы погасить «атомный огонь» вручную, без всякой автоматики, погружая в толщу реактора стержни из бора или кадмия (сечения захвата нейтронов для них огромны: для кадмия, например, 0захв = 245О барн).
всегда меньше единицы. Очевидно, существуют какие-то критические размеры реактора, при которых произведение k = kco р=1. Оставалось выяснить, насколько велики эти размеры.
В декабре 1940 г. Ганс Халбан и Лео Коварски в Англии, куда они после оккупации Франции эмигрировали со всем запасом урана и тяжелой воды, установили, что для осуществления незатухающей ядерной реакции достаточно взять около 5 т тяжелой воды и разместить в ней должным образом примерно столько же тонн урана. К аналогичному выводу пришел и Гейзенберг в Германии. Однако такого количества тяжелой воды не было тогда во всем мире, и трудно было ожидать, что она появится в ближайшее время. Поэтому Ферми пытался определить критические размеры уран-гр афитового реактора и в течение последующих двух лет достиг цели.
Итак, ядерный реактор построить можно. Но можно ли им управлять? Не взорвется ли он, как только значение коэффициента размножения нейтронов k превысит единицу? Оказалось, что природа и здесь пошла навстречу человеку.
В лавине работ, которые появились сразу вслед за открытием деления урана, была одна, которую вначале не оценили должным образом. В марте 1939 г. Робертс, Мейер и Вонг из Колумбийского университета обнаружили, что примерно 1 % нейтронов вылетает при делении урана не вместе с осколками, а чуть позже — через 0,2, 0,9 и даже через 56 с. Физика этого явления вскоре стала понятной: запаздывающие нейтроны, в отличие от мгновенных, вылетают не из ядра урана, а из его осколков.
Осколки эти — свыше сотни изотопов около сорока различных элементов из середины таблицы Менделеева — отягощены избытком нейтронов и стремятся от них избавиться. Большая часть изотопов освобождается от нейтронов путем Р-распада, то есть превращая их в протоны,— точно так же, как это происходило в опытах Ферми по поглощению нейтронов ядрами. Однако небольшая часть образовавшихся изотопов, после некоторых колебаний, выбрасывает лишний нейтрон целиком, не расщепляя его на протон и электрон. Именно эти запаздывающие нейтроны, которые составляют всего 0,64 % от общего их числа, позволяют управлять работой ядерного реактора. В самом деле, если по какой-то причине число нейтронов в реакторе внезапно увеличится, то благодаря запаздывающим нейтронам они станут размножаться лавинообразно не сразу, а только через несколько 288
секунд. Этого времени вполне достаточно, чтобы погасить «атомный огонь» вручную, без всякой автоматики, погружая в толщу реактора стержни из бора или кадмия (сечения захвата нейтронов для них огромны: для кадмия, например, 0захв = 245О барн).
 ции мира. Во Франции АЭС вырабатыва ют 70 % электроэнергии, а к концу ве-ка эта доля возрастет до 85 % (во всем мире — до 30 %).
История овладения атомной энергией уникальна во многих отношениях: по значимости проблемы, обстоятельствам, сопутствовавшим ее решению, и последствиям, которые еще далеко не всеми осознаны. В науке и раньше так случалось, что два исследователя независимо друг от друга открывали одно и то же явление. Само по себе это не очень удиви-верим в объективность законов природы.
Но впервые случилось так, что сотни и тысячи людей, разделенные океанами, пожаром войны и стеной секретности, последовательно, шаг за шагом приходили к одинаковым заключениям, ставили и решали одни и те же научные, технологические и инженерные задачи и примерно в той же последовательности. Только в 1955 г., после 15 лет практически полной изоляции, ученые из СССР и США, Франции и Англии, Канады и Японии — всего 79 стран — собрались в Женеве на Первую международную конференцию по мирному использованию атомной энергии и смогли убедиться, что их независимые измерения и формулы совпали с большой точностью. Мало того, часто совпадали даже обозначения в формулах, полученных в разное время и разными людьми. Как будто Книга Природы открылась всем им одновременно, а они лишь записали ее письмена.
Оглядываясь назад, трудно удержаться от удивления, насколько узкой оказалась тропа и сколь хрупким мостик из века пара и электричества в эпоху атома и ядра. Ведь любой из четырех сомножителей в формуле для коэффициента размножения нейтронов мог оказаться на 5—10 % меньше — и реактор на природном уране был бы невозможен. А если бы не запаздывающие нейтроны, то управление реактором стало бы специальной и трудной проблемой.
Все физические процессы, происходящие внутри ядерного реактора, мы знаем теперь во всех деталях. Для начала цепной реакции в принципе достаточно даже одного нейтрона. В толще урана они всегда есть: каждую секунду в 1 кг урана спонтанно делятся 7 ядер, и вылетающие при этом нейтроны могут служить «спичкой», поджигающей «урановый костер». Вылетевшие нейтроны, прежде чем дать 290
ции мира. Во Франции АЭС вырабатыва ют 70 % электроэнергии, а к концу ве-ка эта доля возрастет до 85 % (во всем мире — до 30 %).
История овладения атомной энергией уникальна во многих отношениях: по значимости проблемы, обстоятельствам, сопутствовавшим ее решению, и последствиям, которые еще далеко не всеми осознаны. В науке и раньше так случалось, что два исследователя независимо друг от друга открывали одно и то же явление. Само по себе это не очень удиви-верим в объективность законов природы.
Но впервые случилось так, что сотни и тысячи людей, разделенные океанами, пожаром войны и стеной секретности, последовательно, шаг за шагом приходили к одинаковым заключениям, ставили и решали одни и те же научные, технологические и инженерные задачи и примерно в той же последовательности. Только в 1955 г., после 15 лет практически полной изоляции, ученые из СССР и США, Франции и Англии, Канады и Японии — всего 79 стран — собрались в Женеве на Первую международную конференцию по мирному использованию атомной энергии и смогли убедиться, что их независимые измерения и формулы совпали с большой точностью. Мало того, часто совпадали даже обозначения в формулах, полученных в разное время и разными людьми. Как будто Книга Природы открылась всем им одновременно, а они лишь записали ее письмена.
Оглядываясь назад, трудно удержаться от удивления, насколько узкой оказалась тропа и сколь хрупким мостик из века пара и электричества в эпоху атома и ядра. Ведь любой из четырех сомножителей в формуле для коэффициента размножения нейтронов мог оказаться на 5—10 % меньше — и реактор на природном уране был бы невозможен. А если бы не запаздывающие нейтроны, то управление реактором стало бы специальной и трудной проблемой.
Все физические процессы, происходящие внутри ядерного реактора, мы знаем теперь во всех деталях. Для начала цепной реакции в принципе достаточно даже одного нейтрона. В толще урана они всегда есть: каждую секунду в 1 кг урана спонтанно делятся 7 ядер, и вылетающие при этом нейтроны могут служить «спичкой», поджигающей «урановый костер». Вылетевшие нейтроны, прежде чем дать 290
 начало новому поколению нейтронов, живут в реакторе меньше тысячной доли секунды. За это время они успевают испытать с ядрами углерода 114 соударений, пройти путь 54 см, замедлиться до тепловых скоростей и вызвать новое деление ядра урана. Число нейтронов в реакторе нарастает лавинообразно и через несколько секунд достигает уровня, который заранее задан расположением регулирующих стержней поглотителей. В каждом кубическОхМ сантиметре объема мощного реактора содержится примерно пол миллиарда нейтронов, которые всегда «находятся в пути» от одного ядра урана к другому. В целом же внутри корпуса реактора устанавливается некоторое стационарное распределение нейтронов, так называемое нейтронное поле довольно сложной конфигурации, которое отчасти можно уподобить распределению электрического поля в электролитических ваннах. Им можно управлять, иногда оно испытывает колебания и всегда является предметом пристального внимания физиков и повседневных забот инженеров.
В целом, несмотря на сложность физических процессов, происходящих в «атомном котле», его принципиальная схема оказалась проста до чрезвычайности. «Урановый реактор олицетворяет собой самое гениальное и замечательное достижение разума за всю историю человечества»,— писал Фредерик Содди в конце жизни, через 50 лет после начала своих опытов с ураном и торием.
начало новому поколению нейтронов, живут в реакторе меньше тысячной доли секунды. За это время они успевают испытать с ядрами углерода 114 соударений, пройти путь 54 см, замедлиться до тепловых скоростей и вызвать новое деление ядра урана. Число нейтронов в реакторе нарастает лавинообразно и через несколько секунд достигает уровня, который заранее задан расположением регулирующих стержней поглотителей. В каждом кубическОхМ сантиметре объема мощного реактора содержится примерно пол миллиарда нейтронов, которые всегда «находятся в пути» от одного ядра урана к другому. В целом же внутри корпуса реактора устанавливается некоторое стационарное распределение нейтронов, так называемое нейтронное поле довольно сложной конфигурации, которое отчасти можно уподобить распределению электрического поля в электролитических ваннах. Им можно управлять, иногда оно испытывает колебания и всегда является предметом пристального внимания физиков и повседневных забот инженеров.
В целом, несмотря на сложность физических процессов, происходящих в «атомном котле», его принципиальная схема оказалась проста до чрезвычайности. «Урановый реактор олицетворяет собой самое гениальное и замечательное достижение разума за всю историю человечества»,— писал Фредерик Содди в конце жизни, через 50 лет после начала своих опытов с ураном и торием.
 ВОКРУГ КВАНТА
В феврале 1939 г. статьи Гана и Штрассмана, Мейтнер и Фриша почти одновременно дошли до Ленинграда. Как и повсюду, в лаборатории И. В. Курчатова немедленно начались эксперименты. Вскоре там тоже наблюдали осколки ядер урана, и уже в апреле Георгий Николаевич Флеров и Лев Ильич Русинов измерили число вторичных нейтронов деления v = 3±l, а в мае 1940 г. Флеров и Константин Антонович Петржак натолкнулись на новое, неожиданное явление природы — спонтанное деление ядер урана. Оказалось, что даже в отсутствие нейтронов, без внешнего воздействия, ядра урана самопроизвольно взрываются. Это происходит очень редко: период полураспада по каналу деления равен 1016 лет, то есть в миллион раз больше, чем время существования Вселенной, и в два миллиарда раз больше, чем период сс-распада урана. В среднем за час из 3-1021 ядер, содержащихся в 1 г урана, распадается всего 23 ядра. Это очень мало, но именно такие сигналы природы свидетельствуют о самых важных деталях ее устройства.
ВОКРУГ КВАНТА
В феврале 1939 г. статьи Гана и Штрассмана, Мейтнер и Фриша почти одновременно дошли до Ленинграда. Как и повсюду, в лаборатории И. В. Курчатова немедленно начались эксперименты. Вскоре там тоже наблюдали осколки ядер урана, и уже в апреле Георгий Николаевич Флеров и Лев Ильич Русинов измерили число вторичных нейтронов деления v = 3±l, а в мае 1940 г. Флеров и Константин Антонович Петржак натолкнулись на новое, неожиданное явление природы — спонтанное деление ядер урана. Оказалось, что даже в отсутствие нейтронов, без внешнего воздействия, ядра урана самопроизвольно взрываются. Это происходит очень редко: период полураспада по каналу деления равен 1016 лет, то есть в миллион раз больше, чем время существования Вселенной, и в два миллиарда раз больше, чем период сс-распада урана. В среднем за час из 3-1021 ядер, содержащихся в 1 г урана, распадается всего 23 ядра. Это очень мало, но именно такие сигналы природы свидетельствуют о самых важных деталях ее устройства.
 отношении много вреднее: в каждой тонне угля содержится примерно 80 г урана, поэтому радиоактивность шлейфов дыма мощных ТЭЦ в сотни раз превышает выбросы АЭС, не говоря уж о том, что сернистый газ этого дыма со временем уничтожает в округе все леса и живность.
И все же люди инстинктивно сопротивляются строительству АЭС, по этому поводу устраиваются референдумы и демонстрации, уходят в отставку правительства. Причина этого явления — не только в неосведомленности большей части людей относительно природы атомной энергии: как правило, они отождествляют ее с атомной бомбой. По-видимому, эмоциональное неприятие атомной энергии сродни тем многочисленным психологическим феноменам человеческого сознания, которые часто побуждают нас к поступкам, явно противоречащим нашим же целям. К примеру, многие горожане мечтают жить в тишине, но мало кто из них пожелает поселиться в заброшенном замке — даже если он не верит в привидения и вампиров. Но независимо от капризов психологии логика жизни побеждает: на пепелище Хиросимы вновь выросли дома и рождаются дети. И даже трагедия Чернобыля не может надолго изменить логику развития атомной энергетики: у человечества нет пока другой длительной перспективы выжить. Атомную энергию невозможно теперь «закрыть». Точно так же нельзя упразднить автомобили, корабли и самолеты несмотря на то, что каждый год десятки и сотни тысяч людей, к сожалению, тонут в кораблекрушениях, гибнут в авто- и авиакатастрофах.
Грядущие проблемы энергетики без атомной энергии решить невозможно — с этим теперь согласны почти все. Но как надолго хватит «уранового топлива»? В каждом грамме земной породы содержится в среднем 3,5 -10~6 г урана, то есть 3« 10“8 г урана-235. В пересчете на энергию деления это составляет 600 кал, то есть всего лишь в 10 раз меньше, чем химическая энергия, заключенная в грамме угля. Кстати, в 1 г угля урана больше, а именно 0,8-10~4 г, и при сгорании он большей частью остается в золе, которая составляет 20 % от веса исходного угля. Легко сосчитать, что в каждом грамме золы запасено около 60 ккал энергии деления урана-235, то есть примерно в 10 раз больше, чем энергия сгорания самого угля. Таким образом, земля под ногами — это сплошное месторождение ядерного топлива, и нужно только научиться его оттуда извлекать.
Во всем мире считаются рентабельными месторождения с содержанием урана больше чем 10“3 г/г, то есть 1 г на 1 кг породы. В таких месторождениях — около 5 млн. тонн урана или 50 тыс. тонн урана-235, из которых сейчас на планете добывается около 300 тонн в год. Современный уровень потребления электроэнергии соответствует сжиганию около 500 тонн урана-235 в год, то есть при нынешних темпах развития энергетики запасов урана-235 хватит ненадолго — не более чем на 100 лет. Отсюда ясно, что для решения энергетической проблемы будущего нужно найти способ использовать уран-238. Такой способ нашли довольно быстро: Ферми предложил идею «реактора-размножителя», при работе которого ядерного топлива образуется больше, чем сгорает.
отношении много вреднее: в каждой тонне угля содержится примерно 80 г урана, поэтому радиоактивность шлейфов дыма мощных ТЭЦ в сотни раз превышает выбросы АЭС, не говоря уж о том, что сернистый газ этого дыма со временем уничтожает в округе все леса и живность.
И все же люди инстинктивно сопротивляются строительству АЭС, по этому поводу устраиваются референдумы и демонстрации, уходят в отставку правительства. Причина этого явления — не только в неосведомленности большей части людей относительно природы атомной энергии: как правило, они отождествляют ее с атомной бомбой. По-видимому, эмоциональное неприятие атомной энергии сродни тем многочисленным психологическим феноменам человеческого сознания, которые часто побуждают нас к поступкам, явно противоречащим нашим же целям. К примеру, многие горожане мечтают жить в тишине, но мало кто из них пожелает поселиться в заброшенном замке — даже если он не верит в привидения и вампиров. Но независимо от капризов психологии логика жизни побеждает: на пепелище Хиросимы вновь выросли дома и рождаются дети. И даже трагедия Чернобыля не может надолго изменить логику развития атомной энергетики: у человечества нет пока другой длительной перспективы выжить. Атомную энергию невозможно теперь «закрыть». Точно так же нельзя упразднить автомобили, корабли и самолеты несмотря на то, что каждый год десятки и сотни тысяч людей, к сожалению, тонут в кораблекрушениях, гибнут в авто- и авиакатастрофах.
Грядущие проблемы энергетики без атомной энергии решить невозможно — с этим теперь согласны почти все. Но как надолго хватит «уранового топлива»? В каждом грамме земной породы содержится в среднем 3,5 -10~6 г урана, то есть 3« 10“8 г урана-235. В пересчете на энергию деления это составляет 600 кал, то есть всего лишь в 10 раз меньше, чем химическая энергия, заключенная в грамме угля. Кстати, в 1 г угля урана больше, а именно 0,8-10~4 г, и при сгорании он большей частью остается в золе, которая составляет 20 % от веса исходного угля. Легко сосчитать, что в каждом грамме золы запасено около 60 ккал энергии деления урана-235, то есть примерно в 10 раз больше, чем энергия сгорания самого угля. Таким образом, земля под ногами — это сплошное месторождение ядерного топлива, и нужно только научиться его оттуда извлекать.
Во всем мире считаются рентабельными месторождения с содержанием урана больше чем 10“3 г/г, то есть 1 г на 1 кг породы. В таких месторождениях — около 5 млн. тонн урана или 50 тыс. тонн урана-235, из которых сейчас на планете добывается около 300 тонн в год. Современный уровень потребления электроэнергии соответствует сжиганию около 500 тонн урана-235 в год, то есть при нынешних темпах развития энергетики запасов урана-235 хватит ненадолго — не более чем на 100 лет. Отсюда ясно, что для решения энергетической проблемы будущего нужно найти способ использовать уран-238. Такой способ нашли довольно быстро: Ферми предложил идею «реактора-размножителя», при работе которого ядерного топлива образуется больше, чем сгорает.
 239 XT . ~
ЗЗмин -NP + е + v
239 XT . ~
ЗЗмин -NP + е + v
 2,3дня “Рп + е+*
2,3дня “Рп + е+*
 235 у?
24 360 лет 92 а'
По существу он был прав тогда, говоря о наблюдении трансурановых элементов, хотя и не представлял всей сложности наблюдаемого явления.
Возвращаясь к событиям тех не очень далеких, но уже исторических дней, трудно удержаться от мысли, что решение Ферми прекратить исследования реакций нейтронов с ураном (которое он никогда не мог себе простить) обернулось для человечества неожиданным благом. Страшно подумать, как бы повернулась история, если бы деление урана было открыто не в 1938 г., а в 1934 г. — вскоре после прихода нацистов к власти. Трудно сомневаться в том, что идущий к войне фашизм сумел бы использовать весь научный потенциал Германии, чтобы создать и применить ядерное оружие.
Открытие плутония изменило сам подход к решению урановой проблемы. Прежде всего, стало ясно, что поглощение нейтронов в уране-238 — полезный процесс, поскольку при этом образуется «ядерное топливо» — столь же и даже более эффективное, чем уран-235. Кроме того, плутоний можно отделять от урана, из которого он образуется, химическими методами, а это несравнимо проще, чем разделять изотопы урана. Однако вся эта красивая схема могла стать реаль-300
ностью лишь при условии, что цепная ядерная реакция в природном уране действительно осуществима. (Сырые поленья можно просушить только в том случае, если костер пусть плохо, но все же горит.) Пуск первого ядерного реактора в декабре 1942 г. разрешил это последнее сомнение. Отныне на пути к ядерной энергии оставались лишь инженерные и технологические трудности. Их тоже немало, и преодолеть их было не просто: достаточно вспомнить, что для выделения 1 г плутония надо переработать примерно 1 кг облученного урана, пропустив его через 30 химических реакций и более сотни операций. Но уже в августе 1944 г. в Хэнфорде были запущены огромные «урановые котлы», а весной 1945 г. они давали почти по килограмму плутония в день.
В истории атомной энергии поражает контраст между простотой конечного результата (урановые стержни в баке с водой) и изощренностью физических идей, необходимых для понимания процессов, происходящих в этом баке. Для решения проблемы ядерной энергии были использованы все главные достижения науки XX века: теория относительности и квантовая механика, атомная и ядерная физика, учение о радиоактивности и техника ускорителей. Пожалуй, никогда прежде повседневная жизньлюдей не зависела так явно от успехов самого абстрактного знания.
235 у?
24 360 лет 92 а'
По существу он был прав тогда, говоря о наблюдении трансурановых элементов, хотя и не представлял всей сложности наблюдаемого явления.
Возвращаясь к событиям тех не очень далеких, но уже исторических дней, трудно удержаться от мысли, что решение Ферми прекратить исследования реакций нейтронов с ураном (которое он никогда не мог себе простить) обернулось для человечества неожиданным благом. Страшно подумать, как бы повернулась история, если бы деление урана было открыто не в 1938 г., а в 1934 г. — вскоре после прихода нацистов к власти. Трудно сомневаться в том, что идущий к войне фашизм сумел бы использовать весь научный потенциал Германии, чтобы создать и применить ядерное оружие.
Открытие плутония изменило сам подход к решению урановой проблемы. Прежде всего, стало ясно, что поглощение нейтронов в уране-238 — полезный процесс, поскольку при этом образуется «ядерное топливо» — столь же и даже более эффективное, чем уран-235. Кроме того, плутоний можно отделять от урана, из которого он образуется, химическими методами, а это несравнимо проще, чем разделять изотопы урана. Однако вся эта красивая схема могла стать реаль-300
ностью лишь при условии, что цепная ядерная реакция в природном уране действительно осуществима. (Сырые поленья можно просушить только в том случае, если костер пусть плохо, но все же горит.) Пуск первого ядерного реактора в декабре 1942 г. разрешил это последнее сомнение. Отныне на пути к ядерной энергии оставались лишь инженерные и технологические трудности. Их тоже немало, и преодолеть их было не просто: достаточно вспомнить, что для выделения 1 г плутония надо переработать примерно 1 кг облученного урана, пропустив его через 30 химических реакций и более сотни операций. Но уже в августе 1944 г. в Хэнфорде были запущены огромные «урановые котлы», а весной 1945 г. они давали почти по килограмму плутония в день.
В истории атомной энергии поражает контраст между простотой конечного результата (урановые стержни в баке с водой) и изощренностью физических идей, необходимых для понимания процессов, происходящих в этом баке. Для решения проблемы ядерной энергии были использованы все главные достижения науки XX века: теория относительности и квантовая механика, атомная и ядерная физика, учение о радиоактивности и техника ускорителей. Пожалуй, никогда прежде повседневная жизньлюдей не зависела так явно от успехов самого абстрактного знания.

 производству. Одним словом, сделать атомную бомбу сейчас — не проблема, значительно труднее понять, как теперь жить на Земле, если на каждого обитателя планеты, вклю
чая стариков и грудных младенцев, уже сейчас накоплено по 5 т ядерной взрывчатки.
Со времени открытия радиоактивности, выяснения ее природы и запасов энергии, с ней связанных, ученые всегда опасались, что, влекомые инстинктом познания, они невольно уподобятся злополучной Пандоре.
В 1903 г. Резерфорд как-то заметил: «Может статься, что какой-нибудь идиот в лаборатории взорвет ненароком весь мир».
В том же году Пьер Кюри с беспокойством говорил в своей нобелевской речи: «Можно думать, что в преступных руках радий станет очень опасным, и здесь уместно задать вопрос, заинтересовано ли человечество в дальнейшем раскрытии секретов природы, достаточно ли оно созрело для того, чтобы с пользой применить полученные знания, не могут ли они повлиять отрицательно на будущее человечества?»
производству. Одним словом, сделать атомную бомбу сейчас — не проблема, значительно труднее понять, как теперь жить на Земле, если на каждого обитателя планеты, вклю
чая стариков и грудных младенцев, уже сейчас накоплено по 5 т ядерной взрывчатки.
Со времени открытия радиоактивности, выяснения ее природы и запасов энергии, с ней связанных, ученые всегда опасались, что, влекомые инстинктом познания, они невольно уподобятся злополучной Пандоре.
В 1903 г. Резерфорд как-то заметил: «Может статься, что какой-нибудь идиот в лаборатории взорвет ненароком весь мир».
В том же году Пьер Кюри с беспокойством говорил в своей нобелевской речи: «Можно думать, что в преступных руках радий станет очень опасным, и здесь уместно задать вопрос, заинтересовано ли человечество в дальнейшем раскрытии секретов природы, достаточно ли оно созрело для того, чтобы с пользой применить полученные знания, не могут ли они повлиять отрицательно на будущее человечества?»

 ВОКРУГ КВАНТА
ВОКРУГ КВАНТА
 ным успехом и широкой известностью. (Фредерик Жолио-Кюри, по его собственному признанию, выбрал жизненный путь под влиянием книги Содди «Радий и его разгадка».) В этих книгах он настойчиво внушал, какие необратимые изменения в жизнь людей принесла с собой новая наука о радиоактивности. Мало кто в его время с такой определенностью и беспокойством говорил о будущем атомной энергии, об экологии и энергетическом кризисе — обо всем том, что лишь сейчас, три четверти века спустя, стало очевидным для многих. Уже в своей лекции 23 февраля 1904 г. собравшимся, что «искусственная трансму-
Содди
тация
блемы
Представленные здесь отрывки из многочисленных книг
объяснял
элементов навсегда освободит человечество от проэнергии».
Содди интересны во многих отношениях: и как документы эпохи, и как отпечаток его личности, и как редкая возможность взглянуть глазами современника на первые шаги атомной эры, зная уже, к чему они впоследствии привели.
В 1907 г. в своей знаменитой книге «Радий и его разгадка» Содди писал: «Через несколько лет основы радиоактивности будут преподаваться во всех школах, ибо они принадлежат к основным принципам физики».
«В последнее столетие культурное человечество стало, так сказать, совершеннолетним и вступило в обладание наследством, которое солнце в течение долгих времен запасло в каменном угле. Человечество стремится как можно скорее растратить это наследство. С юношеской беззаботностью оно не думает о будущем и живет надеждою, что неисчерпаемы те запасы энергии, от которых наша культура зависит во всех отношениях...»
«Мы действительно переживаем замечательный момент. Первым шагом на длинном пути от варварства к цивилизации, пройденным человеком, было, по-видимому, искусство добывать огонь... Нетрудно себе представить, как он впервые, благодаря естественным пожарам, познал огонь и его свойства. Открытый нами недавно внутренний запас энергии в атомах ставит нас в то же положение, в котором первобытный человек находился по отношению к стихийной силе огня: мы знаем о существовании этого внутреннего запаса только благодаря естественным проявлениям радиоактивности».
«Не надо особого полета фантазии, чтобы в энергии видеть источник физической жизни вселенной, а ключ к первоисточникам энергии, как мы в настоящее время знаем, дает превращение элементов».
«Жизнь зависит, конечно, столько же от постоянного притока вещества, как и от постоянного притока энергии... Одно и то же вещество, одни и те же химические элементы служат неизменно для бесчисленных циклов жизни, но для них необходим непрерывный приток свежего запаса энергии... Одно и то же количество энергии в одних и тех же условиях работает только один раз. Борьба за существование в основе своей и есть непрерывная борьба за свежий запас физической энергии».
«Дикий человек, который не знал земледелия и не умел добывать огня, погибал от голода и холода, если он не уподоблялся хищному зверю и не пожирал других зверей. Хотя запасы тепла и пищи существовали везде вокруг него и в силу естественных процессов должны были быть ему известны, тем не менее он не умел воспользоваться ими для своих целей. Теперь — нечто подобное. Вся наша цивилизованная раса и теперь еще живет в борьбе за ограниченный запас энергии, тогда как кругом находятся неистощимые запасы, способные поддержать нашу жизнь...»
«Благодаря завоеваниям экспериментальной науки в области радиоактивности, наследство человека увеличилось, его стремления возвысились, и судьба его в некоторых отношениях настолько облагородилась, что мы в настоящее время не можем даже этого вполне оценить. Истинное благополучие мира лежит в его энергии, и, благодаря открытию радиоактивности, в первый раз стало ясно, что тяжелая борьба за существование и за остатки энергии, за счет которой развился род человеческий, не есть уже больше единственно возможный и неизбежный его удел.
Законно стало стремление человека верить в то, что настанет некогда день, когда он получит возможность овладеть для своих целей первоисточниками энергии, которые природа так ревниво охраняет для будущего. До осуществления этой надежды, без сомнения, очень далеко, но самая возможность ее изменяет отношение человека к окружающему и придает высший смысл существованию».
Четыре года спустя в своей книге «Материя и энергия» он продолжал:
«Страх израсходовать запас пищи врожден нам; страх израсходовать запас топлива человек еще должен развить в себе... Прежние эпохи получили название от некоего мате-
риала: был век каменный, бронзовый, железный. Но ни один из них не состоялся бы, если бы человек не знал огня. Истинное богатство мира — его энергия. Именно признание энергии особой сущностью отличает нынешний век от веков минувших...»
«Век, в который мы живем, век каменного угля, черпает свою жизненную влагу из мелеющей лужи, оставшейся между приливом и отливом великой космической волны... Шумный прогресс последнего полустолетия, открывающего повсюду девственные территории и совершенно не думающего о сохранении естественных источников, сменяется периодом раздумья; цивилизацщ! приходится подумать о грядущем расчете со своим кредитором.
Цивилизация, как она сейчас существует, даже с физической точки Зрения не представляет собой непрерывного само-поддерживающегося движения... Она становится возможной лишь после многовекового накопления энергии. Аппетит ее увеличивается тем, чем она питается. Она пожинает то, чего не сеяла, и до сих пор тратит, не возобновляя. Ее сырой материал — энергия, а ее продукт — знание...»
«Пока все победы науки над природой смахивают на успехи школьника. Но этот период уже проходит... Экономия и бережливость неизбежно сменят идею развития и прогресса... Покуда же наука для нас — попутный ветер. Существует ошибочное представление, будто наука создает богатство, рост которого сопутствует применению знаний. Современная наука и ее синоним, современная цивилизация, не создает ничего, кроме знания... Мы склонны думать, таким образом, что потомки наши будут свидетелями интересного состязания между прогрессом науки, с одной стороны, и истощением естественных ресурсов — с другой...»
«Рано или поздно — но, разумеется, не в бесконечно отдаленном будущем — на Земле для пополнения естественного расходования энергии не останется ничего, кроме первоначальных запасов атомной энергии...»
В 1920 г., пережив смерть Мозли и варварство первой мировой войны, он добавлял: «Будем надеяться, что достижение в области источников физических сил, подвластных человечеству, не разделит судьбу тех, которые в прошлом превращали заслуженное наукой благословение в проклятие. Как неожиданно и внезапно было сделано само открытие радиоактивности, так в любой момент какой-нибудь счастливец из небольшой группы исследователей, погруженных в эту область науки, может найти ключ и использовать его. Таким образом, первоисточник природной энергии был бы открыт
314
для человеческого знания и был бы использован у самого истока,— на благо или во вред человеку, смотря по тому, правильно ли усвоены длинные и горькие уроки тяжелого прошлого и настоящего».
Среди открывателей и первых исследователей радиоактивности Содди — почти единственный, кто дожил до кошмара Хиросимы и дождался пуска первой атомной электростанции. На склоне лет он написал еще одну книгу — «История атомной энергии», в которой подвел итоги полувековой и поистине фантастической истории приручения человеком атомного огня.
ным успехом и широкой известностью. (Фредерик Жолио-Кюри, по его собственному признанию, выбрал жизненный путь под влиянием книги Содди «Радий и его разгадка».) В этих книгах он настойчиво внушал, какие необратимые изменения в жизнь людей принесла с собой новая наука о радиоактивности. Мало кто в его время с такой определенностью и беспокойством говорил о будущем атомной энергии, об экологии и энергетическом кризисе — обо всем том, что лишь сейчас, три четверти века спустя, стало очевидным для многих. Уже в своей лекции 23 февраля 1904 г. собравшимся, что «искусственная трансму-
Содди
тация
блемы
Представленные здесь отрывки из многочисленных книг
объяснял
элементов навсегда освободит человечество от проэнергии».
Содди интересны во многих отношениях: и как документы эпохи, и как отпечаток его личности, и как редкая возможность взглянуть глазами современника на первые шаги атомной эры, зная уже, к чему они впоследствии привели.
В 1907 г. в своей знаменитой книге «Радий и его разгадка» Содди писал: «Через несколько лет основы радиоактивности будут преподаваться во всех школах, ибо они принадлежат к основным принципам физики».
«В последнее столетие культурное человечество стало, так сказать, совершеннолетним и вступило в обладание наследством, которое солнце в течение долгих времен запасло в каменном угле. Человечество стремится как можно скорее растратить это наследство. С юношеской беззаботностью оно не думает о будущем и живет надеждою, что неисчерпаемы те запасы энергии, от которых наша культура зависит во всех отношениях...»
«Мы действительно переживаем замечательный момент. Первым шагом на длинном пути от варварства к цивилизации, пройденным человеком, было, по-видимому, искусство добывать огонь... Нетрудно себе представить, как он впервые, благодаря естественным пожарам, познал огонь и его свойства. Открытый нами недавно внутренний запас энергии в атомах ставит нас в то же положение, в котором первобытный человек находился по отношению к стихийной силе огня: мы знаем о существовании этого внутреннего запаса только благодаря естественным проявлениям радиоактивности».
«Не надо особого полета фантазии, чтобы в энергии видеть источник физической жизни вселенной, а ключ к первоисточникам энергии, как мы в настоящее время знаем, дает превращение элементов».
«Жизнь зависит, конечно, столько же от постоянного притока вещества, как и от постоянного притока энергии... Одно и то же вещество, одни и те же химические элементы служат неизменно для бесчисленных циклов жизни, но для них необходим непрерывный приток свежего запаса энергии... Одно и то же количество энергии в одних и тех же условиях работает только один раз. Борьба за существование в основе своей и есть непрерывная борьба за свежий запас физической энергии».
«Дикий человек, который не знал земледелия и не умел добывать огня, погибал от голода и холода, если он не уподоблялся хищному зверю и не пожирал других зверей. Хотя запасы тепла и пищи существовали везде вокруг него и в силу естественных процессов должны были быть ему известны, тем не менее он не умел воспользоваться ими для своих целей. Теперь — нечто подобное. Вся наша цивилизованная раса и теперь еще живет в борьбе за ограниченный запас энергии, тогда как кругом находятся неистощимые запасы, способные поддержать нашу жизнь...»
«Благодаря завоеваниям экспериментальной науки в области радиоактивности, наследство человека увеличилось, его стремления возвысились, и судьба его в некоторых отношениях настолько облагородилась, что мы в настоящее время не можем даже этого вполне оценить. Истинное благополучие мира лежит в его энергии, и, благодаря открытию радиоактивности, в первый раз стало ясно, что тяжелая борьба за существование и за остатки энергии, за счет которой развился род человеческий, не есть уже больше единственно возможный и неизбежный его удел.
Законно стало стремление человека верить в то, что настанет некогда день, когда он получит возможность овладеть для своих целей первоисточниками энергии, которые природа так ревниво охраняет для будущего. До осуществления этой надежды, без сомнения, очень далеко, но самая возможность ее изменяет отношение человека к окружающему и придает высший смысл существованию».
Четыре года спустя в своей книге «Материя и энергия» он продолжал:
«Страх израсходовать запас пищи врожден нам; страх израсходовать запас топлива человек еще должен развить в себе... Прежние эпохи получили название от некоего мате-
риала: был век каменный, бронзовый, железный. Но ни один из них не состоялся бы, если бы человек не знал огня. Истинное богатство мира — его энергия. Именно признание энергии особой сущностью отличает нынешний век от веков минувших...»
«Век, в который мы живем, век каменного угля, черпает свою жизненную влагу из мелеющей лужи, оставшейся между приливом и отливом великой космической волны... Шумный прогресс последнего полустолетия, открывающего повсюду девственные территории и совершенно не думающего о сохранении естественных источников, сменяется периодом раздумья; цивилизацщ! приходится подумать о грядущем расчете со своим кредитором.
Цивилизация, как она сейчас существует, даже с физической точки Зрения не представляет собой непрерывного само-поддерживающегося движения... Она становится возможной лишь после многовекового накопления энергии. Аппетит ее увеличивается тем, чем она питается. Она пожинает то, чего не сеяла, и до сих пор тратит, не возобновляя. Ее сырой материал — энергия, а ее продукт — знание...»
«Пока все победы науки над природой смахивают на успехи школьника. Но этот период уже проходит... Экономия и бережливость неизбежно сменят идею развития и прогресса... Покуда же наука для нас — попутный ветер. Существует ошибочное представление, будто наука создает богатство, рост которого сопутствует применению знаний. Современная наука и ее синоним, современная цивилизация, не создает ничего, кроме знания... Мы склонны думать, таким образом, что потомки наши будут свидетелями интересного состязания между прогрессом науки, с одной стороны, и истощением естественных ресурсов — с другой...»
«Рано или поздно — но, разумеется, не в бесконечно отдаленном будущем — на Земле для пополнения естественного расходования энергии не останется ничего, кроме первоначальных запасов атомной энергии...»
В 1920 г., пережив смерть Мозли и варварство первой мировой войны, он добавлял: «Будем надеяться, что достижение в области источников физических сил, подвластных человечеству, не разделит судьбу тех, которые в прошлом превращали заслуженное наукой благословение в проклятие. Как неожиданно и внезапно было сделано само открытие радиоактивности, так в любой момент какой-нибудь счастливец из небольшой группы исследователей, погруженных в эту область науки, может найти ключ и использовать его. Таким образом, первоисточник природной энергии был бы открыт
314
для человеческого знания и был бы использован у самого истока,— на благо или во вред человеку, смотря по тому, правильно ли усвоены длинные и горькие уроки тяжелого прошлого и настоящего».
Среди открывателей и первых исследователей радиоактивности Содди — почти единственный, кто дожил до кошмара Хиросимы и дождался пуска первой атомной электростанции. На склоне лет он написал еще одну книгу — «История атомной энергии», в которой подвел итоги полувековой и поистине фантастической истории приручения человеком атомного огня.
 3 млрд. (ЗИО9) градусов и началась необратимая аннигиляция электронов и позитронов в фотоны.
В конце третьей минуты температура первичного вещества уменьшилась до 1 млрд, градусов, плотность упала до плотности воды и началось образование ядер гелия из протонов и нейтронов.
Еще через час температура снизилась до 300 млн. градусов и образовалась та смесь водорода и гелия, которую мы до сих пор наблюдаем повсеместно во Вселенной.
Прошло еще около миллиона лет, прежде чем температура понизилась до 3000 градусов и электроны объединились с ядрами водорода и гелия: отныне фотоны не могли их разрушить, излучение отделилось от вещества.
Теперь Вселенная представляла собой однородную смесь, состоящую на 3/4 из водорода и на 1/4 из гелия. Плотность ее по космическим масштабам была довольно большой: несколько тысяч атомов в кубическом сантиметре (в наше время — всего один-два атома на кубический метр), а примеси других атомов (в основном дейтерия и лития) не превышали 0,0001 %. Как раз в это время, подчиняясь закону всемирного тяготения, первичная смесь водорода и гелия начала собираться в сгустки, из которых впоследствии образовались галактики и звезды.
Уже Ньютон знал, что однородная большая масса вещества неустойчива, но только два столетия спустя, в 1902 г., мысли Ньютона о гравитационной неустойчивости распределенных масс вещества получили развитие в работах Джеймса Хопвуда Джинса (1877—1946) (нам он уже известен как один из авторов распределения Рэлея — Джинса в теории теплового излучения).
Уплотнение водородно-гелиевых сгущений происходило довольно быстро: уже через миллион лет плотность и температура внутри таких сгустков достигает значений, при которых начинается ядерное горение водорода. В этот момент сжатие прекращается противодавлением излучения и образовавшаяся звезда стабилизируется до тех пор, пока не исчерпает запасов ядерной энергии. Время жизни звезд зависит от их массы: чем меньше звезда, тем дольше она живет. Звезды с массой Л4<Л4О живут десятки миллиардов лет, а с массой М>5МО — в тысячу раз меньше.
На ранних стадиях расширения Вселенной чаще образовывались массивные звезды, которые быстро сжигали запасы ядерного топлива и взрывались как сверхновые. Взрыв сверхновой — это грандиозное событие даже по космическим масштабам. По существу, это взрыв термоядерной бомбы величиной с наше Солнце. Энергия, которая при этом выделяется, в сотни миллиардов раз превышает излучение Солнца, и сверхновая некоторое время светит, как целая галактика. Масса сброшенной при взрыве оболочки сверхновой сравнима с массой Солнца, а ее вещество обогащено тяжелыми элементами, которые образовались в мощном потоке нейтронов термоядерного взрыва.
Именно эти взрывы изменили первоначальный химический состав вещества Вселенной: теперь, кроме водорода и гелия, оно содержит также от 1 до 3 % примесей тяжелых элементов. Это — как соль в космическом супе, но именно из этой соли построена Земля. Соотношение элементов в Земле с большой точностью повторяет распределение, тяжелых элементов на Солнце (гелий и свободный водород улетучились уже в раннюю геологическую эпоху Земли). Состав тканей человека не отличается существенно от состава морской воды и распространенности элементов в Земле, так что в итоге все мы — остатки взорвавшейся некогда звезды.
Сейчас взрывы сверхновых в нашей Галактике происходят очень редко: одно-два в столетие. За последнюю тысячу лет в летописях зафиксировано только четыре из них: в 1006, 1054, 1572 гг. (звезда Тихо Браге) и в 1604 г. (звезда Кеплера). Они светили ярче Венеры и были видны днем. (Две последние вспышки поколебали средневековый догмат о неизменности неба и немало содействовали изобретению телескопа в 1608 г.) Однако в первый миллиард лет существования Вселенной именно такие взрывы определили современный ее облик.
Наше Солнце — звезда третьего поколения. Оно образовалось из космической пыли, уже дважды прошедшей через космические тигли, около 5 млрд, лет назад. Через 5—7 млрд, лет оно истощит запасы водорода и перейдет в стадию гелиевого горения — с этого момента дни его сочтены. Внешняя оболочка Солнца, окружающая гелиевую сердцевину, начнет быстро расширяться, достигнет орбиты Земли и превратит ее в раскаленную пустыню: Солнце перейдет в стадию красного гиганта, подобного Альдебарану или Бетельгейзе. Это продлится недолго: всего через 10 тыс. лет оболочка Солнца рассеется, а само оно превратится в белый карлик, похожий на звезду Сириус В — спутник Сириуса А, самой яркой звезды нашего неба (которая сама к этому времени, вероятнее всего, взорвется). Но вряд ли кому-либо из людей придется наблюдать эту картину апокалипсиса.
Вселенная продолжает расширяться и охлаждаться до сих пор. Этот вывод следует из уравнений общей теории относительности Эйнштейна. Но когда советский физик Александр Александрович Фридман (1888—1925) в 1922 г. нашел такие решения этих уравнений, из которых следовало, что Вселенная расширяется, Эйнштейн возражал против такого заключения и лишь впоследствии признал свою неправоту. Семь лет спустя, в 1929 г., американский астроном Эдвин Пауэлл Хаббл (1889—1953) обнаружил «разбегание галактик» и даже измерил его скорость. Оказалось, что далекие галактики удаляются тем быстрее, чем дальше они отстоят от
3 млрд. (ЗИО9) градусов и началась необратимая аннигиляция электронов и позитронов в фотоны.
В конце третьей минуты температура первичного вещества уменьшилась до 1 млрд, градусов, плотность упала до плотности воды и началось образование ядер гелия из протонов и нейтронов.
Еще через час температура снизилась до 300 млн. градусов и образовалась та смесь водорода и гелия, которую мы до сих пор наблюдаем повсеместно во Вселенной.
Прошло еще около миллиона лет, прежде чем температура понизилась до 3000 градусов и электроны объединились с ядрами водорода и гелия: отныне фотоны не могли их разрушить, излучение отделилось от вещества.
Теперь Вселенная представляла собой однородную смесь, состоящую на 3/4 из водорода и на 1/4 из гелия. Плотность ее по космическим масштабам была довольно большой: несколько тысяч атомов в кубическом сантиметре (в наше время — всего один-два атома на кубический метр), а примеси других атомов (в основном дейтерия и лития) не превышали 0,0001 %. Как раз в это время, подчиняясь закону всемирного тяготения, первичная смесь водорода и гелия начала собираться в сгустки, из которых впоследствии образовались галактики и звезды.
Уже Ньютон знал, что однородная большая масса вещества неустойчива, но только два столетия спустя, в 1902 г., мысли Ньютона о гравитационной неустойчивости распределенных масс вещества получили развитие в работах Джеймса Хопвуда Джинса (1877—1946) (нам он уже известен как один из авторов распределения Рэлея — Джинса в теории теплового излучения).
Уплотнение водородно-гелиевых сгущений происходило довольно быстро: уже через миллион лет плотность и температура внутри таких сгустков достигает значений, при которых начинается ядерное горение водорода. В этот момент сжатие прекращается противодавлением излучения и образовавшаяся звезда стабилизируется до тех пор, пока не исчерпает запасов ядерной энергии. Время жизни звезд зависит от их массы: чем меньше звезда, тем дольше она живет. Звезды с массой Л4<Л4О живут десятки миллиардов лет, а с массой М>5МО — в тысячу раз меньше.
На ранних стадиях расширения Вселенной чаще образовывались массивные звезды, которые быстро сжигали запасы ядерного топлива и взрывались как сверхновые. Взрыв сверхновой — это грандиозное событие даже по космическим масштабам. По существу, это взрыв термоядерной бомбы величиной с наше Солнце. Энергия, которая при этом выделяется, в сотни миллиардов раз превышает излучение Солнца, и сверхновая некоторое время светит, как целая галактика. Масса сброшенной при взрыве оболочки сверхновой сравнима с массой Солнца, а ее вещество обогащено тяжелыми элементами, которые образовались в мощном потоке нейтронов термоядерного взрыва.
Именно эти взрывы изменили первоначальный химический состав вещества Вселенной: теперь, кроме водорода и гелия, оно содержит также от 1 до 3 % примесей тяжелых элементов. Это — как соль в космическом супе, но именно из этой соли построена Земля. Соотношение элементов в Земле с большой точностью повторяет распределение, тяжелых элементов на Солнце (гелий и свободный водород улетучились уже в раннюю геологическую эпоху Земли). Состав тканей человека не отличается существенно от состава морской воды и распространенности элементов в Земле, так что в итоге все мы — остатки взорвавшейся некогда звезды.
Сейчас взрывы сверхновых в нашей Галактике происходят очень редко: одно-два в столетие. За последнюю тысячу лет в летописях зафиксировано только четыре из них: в 1006, 1054, 1572 гг. (звезда Тихо Браге) и в 1604 г. (звезда Кеплера). Они светили ярче Венеры и были видны днем. (Две последние вспышки поколебали средневековый догмат о неизменности неба и немало содействовали изобретению телескопа в 1608 г.) Однако в первый миллиард лет существования Вселенной именно такие взрывы определили современный ее облик.
Наше Солнце — звезда третьего поколения. Оно образовалось из космической пыли, уже дважды прошедшей через космические тигли, около 5 млрд, лет назад. Через 5—7 млрд, лет оно истощит запасы водорода и перейдет в стадию гелиевого горения — с этого момента дни его сочтены. Внешняя оболочка Солнца, окружающая гелиевую сердцевину, начнет быстро расширяться, достигнет орбиты Земли и превратит ее в раскаленную пустыню: Солнце перейдет в стадию красного гиганта, подобного Альдебарану или Бетельгейзе. Это продлится недолго: всего через 10 тыс. лет оболочка Солнца рассеется, а само оно превратится в белый карлик, похожий на звезду Сириус В — спутник Сириуса А, самой яркой звезды нашего неба (которая сама к этому времени, вероятнее всего, взорвется). Но вряд ли кому-либо из людей придется наблюдать эту картину апокалипсиса.
Вселенная продолжает расширяться и охлаждаться до сих пор. Этот вывод следует из уравнений общей теории относительности Эйнштейна. Но когда советский физик Александр Александрович Фридман (1888—1925) в 1922 г. нашел такие решения этих уравнений, из которых следовало, что Вселенная расширяется, Эйнштейн возражал против такого заключения и лишь впоследствии признал свою неправоту. Семь лет спустя, в 1929 г., американский астроном Эдвин Пауэлл Хаббл (1889—1953) обнаружил «разбегание галактик» и даже измерил его скорость. Оказалось, что далекие галактики удаляются тем быстрее, чем дальше они отстоят от
 нас — в полном согласии со следствиями гипотезы «боль
шого взрыва». На границе видимой Вселенной (10—15 млрд, световых лет) галактики удаляются от нас со скоростью близкой к скорости света.
Свидетелем эпохи «большого взрыва», происшедшего около 15 млрд, лет назад, осталось реликтовое излучение, открытое Арно Пензиасом и Робертом Уилсоном в 1965 г. (Нобелевская премия 1978 г.): это то излучение, которое через 0,01 с после «большого взрыва» имело температуру 1011 градусов, а миллион лет спустя охладилось до 3000 градусов. Сейчас реликтовое излучение равномерно заполняет всю Вселенную (около 500 квантов в кубическом сантиметре), его средняя температура равна 2,82 К, а спектр подчиняется той самой знаменитой формуле Планка для равновесного излучения абсолютно черного тела, с которой началось развитие квантовой физики и с рассказа о которой мы начали эту книгу.
Круг замкнулся. Как говорили в древнем Китае: «Человек восходит корнями к предкам, но корни всего сущего находятся на небе».
Гипотезу «большого взрыва» выдвинул Георгий Гамов в 1948 г. — через двадцать лет после объяснения им явления а-распада. Основанием для такого предположения послужила космологическая теория Фридмана и подтверждение ее Хабблом. Сейчас гипотезу Гамова называют «теорией горячей Вселенной», а еще чаще — «стандартной моделью» ранней Вселенной. Эти нарочито прозаические слова не соответствуют величию и грандиозности предмета обсуждения: ведь речь идет о начале мира, и при всем желании сохранить научную строгость и объективность умозаключений трудно отрешиться от сопутствующего им чувства нереальности.
нас — в полном согласии со следствиями гипотезы «боль
шого взрыва». На границе видимой Вселенной (10—15 млрд, световых лет) галактики удаляются от нас со скоростью близкой к скорости света.
Свидетелем эпохи «большого взрыва», происшедшего около 15 млрд, лет назад, осталось реликтовое излучение, открытое Арно Пензиасом и Робертом Уилсоном в 1965 г. (Нобелевская премия 1978 г.): это то излучение, которое через 0,01 с после «большого взрыва» имело температуру 1011 градусов, а миллион лет спустя охладилось до 3000 градусов. Сейчас реликтовое излучение равномерно заполняет всю Вселенную (около 500 квантов в кубическом сантиметре), его средняя температура равна 2,82 К, а спектр подчиняется той самой знаменитой формуле Планка для равновесного излучения абсолютно черного тела, с которой началось развитие квантовой физики и с рассказа о которой мы начали эту книгу.
Круг замкнулся. Как говорили в древнем Китае: «Человек восходит корнями к предкам, но корни всего сущего находятся на небе».
Гипотезу «большого взрыва» выдвинул Георгий Гамов в 1948 г. — через двадцать лет после объяснения им явления а-распада. Основанием для такого предположения послужила космологическая теория Фридмана и подтверждение ее Хабблом. Сейчас гипотезу Гамова называют «теорией горячей Вселенной», а еще чаще — «стандартной моделью» ранней Вселенной. Эти нарочито прозаические слова не соответствуют величию и грандиозности предмета обсуждения: ведь речь идет о начале мира, и при всем желании сохранить научную строгость и объективность умозаключений трудно отрешиться от сопутствующего им чувства нереальности.
 Человеческая жизнь (менее 100 лет), вся история науки (300—400 лет), история цивилизаций (10 тыс. лет), появление человека (миллион лет) и даже возникновение Солнечной системы (около 5 млрд, лет),— все это лишь незначительные фрагменты летописи Вселенной.
Но почему мы должны верить во всю эту поистине библейскую картину рождения мира? Ответ прост, хотя, быть может, и не вполне убедителен: по той же самой причине, по которой мы верим в созданную нашим воображением картину атома: до сих пор все наблюдаемые следствия «стандартной модели» согласуются с предсказаниями теории «большого взрыва».
«Истина удивительнее всякой фантазии», и, по словам Фарадея, «ничто не может быть настолько прекрасным, чтобы заменить истину». Правда о звездах и Вселенной оказалась еще более захватывающей, чем все поэтические вымыслы о них. Эта правда, возвышая дух, подавляет воображение. Мы знаем теперь, что свет звезд, который на протяжении столетий был символом покоя и безмятежности, хранит в себе память о гибели и возрождении атомов, о магнитных бурях и космических взрывах. И это знание не проходит для нас бесследно.
Азарт научного поиска и неизбежные мелочи, сопутствующие ему, заслоняют часто величие открываемых явлений. И все же, оставаясь наедине со звездной бездной, трудно отрешиться от первобытного страха, так похожего на чувства человека, стоящего на краю пропасти.
«Астрономия — счастливая наука, ойа не нуждается в украшениях»,— сказал однажды Франсуа Араго. Это — древнейшая из наук, однако истинные законы неба узнали совсем недавно, после создания квантовой физики: устройство Вселенной нельзя понять прежде, чем изучены строение атома и структура ядра.
Мы живем в удивительное время: прошло всего полвека с тех пор, как стал известен наш адрес на окраине Галактики. На наших глазах происходит самая большая революция в астрономии со времен Коперника и Галилея, и постепенно пришедшая ей на смену астрофизика может изменить самосознание человека даже больше, чем открытие атомной энергии.
Человеческая жизнь (менее 100 лет), вся история науки (300—400 лет), история цивилизаций (10 тыс. лет), появление человека (миллион лет) и даже возникновение Солнечной системы (около 5 млрд, лет),— все это лишь незначительные фрагменты летописи Вселенной.
Но почему мы должны верить во всю эту поистине библейскую картину рождения мира? Ответ прост, хотя, быть может, и не вполне убедителен: по той же самой причине, по которой мы верим в созданную нашим воображением картину атома: до сих пор все наблюдаемые следствия «стандартной модели» согласуются с предсказаниями теории «большого взрыва».
«Истина удивительнее всякой фантазии», и, по словам Фарадея, «ничто не может быть настолько прекрасным, чтобы заменить истину». Правда о звездах и Вселенной оказалась еще более захватывающей, чем все поэтические вымыслы о них. Эта правда, возвышая дух, подавляет воображение. Мы знаем теперь, что свет звезд, который на протяжении столетий был символом покоя и безмятежности, хранит в себе память о гибели и возрождении атомов, о магнитных бурях и космических взрывах. И это знание не проходит для нас бесследно.
Азарт научного поиска и неизбежные мелочи, сопутствующие ему, заслоняют часто величие открываемых явлений. И все же, оставаясь наедине со звездной бездной, трудно отрешиться от первобытного страха, так похожего на чувства человека, стоящего на краю пропасти.
«Астрономия — счастливая наука, ойа не нуждается в украшениях»,— сказал однажды Франсуа Араго. Это — древнейшая из наук, однако истинные законы неба узнали совсем недавно, после создания квантовой физики: устройство Вселенной нельзя понять прежде, чем изучены строение атома и структура ядра.
Мы живем в удивительное время: прошло всего полвека с тех пор, как стал известен наш адрес на окраине Галактики. На наших глазах происходит самая большая революция в астрономии со времен Коперника и Галилея, и постепенно пришедшая ей на смену астрофизика может изменить самосознание человека даже больше, чем открытие атомной энергии.
 усваивается растениями. (Это число впервые измерил в 1860 г. отец Анри Беккереля Эгмон Беккерель.) Это немного, но эта узкая тропа — единственный путь, связывающий царство неживой материи с миром живых существ, по которому энергия термоядерных топок Солнца, непрерывно дробясь, достигает нервных клеток мозга человека, способного понять и оценить весь этот непостижимый замысел Природы и его постигаемое воплощение.
усваивается растениями. (Это число впервые измерил в 1860 г. отец Анри Беккереля Эгмон Беккерель.) Это немного, но эта узкая тропа — единственный путь, связывающий царство неживой материи с миром живых существ, по которому энергия термоядерных топок Солнца, непрерывно дробясь, достигает нервных клеток мозга человека, способного понять и оценить весь этот непостижимый замысел Природы и его постигаемое воплощение.
 остроумных правил, которые надлежало заучить наизусть — настолько они были чужды духу средневековой Европы, привыкшей верить, а не искать корней истины. Но объем знаний стремительно рос, и их уже не удавалось согласовать с направлением мыслей средневековых умов.
Конец средневековья обычно связывают с открытием Америки в 1492 г. Некоторые указывают даже более точную дату: 13 декабря 1250 г.— день, когда в замке Флорентино близ Лючеры умер король Фридрих II Гогенштауфен. Конечно, не следует относиться к этим датам всерьез, но несколько таких дат, взятых вместе, создают несомненное ощущение достоверности перелома, который произошел в сознании людей на рубеже XIII и XIV веков. В истории этот период назвали Возрождением. Подчиняясь внутренним законам развития и без видимых на то причин, Европа всего за два века возродила зачатки древних знаний, до того более десяти веков находившихся в небрежении и получивших впоследствии название научных.
В период Возрождения в умах людей произошел поворот от стремления осознать свое место в мире к попыткам понять его рациональное устройство без ссылок на чудеса и божественное откровение. Вначале переворот носил аристократический характер, но изобретение книгопечатания распространило его на все слои общества. Суть перелома — освобождение от давления авторитетов и переход от средневековой веры к знанию нового времени. Церковь всячески противилась новым веяниям, она строго судила философов, которые признавали, что есть вещи истинные с точки зрения философии, но ложные с точки зрения веры, «как будто в противовес истине, заключенной в священном писании, может находиться истина в книгах язычников».
Если отвлечься от политических страстей времени, в которое жил Галилей, становится ясно, что судили его не только за сочувствие системе Коперника: такие же мысли столетием раньше отстаивал кардинал Николай Кузанский (1401 — 1464) и остался безнаказанным. Но в то время как ученый кардинал утверждал их, ссылаясь на авторитеты — как то и подобает верующему, Галилей — доказывал, как того требует наука, то есть предлагал проверить каждому, опираясь лишь на опыт и здравый смысл. Именно этого не могли простить ему служители церкви. Но рухнувшую плотину веры починить было уже нельзя, и освобожденный дух стал искать новые пути для своего развития.
Принципы научного знания и метод, позволяющий их осуществить, начали искать задолго до возникновения современной науки. Уже в XIII веке Роджер Бэкон в своем знаменитом трактате писал: «Существует естественный и несовершенный опыт, который не сознает своего могущества и не отдает себе отчета в своих приемах: им пользуются ремесленники, а не ученые... Выше всех умозрительных знаний и искусств стоит умение производить опыты, и эта наука есть царица наук...
Философы должны знать, что их наука бессильна, если они не применяют к ней могущественную математику... Невозможно отличить софизм от доказательства, не проверив заключение путем опыта и применения».
В 1440 г. Николай Кузанский написал книгу «Об ученом невежестве», в которой настаивал, что все познания о природе необходимо записывать в цифрах, а все опыты над нею производить с весами в руках.
Утверждение новых взглядов происходило медленно. Например, арабские цифры уже в X веке вошли во всеобщее употребление, но даже в XVI веке вычисления повсеместно производили не на бумаге, а с помощью особых жетонов, которые были еще менее совершенны, чем наши конторские счеты.
Настоящую историю научного метода принято начинать с Галилея и Ньютона. Согласно той же традиции Галилео Галилей (1564—1642) считается родоначальником экспериментальной физики, а Исаак Ньютон (1643—1727) — основателем теоретической физики. Конечно, в их время не было такого разделения единой науки физики на две части, не было даже самой физики — она называлась натуральной философией. Но такое разделение имеет глубокий смысл: оно помогает понять особенности научного метода и, по существу, эквивалентно делению науки на опыт и математику, которое сформулировал еще Роджер Бэкон.
остроумных правил, которые надлежало заучить наизусть — настолько они были чужды духу средневековой Европы, привыкшей верить, а не искать корней истины. Но объем знаний стремительно рос, и их уже не удавалось согласовать с направлением мыслей средневековых умов.
Конец средневековья обычно связывают с открытием Америки в 1492 г. Некоторые указывают даже более точную дату: 13 декабря 1250 г.— день, когда в замке Флорентино близ Лючеры умер король Фридрих II Гогенштауфен. Конечно, не следует относиться к этим датам всерьез, но несколько таких дат, взятых вместе, создают несомненное ощущение достоверности перелома, который произошел в сознании людей на рубеже XIII и XIV веков. В истории этот период назвали Возрождением. Подчиняясь внутренним законам развития и без видимых на то причин, Европа всего за два века возродила зачатки древних знаний, до того более десяти веков находившихся в небрежении и получивших впоследствии название научных.
В период Возрождения в умах людей произошел поворот от стремления осознать свое место в мире к попыткам понять его рациональное устройство без ссылок на чудеса и божественное откровение. Вначале переворот носил аристократический характер, но изобретение книгопечатания распространило его на все слои общества. Суть перелома — освобождение от давления авторитетов и переход от средневековой веры к знанию нового времени. Церковь всячески противилась новым веяниям, она строго судила философов, которые признавали, что есть вещи истинные с точки зрения философии, но ложные с точки зрения веры, «как будто в противовес истине, заключенной в священном писании, может находиться истина в книгах язычников».
Если отвлечься от политических страстей времени, в которое жил Галилей, становится ясно, что судили его не только за сочувствие системе Коперника: такие же мысли столетием раньше отстаивал кардинал Николай Кузанский (1401 — 1464) и остался безнаказанным. Но в то время как ученый кардинал утверждал их, ссылаясь на авторитеты — как то и подобает верующему, Галилей — доказывал, как того требует наука, то есть предлагал проверить каждому, опираясь лишь на опыт и здравый смысл. Именно этого не могли простить ему служители церкви. Но рухнувшую плотину веры починить было уже нельзя, и освобожденный дух стал искать новые пути для своего развития.
Принципы научного знания и метод, позволяющий их осуществить, начали искать задолго до возникновения современной науки. Уже в XIII веке Роджер Бэкон в своем знаменитом трактате писал: «Существует естественный и несовершенный опыт, который не сознает своего могущества и не отдает себе отчета в своих приемах: им пользуются ремесленники, а не ученые... Выше всех умозрительных знаний и искусств стоит умение производить опыты, и эта наука есть царица наук...
Философы должны знать, что их наука бессильна, если они не применяют к ней могущественную математику... Невозможно отличить софизм от доказательства, не проверив заключение путем опыта и применения».
В 1440 г. Николай Кузанский написал книгу «Об ученом невежестве», в которой настаивал, что все познания о природе необходимо записывать в цифрах, а все опыты над нею производить с весами в руках.
Утверждение новых взглядов происходило медленно. Например, арабские цифры уже в X веке вошли во всеобщее употребление, но даже в XVI веке вычисления повсеместно производили не на бумаге, а с помощью особых жетонов, которые были еще менее совершенны, чем наши конторские счеты.
Настоящую историю научного метода принято начинать с Галилея и Ньютона. Согласно той же традиции Галилео Галилей (1564—1642) считается родоначальником экспериментальной физики, а Исаак Ньютон (1643—1727) — основателем теоретической физики. Конечно, в их время не было такого разделения единой науки физики на две части, не было даже самой физики — она называлась натуральной философией. Но такое разделение имеет глубокий смысл: оно помогает понять особенности научного метода и, по существу, эквивалентно делению науки на опыт и математику, которое сформулировал еще Роджер Бэкон.

 консервируется впрок и проявляется лишь тогда, когда изменившиеся внешние условия грозят уничтожить биологический вид. Эволюция не прекратилась и теперь — она лишь изменила свои формы: на протяжении тысячелетий тело человека осталось практически без изменений, зато его сознание изменилось неузнаваемо и необратимо. Быть может, наука — это именно тот источник новых идей, которые спасут человечество в грядущих катастрофах.
Наука — это соглашение между людьми, достаточно плодотворное, чтобы стать всеобщим. На основе этого соглашения вырос и развивается своего рода коллективный разум — если и не бессмертный, то сравнительно долговечный. Как долго он проживет и где границы научного метода — пока неясно, однако то, что они существуют,— несомненно.
консервируется впрок и проявляется лишь тогда, когда изменившиеся внешние условия грозят уничтожить биологический вид. Эволюция не прекратилась и теперь — она лишь изменила свои формы: на протяжении тысячелетий тело человека осталось практически без изменений, зато его сознание изменилось неузнаваемо и необратимо. Быть может, наука — это именно тот источник новых идей, которые спасут человечество в грядущих катастрофах.
Наука — это соглашение между людьми, достаточно плодотворное, чтобы стать всеобщим. На основе этого соглашения вырос и развивается своего рода коллективный разум — если и не бессмертный, то сравнительно долговечный. Как долго он проживет и где границы научного метода — пока неясно, однако то, что они существуют,— несомненно.
 ниях случая» находит единственные и неповторимые, а из «бесконечной вереницы явлений» безошибочно выби
Существует очевидная дополнительность методов науки и искусства в процессе познания окружающего мира. Рабочий, повседневный метод науки — это анализ фактов и выяснение их причин, стремление «найти вечный закон в чудесных превращениях случая», попытки «отыскать неподвижный полюс в бесконечной веренице явлений». В искусстве преобладает бессознательный синтез, который в тех же «превращерает лишь те, которые позволяют почувствовать гармонию целого.
Мир человеческих восприятий бесконечно разнообразен, но хаотичен и окрашен личными переживаниями. Человек стремится упорядочить свои впечатления и согласовать их с впечатлениями других. Для этого он изобрел науку и создал искусство. Именно это стремление стало общей побудительной причиной их возникновения. Их объединяет чувство удивления, которое они после себя оставляют: как возникла эта формула, эта поэма, эта теория и эта мелодия. («Начало знания — удивление»,— говорили в древности.)
Природа творчества едина во всех искусствах и науках. Она определяется интуитивной способностью группировать факты и впечатления окружающего мира таким образом, чтобы удовлетворить нашу эмоциональную потребность в чувстве гармонии, которое человек испытывает, выделив из хаоса внешних впечатлений нечто цельное и законченное: статую из мрамора, поэму из слов, формулу из чисел. Это эмоциональное удовлетворение одновременно и первый критерий истинности созданного, которая, конечно, в дальнейшем проверяется: в науке — опытом, в искусстве — временем.
«Ученый изучает природу не потому, что это полезно: он изучает ее потому, что это доставляет ему удовольствие, потому, что она — прекрасна. Если бы природа не была прекрасной, она не стоила бы того труда, который тратится на ее познание, и жизнь не стоила бы того труда, который нужен, чтобы ее прожить».
Эти слова принадлежат Анри Пуанкаре. Эстетическое восприятие логической красоты науки в той или иной форме присуще каждому настоящему физику. Но, пожалуй, никто не сказал об этом лучше Пуанкаре. «Он любил науку не только ради науки. Она доставляла ему духовную радость и наслаждение художника, постигшего искусство облекать красоту в реальные формы»,— писал о нем русский переводчик его знаменитых книг: «Наука и метод», «Наука и гипотеза», «Ценность науки», «Последние мысли», которые определили выбор жизненного пути Луи де Бройля, Фредерика Жолио-Кюри и еще многих других.
ниях случая» находит единственные и неповторимые, а из «бесконечной вереницы явлений» безошибочно выби
Существует очевидная дополнительность методов науки и искусства в процессе познания окружающего мира. Рабочий, повседневный метод науки — это анализ фактов и выяснение их причин, стремление «найти вечный закон в чудесных превращениях случая», попытки «отыскать неподвижный полюс в бесконечной веренице явлений». В искусстве преобладает бессознательный синтез, который в тех же «превращерает лишь те, которые позволяют почувствовать гармонию целого.
Мир человеческих восприятий бесконечно разнообразен, но хаотичен и окрашен личными переживаниями. Человек стремится упорядочить свои впечатления и согласовать их с впечатлениями других. Для этого он изобрел науку и создал искусство. Именно это стремление стало общей побудительной причиной их возникновения. Их объединяет чувство удивления, которое они после себя оставляют: как возникла эта формула, эта поэма, эта теория и эта мелодия. («Начало знания — удивление»,— говорили в древности.)
Природа творчества едина во всех искусствах и науках. Она определяется интуитивной способностью группировать факты и впечатления окружающего мира таким образом, чтобы удовлетворить нашу эмоциональную потребность в чувстве гармонии, которое человек испытывает, выделив из хаоса внешних впечатлений нечто цельное и законченное: статую из мрамора, поэму из слов, формулу из чисел. Это эмоциональное удовлетворение одновременно и первый критерий истинности созданного, которая, конечно, в дальнейшем проверяется: в науке — опытом, в искусстве — временем.
«Ученый изучает природу не потому, что это полезно: он изучает ее потому, что это доставляет ему удовольствие, потому, что она — прекрасна. Если бы природа не была прекрасной, она не стоила бы того труда, который тратится на ее познание, и жизнь не стоила бы того труда, который нужен, чтобы ее прожить».
Эти слова принадлежат Анри Пуанкаре. Эстетическое восприятие логической красоты науки в той или иной форме присуще каждому настоящему физику. Но, пожалуй, никто не сказал об этом лучше Пуанкаре. «Он любил науку не только ради науки. Она доставляла ему духовную радость и наслаждение художника, постигшего искусство облекать красоту в реальные формы»,— писал о нем русский переводчик его знаменитых книг: «Наука и метод», «Наука и гипотеза», «Ценность науки», «Последние мысли», которые определили выбор жизненного пути Луи де Бройля, Фредерика Жолио-Кюри и еще многих других.
 ОГЛАВЛЕНИЕ
Причинность и случайность, вероятность и достоверность 178
Научно-художественное издание
ПОНОМАРЕВ Леонид Иванович
ПОД ЗНАКОМ КВАНТА
Оформление художника В. Я. Батищева Иллюстрации О. О. Левенок
Заведующий редакцией Л. И. Гладнева Редакторы Е. К. Козлова,
В. А. Григорова
Младший редактор В. А. Кузнецова Художественный редактор Т. Н. Кольченко Технические редакторы И. Ш. Аксельрод, А. П. Колесникова
Корректоры Е. Ю. Рычагова, М. Л. Медведская
ИБ.№ 32804
Сдано в набор 25.11.88. Подписано к печати 25.10.89. Формат 84X108/32. Бумага тип. № 1. Гарнитура литературная. Печать высокая. Усл. печ. л. 19,32. Усл. кр.-отт. 19,74. Уч.-изд. л. 20,47. Тираж 75 000 экз. Заказ № 1269. Цена 1 р. 70 к.
Ордена Трудового Красного Знамени Издательство «Наука»
Главная редакция физико-математической литературы 117071 Москва В-71, Ленинский проспект, 15
Ленинградская типография № 2 головное предприятие ордена Трудового Красного Знамени Ленинградского объединения «Техническая книга» им. Евгении Соколовой Государственного комитета СССР по печати. 198052, г. Ленинград, Л-52, Измайловский проспект, 29.
NAUKA PUBLISHERS
Main Editorial Board for Literature on Physics and Mathematics
Leninski prospect, 15, Moscow 117071, USSR
UNDER THE SIGN OF QUANTUM
Leonid I. PONOMAREV, Prof. (Phys. & Math.)
I. V. Kurchatov Atomic Energy Institute, Moscow, USSR
READERSHIP: The book will appeal to any reader with a scientific bent who is intrigued by the triumphs of modern science, before which pale the fantasies of science fiction.
CONTENTS: Origins: Atom. Waves. Quanta. Spectra. Ions. Radiant Matter. Atoms, Electron, Waves. The Planetary Atom. Spectral Series. Photons. Pre-Bohr Times. The Bohr Atom. Post-Bohr Time. Teachings of the Ancients. Elements and Atoms. The Periodic Law. Ideas: Phenomenon, Image, Concept, Formula. Heisenberg’s Matrix Mechanics. Louis de Broglie. Matter Waves. Optical Mechanical Analogy. Schrodinger Equation. The Image of the Atom. Quantum Truth. Wave-Particle Duality. Uncertainty Relation. Complementarity Principle. Probability Waves. The Atom and the Probability. Causality and Chance. What is an Atom? Physical Reality. Results: Rontgen. Becquerel. Pierre and Marie Curie. Rutherford and Soddy.Isotopes. Uranium Family. Nuclear Binding Energy. The Neutron. Artificial Radioaktivity. Nuclear Fission. Tunnel Effect. Effective Cross-Sections. Fission. Chain Reaction. Nuclear Reactor. Atomic Energy. The Atomic Bomb. The Atomic Problem. Solar Light. Crucibles of Elements. The Fate of the Sun. Reflections: Inception of the Scientific Method. Essence of the, Scientific Method and its Development. Truth and Completeness of the Scientific Picture of the World. Science and Humanity. Science and Art. Future of Science.
THE AUTHOR: Leonid I. Ponomarev, professor of physics, the head of the theoretical department in I. V. Kurchatov Atomic Energy Institute, Moscow, USSR.
ОГЛАВЛЕНИЕ
Причинность и случайность, вероятность и достоверность 178
Научно-художественное издание
ПОНОМАРЕВ Леонид Иванович
ПОД ЗНАКОМ КВАНТА
Оформление художника В. Я. Батищева Иллюстрации О. О. Левенок
Заведующий редакцией Л. И. Гладнева Редакторы Е. К. Козлова,
В. А. Григорова
Младший редактор В. А. Кузнецова Художественный редактор Т. Н. Кольченко Технические редакторы И. Ш. Аксельрод, А. П. Колесникова
Корректоры Е. Ю. Рычагова, М. Л. Медведская
ИБ.№ 32804
Сдано в набор 25.11.88. Подписано к печати 25.10.89. Формат 84X108/32. Бумага тип. № 1. Гарнитура литературная. Печать высокая. Усл. печ. л. 19,32. Усл. кр.-отт. 19,74. Уч.-изд. л. 20,47. Тираж 75 000 экз. Заказ № 1269. Цена 1 р. 70 к.
Ордена Трудового Красного Знамени Издательство «Наука»
Главная редакция физико-математической литературы 117071 Москва В-71, Ленинский проспект, 15
Ленинградская типография № 2 головное предприятие ордена Трудового Красного Знамени Ленинградского объединения «Техническая книга» им. Евгении Соколовой Государственного комитета СССР по печати. 198052, г. Ленинград, Л-52, Измайловский проспект, 29.
NAUKA PUBLISHERS
Main Editorial Board for Literature on Physics and Mathematics
Leninski prospect, 15, Moscow 117071, USSR
UNDER THE SIGN OF QUANTUM
Leonid I. PONOMAREV, Prof. (Phys. & Math.)
I. V. Kurchatov Atomic Energy Institute, Moscow, USSR
READERSHIP: The book will appeal to any reader with a scientific bent who is intrigued by the triumphs of modern science, before which pale the fantasies of science fiction.
CONTENTS: Origins: Atom. Waves. Quanta. Spectra. Ions. Radiant Matter. Atoms, Electron, Waves. The Planetary Atom. Spectral Series. Photons. Pre-Bohr Times. The Bohr Atom. Post-Bohr Time. Teachings of the Ancients. Elements and Atoms. The Periodic Law. Ideas: Phenomenon, Image, Concept, Formula. Heisenberg’s Matrix Mechanics. Louis de Broglie. Matter Waves. Optical Mechanical Analogy. Schrodinger Equation. The Image of the Atom. Quantum Truth. Wave-Particle Duality. Uncertainty Relation. Complementarity Principle. Probability Waves. The Atom and the Probability. Causality and Chance. What is an Atom? Physical Reality. Results: Rontgen. Becquerel. Pierre and Marie Curie. Rutherford and Soddy.Isotopes. Uranium Family. Nuclear Binding Energy. The Neutron. Artificial Radioaktivity. Nuclear Fission. Tunnel Effect. Effective Cross-Sections. Fission. Chain Reaction. Nuclear Reactor. Atomic Energy. The Atomic Bomb. The Atomic Problem. Solar Light. Crucibles of Elements. The Fate of the Sun. Reflections: Inception of the Scientific Method. Essence of the, Scientific Method and its Development. Truth and Completeness of the Scientific Picture of the World. Science and Humanity. Science and Art. Future of Science.
THE AUTHOR: Leonid I. Ponomarev, professor of physics, the head of the theoretical department in I. V. Kurchatov Atomic Energy Institute, Moscow, USSR.

